Method Article
Le volet axial de l’artère épigastrique inférieure superficielle pour étudier les effets de préconditionnement ischémique dans un modèle de rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit la récolte, la suture et la surveillance des lambeaux fasciocutanés chez le rat qui permettent une bonne visualisation et manipulation du flux sanguin à travers les vaisseaux épigastriques inférieurs superficiels au moyen du clampage et de la ligature des vaisseaux fémoraux. Ceci est essentiel pour les études impliquant un préconditionnement ischémique.
Résumé
Les lambeaux fasciocutanés (FCF) sont devenus l’étalon-or pour la reconstruction de défauts complexes en chirurgie plastique et reconstructive. Cette technique de préservation musculaire permet de transférer des tissus vascularisés pour couvrir tout défaut important. Le FCF peut être utilisé comme rabats pédiculés ou comme rabats libres; cependant, dans la littérature, les taux d’échec pour le FCF pédiculé et le FCF libre sont supérieurs à 5%, ce qui laisse place à l’amélioration de ces techniques et à l’expansion des connaissances dans ce domaine. Le préconditionnement ischémique (PI) a été largement étudié, mais les mécanismes et l’optimisation du régime I.P. restent à déterminer. Ce phénomène est en effet peu exploré en chirurgie plastique et reconstructive. Ici, un modèle chirurgical est présenté pour étudier le régime I.P. dans un modèle de lambeau fasciocutané axial de rat, décrivant comment évaluer de manière sûre et fiable les effets de I.P. sur la survie du lambeau. Cet article décrit l’intervention chirurgicale complète, y compris des suggestions pour améliorer la fiabilité de ce modèle. L’objectif est de fournir aux chercheurs un modèle reproductible et fiable pour tester divers schémas de préconditionnement ischémique et évaluer leurs effets sur la capacité de survie des volets.
Introduction
La chirurgie plastique et reconstructive est en constante évolution. Le développement des lambeaux musculaires, fasciocutanés et perforateurs a permis d’offrir des reconstructions de meilleure qualité tout en réduisant la morbidité. En combinant ces connaissances anatomiques améliorées avec des compétences techniques améliorées, les chirurgiens reconstructeurs peuvent effectuer des transferts de lambeaux libres lorsque les défauts ne sont pas proches d’une solution locale. Cependant, alors que la chirurgie du lambeau perforateur est actuellement la technique la plus avancée en chirurgie reconstructive, la littérature rapporte un taux d’échec de 5% dans les transferts de lambeaux libres 1,2,3, et jusqu’à 20% pour la reconstruction de lambeau pédiculé 4,5,6. Une défaillance partielle à totale du volet se produit lorsque le pédicule du volet est compromis, il est donc essentiel de rechercher continuellement des améliorations aux techniques actuelles. Une des méthodes pour améliorer la survie du lambeau est de favoriser sa néovascularisation sur le lit de la plaie, permettant ainsi la perfusion par une source autre que le pédicule. Le préconditionnement ischémique (PI) a été initialement décrit dans un modèle cardiaque7, démontrant qu’un organe exposé à une ischémie contrôlée survit à un degré plus élevé après avoir perdu son approvisionnement en sang primaire en subissant une néovascularisation induite par l’ischémie. Plusieurs auteurs ont étudié ce principe fondamental pour optimiser la survie des lambeaux dans les modèles précliniques et cliniques 8,9,10.
L’avantage de cette technique par rapport à d’autres méthodes pour améliorer la survie du lambeau est sa facilité de mise en œuvre, consistant en des tests de pince / pince de la source sanguine. Dans le modèle du rat, les auteurs précédents ont utilisé le lambeau superficiel de l’artère épigastrique inférieure (SIEA) pour étudier l’I.P. en serrant le pédicule principal11,12,13. Néanmoins, plusieurs problèmes techniques peuvent être rencontrés avec ce modèle, et la littérature manque de protocoles bien décrits.
Par conséquent, ce travail vise à fournir aux chercheurs une description détaillée d’une technique d’approvisionnement en volets SIEA chez le rat avec une dissection étendue des vaisseaux fémoraux pour permettre des études I.P. sur un modèle de volet fasciocutané axial. Ce modèle conserve l’intégrité des vaisseaux épigastriques et manipule plutôt les vaisseaux fémoraux, qui sont plus résistants. Nous partageons notre expérience et nos outils pour améliorer l’étude de ce phénomène et augmenter la réplicabilité de cette procédure.
Protocole
Le Massachusetts General Hospital Institutional Animal Care and Use Committee a approuvé le protocole expérimental (protocole IACUC- #2022N000099). Les auteurs ont suivi la liste de contrôle des lignes directrices ARRIVE (Animal Research: Reporting In Vivo Experiments) pour ce travail. Tous les animaux ont reçu des soins sans cruauté conformément au Guide de l’Institut national de la santé pour le soin et l’utilisation des animaux de laboratoire. Au total, 12 rats Lewis mâles (250-350 g, âgés de 8 à 10 semaines) ont été utilisés pour toutes les expériences.
1. Préparation des animaux
REMARQUE: Les rats ont un taux métabolique élevé et des réserves de graisse limitées; Par conséquent, ne les ayez pas rapidement avant la chirurgie et ne limitez jamais l’eau avant la chirurgie.
- Pour toutes les procédures, endormir l’animal en utilisant de l’isoflurane à 3% à 5% dans la chambre du vaporisateur de précision à l’isoflurane (voir le tableau des matériaux). Lorsque l’animal est bien sous sédatif, réduire la dose d’isoflurane à 1 % à 3 % par un cône nasal.
REMARQUE : Un deuxième chercheur doit surveiller en permanence la fréquence respiratoire et adapter la dose d’isoflurane. - À 2 jours avant la chirurgie initiale, placez un collier électronique en plastique (de la taille d’un rat; voir le tableau des matériaux) sur l’animal et utilisez une suture en nylon 3-0 pour fixer le collier électronique sur les côtés dorsal et ventral du cou de l’animal. Prévoir 2 jours pour l’acclimatation à ce collier électronique; Il doit être bien ajusté mais ne pas obstruer les voies respiratoires de l’animal.
2. Soins préopératoires
- Le jour de la chirurgie initiale, rasez la partie antérieure inférieure de l’abdomen, en dégageant la zone de la partie latérale de l’animal jusqu’à légèrement au-delà de la ligne médiane.
- Ensuite, utilisez un produit dépilatoire (crème dépilatoire; voir Tableau des matières) pour enlever tous les poils restants dans cette zone (la face antérieure inférieure de l’abdomen comme décrit à l’étape précédente).
- Bien laver et sécher la zone avec un gommage chirurgical et une solution de bétadine (10% povidone-iode).
- Administrer 0,05 mg/kg de buprénorphine par voie sous-cutanée.
3. Surveillance peropératoire
- Assurez-vous que l’animal reste sur 1% -3% isoflurane via un vaporisateur de précision et un cône nasal tout au long de la chirurgie. Surveillez la fréquence respiratoire, la respiration et le niveau de saturation en oxygène de l’animal par observation visuelle et un oxymètre de pouls de rongeur conçu pour un rat.
NOTE: La fréquence respiratoire typique est de 80-90 cycles par minute14,15. Toute réaction indiquant la conscience observée pendant la chirurgie nécessite une augmentation du taux d’isoflurane. - Placez l’animal sur un coussin chauffant pendant toute la durée de la chirurgie, car la température corporelle des rongeurs se refroidit rapidement sous anesthésie.
4. Prélèvement épigastrique des lambeaux
- Placez l’animal en décubitus dorsal. Rasez l’abdomen du dessous du pli inguinal au-dessus du niveau du processus xiphoïde.
- À l’aide d’un stylo et d’une règle à peau stérile, marquez d’abord la ligne médiane de l’abdomen de l’animal, puis le pli inguinal. Une incision le long de la ligne de pli inguinal expose les vaisseaux épigastriques inférieurs ramifiés des vaisseaux fémoraux.
- Avant l’incision, dessinez le futur lambeau sous la forme d’un ovale ou d’un rectangle jusqu’à 6 cm verticalement et 3 cm horizontalement, en s’étendant crânienment à partir du pli inguinal.
- Dessinez cinq ou six marques équidistantes perpendiculaires aux limites du volet. Ceux-ci servent de guides pour mieux réaligner la peau une fois que le lambeau a été soulevé et qu’il est suturé à nouveau en place (Figure 1).
- À l’aide de ciseaux Ragnell (voir Tableau des matériaux), faites une incision longitudinale de 3 à 4 cm sur le pli inguinal.
REMARQUE: Les chercheurs doivent faire preuve de prudence et tirer la peau vers le haut pour éviter d’endommager les vaisseaux. - Exposer et identifier les vaisseaux fémoraux et épigastriques à l’aide de pinces microchirurgicales #4 des bijoutiers (voir Tableau des matériaux), en ouvrant et en fermant les pinces pour séparer le fascia et accéder aux vaisseaux qui se trouvent sous le coussinet adipeux inguinal.
- Utilisez l’incision inguinale pour commencer l’incision à lambeau à l’aide des ciseaux Ragnell. Faites attention à saper toute l’épaisseur de la peau et du tissu conjonctif sur le muscle abdominal.
- Pour faciliter la récolte des volets, assurez-vous que les ciseaux suivent le bon plan de dissection en poussant vers le muscle et en écartant les lames des ciseaux. Effectuez ce sapage du volet en vous déplaçant dans une direction coordonnée autour du dessin du volet.
NOTE: Pour déterminer le plan approprié, aucun microvaisseau ne doit rester présent sous le plan de dissection.
- Pour faciliter la récolte des volets, assurez-vous que les ciseaux suivent le bon plan de dissection en poussant vers le muscle et en écartant les lames des ciseaux. Effectuez ce sapage du volet en vous déplaçant dans une direction coordonnée autour du dessin du volet.
- Lorsque l’extrémité initiale du lambeau est libérée de la peau environnante, poursuivre l’approvisionnement du lambeau en sapant de la partie distale à la partie proximale, en utilisant les pointes de ciseaux Ragnell pour séparer le lambeau du muscle tout en cautérisant les vaisseaux perforateurs et les vaisseaux du plexus dermique autour du lambeau. Cela garantit que tout le sang circule vers le lambeau via les vaisseaux épigastriques.
NOTE: Il faut veiller à ne pas endommager le système vasculaire du lambeau en tirant trop fort ou en tordant la peau pendant la récolte du lambeau. Il est suggéré de placer soigneusement la partie libérée du lambeau sur le pouce de la main du chirurgien tout en travaillant sur la partie proximale du lambeau. - Une fois le lambeau entièrement récolté, les branches des vaisseaux épigastriques inférieurs superficiels sont visibles sur l’aspect profond de la peau. Essayez d’encapsuler l’intégralité des deux branches du SIEA avec le volet en soulevant doucement le volet vers le haut pour visualiser les vaisseaux.
- Une fois le lambeau récolté, séparez les coussinets graisseux sur la face inférieure sur les côtés médial et latéral du rabat. Utilisez la cautérisation bipolaire (voir le tableau des matériaux) pour cautériser les coussinets graisseux près du bord de l’incision, tout en veillant à ne pas endommager le pédicule épigastrique superficiel inférieur (Figure 2).
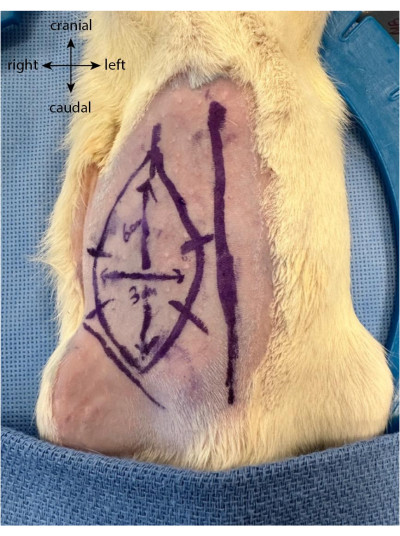
Figure 1 : Dessin du lambeau sur l’abdomen de l’animal. La ligne médiane est utilisée comme marqueur pour localiser l’emplacement du lambeau épigastrique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Rabat entièrement surélevé. Le coussinet graisseux est conservé à la partie proximale du lambeau pour préserver la vascularisation provenant du pédicule épigastrique superficiel inférieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Préparation des vaisseaux et induction de l’ischémie
REMARQUE : Le volet est entièrement récolté à ce stade, mais les vaisseaux ne sont pas encore préparés pour le préconditionnement ischémique.
- Avant la préparation du vaisseau fémoral, injecter une dose unique de 17,5 UI d’héparine de sodium par la veine pénienne.
REMARQUE: Cette injection se fait en exposant le gland, en tenant le pénis à l’extérieur à l’aide d’une pince Adson atraumatique, en identifiant la veine pénienne et en injectant superficiellement et le long de la veine du pénis à l’aide d’une seringue de 27 G. - Pour créer une meilleure exposition, placez l’animal dans un rétracteur auto-retenant Lone Star (voir le tableau des matériaux).
REMARQUE: Les haubans élastiques Lone Star éloignent la peau du site chirurgical, ce qui permet une meilleure vue des vaisseaux. Le chercheur doit maintenant travailler sous un microscope chirurgical (grossissement 40x). - Pour exposer les vaisseaux, utilisez deux pinces microchirurgicales #4 pour disséquer les vaisseaux fémoraux à la fois proximale et distale à l’émergence des vaisseaux épigastriques superficiels. Ne tenez pas les vaisseaux directement, mais utilisez plutôt les pinces pour séparer doucement le tissu conjonctif couche par couche en ouvrant et en fermant la pince verticalement aux vaisseaux.
- Sur les vaisseaux fémoraux distaux, nettoyez le fascia et libérez doucement le nerf de l’artère et de la veine. Utilisation d’un 8-0 suture en nylon (voir le tableau des matériaux), ligaturer les vaisseaux fémoraux distaux en contournant le porte-aiguille microchirurgical sous l’artère et la veine, en serrant la suture et en attachant ces vaisseaux (Figure 3). Le nerf ne doit pas être blessé ni attaché pour minimiser la morbidité postopératoire.
REMARQUE: Les chirurgiens peuvent utiliser l’une des pinces pour tirer doucement le fascia latéral au nerf avec une main et utiliser une autre paire pour séparer complètement le nerf des vaisseaux. - Utilisation d’un 8-0 suture, ligaturer les vaisseaux distaux juste après l’émergence des vaisseaux épigastriques, en laissant une distance de 1 mm après l’origine du pédicule. Cela garantit qu’aucun flux inverse ne traverse le SIEA à partir des branches profondes pendant les phases ischémiques.
NOTE: La figure 3 montre les vaisseaux fémoraux distaux ligaturés après l’émergence du pédicule SIEA. - Sur les vaisseaux fémoraux proximaux, répétez le même processus de nettoyage du tissu conjonctif. Cependant, séparez l’artère et la veine l’une de l’autre pour permettre un serrage efficace. Cela peut être réalisé en plaçant doucement des pinces fermées entre l’artère et la veine et en ouvrant lentement les pinces dans le sens de marche des vaisseaux.
- Pour induire une ischémie intermittente, placez des pinces microchirurgicales séparément sur chaque artère fémorale proximale et veine (Figure 4).
- Lorsque les lésions ischémiques sont terminées, suturer le volet à sa position initiale, en alignant les marques comme dessinées avant l’opération (étape 4.2.2). Suturer le volet à l’aide d’une suture de course avec du nylon 3-0 (voir le tableau des matériaux), en commençant par le pli inguinal médialement, autour du rabat, et en terminant au pli inguinal latéralement.
REMARQUE: Le long du pli inguinal, la même suture peut être utilisée pour placer des points interrompus. Cela permet aux chercheurs d’ouvrir cette zone sans affecter la fermeture du volet. - Pour vérifier l’apport sanguin au lambeau, injecter 0,25 mL de fluorescéine stérile sodique (10 %, voir le tableau des matières) dans la veine du pénis en utilisant la même technique et les mêmes outils que ceux décrits pour l’injection de solution saline d’héparine (étape 5.1). Après 3 min, faire briller une lampe UV-366 nm à ondes longues (lumière d’excitation à la fluorescéine) pour révéler les zones fluorescentes correspondant aux zones perfusées.
- Après la fermeture et la vérification, étaler le métronidazole broyé (voir le tableau des matières) le long des sutures pour prévenir l’automutilation et vaporiser un pansement liquide dans la même zone.
- Avant la récupération de l’animal de l’anesthésie, administrer du carprofène (2-5 mg / kg) par voie sous-cutanée.
- Les chercheurs peuvent maintenant accéder aux vaisseaux fémoraux, la seule source d’alimentation du volet, pour tester des régimes expérimentaux de préconditionnement ischémique pendant plusieurs jours d’affilée. Chaque jour de chirurgie, fournir une dose de 2-5 mg / kg de Carprofène par voie sous-cutanée.
- À la fin de la période de préconditionnement ischémique, pour retirer le lambeau de l’approvisionnement en sang épigastrique, cautériser inférieur au coussinet graisseux le long du bord inférieur du lambeau.
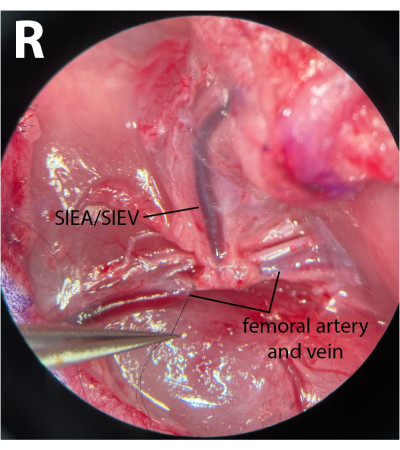
Figure 3 : Vue microscopique des vaisseaux fémoraux. Les vaisseaux fémoraux distaux sont attachés. Le nerf a été préservé. Le côté dissection est le pli inguinal droit (R). Grossissement: 40x. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Serrage des vaisseaux fémoraux proximaux à l’aide de deux pinces microchirurgicales distinctes. Cela permet un meilleur contrôle du serrage, assurant l’absence de flux veineux artériel et rétrograde. (A) montre les deux vaisseaux fémoraux gauche (L) serrés. Les vaisseaux épigastriques inférieurs superficiels sont visibles (SIEA/SIEV). (B) présente une artère fémorale serrée et une veine fémorale avant serrage, sur le pli inguinal droit de l’animal (R). Grossissement: 40x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Soins postopératoires
- Administrer du carprofène (2-5 mg / kg) par voie sous-cutanée une fois par jour pendant 4 jours postopératoires et une fois après toute sédation supplémentaire.
- Pendant les 24 premières h, observez l’animal deux fois. Ensuite, évaluez l’animal et le volet au moins une fois par jour jusqu’à la fin de l’étude.
REMARQUE : L’animal doit être vif, alerte et réactif. S’il y a des signes d’infections opportunistes systémiques (c.-à-d. léthargie ou perte de poids), l’animal doit être euthanasié selon les protocoles approuvés par l’établissement. - Surveiller le lambeau pour détecter une nécrose précoce (avant la ligature du jour 5 postopératoire [POD5]), une déhiscence du site chirurgical, une infection, un hématome, une ischémie et / ou une autophagie du lambeau.
- S’il y a déhiscence du site chirurgical, débrider les bords de la cicatrice, nettoyer le site avec 10% de povidone iodée avant de rincer abondamment avec de l’eau stérile ou une solution saline stérile, et fermer la plaie à l’aide de sutures en nylon 3-0 interrompues.
- À la fin de l’étude, euthanasier l’animal avec une injection intraveineuse de 0,1 à 0,2 mL de solution de phénobarbital de sodium à 31 % ou avec le protocole recommandé par l’IACUC local. Confirmer la mort par l’absence de battements cardiaques et de mouvements respiratoires.
Résultats
Tous les volets étaient viables sur POD5, montrant une bonne vascularisation par le SIEA seul. La figure 5 montre le lambeau avant et après l’injection de fluorescéine IV, montrant une vascularisation complète.

Figure 5 : Angiographie immédiate à la fluorescéine intraveineuse (POD0). Cette évaluation montre la vascularisation du lambeau par le seul SIEA. La fluorescence verte montre des tissus bien perfusés, y compris toute la palette à rabat. Grossissement: 40x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Un logiciel d’analyse des pixels (voir Tableau des matériaux) a été utilisé pour apporter une évaluation objective de la capacité de survie des volets. La fluorescence de la fluorescéine est située dans la longueur d’onde verte (une fenêtre de 115 à 255 nm a été utilisée). En sélectionnant la circonférence du volet, le logiciel fournit un pourcentage de pixels inclus dans la longueur d’onde spécifique. Cela permet de mesurer avec précision la capacité de survie des volets, car les pixels inclus dans les zones nécrotiques ne sont pas dans la fenêtre de longueur d’onde de fluorescence.
Les résultats de deux modèles témoins sont présentés : un groupe témoin négatif pour confirmer la viabilité de ce modèle de volet fasciocutané axial sans I.P., et un groupe témoin positif pour vérifier sa non-survivabilité en cas de ligature sur POD 5 sans I.P. préalable avec la littérature actuelle16. La figure 6 montre la conception expérimentale de ces deux modèles de contrôle.

Figure 6 : Chronologie des modèles des groupes témoins. Tous les groupes ont subi une élévation des volets sur POD0. Le groupe témoin négatif consistait en une observation du lambeau sans intervention chirurgicale sur les vaisseaux du volet. Le groupe témoin positif consistait en une ligature sur POD5 sans préconditionnement ischémique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Comme le montre la figure 7, le groupe témoin négatif a présenté toute la viabilité de la palette de volets. Dans ce groupe, 99,50% ± 0,76% de survie ont été observés à POD10, où aucune ligature n’a été effectuée sur les vaisseaux d’alimentation. Tous les animaux sont restés en bonne santé pendant cette période d’observation.
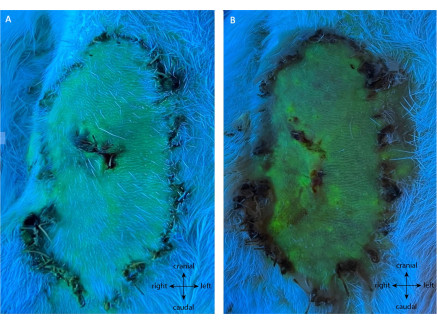
Figure 7 : Angiographie du témoin négatif à (A) POD5 et (B) POD10. Cette évaluation montre la survie totale du lambeau sans intervention sur son pédicule. La fluorescence verte montre des tissus bien perfusés, y compris toute la palette de rabat. Remarque : des biopsies témoins ont été effectuées sur cette réplique. Grossissement: 40x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le groupe témoin positif a subi la même chirurgie initiale de prélèvement de lambeau. Par la suite, sur POD5, les vaisseaux ont été cautérisés, coupant directement le flux sanguin vers le lambeau. Aucune I.P. n’a été réalisée avant la ligature. Tout au long de POD5-10, une nécrose progressive du lambeau a été remarquée lorsque le volet est devenu sombre et a durci. Comme le montre la figure 8A, la post-ligature du lambeau n’a montré aucune fluorescence après injection de fluorescéine IV en dehors de l’extrémité, tandis que la peau environnante était perfusée. Au POD10, le volet était viable sur 11,25% ± 1,58% de sa surface pour toutes les répliques (Figure 8B), montrant une faible autonomie de son pédicule principal sur POD5. Fait intéressant, la pointe distale était la seule partie qui a été autonome et qui a survécu au POD10.
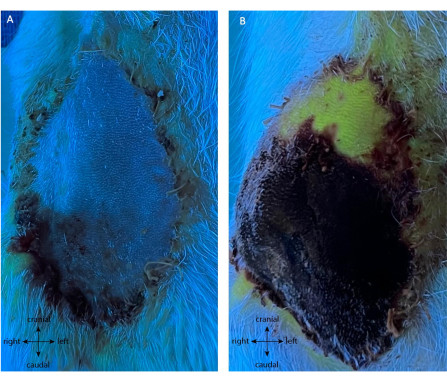
Figure 8 : Angiographie du témoin positif à (A) POD5 et (B) POD10 après la ligature. L’absence de fluorescence verte immédiatement après la ligature (A) ne montre aucune perfusion du lambeau, prouvant l’absence de néovascularisation. Ceci est confirmé à POD10 (B), avec nécrose de 85% de la palette cutanée (noir/violet). Fait intéressant, la pointe distale est viable et néovascularisée (partie fluorescente verte du volet). Grossissement: 40x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Un groupe (n = 3) utilisant des cycles courts de PI a également été testé pour démontrer la valeur de ce modèle. Les animaux ont subi trois cycles de 15 min d’ischémie, suivis de 15 min de reperfusion par serrage et déserrage de l’artère et de la veine des vaisseaux fémoraux proximaux, accessibles par le pli inguinal sur POD0, 1, 2 et 3, avant la ligature sur POD516.
Visuellement, les chercheurs ont confirmé la fonctionnalité de la période de serrage en observant une décoloration pâle/bleue du lambeau et un assombrissement du sang dans les vaisseaux épigastriques pendant les périodes d’ischémie. De plus, les chercheurs ont injecté de la fluorescéine sur POD5 après la ligature et ont observé une survie comparable au lambeau avec le groupe témoin positif (13,67% ± 5,03% de survie du lambeau), montrant que ce protocole I.P. est inefficace dans ce modèle (Figure 9).

Figure 9 : Analyse statistique de la viabilité de la surface des volets sur POD10. Des tests U de Mann-Whitney ont été effectués pour comparer les groupes. Les valeurs p bilatérales sont indiquées sur les lignes en zigzag U. Le groupe témoin négatif (n = 4) a montré une capacité de survie de 99,5%. Le groupe témoin positif (n = 5) a montré une capacité de survie de 11,25%. Le groupe expérimental, par exemple, a montré une capacité de survie de 13,67%, montrant une amélioration non significative par rapport au témoin positif (p = 0,86). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cet article décrit un modèle de lambeau fasciocutané reproductible récolté chez le rat, permettant une évaluation I.P. Ce protocole chirurgical étape par étape donne aux groupes de recherche un modèle fiable pour tester différents schémas IP. En empêchant toute vascularisation autre que le pédicule, ce modèle permet d’étudier la néovascularisation du lambeau à partir du lit et de la marge de la plaie. Cette étude a effectué la ligature sur POD5, car des études antérieures ont observé l’autonomisation de ce lambeau chez le rat sur POD5-711,13,16. Ce modèle vise à faciliter les études sur les lésions ischémiques-reperfusionnelles (IRI) qui optimisent et raccourcissent l’intervalle nécessaire à une autonomie complète. Ainsi, pour voir les résultats les plus significatifs avec le préconditionnement ischémique, notre objectif était de ligaturer les vaisseaux d’alimentation après autonomisation mais avant néovascularisation complète du lambeau (décrite comme se produisant sur POD716).
Le succès du modèle réside dans le fait de s’assurer qu’aucun dommage aux vaisseaux fémoraux ou SIE ne se produit lors de l’obtention du lambeau cutané, ce qui obligerait le chirurgien à maintenir la visualisation des vaisseaux pendant toute la procédure de lambeau. De plus, les vaisseaux fémoraux distaux doivent être correctement ligaturés pour induire une ischémie avec précision à travers les vaisseaux proximaux sans reflux provenant d’autres vaisseaux. Ces étapes sont essentielles pour observer les résultats expérimentaux.
L’avantage de ce modèle est qu’il préserve l’intégrité des vaisseaux épigastriques en manipulant les vaisseaux fémoraux à la place, après une préparation minutieuse des vaisseaux s’assurant que les vaisseaux fémoraux proximaux sont la seule source de sang pour le pédicule SIEA. L’avantage est que la taille des vaisseaux fémoraux serrés permet une bonne récupération de sa lumière. En revanche, une pince microchirurgicale veineuse peut endommager de façon permanente les vaisseaux épigastriques, nécessitant la fin de l’expérience. De plus, le curage du vaisseau fémoral dans le pli inguinal est plus accessible que dans le coussinet adipeux épigastrique après la chirurgie initiale en raison de la fibrose postopératoire. Ce modèle permet un accès plus sûr pour les chirurgies répétitives impliquant le serrage des vaisseaux; Hsu et coll.17 ont décrit un modèle similaire pour une étude IRI, mais n’ont pas décrit la procédure.
Une autre innovation de ce modèle est les injections IV de fluorescéine pour confirmer la vascularisation et la viabilité du lambeau. D’autres auteurs ont décrit des injections intraveineuses de vert d’indocyanine (ICG) dans un modèle de lambeau de rat18,19, similaire à son utilisation dans les cliniques 20,21. Cependant, le coût de l’ICG et du matériel spécifique nécessaire est une limitation et ne semble pas être une technique efficace22. Nous avons décrit une technique simple qui peut être utilisée dans n’importe quel laboratoire avec une simple lampe à bois, permettant une bonne visualisation de la viabilité et de la vascularisation du volet.
L’une des limites de ce modèle est l’impossibilité d’évaluer correctement deux volets chez le même animal. Il n’est pas possible d’évaluer simultanément à la fois un volet traité et un témoin biologique, en raison des effets potentiels de la PI à distance provoquée par le serrage du pédicule du volet controlatéral23.
Les applications cliniques de l’IP. peuvent améliorer la survie des lambeaux fasciocutanés en fournissant des protocoles fiables de séquences de pince / unclamp sur table par des chirurgiens plasticiens. Certains auteurs ont décrit l’utilisation de l’IP pour permettre une division plus précoce des pédicules dans les lambeaux frontaux et les lambeaux d’aine24,25. Cependant, les protocoles d’IP doivent être optimisés pour fournir aux chirurgiens un outil fiable permettant son utilisation plus courante. Le modèle que nous décrivons et l’I.P. à distance montrent des résultats prometteurs dans l’amélioration de la capacité de survie des volets fasciocutanés26. Enfin, ce modèle convient à l’étude des lésions d’ischémie-reperfusion et de la réponse systémique à ces types de stress, domaine de recherche23.
En conclusion, cette description précise d’un modèle fiable et reproductible offre un outil précieux pour les études sur les lésions intraveineuses et d’ischémie-reperfusion dans un modèle de volet fasciocutané de rat, fournissant aux chercheurs des vaisseaux plus grands à manipuler et à accéder par rapport aux modèles précédents.
Déclarations de divulgation
Tous les auteurs n’ont aucun intérêt financier à déclarer.
Remerciements
Ce travail a été financé par le Massachusetts General Hospital (W.G.A) et Shriners Children’s Boston (B.U, K.U, C.L.C). Y.B et I.F.v.R sont financés par les Hôpitaux Shriners pour enfants (ID de proposition : #970280 et #857829 respectivement).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Références
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon