Method Article
El colgajo axial superficial de la arteria epigástrica inferior para estudiar los efectos del preacondicionamiento isquémico en un modelo de rata
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la recolección, sutura y monitoreo de colgajos fasciocutáneos en ratas que permiten una buena visualización y manipulación del flujo sanguíneo a través de los vasos epigástricos inferiores superficiales mediante el pinzamiento y la ligadura de los vasos femorales. Esto es crítico para los estudios que involucran preacondicionamiento isquémico.
Resumen
Los colgajos fasciocutáneos (FCF) se han convertido en el estándar de oro para la reconstrucción de defectos complejos en cirugía plástica y reconstructiva. Esta técnica de preservación muscular permite transferir tejidos vascularizados para cubrir cualquier defecto grande. FCF se puede utilizar como colgajos pediculados o como colgajos libres; sin embargo, en la literatura, las tasas de fracaso para FCF pediculado y FCF libre son superiores al 5%, dejando margen de mejora para estas técnicas y una mayor expansión del conocimiento en esta área. El preacondicionamiento isquémico (P.I.) ha sido ampliamente estudiado, pero los mecanismos y la optimización del régimen I.P. aún no se han determinado. Este fenómeno está poco explorado en cirugía plástica y reconstructiva. Aquí, se presenta un modelo quirúrgico para estudiar el régimen de P.I. en un modelo de colgajo fasciocutáneo axial de rata, que describe cómo evaluar de manera segura y confiable los efectos de I.P. en la supervivencia del colgajo. Este artículo describe el procedimiento quirúrgico completo, incluyendo sugerencias para mejorar la confiabilidad de este modelo. El objetivo es proporcionar a los investigadores un modelo reproducible y confiable para probar varios regímenes de preacondicionamiento isquémico y evaluar sus efectos sobre la supervivencia del colgajo.
Introducción
La cirugía plástica y reconstructiva está en constante evolución. El desarrollo de colgajos musculares, fasciocutáneos y perforantes ha permitido ofrecer reconstrucciones de mejor calidad y reducir la morbilidad. Combinando este conocimiento anatómico mejorado con habilidades técnicas mejoradas, los cirujanos reconstructivos pueden realizar transferencias de colgajo gratuitas cuando los defectos no están cerca de ninguna solución local. Sin embargo, mientras que la cirugía con colgajo perforante es actualmente la técnica más avanzada en cirugía reconstructiva, la literatura reporta una tasa de fracaso del 5% en las transferencias de colgajo libre 1,2,3, y de hasta el 20% para la reconstrucción con colgajo pediculado 4,5,6. La falla parcial o total del colgajo ocurre cuando el pedículo del colgajo está comprometido, por lo tanto, es esencial buscar continuamente mejoras en las técnicas actuales. Uno de los métodos para mejorar la supervivencia del colgajo es promover su neovascularización en el lecho de la herida, permitiendo así la perfusión por una fuente distinta al pedículo. El preacondicionamiento isquémico (I.P.) se ha descrito inicialmente en un modelo cardíaco7, lo que demuestra que un órgano expuesto a isquemia controlada sobrevive en mayor grado después de perder su suministro primario de sangre al someterse a una neovascularización inducida por isquemia. Varios autores han estudiado este principio fundamental para optimizar la supervivencia del colgajo en modelos preclínicos y clínicos 8,9,10.
La ventaja de esta técnica sobre otros métodos para mejorar la supervivencia del colgajo es su facilidad de implementación, que consiste en pruebas de pinza/desclamp de la fuente de sangre. En el modelo de rata, los autores anteriores utilizaron el colgajo de la arteria epigástrica inferior superficial (SIEA) para estudiar la P.I. mediante el pinzamiento del pedículo principal11,12,13. No obstante, se pueden encontrar varios problemas técnicos con este modelo, y la literatura carece de protocolos bien descritos.
Por lo tanto, este trabajo tiene como objetivo proporcionar a los investigadores una descripción detallada de una técnica de obtención de colgajo SIEA de rata con una disección extendida de los vasos femorales para permitir estudios de IP en un modelo de colgajo fasciocutáneo axial. Este modelo conserva la integridad de los vasos epigástricos y en su lugar manipula los vasos femorales, que son más resistentes. Compartimos nuestra experiencia y herramientas para mejorar el estudio de este fenómeno y aumentar la replicabilidad de este procedimiento.
Protocolo
El Comité Institucional de Cuidado y Uso de Animales del Hospital General de Massachusetts aprobó el protocolo experimental (IACUC- protocolo #2022N000099). Los autores siguieron la lista de verificación de la guía ARRIVE (Animal Research: Reporting In Vivo Experiments) para este trabajo. Todos los animales recibieron atención humanitaria siguiendo la Guía del Instituto Nacional de Salud para el Cuidado y Uso de Animales de Laboratorio. Un total de 12 ratas Lewis macho (250-350 g, 8-10 semanas de edad) se utilizaron para todos los experimentos.
1. Preparación de animales
NOTA: Las ratas tienen una alta tasa metabólica y reservas de grasa limitadas; Por lo tanto, no los tenga ayuno antes de la cirugía y nunca restrinja el agua antes de la cirugía.
- Para todos los procedimientos, sedar al animal usando isoflurano al 3% -5% en la cámara del vaporizador de precisión de isoflurano (ver Tabla de materiales). Cuando el animal esté bien sedado, reduzca la dosis de isoflurano al 1% -3% a través de un cono nasal.
NOTA: Un segundo investigador debe monitorear continuamente la frecuencia respiratoria y adaptar la dosis de isoflurano. - A los 2 días antes de la cirugía inicial, coloque un collar electrónico de plástico (del tamaño de una rata; consulte la Tabla de materiales) en el animal y use una sutura de nylon 3-0 para asegurar el collar electrónico en los lados dorsal y ventral del cuello del animal. Espere 2 días para la aclimatación a este collar electrónico; Debe ajustarse perfectamente pero no obstruir las vías respiratorias del animal.
2. Cuidados preoperatorios
- El día de la cirugía inicial, afeite la cara anterior inferior del abdomen, despejando el área desde la parte lateral del animal hasta un poco más allá de la línea media.
- Luego, use un producto depilatorio (crema depilatoria; ver Tabla de materiales) para eliminar todo el vello restante en esta área (la cara anterior inferior del abdomen como se describe en el paso anterior).
- Lave y seque bien el área con exfoliante quirúrgico y solución de betadina (povidona yodada al 10%).
- Administrar 0,05 mg/kg de buprenorfina por vía subcutánea.
3. Monitorización intraoperatoria
- Asegúrese de que el animal permanezca con isoflurano al 1% -3% a través de un vaporizador de precisión y un cono nasal durante toda la cirugía. Controle la frecuencia respiratoria, la respiración y el nivel de saturación de oxígeno del animal mediante la observación visual y un oxímetro de pulso de roedor hecho para una rata.
NOTA: La frecuencia respiratoria típica es de 80-90 ciclos por minuto14,15. Cualquier reacción que indique conciencia observada durante la cirugía requiere aumentar la tasa de isoflurano. - Coloque al animal en una almohadilla de calentamiento durante toda la cirugía, ya que la temperatura corporal de los roedores se enfría rápidamente bajo anestesia.
4. Recolección del colgajo epigástrico
- Coloque al animal en posición supina. Afeite el abdomen desde debajo del pliegue inguinal hasta por encima del nivel del proceso xifoides.
- Usando una pluma de piel estéril y una regla, primero marque la línea media del abdomen del animal y luego el pliegue inguinal. Una incisión a lo largo de la línea de pliegue inguinal expone los vasos epigástricos inferiores que se ramifican de los vasos femorales.
- Antes de la incisión, dibuje el colgajo futuro como un óvalo o un rectángulo de hasta 6 cm verticalmente y 3 cm horizontalmente, extendiéndose cranealmente desde el pliegue inguinal.
- Dibuja cinco o seis marcas equidistantes perpendiculares a los límites del colgajo. Estos sirven como guías para realinear mejor la piel después de que el colgajo se haya levantado y se suture de nuevo en su lugar (Figura 1).
- Usando tijeras Ragnell (ver Tabla de materiales), haga una incisión longitudinal de 3-4 cm en el pliegue inguinal.
NOTA: Los investigadores deben tener precaución y tirar de la piel hacia arriba para evitar dañar los vasos. - Exponga e identifique los vasos femorales y epigástricos utilizando pinzas microquirúrgicas # 4 joyeros (ver Tabla de materiales), abriendo y cerrando los fórceps para separar la fascia y obtener acceso a los vasos que están debajo de la almohadilla de grasa inguinal.
- Use la incisión inguinal para comenzar la incisión del colgajo usando las tijeras Ragnell. Preste atención para socavar todo el grosor de la piel y el tejido conectivo sobre el músculo abdominal.
- Para facilitar la recolección del colgajo, asegúrese de que las tijeras sigan el plano de disección correcto empujando hacia el músculo y extendiendo las hojas de las tijeras. Realice este socavamiento de la solapa moviéndose en una dirección coordinada alrededor del dibujo de la solapa.
NOTA: Para determinar el plano adecuado, no deben permanecer microvasos por debajo del plano de disección.
- Para facilitar la recolección del colgajo, asegúrese de que las tijeras sigan el plano de disección correcto empujando hacia el músculo y extendiendo las hojas de las tijeras. Realice este socavamiento de la solapa moviéndose en una dirección coordinada alrededor del dibujo de la solapa.
- A medida que la punta inicial del colgajo se libera de la piel circundante, continúe la obtención del colgajo socavando desde la parte distal a la proximal, utilizando las puntas de tijera de Ragnell para separar el colgajo del músculo mientras cauteriza cualquier vaso perforante y vasos del plexo dérmico alrededor del colgajo. Esto asegura que toda la sangre fluya hacia el colgajo a través de los vasos epigástricos.
NOTA: Se debe prestar atención a no dañar la vasculatura del colgajo tirando con demasiada fuerza o torciendo la piel mientras se cosecha el colgajo. Se sugiere colocar la parte liberada del colgajo cuidadosamente sobre el pulgar de la mano del cirujano mientras se trabaja en la parte proximal del colgajo. - Una vez que el colgajo se cosecha por completo, las ramas de los vasos epigástricos inferiores superficiales son visibles en el aspecto profundo de la piel. Trate de encapsular la totalidad de ambas ramas del SIEA con el colgajo levantando suavemente el colgajo hacia arriba para visualizar los vasos.
- Una vez que se cosecha el colgajo, separe las almohadillas de grasa en el aspecto inferior en los lados medial y lateral del colgajo. Use la cauterización bipolar (consulte la Tabla de materiales) para cauterizar las almohadillas de grasa cerca del borde de la incisión, prestando atención a no dañar el pedículo epigástrico inferior superficial (Figura 2).
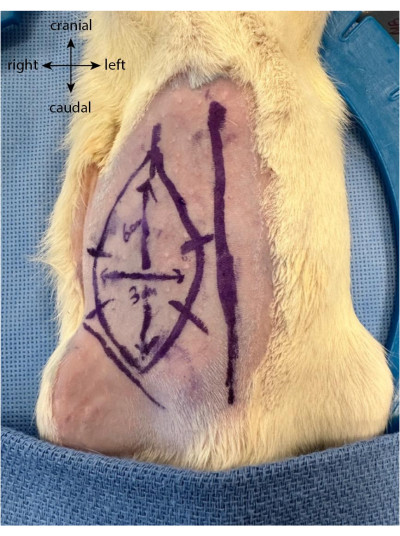
Figura 1: Dibujo del colgajo en el abdomen del animal. La línea media se utiliza como marcador para localizar la ubicación del colgajo epigástrico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Solap totalmente elevado. La almohadilla de grasa se conserva en la parte proximal del colgajo para preservar la vascularización proveniente del pedículo epigástrico inferior superficial. Haga clic aquí para ver una versión más grande de esta figura.
5. Preparación de vasos e inducción de isquemia
NOTA: El colgajo se cosecha completamente en esta etapa, pero los vasos aún no están preparados para el preacondicionamiento isquémico.
- Antes de la preparación del vaso femoral, inyecte una dosis única de 17,5 UI de heparina sódica a través de la vena del pene.
NOTA: Esta inyección se realiza exponiendo el glande, sosteniendo el pene externamente usando pinzas Adson atraumáticas, identificando la vena del pene e inyectando superficialmente y a lo largo de la vena del pene con una jeringa de 27 G. - Para crear una mejor exposición, coloque al animal dentro de un retractor de autoretención Lone Star (consulte la Tabla de materiales).
NOTA: Los soportes elásticos Lone Star alejan la piel del sitio quirúrgico, lo que permite una mejor vista de los vasos. El investigador ahora debe trabajar bajo un microscopio quirúrgico (aumento de 40x). - Para exponer los vasos, use dos pinzas microquirúrgicas # 4 para diseccionar los vasos femorales tanto proximal como distalmente a la aparición de los vasos epigástricos superficiales. No sostenga los vasos directamente, sino que use los fórceps para separar suavemente el tejido conectivo capa por capa abriendo y cerrando los fórceps verticalmente a los vasos.
- En los vasos femorales distales, limpie la fascia y libere suavemente el nervio de la arteria y la vena. Usando un 8-0 sutura de nylon (consulte la Tabla de materiales), ligar los vasos femorales distales eludiendo el soporte de la aguja microquirúrgica debajo de la arteria y la vena, sujetando la sutura y atando estos vasos (Figura 3). El nervio no debe ser dañado ni atado para minimizar la morbilidad postoperatoria.
NOTA: Los cirujanos pueden usar uno de los fórceps para tirar suavemente de la fascia lateral al nervio con una mano y usar otro par para separar completamente el nervio de los vasos. - Usando un 8-0 sutura, ligar los vasos distales justo después de la aparición de los vasos epigástricos, dejando una distancia de 1 mm después del origen pedicular. Esto asegura que ningún flujo inverso pase a través del SIEA desde las ramas profundas durante las fases isquémicas.
NOTA: La figura 3 muestra los vasos femorales distales ligados después de la aparición del pedículo SIEA. - En los vasos femorales proximales, repita el mismo proceso de limpieza del tejido conectivo. Sin embargo, separe la arteria y la vena entre sí para permitir un pinzamiento eficiente. Esto se puede lograr colocando suavemente fórceps cerrados entre la arteria y la vena y abriendo lentamente los tforceps en la dirección de carrera de los vasos.
- Para inducir isquemia intermitente, coloque pinzas microquirúrgicas por separado en cada arteria y vena femoral proximal (Figura 4).
- Cuando se completen las lesiones isquémicas, suturar el colgajo a su posición original, alineando las marcas tal como se dibujaron antes del operatorio (paso 4.2.2). Suture el colgajo usando una sutura con nylon 3-0 (ver Tabla de materiales), comenzando en el pliegue inguinal medialmente, alrededor del colgajo y terminando en el pliegue inguinal lateralmente.
NOTA: A lo largo del pliegue inguinal, se puede usar la misma sutura para colocar puntos interrumpidos. Esto permite a los investigadores abrir esta área sin afectar el cierre del colgajo. - Para verificar el suministro de sangre al colgajo, inyecte 0,25 ml de fluoresceína sódica estéril (10%, ver Tabla de materiales) en la vena del pene utilizando la misma técnica y herramientas descritas para la inyección de solución salina de heparina (paso 5.1). Después de 3 minutos, encienda una lámpara UV-366 nm de onda larga (luz de excitación fluoresceína) para revelar las áreas fluorescentes correspondientes a las áreas perfundidas.
- Después del cierre y la verificación, extienda metronidazol triturado (consulte la Tabla de materiales) a lo largo de las suturas para evitar la automutilación, y rocíe vendaje líquido en la misma área.
- Antes de la recuperación del animal de la anestesia, administrar carprofeno (2-5 mg / kg) por vía subcutánea.
- Los investigadores ahora pueden acceder a los vasos femorales, la única fuente de alimentación para el colgajo, para probar regímenes experimentales de preacondicionamiento isquémico durante varios días seguidos. En todos los días de la cirugía, proporcione una dosis de 2-5 mg / kg de carprofeno por vía subcutánea.
- Al final del período de preacondicionamiento isquémico, para eliminar el colgajo del suministro de sangre epigástrica, cauterice inferior a la almohadilla de grasa a lo largo del borde inferior del colgajo.
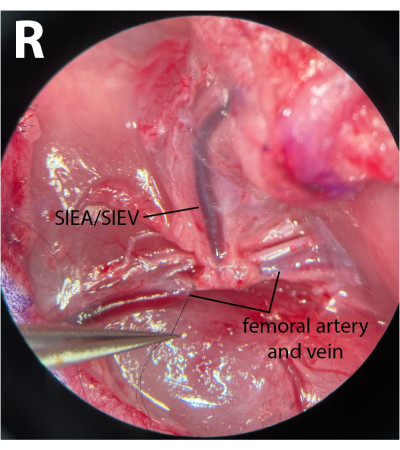
Figura 3: Vista microscópica de los vasos femorales. Los vasos femorales distales están atados. El nervio se ha conservado. El lado de la disección es el pliegue inguinal derecho (R). Ampliación: 40x. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Pinzamiento de los vasos femorales proximales utilizando dos pinzas microquirúrgicas separadas. Esto permite un mejor control del pinzamiento, asegurando la ausencia de flujo venoso arterial y retrógrado. (A) muestra los dos vasos femorales izquierdos (L) sujetados. Los vasos epigástricos inferiores superficiales son visibles (SIEA/SIEV). (B) muestra una arteria femoral pinzada y una vena femoral antes del pinzamiento, en el pliegue inguinal derecho del animal (R). Ampliación: 40x. Haga clic aquí para ver una versión más grande de esta figura.
6. Cuidados postoperatorios
- Administrar carprofeno (2-5 mg/kg) por vía subcutánea una vez al día durante 4 días después de la operación y una vez después de cualquier sedación suplementaria.
- Durante las primeras 24 h, observe al animal dos veces. Luego, evalúe el animal y el colgajo al menos una vez al día hasta el final del estudio.
NOTA: El animal debe ser brillante, alerta y reactivo. Si hay signos de infecciones oportunistas sistémicas (es decir, letargo o pérdida de peso), el animal debe ser sacrificado siguiendo los protocolos aprobados por la institución. - Controle el colgajo para detectar necrosis temprana (antes de la ligadura en el día postoperatorio 5 [POD5]), dehiscencia del sitio quirúrgico, infección, hematoma, isquemia y / o autofagia del colgajo.
- Si hay dehiscencia en el sitio quirúrgico, desbridar los márgenes de la cicatriz, limpiar el sitio con povidona yodada al 10% antes de enjuagar bien con agua estéril o solución salina estéril, y cerrar la herida con suturas de nylon 3-0 interrumpidas.
- Al final del estudio, eutanasia al animal con una inyección IV de 0.1-0.2 mL de solución de fenobarbital sódico al 31% o con el protocolo recomendado por el IACUC local. Confirmar la muerte por la ausencia de latidos cardíacos y movimientos respiratorios.
Resultados
Todos los colgajos fueron viables en POD5, mostrando una buena vascularización por el SIEA solo. La figura 5 muestra el colgajo antes y después de la inyección IV de fluoresceína, mostrando una vascularización completa.

Figura 5: Angiografía con fluoresceína intravenosa inmediata (POD0). Esta evaluación muestra la vascularización del colgajo por el SIEA solo. La fluorescencia verde muestra tejido bien perfundido incluyendo toda la paleta del colgajo. Ampliación: 40x. Haga clic aquí para ver una versión más grande de esta figura.
Se utilizó un software de análisis de píxeles (ver Tabla de materiales) para proporcionar una evaluación objetiva de la capacidad de supervivencia del colgajo. La fluoresceína fluorescente se encuentra en la longitud de onda verde (se utilizó una ventana de 115 a 255 nm). Al seleccionar la circunferencia de la solapa, el software proporciona un porcentaje de píxeles incluidos en la longitud de onda específica. Esto permite la medición precisa de la capacidad de supervivencia del colgajo, ya que los píxeles incluidos en las áreas necróticas no están dentro de la ventana de longitud de onda de fluorescencia.
Se presentan los resultados de dos modelos control: un grupo control negativo para confirmar la viabilidad de este modelo de colgajo fasciocutáneo axial sin P.I., y un grupo control positivo para verificar su no supervivencia en caso de ligadura en POD 5 sin I.P. previo con la literatura actual16. La Figura 6 muestra el diseño experimental para ambos modelos de control.

Figura 6: Línea de tiempo de los modelos de grupo de control. Todos los grupos se sometieron a elevación del colgajo en POD0. El grupo de control negativo consistió en la observación del colgajo sin intervención quirúrgica en los vasos del colgajo. El grupo control positivo consistió en ligadura en POD5 sin preacondicionamiento isquémico. Haga clic aquí para ver una versión más grande de esta figura.
Como se ve en la Figura 7, el grupo de control negativo presentó toda la viabilidad de la paleta de solapa. En este grupo, 99,50% ± 0,76% de supervivencia se experimentó en POD10, donde no se realizó ligadura en los vasos de alimentación. Todos los animales permanecieron sanos durante este período de observación.
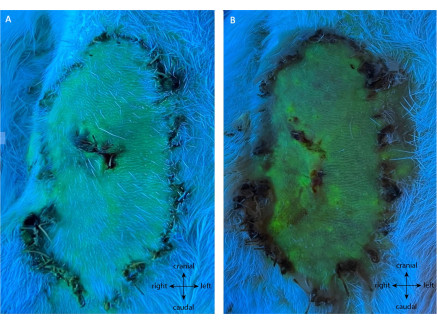
Figura 7: Angiografía del control negativo en (A) POD5 y (B) POD10. Esta evaluación muestra la supervivencia completa del colgajo sin intervención en su pedículo. La fluorescencia verde muestra tejido bien perfundido, incluyendo toda la paleta del colgajo. Nota: las biopsias de control se tomaron en esta réplica. Ampliación: 40x. Haga clic aquí para ver una versión más grande de esta figura.
El grupo de control positivo se sometió a la misma cirugía inicial de recolección de colgajo. Posteriormente, en POD5, los vasos fueron cauterizados, cortando directamente el flujo sanguíneo al colgajo. No se realizó ninguna P.I. antes de la ligadura. A lo largo de POD5-10, se notó necrosis progresiva del colgajo a medida que el colgajo se volvía de color oscuro y se endurecía. Como se ve en la Figura 8A, el colgajo posterior a la ligadura no mostró ninguna fluorescencia después de la inyección de fluoresceína IV, aparte de la punta, mientras que la piel circundante estaba perfundida. Para POD10, el colgajo era viable sobre el 11,25% ± el 1,58% de su superficie para todas las réplicas (Figura 8B), mostrando una pobre autonomización de su pedículo principal en POD5. Curiosamente, la punta distal fue la única parte que se autonomizó y sobrevivió en POD10.
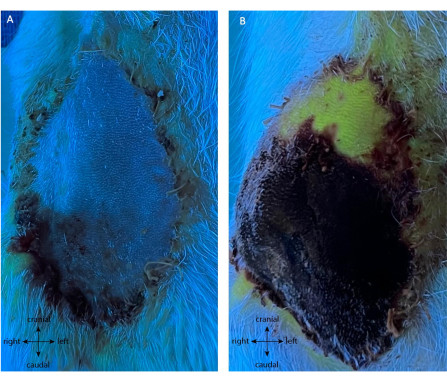
Figura 8: Angiografía del control positivo en (A) POD5 y (B) POD10 post ligadura. La ausencia de la fluorescencia verde inmediatamente después de la ligadura (A) no muestra perfusión del colgajo, lo que demuestra la ausencia de neovascularización. Esto se confirma en POD10 (B), con necrosis del 85% de la paleta de piel (negro / púrpura). Curiosamente, la punta distal es viable y neovascularizada (parte verde fluorescente del colgajo). Ampliación: 40x. Haga clic aquí para ver una versión más grande de esta figura.
También se probó un grupo (n = 3) que utilizó ciclos cortos de I.P. para demostrar el valor de este modelo. Los animales se sometieron a tres ciclos de 15 min de isquemia, seguidos de 15 min de reperfusión mediante pinzamiento y despinzamiento de la arteria y vena de los vasos femorales proximales, accedidos a través del pliegue inguinal en POD0, 1, 2 y 3, antes de la ligadura en POD516.
Visualmente, los investigadores confirmaron la funcionalidad del período de pinzamiento observando una decoloración pálida / azul del colgajo y el oscurecimiento de la sangre en los vasos epigástricos durante los períodos de isquemia. Además, los investigadores inyectaron fluoresceína en POD5 después de la ligadura y observaron una supervivencia de colgajo comparable con el grupo de control positivo (13,67% ± 5,03% de supervivencia del colgajo), lo que demuestra que este protocolo de IP es ineficiente en este modelo (Figura 9).

Figura 9: Análisis estadístico de la viabilidad de la superficie del colgajo en POD10. Se realizaron pruebas U de Mann-Whitney para comparar grupos. Los valores p de dos colas se muestran sobre las líneas en zigzag U. El grupo control negativo (n = 4) mostró 99,5% de supervivencia. El grupo control positivo (n = 5) mostró una supervivencia del 11,25%. El grupo experimental, como ejemplo, mostró una supervivencia del 13,67%, mostrando una mejoría no significativa en comparación con el control positivo (p = 0,86). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo describe un modelo de colgajo fasciocutáneo reproducible cosechado en ratas, lo que permite la evaluación de IP. Este protocolo quirúrgico paso a paso proporciona a los grupos de investigación un modelo confiable para probar diferentes regímenes de PI. Al prevenir cualquier vascularización que no sea el pedículo, este modelo permite estudiar la neovascularización del colgajo desde el lecho de la herida y el margen. Este estudio realizó la ligadura en POD5, ya que estudios previos han observado la autonomización de este colgajo en ratas en POD5-711,13,16. Este modelo tiene como objetivo ayudar en los estudios de lesión por isquemia-reperfusión (IRI) que optimizan y acortan el intervalo necesario para la autonomización completa. Por lo tanto, para ver los resultados más significativos con el preacondicionamiento isquémico, nuestro objetivo fue ligar los vasos alimentadores después de la autonomización pero antes de la neovascularización completa del colgajo (descrito en POD716).
El éxito del modelo radica en garantizar que no se produzcan daños en los vasos femorales o SIE durante la obtención del colgajo de piel, lo que requeriría que el cirujano mantenga la visualización de los vasos durante todo el procedimiento de colgajo. Además, los vasos femorales distales deben estar ligados correctamente para inducir isquemia con precisión a través de los vasos proximales sin reflujo proveniente de otros vasos. Estos pasos son críticos para observar los resultados experimentales.
El beneficio de este modelo es que preserva la integridad de los vasos epigástricos mediante la manipulación de los vasos femorales, después de una cuidadosa preparación de los vasos, asegurando que los vasos femorales proximales sean la única fuente de sangre para el pedículo SIEA. La ventaja es que el tamaño de los vasos femorales pinzados permite una buena recuperación de su luz. Por el contrario, una pinza microquirúrgica venosa puede dañar permanentemente los vasos epigástricos, lo que requiere la terminación del experimento. Además, la disección del vaso femoral en el pliegue inguinal es más accesible que en la almohadilla de grasa epigástrica después de la cirugía inicial debido a la fibrosis postoperatoria. Este modelo permite un acceso más seguro para cirugías repetitivas que involucran la sujeción de vasos; Hsu et al.17 describieron un modelo similar para un estudio IRI, pero no describieron el procedimiento.
Otra innovación de este modelo son las inyecciones de fluoresceína IV para confirmar la vascularización y viabilidad del colgajo. Otros autores describieron inyecciones IV de verde de indocianina (ICG) en un colgajo de rata modelo18,19, similar a su uso en clínicas 20,21. Sin embargo, el costo de ICG y el hardware específico necesario es una limitación y no parece ser una técnica eficiente22. Describimos una técnica simple que se puede utilizar en cualquier laboratorio con una simple lámpara de madera, permitiendo una buena visualización de la viabilidad y vascularización del colgajo.
Una limitación de este modelo es la imposibilidad de evaluar adecuadamente dos colgajos en el mismo animal. No es posible evaluar simultáneamente un colgajo tratado y un control biológico, debido a los efectos potenciales de la P.I. remota provocada por la pinzamiento del pedículo del colgajo contralateral23.
Las aplicaciones clínicas de I.P. pueden mejorar la supervivencia del colgajo fasciocutáneo al proporcionar protocolos confiables de secuencias de pinza/despinzamiento en mesa por cirujanos plásticos. Algunos autores han descrito el uso de IP para permitir una división pedicular más temprana en colgajos de frente e ingle24,25. Sin embargo, los protocolos de P.I. deben optimizarse para proporcionar a los cirujanos una herramienta confiable para permitir su uso más común. Tanto la localización -posibilitada con el modelo que describimos- como la I.P. remota muestran resultados prometedores en la mejora de la supervivencia del colgajo fasciocutáneo26. Finalmente, este modelo es adecuado para el estudio de las lesiones por isquemia-reperfusión y la respuesta sistémica a tales tipos de estrés, que es un área de interésde investigación 23.
En conclusión, esta descripción precisa de un modelo confiable y reproducible ofrece una herramienta valiosa para los estudios de lesiones por I.P. e isquemia-reperfusión en un modelo de colgajo fasciocutáneo de rata, proporcionando a los investigadores vasos más grandes para manipular y acceder en comparación con los modelos anteriores.
Divulgaciones
Todos los autores no tienen ningún interés financiero que declarar.
Agradecimientos
Este trabajo fue financiado por el Hospital General de Massachusetts (W.G.A) y Shriners Children's Boston (B.U, K.U, C.L.C). Y.B e I.F.v.R son financiados por los Hospitales Shriners para Niños (ID de propuesta: #970280 y #857829 respectivamente).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referencias
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados