Method Article
ゼブラフィッシュ脳に侵入する膠芽腫細胞における微小管動態のライブイメージング
要約
脊椎動物の脳組織に侵入する膠芽腫(GBM)細胞における微小管動態のライブイメージングを可能にする技術を報告する。蛍光タグ付きGBM細胞の透明なゼブラフィッシュ脳への同所性注射と高解像度の生体内イメージングを組み合わせることで、 in situ がん浸潤中の細胞骨格動態の測定が可能になります。
要約
実際の集団での生存期間の中央値は6〜15か月で、膠芽腫(GBM)は最も壊滅的な悪性脳腫瘍です。治療の失敗は主にGBM細胞の侵襲性によるものであり、これはGBMの運動特性をよりよく理解する必要性を物語っています。GBMの浸潤を支える分子機構を調べるためには、浸潤時のタンパク質動態の詳細な特性評価を可能にする新しい生理学的モデルが必要です。これらの観察結果は、腫瘍浸潤をブロックし、患者の転帰を改善するための新しい標的の発見への道を開くでしょう。この論文は、ゼブラフィッシュ脳内のGBM細胞の同所性異種移植片が、細胞内の生体内ライブイメージングをどのように可能にするかを報告しています。微小管(MT)に着目し、GBM細胞におけるMT標識、受精後3日(dpf)ゼブラフィッシュ幼虫の透明脳へのGBM細胞のマイクロインジェクション、播種異種移植片におけるMTの生体内イメージング、GBM侵入時のMT動態評価のためのMT動態の変化、および取得したデータの解析の手順について説明します。
概要
細胞の運動性は、極性軸の確立と力を生み出す細胞骨格の再配列を必要とする常同型のプロセスです。アクチン重合とそのミオシンとの会合は、細胞の動きに必要な突出力と収縮力の主な寄与因子として認識されています1。微小管は、遊走中の細胞分極と方向性持続性の主なアクターであると考えられています2。近年、MTは、3D3における細胞浸潤中の機械圧縮力をサポートするために突起を作成および安定化することも示されています。最近では、MTは局所接着時のメカノトランスダクションと機械感受性移動に直接関与しています4。MTプラス末端ダイナミクスを特徴付ける動的不安定性は、重合(増殖)と解重合(収縮)の繰り返し相から成り立っており、これらは多数の微小管結合タンパク質と、RHO-GTPase5,6,7によって支配されるような細胞内シグナル伝達カスケードによって制御されています。細胞の移動と浸潤におけるMTネットワークの役割により、MTダイナミクスの研究は、免疫細胞ホーミング、創傷治癒、および癌浸潤のメカニズムをよりよく理解するための重要な要素になりました。
癌細胞が原発腫瘍コアから脱出し、組織内に広がり、二次腫瘍を生成する能力は、50年前に宣言された癌との戦いにおける世界的な成功を防ぐための重要なステップです8,9。最大のハードルの1つは、癌細胞がどのように活発に組織に侵入するかを理解することでした。主要な浸潤メカニズムは、非腫瘍性細胞の移動を支配するものと同じ原理に依存しています10。しかし、がん細胞の遊走特異性が浮上しており11、このタイプの遊走のより良い特徴付けの必要性を引き起こしています。具体的には、腫瘍微小環境ががんの進行のキープレーヤーとして現れるため12、がん細胞の拡散のメカニズムを解明するには、関連する生理学的状況でがん細胞の浸潤を観察および分析することが不可欠です。
MTは、増殖と浸潤の両方を維持するために、癌の進行の中心です。MT動態をその場で正確に分析することで、両方のプロセスでMT変化因子(MTA)を特定することができます。MTのダイナミクスは、環境の変化によって大きく変化します。in vitroでは、ノコダゾールなどのMT不安定化剤による処理は、細胞が3Dでゲルに埋め込まれている場合の細胞突出の形成を防ぎますが、2D細胞の移動にはほとんど影響を与えません13,14。技術的には困難ですが、生体内イメージングの進歩により、がん細胞浸潤中のMT動態のin vivo解析が可能になります。例えば、マウスの皮下異種移植線維肉腫細胞におけるMTの観察は、腫瘍関連マクロファージが腫瘍細胞のMT動態に影響を与えることを明らかにした15。しかし、これらのマウスモデルは広範な外科的処置を必要とし、高浸潤性脳腫瘍であるGBMなどのアクセスしにくい癌には満足のいくものではありません。
15か月の平均生存期間16という悲惨な結果にもかかわらず、脳実質内でのGBMの播種様式や、脳組織へのGBM細胞の浸潤を維持する重要な分子要素についてはほとんど知られていません。マウス同所性異種移植片(PDX)モデルの改善と頭蓋窓の確立は、GBM細胞浸潤研究の新たな展望を提供しました17,18。しかし、イメージング品質が最適ではないため、このモデルは表在性異種移植片の縦断的イメージングをほとんど可能にし、これまでのところ細胞骨格タンパク質の細胞内イメージングの研究に成功していません。さらに、げっ歯類の使用を減らし、低等脊椎動物に置き換えるための「3R」差し止め命令を受けて、代替モデルが確立されました。
ゼブラフィッシュ(Danio rerio)幼虫で観察された原始免疫を利用して、魚類脳におけるGBM細胞の同所性注射が開発された19,20,21。発達中の中脳における脳室近傍への注射は、ヒトGBM病態生理学21の大部分を要約し、ヒトにおけるのと同じ好ましいGBM浸潤の好ましいパターンが観察される22。魚の幼虫の透明性のおかげで、このモデルは、ほとんどのGBMが発生すると考えられている脳室周囲領域から脳に侵入するGBM細胞の視覚化を可能にします23。
MTはin vitroでのGBM細胞浸潤に不可欠であるため24,25、MTダイナミクスのより良い特性評価と細胞浸潤中の重要な調節因子の同定が必要です。しかし、今日まで、ゼブラフィッシュ同所性モデルで生成されたデータには、侵入過程におけるMT動態の細胞内解析は含まれていない。この論文は、in vivoでのMTダイナミクスを研究し、脳腫瘍浸潤中のその役割を決定するためのプロトコルを提供します。安定した微小管標識に続いて、GBM細胞をゼブラフィッシュ幼虫の脳に3 dpfでマイクロインジェクションし、脳組織での進行中に高い時空間分解能でリアルタイムでイメージングします。蛍光MTのライブイメージングにより、MTプラスエンドダイナミクスの定性的および定量的分析が可能になります。さらに、このモデルにより、MTAがMTダイナミクスおよびGBM細胞の侵襲特性に及ぼす影響をリアルタイムで評価することができます。この比較的非侵襲的なプロトコルは、一度に処理される多数の幼虫と(魚水中での)薬物適用の容易さを組み合わせることで、このモデルを前臨床試験の資産にします。
プロトコル
動物実験は、実験動物の取り扱いに関する欧州連合のガイドラインに従って実施されました。すべてのプロトコルは、パスツール研究所の動物実験のための倫理委員会-CEEA 89およびフランスの研究教育省によって承認されました(許可#01265.03)。注射またはライブイメージングセッション中に、動物は実験手順の終了 Tricaine.At 麻酔され、麻酔薬の過剰摂取によって安楽死させた。このプロトコルで使用される材料、機器、およびソフトウェアに関連する詳細については、 材料の表 を参照してください。プロトコルの一般的なワークフローを 図 1 に示します。
1. α-チューブリン-mKate2を安定発現する膠芽腫細胞の作製
注意: 次の手順は、バイオセーフティキャビネットBSL2 +で実行されます。
- 7 ×10 6 HEK-293T細胞のトランスフェクションのためにリン酸カルシウム法を用いてmKate2-チューブリンを発現するレンチウイルス粒子を作製する。
- 1.5 mLの微量遠心チューブに、第2世代パッケージング プラスミドpsPAX2を10 μg、ウイルスエンベローププラスミドpMD2.Gを5 μg、目的のプラスミドpGK-mKate2-ヒトチューブリンα1aを50 μLのCaCl 2(2.5 Mストック)とともに10 μg加えます。滅菌DNAseフリーH2Oで500 μLに調整します。
注 : CaCl2 を最後に追加することが重要です。 - チューブを数回反転させて混合し、室温(RT)で20分間インキュベートします。
- インキュベーション中に、500 μLのHEPES緩衝生理食塩水(HBS)、pH 7.0(2x)を含む別の1.5 mLマイクロ遠心チューブを準備します。
- 20分後、CaCl2/DNAミックスをHBS(2x)溶液に一滴ずつ加えます。チューブを数回反転させて混ぜます。RTで12分間インキュベートします。
- 12分後、HBSと混合したCaCl2/DNAを、HEK-293T細胞の70%コンフルエントな10 cmディッシュに直接一滴ずつ穏やかに加えます。
- 細胞を加湿インキュベーターに5%CO2 を入れた37°Cで36〜48時間放置します。
- 上清を集め、3,000 × g で5分間回転させて細胞の破片を取り除きます。
- ウイルス粒子を濃縮するには、上清を超遠心チューブに入れ、47,508 × g で4°Cで90分間スピンダウンします。
- 上清を捨て、チューブを逆さまにして紙の上に置いて、チューブの内側を乾かします。
- 30 μLのPBSをウイルスペレットに加えます。ペレットを再懸濁しないでください。4°Cで2時間放置します。
- ピペッティングでウイルス粒子を上下にゆっくりと再懸濁します。泡を作らないでください。-80°Cで保存してください。
注:HEK-2-93T細胞の複数のプレートをトランスフェクトすることにより、より多くのウイルス粒子を生成できます。
- 1.5 mLの微量遠心チューブに、第2世代パッケージング プラスミドpsPAX2を10 μg、ウイルスエンベローププラスミドpMD2.Gを5 μg、目的のプラスミドpGK-mKate2-ヒトチューブリンα1aを50 μLのCaCl 2(2.5 Mストック)とともに10 μg加えます。滅菌DNAseフリーH2Oで500 μLに調整します。
- 膠芽腫細胞にレンチウイルス粒子を感染させる。
注:このプロトコルは、U-87 MG、U-373 MG、T98などの市販の膠芽腫細胞株用に作成されています。初代患者由来の膠芽腫細胞を使用するために、プレートおよび非血清ベースの培地26の特異的コーティングを使用する。- 10%ウシ胎児血清、ペニシリン-ストレプトマイシン(ペニシリンの最終濃度100単位/mL、ストレプトマイシンの最終濃度100 μg/mL)、および非必須アミノ酸(1x)を添加したイーグルの最小必須培地(MEM)で増殖させたU-87 MG膠芽腫細胞の70%コンフルエントな10 cmディッシュを準備します。
- ウイルス粒子を5,000分の1の希釈で細胞に直接加えます。穏やかな渦巻きで混ぜます。ウイルスが20時間以内に細胞に感染するのを待ちます。
- ウイルス含有培地を取り出し、新鮮な培地と交換します。タグ付きチューブリンの発現を48〜72時間許可します。
注意: 次の手順は、バイオセーフティキャビネットBSL2で実行する必要があります。 - 細胞をFACSソートして、mKate2+ 細胞の中で最も明るい15%を選択します。前方散乱および側方散乱(FCS対SSC)ゲーティングを使用してデブリとダブレットセルを除去した後、最も明るい30%のmKate2+ セルに別のゲーティングを適用して、上位15%を維持します。
- MT標識細胞を増幅します。
注:あるいは、高レベルのチューブリン-mKate2に基づくクローン選択を落射蛍光顕微鏡下で行うことができます。
2.ゼブラフィッシュの幼虫をマイクロインジェクション用に準備します
- ゼブラフィッシュの卵を生成します。
- 異種移植の4日前の午後遅くに、目的のゼブラフィッシュ系統の3人の男性と4人の女性をビー玉を補給した交配タンクに入れます。
注:Tg(fli1a:gfp)、Tg(gfap:gfp)、またはTg(Huc:gfp)ラインは、それぞれ内因性血管、神経幹細胞/星状細胞、およびニューロンをマークするために使用されます。 - 翌朝、大理石による産卵によって生産された卵を集めます。
- 漂白剤(0.004%最終)を添加したミネラル源水27 で満たされた50mLの遠心分離管に卵を移して卵をきれいにします。チューブを5分間静かに反転させます。ミネラルウォーターのみで2回洗ってください。
- 0.28 mg / mLメチレンブルーを添加したミネラルウォーターを含むペトリ皿に卵を移します。
- 未受精卵と発育停止卵を取り除きます。胚を28°Cでインキュベートします。
- 異種移植の4日前の午後遅くに、目的のゼブラフィッシュ系統の3人の男性と4人の女性をビー玉を補給した交配タンクに入れます。
- 透明な幼虫を作成します。
- N-フェニルチオ尿素(PTU)(最終0.003%)を8時間後に培地に導入し、メラニン色素沈着を防ぎ、光透過性を確保します。プロトコルの残りの部分では、PTUを培地に入れたままにします。
注:PTU治療は発達障害を引き起こす可能性があるため、異種移植には正常に発達した幼虫のみを選択してください。化学処理の代わりに、色素沈着がない変異ゼブラフィッシュ株キャスパー(真珠層とロイオービソン二重変異体)を使用することができる28。 - インキュベーション温度を29°Cに上げます。
- 毎日温度を1°C上げて、3 dpfの幼虫が注射日に32°Cに達するようにします。
- N-フェニルチオ尿素(PTU)(最終0.003%)を8時間後に培地に導入し、メラニン色素沈着を防ぎ、光透過性を確保します。プロトコルの残りの部分では、PTUを培地に入れたままにします。
- マイクロインジェクションプレートを準備します。
- ミネラルウォーターで20 mLの1%アガロース+ 0.28 mg/mLメチレンブルーを準備します。
- アガロースを10cmのペトリ皿に注ぎ、マイクロインジェクションプラスチックモールドを逆さまにすばやく適用して、幅2.5mmのV字型の溝を作ります(図2B)。
注:プラスチック金型は市販されているか、Zebrafish Book29に記載されている設計に従って社内で構築できます。 - アガロースが固まったら、プラスチック金型を慎重に取り外します。
注:マイクロインジェクションキャストプレートは、4°Cで最大2か月間保存できます。
- 異種移植のために幼虫を準備します。
- 注射の日に、3dpf幼虫における選択された蛍光導入遺伝子発現についてスクリーニングする。非蛍光性の異常に見える動物を取り除きます。
- 先端の細かい時計職人の鉗子で幼虫を手動で脱コリオンします。3 dpfで、2対の細い先端の鉗子で絨毛膜をそっと突くか引き裂いて、幼虫を絨毛膜から解放します。
注:あるいは、プロナーゼAによる酵素処理を使用して、通常24hpfで幼虫を脱絨毛化することができます。 - 脱絨毛化した幼虫をメチレンブルー(0.28 mg / mL)とPTU(0.003%最終)を含むミネラルウォーター培地に維持します。
3.異種移植手順
- マイクロインジェクション針を準備します。
- 中央フィラメントのないホウケイ酸ガラスキャピラリーを取り、垂直ニードルプラーに入れます。
- 次の設定を使用して-8.5を増やし、ヒーター3-毛細血管を伸ばしてマイクロインジェクションニードルに変えます。
- マイクロインジェクターをセットアップします。
- 手動マイクロインジェクターに鉱油をロードします。気泡を取り除きます。
- ユニバーサルキャピラリーホルダーをマイクロインジェクターに差し込み、機械式マイクロマニピュレーターにしっかりと取り付けます(図2A)。
- 膠芽腫細胞を採取します。
注意: 次の手順は、バイオセーフティキャビネットBSL2で実行されます。- 移植日に80%のコンフルエントに達するように、膠芽腫細胞の10 cmプレートを準備します。
- (オプション)細胞にHoechst 35480(200 ng/mL)を添加して、細胞核を一過性に標識します。加湿セルインキュベーター内で37°Cで20分間インキュベートし、PBSで2回洗浄します。
- 細胞のプレートをインキュベーターから取り出し、PBSで一度洗浄します。1 mLの0.05%トリプシン-EDTAを添加し、すべての細胞が完全に剥離するまで細胞インキュベーター内で37°Cで5〜10分間インキュベートして、細胞を剥離します。
注:トリプシン処理が不十分な場合、細胞凝集体が針に詰まったままになるため、このステップは重要です。 - 50 mLの遠沈管内の5 mLの完全膠芽腫細胞培地に細胞を再懸濁します。45 mLの氷冷PBSを加え、134 × g で5分間遠心分離します。
- 上清を廃棄し、完全に上下にピペッティングして、1 mLの氷冷PBSで細胞を再懸濁します。
注:機械的解離のこのステップは、マイクロインジェクション中にキャピラリーが詰まるリスクを防ぐのに大いに役立ちます。 - 49 mLの氷冷PBSを加え、134 × g で5分間遠心分離します。上清を廃棄し、細胞を200 μLの氷冷PBSに再懸濁します。移植手順の間、氷上に保管してください。
- 膠芽腫細胞をゼブラフィッシュ幼虫の中脳にマイクロインジェクションします。
- マイクロインジェクションキャストプレートに、160 mg / Lのトリカインを添加した6 mLのE3培地30 を充填します。
- 12個の脱絨毛幼虫をマイクロインジェクションプレートに移します。タッチに反応しなくなったら、横向きのトレンチに合わせ、頭を上げ、卵黄嚢をサイズ00のペイントブラシでトレンチの壁に押し付けます(図2B、C)。
- 膠芽腫細胞を再懸濁します。マイクロローディングチップを使用して5 μLの細胞をマイクロキャピラリーにロードし、キャピラリーをユニバーサルキャピラリーホルダーに挿入します。
- 反応しない幼虫を含むマイクロインジェクションプレートを実体顕微鏡下に置きます。マイクロマニピュレーターノブを使用して、マイクロキャピラリーの先端をマイクロ注入プレートの境界に配置します。メスで割って、細胞の直径とほぼ同じ大きさの鋭いエントリポイントを作成します。
- マイクロインジェクターにオイルを静かに流し、針の先端を培地に突っ込んで、細胞が毛細血管から流出していることを確認します。毛細血管の先端に細胞を濃縮して、排出される体積あたりに注入される細胞の数を最大化し、脳組織をPBSで満たさないようにします(図2C)。
- オイルが手動でインジェクターに導入されるときに、マイクロキャピラリーから出てくる細胞を注意深く調べます。20〜50個のセルを供給するために手動ノブで必要な回転数を経験的に定義します。通常、細胞が十分に濃縮されている場合、1回の穏やかな回転で~10個の細胞を排出できます。
注意: 液体がマイクロキャピラリーから適切に流出しない場合は、キャピラリーホルダーへのマイクロキャピラリーの取り付けを緩めてみてください。そうすることで、油が漏れて毛細管に沿って滴り落ちる可能性があります。 - 毛細血管の先端を左視神経筋(OT)に対して近づけ、中大脳静脈のすぐ上にあります(MCeV、 図2F)。
- 皮膚の膜が壊れるまで毛細血管を幼虫にそっと押し付けます(図2D、E)。
注:強く押しすぎると、脳の奥深くに細胞が注入され、光学的透明度が低いとMTを詳細に観察できなくなるため、強く押しすぎないでください。イメージング技術は、250〜300μmに達する深さで可能です。ただし、魚の表面から100μmより深く注入しないことをお勧めします。 - OTの適切な位置に到達したら、セルを排出します。毛細血管の先端を注意深く観察して、動物の中に入る細胞の流れを視覚化し、それによって注射を確実に成功させます。
注意: 心室に注射しないように注意してください(図2E)。心室に入ると、細胞は組織に浸潤するのではなく、蓄積して動けなくなる傾向があります(図2I)。心室注射は、脳の激しい腫脹と、前脳と後脳への注入細胞の観察可能な播種を特徴としています(図2J)。 - 必要な数の動物について、手順3.4.9〜3.4.11の手順を繰り返します。毛細血管内の細胞の凝集を防ぐために迅速に進めてください。
注:実験者の注射速度によっては、10〜20匹の幼虫ごとに針を交換する必要がある場合があります。 - 異種移植が完了したら、マイクロインジェクションプレートから幼虫を取り出し、ミネラル源水+ PTU +メチレンブルー培地で満たされた24ウェルプレートでそれらを選び出します。
- 蛍光実体顕微鏡で幼虫を観察することにより、注射が成功したことを検証します(図2G)。OTの上部200μm(z)に位置する20〜50個の細胞によって形成された単一の腫瘍塊を含む異種移植片のみを選択します(図2Hと図2I-Kの注射の失敗)。
注:局在化に成功した異種移植片の収量は、最初は10%から実際にはほぼ100%まで変化します。 - 幼虫を32°Cで少なくとも4時間回復させてからイメージングします。
注:培地に抗生物質を追加しても、幼虫の生存率は向上しません。この段階で、マイクロインジェクションが正しく行われていれば、魚のほぼ100%が生き残ります。
4.膠芽腫異種移植片の生体内イメージング
- ライブイメージングのために幼虫をマウントします。
注:幼虫は注射後4時間(hpi)から画像化できます。MTのライブイメージングは通常、浸潤性GBM細胞が突起を伸ばして腫瘍塊から離れて移動し始めた20hpiから実行されます。- 1%低融点アガロース溶液を調製します。沸騰した1%低融点アガロース溶液500 μLを1.5 mL遠沈管に移し、ヒートブロック上で37°Cで冷却します。アガロースにトリカイン(112 μg/mL)を加え、よく混ぜます。
- 1〜4匹の異種移植幼虫を、ミネラル源水+ PTU +トリカイン(112 μg / mL)で補完したメチレン培地で満たされた3.5 cmのペトリ皿に移します。幼虫が触っても反応しなくなったら、細い先端トランスファーピペットを使用して、アガロースとトリカインを含むチューブに慎重に移します。
注意: アガロースの希釈を制限するために、培地の容量を最小限に抑えてください。 - 幼虫とアガロースを穏やかに混ぜます。通常の(大きな電球の)トランスファーピペットを使用して、アガロースに混合した幼虫をガラス底の3.5 cmビデオイメージング皿の中央に置きます。実体顕微鏡下で、マイクロローディングチップを使用して幼虫を背中にすばやく配置し、魚を操作します。
注:このプロトコルでは、倒立回転円盤共焦点顕微鏡が生体内脳イメージングに使用されるため、幼虫は背側に取り付けられます。正立共焦点顕微鏡を使用する場合は、それに応じて幼虫の位置を調整します。 - 余分なアガロースを除去して、可能な限り薄いアガロース層を維持します。アガロースが固まったら、ミネラル源水2.5 mL + PTU + 0.2xトリカイン(イメージング培地)を加え、次のステップに進みます。
- 浸潤性膠芽腫細胞におけるMT動態のin vivoライブイメージング
注:画像の光学品質は、使用する顕微鏡の性能に大きく依存します。このプロトコルは、sCMOSカメラ(ピクセルサイズ6.5μm、2048 x 2044ピクセル)、長距離対物レンズ、および温度制御された環境チャンバーを備えた倒立回転ディスク共焦点顕微鏡用に書かれています。- アガロース包埋異種移植幼虫を含むビデオイメージング皿を倒立共焦点顕微鏡の環境チャンバーに入れ、温度を32°Cに設定した。 電動XYステージを使用して、10倍の対物レンズを備えたビデオイメージング皿で幼虫を見つけます。
- ESC キーを押して対物レンズの砲塔を下げ、60 倍の対物レンズ (1.4 NA、作動距離: 0.13 mm) に鉱物油を追加し、Esc キーを押して最初の焦点位置に戻ります。
- 赤チャンネル(561 nmレーザー光源、20%レーザー出力、時間暴露:200 ms)で浸潤する膠芽腫細胞を観察し、MTネットワークが広がり、MTフィラメントを簡単に区別できる細胞を選択します(図3B)。
- Z シリーズの設定を行います。200μmの範囲のピエゾステージを使用して、MTネットワークの上部と下部の位置を選択します:10〜30μmの深さのzスタックで、0.3μmのzスライスステップで、移動する細胞の突起にある微小管ネットワークを視覚化するのに十分です。
- タイムラプス取得設定を設定して、取得速度、zスタック深度、蛍光シグナルの最適なバランスを取り、急速な光退色を回避します。MTの画像を5〜10秒ごとに数分間取得します。5D (x、y、z、t、c) ハイパースタックを取得して保存します。
注:取得中のzのドリフトを避けるために、ハードウェアフォーカス安定化としてパーフェクトフォーカスシステムを備えた顕微鏡を使用してください。
- (オプション)MTに対する微小管変化剤(MTA)の効果を判断します。
注:次の手順では、膠芽腫細胞をリアルタイムで移行する際のMTネットワーク上のMTAの影響をテストできます。- ビデオイメージングディッシュからイメージングメディアをそっと取り出します。xyzの位置が失われるため、皿の底に触れないでください。
- 異なる濃度のMTAを含む新しいイメージング媒体を準備します。MTA含有培地をビデオイメージングディッシュに一滴ずつそっと加えます。
- 長期の動画(2〜16時間、10〜20分ごとに1枚の画像)を取得して、MTネットワークとセル移動に対するMTAの各濃度の影響を観察します(図4A)。
- (オプション)培地を静かに取り出し、MTAを含まない新しいイメージング培地を2.5 mL加えて、MTAを洗い流します。ウォッシュアウト手順を3回繰り返して、培地中のMTAの痕跡を取り除きます。
- (オプション)4.3.3と同様の長期ムービーを取得します(図4B)。
注:上記の手順は、幼虫の生存に影響を与えることなくMTネットワークを変更する最小濃度を決定します。ウォッシュアウトステップは、薬物の効果が可逆的であるかどうかを定義します。
- シーケンシャルイメージングによる膠芽腫浸潤に対するMTAの影響を評価します。
- マイクロインジェクションの4時間後に手順4.1から4.2.1に従います。
注:プロトコルのこの部分は、他の蛍光タグ付き膠芽腫細胞株でも達成できます。理想的には、GBMを細胞質タグと核タグで共標識して、細胞の全体的な形態を確実に検出します。 - 作動距離40倍の対水レンズ(NA:1.15、WD:0.6 mm)に切り替えます。
- OT領域を取得するためのzシリーズ範囲を設定します。高感度sCMOSカメラ(画素サイズ11μm、1,200×1,200画素、量子効率95%)を用いてzスタックを取得。
注:zスタックは通常、OTの最も背側の部分(表面に近い)から始まり、腫瘍細胞塊全体を含むのに十分な深さで脳内で終わります。 - 顕微鏡からビデオイメージング皿を取り外します。マイクロローディングチップを使用し、動物の周りでアガロースをそっと突くことにより、幼虫をアガロースから解放します。
注:3 dpf幼虫はまだ非常に壊れやすいので、アガロースからそれらを取り除くときは注意してください。 - 動物がアガロースから遊離したら、ミネラル源水+メチレンブルー+ PTU培地で満たされた24ウェルプレートの単一ウェルに静かに移します。その後のイメージングのために幼虫を識別するために井戸に印を付けます。
- 先に決定した濃度で目的のMTAを培地に加えます(ステップ4.3.3)。毎日薬を補給した培地をリフレッシュしてください。手順4.4.1から4.4.5までのイメージング手順を毎日3〜4日間繰り返します。
- マイクロインジェクションの4時間後に手順4.1から4.2.1に従います。
5. 画像解析
- 無料で入手できるFIJIプラグインでMTダイナミクスを分析します。
注:多くのレビューとプロトコルは、セル31、32、33、34のMTダイナミクス分析の方法を説明しており、この段階で適用できます。このプロトコルでは、基本的なMT動的特性を測定するための2つの方法について簡単に説明します。- 5Dハイパースタックを開き、zスライスが単一の平面に投影された4Dスタックを生成して、zで最大強度投影(MIP)を作成します(画像|スタック|Zプロジェクト|最大強度)(図3B)。
- 4D MIPスタックを開き、フィジーの手動トラッキング機能を使用して突起ベースのMTの終端を手動でトラッキングします (プラグイン|追跡|手動追跡)。(図3D)。成長速度、収縮速度、レスキュー周波数、大災害頻度などのMTダイナミクスのパラメータを抽出します。
- または、MTに沿って幅10ピクセルのセグメント化された線を描画して分析します(図3B)。 マルチキモグラフ 機能を使用する(分析|マルチキモグラフ)(図3C)フィジーで。MTの成長段階(G)、一時停止の長さ(P)、およびMTの大災害の頻度を観察および測定します。
- 長期膠芽腫浸潤の解析
注:この解析では、バイオイメージングソフトウェアによる4Dビジュアライゼーションと解析を使用する必要があります。- ファイルコンバータソフトウェアを使用して、ステップ4.4.3 (4 hpi)の生の4D zスタックを適切なソフトウェアフォーマットに変換します。
- ソフトウェアを開き、変換されたzスタックファイルを Surpass ビューにインポートします(図5A)。
- 腫瘍細胞をセグメント化し、赤チャンネルの無関係な自家蛍光を破棄するには、 新しいサーフェスを追加 をクリックし、5ステップのプロセスに従います。
- ウィンドウがポップアップしたら、 次の 矢印をクリックしてデフォルト設定を検証します。手順 2/5 に進みます。
注:蛍光シグナルが561チャンネルで取得された場合、眼の残留色素沈着による自家蛍光が強くなり、自動セグメンテーションプロセスが変化する可能性があります。異種移植片が目の近くにある場合、これは問題になります。その場合、セグメンテーションは、非膠芽腫細胞シグナルを切断および削除することによって手動で終了しなければならない。 - [ソース チャネル] | [561 チャネル] に移動します。[サーフェスの詳細]に1.50 μmを追加し、[背景の減算]に球の直径に2.5 μmを追加して、画像を滑らかにします(ガウスフィルター)。次へ進む矢印をクリックして、手順 3/5 に進みます。
- 信号の強度に応じて、すべてのセルプロセスが含まれるように しきい値 (バックグラウンド減算)を手動で調整します。手順 4/5 に進みます。
- 細胞の一部を表さないイベント(例えば、破片、自家蛍光)を除去することによって、セグメント化されたシグナルをフィルタリングする。[ ボリューム|フィルタータイプ ]をクリックし、しきい値を手動で調整して、セルの一部を表す最小ボリュームより下のすべてのイベントを除外します。手順 5/5 に進みます。
注:自家蛍光シグナルの体積が最小の細胞部分よりも大きい場合は、とにかく続行し、不要なシグナルを 左クリックして 削除して 手動で削除 します。 - 分類ステップを破棄し、二重緑色の矢印をクリックしてセグメンテーションウィザードを終了し、腫瘍細胞の表面ビューの作成を完了します(図5B)。
- ウィンドウがポップアップしたら、 次の 矢印をクリックしてデフォルト設定を検証します。手順 2/5 に進みます。
- セグメント化された細胞が互いに接触せず、固有のオブジェクトを形成しない場合は、それらを人工的にマージして腫瘍細胞塊オブジェクトを作成します。簡単に言うと、ボリューム |特定の値|詳細な統計|をクリックします。一番上のイベントを 左クリック し、 Shiftキーを押しながら 最後のイベントを左クリックして、すべてのイベントを選択します。選択 |編集|統合に移動します。
- 腫瘍細胞塊の重心を定義します。[新しいスポットを追加]をクリックします|自動作成|をスキップする追加 (カーソルが交差) |オブジェクトの中心。Shiftキーを押しながら左クリックして、セグメント化された腫瘍細胞塊の重心であるスポットを作成します。
- 各GBM細胞と腫瘍塊の重心との間の3D距離を測定します。これを行うには、スポットビューに留まり、ツールアイコンを選択して、重心チャネルまでの距離を作成します|距離変換。重心チャネルへの新しい距離が、488 チャネルと 561 チャネルと一緒に作成されるのを待ちます (青色、図 5C)。
注:このチャネル内のすべてのボクセルの強度は、ボクセルから腫瘍細胞塊の重心までの3D距離に対応します。 - セグメント化されたすべてのセルの重心までの3D距離を測定するには、[ 新しいスポットの追加]をクリックします|自動作成|をスキップする追加 (カーソルが交差) |特定のチャネル561。 Shift キーを押しながら、細胞核領域を左クリックします。すべてのセルに対してこのタスクを実行します(図5D)。
注:細胞の蛍光シグナルをよりよく理解するために 、表面 ビューを削除します。または、存在する場合は、精度を高めるために核信号(405 nmまたは647 nm信号)を使用します。 - 統計|をクリックします詳細な|特定の値|強度平均Ch=重心までの距離。
注:強度の値は、細胞核領域と重心の間のμm単位の3D距離です。 - これらの強度を平均して、4hpiでの腫瘍塊の半径を計算します。解析のすべての時点(24 hpi、48 hpi、および 72 hpi)に対してこの手順を繰り返します。
注:細胞浸潤を過小評価しないように、最も播種性の高い10個または20個の細胞のみを測定してください。実際、注射中の細胞の強制圧縮は、腫瘍塊の中心にある細胞が移動するのを妨げる可能性がある。 - 浸潤指数(II)を、t = 4 hpiでの腫瘍塊の平均半径にわたる、最も播種性の高い細胞のt = 24 hpi/48 hpi/72 hpiでの平均3D距離間の比として計算します(図5E)。
結果
ここでは、生体内GBM侵潤時にMTが果たす役割を解析するために、レンチウイルス感染によるGBM細胞の安定なMT標識、3 dpfゼブラフィッシュ幼虫におけるGBM細胞の同所性異種移植、MT動態の高解像度生体内イメージング、MTA処理とそのGBM侵潤への影響、MT動態と生体内浸潤の画像解析について説明します(図1)。 MTダイナミクスは、成長および縮小するMTに沿ってキモグラフを構築するか(図3C)、個々のMTエッジを経時的に手動で追跡することによって測定されます(図3D)。幼虫培地に投与される薬物処置の例およびMTネットワーク組織に対するその可逆的効果を図4に示す。低用量のノコダゾール(200nM)による治療は、MTネットワークの進行性の収縮および4時間後の膠芽腫細胞突出の消失をもたらす(図4A)。薬物を洗い流すと、膠芽腫細胞が突起を形成する能力が回復した。細胞は、ウォッシュアウトの12時間後に血管系に沿って移動を再開した(図4B)。これらのデータは、200 nMノコダゾールによる治療がMTネットワークを破壊し、in vivo膠芽腫細胞の浸潤を迅速にブロックするのに十分であることを示唆しています。世界的な膠芽腫細胞浸潤に関する同じ治療の3日間の分析により、ノコダゾール200 nMは、対照と比較して、魚の一般的な健康状態に影響を与えることなく、in vivoで長期の膠芽腫細胞浸潤を停止させることが明らかになりました(図4C)。
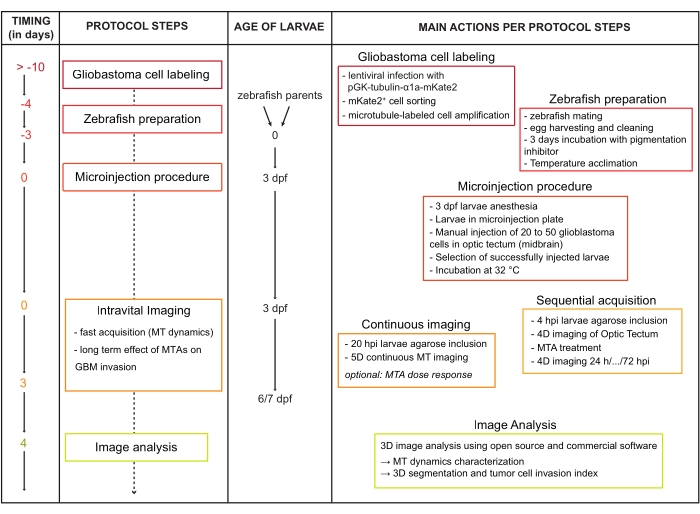
図1:プロトコルワークフロー図略語:dpf =受精後の日数。hpi =注射後数時間。MT =微小管;MTA =微小管変化剤;GBM =多形性膠芽腫。この図の拡大版を表示するには、ここをクリックしてください。
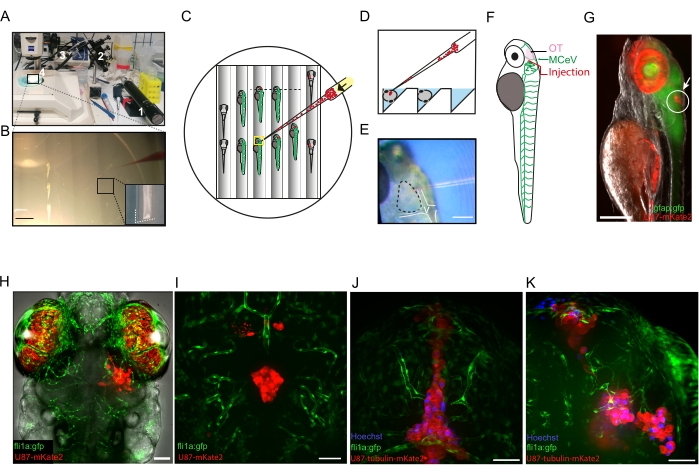
図2:3 dpfゼブラフィッシュ幼虫の脳に膠芽腫細胞をマイクロインジェクションする。 (A)異種移植に使用した機器の写真:1、オイルマイクロインジェクター;2、機械式マイクロマニピュレーター;3、ユニバーサルキャピラリーホルダー。4、ガラスキャピラリー。マイクロインジェクションプレートは実体顕微鏡下にあります。(B)麻酔をかけた3匹のDFPゼブラフィッシュの幼虫が溝に整列し、マイクロインジェクションの準備ができている写真。赤い染料を装填したマイクロキャピラリーの先端が写真の右側に見えます。アガロースプレートに組み込まれたパターン化されたトレンチの詳細は、右下隅の挿入図に見られます。スケールバー= 3mm。 (C)代表的なマイクロインジェクションプレートのスキーム。すぐに注入できる幼虫を横方向(プレートの中央)に配置します。なお、細胞は注入に進む前にマイクロキャピラリーの先端(黒矢印)に集中する。注入された幼虫は、腹側に配置されたプレートの右側に示されています。(D)マイクロインジェクションプレート内の横方向スライスのスキーム(Cの黒い点線に沿って)は、注入中に幼虫が配置されるトレンチを示す。(E)視蓋を貫通する準備ができている毛細血管の先端を示す写真(点線)。心室は白い線で描かれています。スケールバー= 150μm。 (F)内皮細胞でgfpを発現する3 dpf fli1a:gfp幼虫のスキームで、細胞が注入されるOT領域を示し、中大脳静脈のすぐ上。(G)U87-mkate2細胞のマイクロインジェクション後に横方向に配置した3 dpf gfap:gfp幼虫(神経幹細胞で発現するgfp)の蛍光画像(白丸と白矢印)。赤色の高い自家蛍光は、目の虹彩色素によって引き起こされます。スケールバー = 100 μm。 (H)16hpiでfli1a:gfp幼虫の注入に成功した共焦点蛍光画像。スケールバー:50 μm.(I-K)96 hpi(I)および4 hpi(J、K)での注入に失敗したfli1a:gfp幼虫の共焦点蛍光画像。GBM細胞は、脳室(I、J)または脳内の複数の病巣(K)に注射されています。スケールバー= 50μm。略語:dpf =受精後の日数。OT =視蓋;MCeV =中大脳静脈;GFP =緑色蛍光タンパク質。GFAP =グリア線維性酸性タンパク質;HPI =注射後数時間。この図の拡大版を表示するには、ここをクリックしてください。
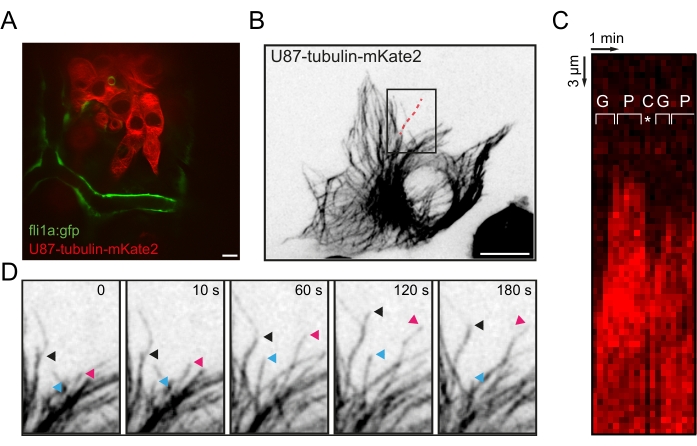
図3:膠芽腫細胞における in vivo 微小管動態の可視化。 (A)20hpiのfli1a:GFPゼブラフィッシュ幼虫のOTでチューブリン-α1-mkate2を発現する異種移植U87細胞の代表的な蛍光画像。(B)単一の異種移植U87細胞におけるMTネットワークの最大強度投影蛍光画像。(C) Bの赤い点線に沿ったキモグラフは、MTの動的不安定性の成長、一時停止、および大惨事の段階を示しています。(d)3つのMT+末端の追跡を強調する B のボックス化された領域のタイムラプスシーケンス。スケールバー= 10 μm。略語:OT =視蓋;GFP = 緑色蛍光タンパク質;hpi =注射後数時間。MT =微小管;G =成長期;P =一時停止フェーズ。C =大災害フェーズ。 この図の拡大版を表示するには、ここをクリックしてください。

図4: in vivoでの膠芽腫浸潤に対する微小管変化剤の効果を可視化する。 (a)ノカダゾール(200nM)で処理したゼブラフィッシュ幼虫においてチューブリン-α1a-mkate2を発現するU87細胞のタイムラプス配列。矢印は、血管に沿って脳に侵入する2つの異なる細胞の突起の先端を指しています。ノコダゾールで処理したときの突起の収縮に注意してください。.スケールバー = 10 μm。 (B)U87細胞浸潤に対するノコダゾールウォッシュアウトの効果を表すタイムラプスシーケンス。ウォッシュアウト後500分で、白いアスタリスクでマークされた細胞はMTベースの突起(白い矢印)を伸ばし、血管に沿った浸潤の再開を可能にします。スケールバー= 20μm。 (C)DMSOまたはノコダゾール(200nM)で72時間処理された異種移植幼虫の脳の3D表現。U87細胞シグナルはセグメント化されており(赤色)、fli1a-GFP蛍光シグナル(白色)に集積されています。ノコダゾールで処理されたU87細胞の播種の減少に注意してください。.スケールバー= 30μm。略語:GFP =緑色蛍光タンパク質;hpi =注射後数時間。MT =微小管。 この図の拡大版を表示するには、ここをクリックしてください。
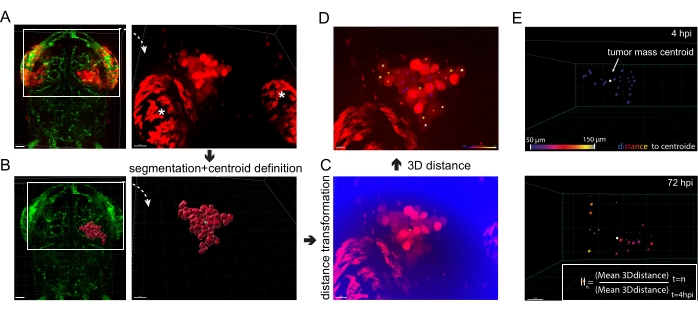
図5: 生体 内膠芽腫浸潤の画像解析。 (A)fli1a-GFPゼブラフィッシュ幼虫の細胞質mKate2を発現する異種移植U87細胞の蛍光画像、4hpi。白いアスタリスクは、眼の虹彩色素からの典型的な自家蛍光を強調しています。スケールバー = 40 μm。 (B) AのU87細胞シグナルに対応するセグメント化された表面と結合したfli1a-GFP幼虫の蛍光画像。腫瘍塊の重心は緑色に見えます。スケールバー = 40 μm。 (C) A の赤チャンネル信号と新しく定義された「重心までの距離」チャンネル(青)を表す蛍光画像。スケールバー = 30 μm。 (D)色付きのスポットを重ね合わせた赤チャンネル蛍光画像で、その色は細胞から重心までの距離を表し(緑)、紫は重心に最も近く、白は最も離れています。スケールバー = 20 μm。 (E)世界的なGBM侵入の逐次分析の例。3D距離は4hpiと72hpiで決定され、侵入指数(II)は受信トレイの式に従って計算されます。スケールバー= 20μm。略語:GFP =緑色蛍光タンパク質;HPI =注射後数時間。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
腫瘍異種移植片を単一細胞分解能でイメージングすることは、GBM生物学の理解を深めるために不可欠なツールになる可能性があります。マウスPDXモデルにおけるライブイメージングは、GBMが集合的に脳組織にどのように侵入するかについての貴重な発見をもたらした18。しかし、今日まで、時空間分解能はGBMの侵入を制御するタンパク質のダイナミクスを明らかにするのに十分なほど高くはありません。我々は、透明なゼブラフィッシュ幼虫におけるGBM細胞の同所性生着と高解像度の生体内イメージングを組み合わせることにより、MTなどの細胞骨格タンパク質を十分に詳細に解析し、 in situGBM 侵入中の動態を解析できると推論しました。
方法論の重要なステップは、GBM細胞の調製とマイクロインジェクション手順にあります。不健康で不適切に解離した細胞は、一緒にまたは毛細血管の境界にくっつき、注射の流れを遮断します。さらに、細胞は、注入量を最小限に抑え、それらを大量に移植するために、毛細血管内に十分に濃縮される必要がある。より希釈された細胞を大量に注入すると、複数の、時には混合された腫瘍病巣が生じ、その侵襲指数の測定が困難になります。私たちの手では、オイルベースのマイクロインジェクターの手動処理により、同様のモデル19で以前に使用されていた加圧空気ベースの電子マイクロインジェクターよりも噴射フローをより適切に制御できます。これは、脳内の過剰な流れ圧力を防ぎ、それによってその後の組織損傷と注入された細胞の心室凝集を回避するために重要です。
このモデルのいくつかの制限には、両方の種にとって最適ではない温度で実験を実行する必要性が含まれます。ゼブラフィッシュは通常28°Cで飼育されますが、ヒト細胞は37°Cで培養されます。 32°Cを超えると、ゼブラフィッシュの胚発生が変化し、これらの変化は致命的となる可能性があります35。しかし、成体のゼブラフィッシュ異種移植片モデル36で行われていることと同様に、ゼブラフィッシュの幼虫を32°Cの温度に順次順応させると、移植後の28°Cから32°Cへの急激な温度変化と比較して、移植動物の生存率が向上します。 しかし、温度を上げると、ゼブラフィッシュ胚の32°Cを超える温度に対する感受性に応じて、動物の死亡がさらに増加します35。
in vivo MTダイナミクスデータの解釈は、温度が37°Cを下回るとMTダイナミクスが変化するため、慎重に行う必要があります37。同じMTA処理を行った同じGBM細胞における37°Cおよび32°CでのMT動態の並行in vitro測定は、さまざまなGBM細胞間またはin vivo処理間で見られる違いを検証するのに役立ちます。これは、違いが温度感度の変動によって引き起こされるのではなく、異なる調節経路(GBM比較分析の場合)またはMTA処理(MTA効果分析の場合)によって引き起こされることを確認するのに役立つはずです。これは、MTダイナミクスの不均一性がさまざまな侵入能力にリンクされている場合に興味深いものになります。
別の制限は、侵入を監視できる短い時間枠(72〜96時間)であり、MTダイナミクス38の潜在的な変化によって引き起こされる浸潤可塑性の測定を妨げる。96時間後、GBM細胞の浸潤が急激に減少したことに気づきました。注射後6日目に、GBM細胞の数は急速に減少し、おそらく腫瘍微小環境における好中球およびマクロファージの蓄積によって引き起こされる宿主免疫応答に起因する39。MTAを脳全体に送達することは、その活性をMTに依存し、その変化がその後GBM浸潤に影響を与える可能性のある近くのニューロン宿主細胞に影響を与える可能性があります40。このアプローチは、GBM細胞へのMTの変化を制限するshRNAまたはオプトジェネティクスアッセイで補完する必要がありますが、新しい抗侵襲性化合物をスクリーニングするための優れたプラットフォームであることに変わりはありません。
ゼブラフィッシュ脳におけるMT標識GBM細胞の同所性注射は、癌細胞浸潤中のMTの役割を解読するために特に興味深いものであり、起源の組織における癌細胞移動のin situ細胞内イメージングを可能にする動物モデルはほとんどない15。今日まで、GBM移行中のMT機能の研究は、主にin vitroおよびex vivoアッセイに依存しており、in vivo検証の欠如に依存しています24,41,42,43。ここで紹介するアッセイは、目的の遺伝子ノックダウンまたは偏りのない遺伝子ベースのスクリーニングアプローチと組み合わせて、in vivoでのGBM浸潤に重要な新しいMT調節因子を明らかにするのに役立ちます。
GBMは非常に不均一な腫瘍であり、その浸潤特性は標本間で大きく異なります44。それらの異なる浸潤様式の根底にある分子メカニズムを理解することは、GBMの蔓延を阻止するためのアドホック治療を定義するのに役立ちます。さまざまなGBMサンプルの侵襲指数、浸潤モード、およびMTダイナミクスなどの細胞骨格特性を体系的に測定することで、頻繁なゲノム突然変異プロファイルと特定の細胞骨格特性に依存する細胞浸潤パターンとの間の新しい相関関係が明らかになります。これらの変異がMT動態の変化にどのように影響するかを明らかにすることは、細胞移動中のMT調節に関する知識を追加するだけでなく45,46、待望の患者特異的な抗侵襲的治療法にもつながる可能性があります。
ゼブラフィッシュでのマイクロインジェクションの比較的容易さと、利用可能な幼虫の数が多いこと、および薬物の注射の容易さが相まって、この手順は個別化医療に適しています47,48。さらに、マウスのGBM異種移植片の生体内イメージングとは対照的に、皮質49,50の上部500μm部分でのみ発生し、ゼブラフィッシュを使用すると、CNS全体におけるGBM浸潤を視覚化できます。ここで紹介するモデルは、膠芽腫の侵襲能力と治療に対する反応を迅速に分析するための貴重なツールになるための基準を満たしています。
開示事項
著者は開示する利益相反を持っていません。
謝辞
P. Herbomel博士(フランス、パスツール研究所)と彼の研究室、特にValérie BriolatとEmma Colucci-Guyonに、ゼブラフィッシュラインとマイクロインジェクションプレート用のプラスチック金型を提供していただき、ゼブラフィッシュの実験手順に関する貴重な専門知識を提供してくださったことに非常に感謝しています。UtechSフォトニックバイオイメージング(C2RT、パスツール研究所、フランス国立研究機関フランスバイオイメージングの支援、およびANR-10-INBS-04;未来への投資)。この研究は、リーグコントレルガン(EL2017。LNCC)、国立科学研究センター、パスツール研究所、そしてマルグリット・ミシェル夫人とポルケ氏の寛大な寄付によって。
資料
| Name | Company | Catalog Number | Comments |
| Glioblastoma cell culture | |||
| Foetal calf serum | Eurobio | CVFSVF00-01 | Reagent |
| MEM NEAA | Gibco | 11140-050 | Reagent |
| Modified Eagle's medium | Eurobio | CM1MEM18-01 | Reagent |
| Penicillin–streptomycin | Gibco | 15140-122 | Reagent |
| U-87 MG | ECACC | 89081402-1VL | Cells |
| Lenitivirus production | |||
| BD FACSAria III | BD bioscience | Instrument | |
| BD FACSDiva software v8.0 | BD bioscience | Software | |
| HEK-293T | Merck | 12022001 | Cells |
| pMD2.G | Addgene | Plasmid #12259 | Reagent |
| psPAX2 | Addgene | Plasmid #12260 | Reagent |
| Ultracentrifuge Optima XPN-80 | Beckman Coulter | Instrument | |
| Cell passaging and staining | |||
| dPBS | Gibco | 14190-094 | Chemical |
| Hoechst 34580 | Sigma-Aldrich | 63493 | Chemical |
| Trypsin-EDTA (0,05%) | Gibco | 25300-054 | Reagent |
| Zebrafish husbandry | |||
| Fluorescence stereomicroscope LEICA M165FC | LEICA | https://www.leica-microsystems.com/fr/produits/stereomicroscopes-et-macroscopes/informations-detaillees/leica-m165-fc/ | Instrument |
| Methylene Blue hydrate | Sigma-Aldrich | M4159 | Chemical |
| N-Phenylthiourea (PTU) | Sigma-Aldrich | P7629-25G | Chemical |
| Transfer Pipettes fine tips | Samco Scientific | 232 | Equipment |
| Transfer Pipettes Large Bulb3mL | Samco Scientific | 225 | Equipment |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | Cat#: A5040 | Chemical |
| Volvic Source Water | DUTSCHER DOMINIQUE SAS | 999556 | Reagent |
| Xenotransplantation | |||
| 24-well plate | TPP | 92024 | Equipment |
| Borosilicate glass capillaries (1.0 ODx0.58IDx150L mm) | Harvard Apparatus | (#30-0017 GC100-15 | Equipment |
| CellTram oil vario microinjector | Eppendorf | 5176000.025 | Instrument |
| Microloading pipet tips (Microloader) 20µL | Eppendorf | 5242956003 | Equipment |
| Micromanipulator | NARISHIGE | https://products.narishige-group.com/group1/injection/english.html | Equipment |
| Mineral Oil | Sigma | M8410-100ml | Equipment |
| Stereomicroscope | Olympus | KL 2500 LCD | Instrument |
| Universal capillary holder | Eppendorf | 5176190002 | Equipment |
| Vertical Pipette puller | KOPF (Roucaire) | Model 720 | Instrument |
| Intravital Imaging | |||
| 3.5cm glass-bottom videoimaging dish | MatTek Life Sciences, MA, USA | P35G-1,5-14-C | Equipment |
| Acquisition software: NIS-Elements-AR version 5.21 | Nikon | Software | |
| Heat-Block | Techne | DRI-BLOCK DB-2D | Equipment |
| Microscope head Nikon Ti2E | Nikon | Instrument | |
| sCMOS camera Prime 95B | Photometrics | Instrument | |
| sCMOS camera Orca Flash 4 | Hammatsu | Instrument | |
| Ultrapure Low melting point agarose | Invitrogen | 16520-050 | Chemical |
| Yokagawa CSU-W1 spinning disk unit | Hammatsu | Instrument | |
| Drug Treatment | |||
| DMSO | Sigma-Aldrich | D2650-100ML | Chemical |
| Nocodazole | Sigma-Aldrich | M1404-2MG | Chemical |
| Image Analysis | |||
| Imaris 9.5.1 software | Oxford Instruments | Software | |
| ImarisFileConverter 9.5.1 | Oxford Instruments | Software |
参考文献
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112 (4), 453-465 (2003).
- Etienne-Manneville, S. Microtubules in cell migration. Annual Review of Cell and Developmental Biology. 29, 471-499 (2013).
- Bouchet, B. P., Akhmanova, A. Microtubules in 3D cell motility. Journal of Cell Science. 130 (1), 39-50 (2017).
- Seetharaman, S., et al. Microtubules tune mechanosensitive cell responses. Nature Materials. 21 (3), 366-377 (2022).
- Etienne-Manneville, S. From signaling pathways to microtubule dynamics: the key players. Current Opinion in Cell Biology. 22 (1), 104-111 (2010).
- Garcin, C., Straube, A. Microtubules in cell migration. Essays in Biochemistry. 63 (5), 509-520 (2019).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Nature editorial. The 'war on cancer' isn't yet won. Nature. 601 (297), (2022).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Clark, A. G., Vignjevic, D. M. Modes of cancer cell invasion and the role of the microenvironment. Current Opinion in Cell Biology. 36, 13-22 (2015).
- Meyer, A. S., et al. 2D protrusion but not motility predicts growth factor-induced cancer cell migration in 3D collagen. Journal of Cell Biology. 197 (6), 721-729 (2012).
- Bouchet, B. P., et al. Mesenchymal cell invasion requires cooperative regulation of persistent microtubule growth by SLAIN2 and CLASP1. Developmental Cell. 39 (6), 708-723 (2016).
- Luthria, G., et al. In vivo microscopy reveals macrophage polarization locally promotes coherent microtubule dynamics in migrating cancer cells. Nature Commun. 11 (1), 3521(2020).
- Wen, P. Y., Kesari, S. Malignant gliomas in adults. New England Journal of Medicine. 359 (5), 492-507 (2008).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments. (86), e55108(2014).
- Osswald, M., et al. Brain tumour cells interconnect to a functional and resistant network. Nature. 528 (7580), 93-98 (2015).
- Astell, K. R., Sieger, D. Investigating microglia-brain tumor cell interactions in vivo in the larval zebrafish brain. Methods in Cell Biology. , 593-626 (2017).
- Zeng, A., et al. Identify a blood-brain barrier penetrating drug-TNB using zebrafish orthotopic glioblastoma xenograft model. Scientific Reports. 7 (1), 14372(2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Disease Models & Mechanisms. 9 (9), 1063-1065 (2016).
- Umans, R. A., Ten Kate, M., Pollock, C., Sontheimer, H. Fishing for contact: modeling perivascular glioma invasion in the zebrafish brain. ACS Pharmacology & Translational Science. 4 (4), 1295-1305 (2021).
- Lee, J. H., et al. Human glioblastoma arises from subventricular zone cells with low-level driver mutations. Nature. 560 (7717), 243-247 (2018).
- Pagano, A., et al. Epothilone B inhibits migration of glioblastoma cells by inducing microtubule catastrophes and affecting EB1 accumulation at microtubule plus ends. Biochemical Pharmacology. 84 (4), 432-443 (2012).
- Berges, R., et al. The novel tubulin-binding checkpoint activator BAL101553 inhibits EB1-dependent migration and invasion and promotes differentiation of glioblastoma stem-like cells. Molecular Cancer Therapeutics. 15 (11), 2740-2749 (2016).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Volvic source water mineral composition. Volvic. , Available from: https://www.volvic.co.uk/volcanic-water/composition (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Brachydanio rerio). The University of Oregon Press, Eugene. , Chapter 5 (2000).
- E3, M. Recipe E3 medium (for zebrafish embryos. , Cold Spring Harbor Protocols. (2011).
- Straube, A. How to measure microtubule dynamics. Methods in Molecular Biology. 777, 1-14 (2011).
- Honore, S., Braguer, D. Investigating microtubule dynamic instability using microtubule-targeting agents. Methods in Molecular Biology. 777, 245-260 (2011).
- Movsisyan, N., Pardo, L. A. Measurement of microtubule dynamics by spinning disk microscopy in monopolar mitotic spindles. Journal of Visualized Experiments. (153), e60478(2019).
- Serikbaeva, A., Tvorogova, A., Kauanova, S., Vorobjev, I. A. Analysis of microtubule dynamics heterogeneity in cell culture. Methods in Molecular Biology. 1745, 181-204 (2018).
- Schnurr, M. E., Yin, Y., Scott, G. R. Temperature during embryonic development has persistent effects on metabolic enzymes in the muscle of zebrafish. Journal of Experimental Biology. 217 (8), 1370-1380 (2014).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Translational Oncology. 14 (1), 100899(2021).
- Hamilton, L., Astell, K. R., Velikova, G., Sieger, D. A zebrafish live imaging model reveals differential responses of microglia toward glioblastoma cells in vivo. Zebrafish. 13 (6), 523-534 (2016).
- Gillespie, S., Monje, M. An active role for neurons in glioma progression: making sense of Scherer's structures. NeuroOncology. 20 (10), 1292-1299 (2018).
- Wolf, K. J., et al. A mode of cell adhesion and migration facilitated by CD44-dependent microtentacles. Proceedings of the National Academy of Sciences. 117 (21), 11432-11443 (2020).
- Zhou, Y. X., et al. Transcriptional upregulation of microtubule-associated protein 2 is involved in the protein kinase A-induced decrease in the invasiveness of glioma cells. Neuro-Oncology. 17 (12), 1578-1588 (2015).
- Monzo, P., et al. Mechanical confinement triggers glioma linear migration dependent on formin FHOD3. Molecular Biology of the Cell. 27 (8), 1246-1261 (2016).
- Vollmann-Zwerenz, A., Leidgens, V., Feliciello, G., Klein, C. A., Hau, P. Tumor cell invasion in glioblastoma. International Journal of Molecular Science. 21 (6), 1932(2020).
- Feng, H., et al. EGFRvIII stimulates glioma growth and invasion through PKA-dependent serine phosphorylation of Dock180. Oncogene. 33 (19), 2504-2512 (2014).
- Liu, R., et al. Cdk5-mediated regulation of the PIKE-A-Akt pathway and glioblastoma cell invasion. Proceedings of the National Academy of Sciences. 105 (21), 7570-7575 (2008).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trends in Cancer. 6 (7), 569-579 (2020).
- Baxendale, S., van Eeden, F., Wilkinson, R. The power of zebrafish in personalised medicine. Personalised Medicine: Lessons from Neurodegeneration to Cancer. 1007, 179-197 (2017).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Stanchi, F., Matsumoto, K., Gerhardt, H. Imaging glioma progression by intravital microscopy. Methods in Molecular Biology. 1862, 227-243 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved