Method Article
Imágenes en vivo de la dinámica de los microtúbulos en células de glioblastoma que invaden el cerebro del pez cebra
En este artículo
Resumen
Informamos una técnica que permite obtener imágenes en vivo de la dinámica de los microtúbulos en células de glioblastoma (GBM) que invaden el tejido cerebral de un vertebrado. El acoplamiento de la inyección ortotópica de células GBM marcadas con fluorescencia en un cerebro transparente de pez cebra con imágenes intravitales de alta resolución permite la medición de la dinámica del citoesqueleto durante la invasión del cáncer in situ .
Resumen
Con un tiempo medio de supervivencia sombrío en poblaciones reales, entre 6 y 15 meses, el glioblastoma (GBM) es el tumor cerebral maligno más devastador. El fracaso del tratamiento se debe principalmente a la invasividad de las células GBM, lo que habla de la necesidad de una mejor comprensión de las propiedades móviles de GBM. Para investigar el mecanismo molecular que apoya la invasión de GBM, se requieren nuevos modelos fisiológicos que permitan la caracterización en profundidad de la dinámica de las proteínas durante la invasión. Estas observaciones allanarían el camino para el descubrimiento de nuevos objetivos para bloquear la infiltración tumoral y mejorar los resultados de los pacientes. Este documento informa cómo un xenoinjerto ortotópico de células GBM en el cerebro del pez cebra permite imágenes vivas intravitales subcelulares. Centrándonos en los microtúbulos (MT), describimos un procedimiento para el marcado de MT en células GBM, microinyección de células GBM en el cerebro transparente de larvas de pez cebra 3 días después de la fertilización (dpf), imágenes intravitales de MT en los xenoinjertos diseminadores, alteración de la dinámica de MT para evaluar su papel durante la invasión de GBM y análisis de los datos adquiridos.
Introducción
La motilidad celular es un proceso estereotipado que requiere el establecimiento del eje de polaridad y reordenamientos citoesqueléticos generadores de fuerza. La polimerización de actina y su asociación con la miosina son reconocidas como los principales contribuyentes a las fuerzas protrusivas y contráctiles requeridas para el movimiento celular1. Los microtúbulos son considerados los principales actores de la polarización celular y la persistencia direccional durante la migración2. En los últimos años, también se ha demostrado que los MT crean y estabilizan protuberancias para soportar fuerzas mecanocompresivas durante la invasión celular en 3D3. Más recientemente, las MT han estado directamente involucradas en la mecanotransducción en adherencias focales y migración mecanosensible4. La inestabilidad dinámica que caracteriza la dinámica final de MT-plus está hecha de fases repetidas de polimerización (crecimiento) y despolimerización (contracción), que están controladas por una plétora de proteínas de unión a microtúbulos y cascadas de señalización intracelular, como las gobernadas por RHO-GTPasas 5,6,7. El papel de la red MT en la migración e invasión celular ha hecho que la investigación de la dinámica MT sea un elemento clave para comprender mejor los mecanismos de localización de células inmunes, cicatrización de heridas e invasión de cáncer.
La capacidad de las células cancerosas para escapar del núcleo tumoral primario, diseminarse en los tejidos y generar tumores secundarios es un paso crítico para prevenir el éxito global en la guerra contra el cáncer declarada hace 50 años 8,9. Uno de los mayores obstáculos ha sido comprender cómo las células cancerosas invaden activamente el tejido. Los mecanismos clave de invasión se basan en los mismos principios que los que rigen la migración celular no tumoral10. Sin embargo, han surgido especificidades de migración de células cancerosas11, lo que desencadena la necesidad de una mejor caracterización de este tipo de migración. Específicamente, debido a que el microambiente tumoral aparece como un jugador clave en la progresión del cáncer12, observar y analizar la invasión de células cancerosas en un contexto fisiológico relevante es esencial para desentrañar los mecanismos de diseminación de las células cancerosas.
Las MT son fundamentales para la progresión del cáncer, para sostener tanto la proliferación como la invasión. El análisis preciso de la dinámica de MT in situ puede ayudar a identificar agentes modificadores de MT (MTA) en ambos procesos. La dinámica de MT varía drásticamente según un cambio en el entorno. In vitro, el tratamiento con agentes desestabilizadores MT como el nocodazol previene la formación de protrusión celular cuando las células están incrustadas en geles en 3D, mientras que tiene poco efecto sobre la migración celular 2D13,14. Aunque técnicamente desafiantes, los avances en imágenes intravitales permiten el análisis in vivo de la dinámica de MT durante la invasión de células cancerosas. Por ejemplo, la observación de MTs en células de fibrosarcoma xenoinjertadas por vía subcutánea en ratones reveló que los macrófagos asociados a tumores afectan la dinámica de MT en células tumorales15. Sin embargo, estos modelos de ratón implican procedimientos quirúrgicos extensos y siguen siendo insatisfactorios para los cánceres menos accesibles, como el tumor cerebral altamente invasivo, GBM.
A pesar de un sombrío tiempo de supervivencia promedio de 15 meses16, se sabe poco sobre el modo de diseminación del GBM dentro del parénquima cerebral o los elementos moleculares clave que sostienen la invasión de células GBM en el tejido cerebral. La mejoría en el modelo de xenoinjerto ortotópico (PDX) de ratón y el establecimiento de ventanas craneales ofrecieron nuevas perspectivas para los estudios de invasión de células GBM17,18. Sin embargo, debido a la calidad de imagen subóptima, este modelo ha permitido principalmente imágenes longitudinales de xenoinjertos superficiales y no se ha utilizado con éxito para estudiar imágenes subcelulares de proteínas del citoesqueleto hasta ahora. Además, a raíz de la orden judicial de las "3R" para reducir el uso de roedores y reemplazarlos con vertebrados inferiores, se han establecido modelos alternativos.
Aprovechando la inmunidad primitiva observada en larvas de pez cebra (Danio rerio), se desarrolló la inyección ortotópica de células GBM en el cerebro del pez 19,20,21. La inyección en las proximidades de los ventrículos en el mesencéfalo en desarrollo recapitula la mayor parte de la fisiopatología humana del GBM21, yse observa el mismo patrón preferido de invasión del GBM que en los seres humanos, la cooptación de los vasos22. Gracias a la transparencia de las larvas de peces, este modelo permite la visualización de las células GBM que invaden el cerebro desde las áreas periventriculares donde se cree que surgen la mayoría de los GBM23.
Debido a que las MT son esenciales para la invasión celular de GBM in vitro24,25, se necesita una mejor caracterización de la dinámica de MT y la identificación de reguladores clave durante la invasión celular. Sin embargo, hasta la fecha, los datos generados con el modelo ortotópico de pez cebra no han incluido el análisis subcelular de la dinámica de MT durante el proceso de invasión. Este documento proporciona un protocolo para estudiar la dinámica de MT in vivo y determinar su papel durante la invasión del cáncer cerebral. Después del etiquetado estable de microtúbulos, las células GBM se microinyectan a 3 dpf en los cerebros de las larvas de pez cebra y se obtienen imágenes en tiempo real a alta resolución espacio-temporal durante su progresión en el tejido cerebral. Las imágenes en vivo de MT fluorescentes permiten el análisis cualitativo y cuantitativo de la dinámica de MT plus-end. Además, este modelo permite evaluar el efecto de los MTA en la dinámica de MT y en las propiedades invasivas de las células GBM en tiempo real. Este protocolo relativamente no invasivo combinado con un gran número de larvas manejadas a la vez y la facilidad de aplicación de fármacos (en el agua de los peces) hace que el modelo sea un activo para las pruebas preclínicas.
Protocolo
Los experimentos con animales se llevaron a cabo de acuerdo con las directrices de la Unión Europea para el manejo de animales de laboratorio. Todos los protocolos fueron aprobados por el Comité de Ética para la Experimentación Animal del Instituto Pasteur - CEEA 89 y el Ministerio de Investigación y Educación de Francia (permiso #01265.03). Durante las inyecciones o sesiones de imágenes en vivo, los animales fueron anestesiados con Tricaine.At al final de los procedimientos experimentales, fueron sacrificados por sobredosis de anestesia. Consulte la Tabla de materiales para obtener detalles relacionados con los materiales, el equipo y el software utilizados en este protocolo. El flujo de trabajo general del protocolo se describe en la figura 1.
1. Generación de células de glioblastoma que expresan de forma estable α-tubulina-mKate2
NOTA: Los siguientes pasos se realizan en un gabinete de bioseguridad BSL2+.
- Producir partículas lentivirales que expresen mKate2-tubulina utilizando el método de fosfato de calcio para la transfección de 7 × 106 células HEK-293T.
- En un tubo de microcentrífuga de 1,5 ml, añadir 10 μg del plásmido psPAX2 de envasado de2ª generación, 5 μg de plásmido de envoltura viral pMD2.G y 10 μg del plásmido de interés, pGK-mKate2-tubulina humana α1a con 50 μL de CaCl 2 (stock de2,5 M). Ajustar a 500 μL conH2Olibre de ADN estéril.
NOTA: Es importante agregar CaCl2 al final. - Mezclar invirtiendo el tubo varias veces e incubar durante 20 minutos a temperatura ambiente (RT).
- Durante la incubación, prepare otro tubo de microcentrífuga de 1,5 ml con 500 μL de solución salina tamponada con HEPES (HBS), pH 7,0 (2x).
- Después de 20 minutos, agregue la mezcla de CaCl2 / ADN gota a gota en la solución HBS (2x). Mezclar invirtiendo el tubo varias veces. Incubar durante 12 min en RT.
- Después de 12 minutos, agregue suavemente el CaCl2 / ADN mezclado con HBS directamente sobre un plato confluente al 70% de 10 cm de células HEK-293T, gota a gota.
- Dejar las celdas en la incubadora humidificada a 37 °C con 5% deCO2 durante 36-48 h.
- Recoja el sobrenadante y gírelo a 3.000 × g durante 5 minutos para eliminar los restos celulares.
- Para concentrar las partículas virales, cargue el sobrenadante en un tubo de ultracentrífuga y gírelo hacia abajo a 47,508 × g durante 90 min a 4 ° C.
- Deseche el sobrenadante y coloque el tubo boca abajo sobre papel para secar el interior del tubo.
- Agregue 30 μL de PBS en el pellet viral. No vuelva a suspender el pellet. Dejar a 4 °C durante 2 h.
- Resuspenda suavemente las partículas virales pipeteando hacia arriba y hacia abajo. Evite hacer burbujas. Conservar a -80 °C.
NOTA: Se pueden producir grandes cantidades de partículas virales transfectando múltiples placas de células HEK-2-93T.
- En un tubo de microcentrífuga de 1,5 ml, añadir 10 μg del plásmido psPAX2 de envasado de2ª generación, 5 μg de plásmido de envoltura viral pMD2.G y 10 μg del plásmido de interés, pGK-mKate2-tubulina humana α1a con 50 μL de CaCl 2 (stock de2,5 M). Ajustar a 500 μL conH2Olibre de ADN estéril.
- Infectar las células del glioblastoma con partículas lentivirales.
NOTA: Este protocolo está escrito para líneas celulares comerciales de glioblastoma como U-87 MG, U-373 MG o T98. Para utilizar células de glioblastoma primarias derivadas del paciente, utilice un recubrimiento específico de las placas y un medio no suero26.- Prepare un plato confluente al 70% de 10 cm de células de glioblastoma U-87 MG cultivadas en el medio esencial mínimo (MEM) de Eagle suplementado con suero fetal de ternera al 10%, penicilina-estreptomicina (concentración final de 100 unidades/ml para penicilina y 100 μg/ml para estreptomicina) y aminoácidos no esenciales (1x).
- Agregue las partículas virales en una dilución de 1 en 5,000 directamente sobre las células. Mezclar con un suave remolino. Permita que los virus infecten las células durante no más de 20 h.
- Retire el medio que contiene virus y sustitúyalo por un medio de cultivo fresco. Permitir la expresión de la tubulina marcada durante 48-72 h.
NOTA: Los siguientes pasos deben realizarse en un gabinete de bioseguridad BSL2. - FACS-ordena las células para seleccionar el 15% más brillante de células mKate2+ . Después de eliminar los residuos y las celdas dobletes utilizando la dispersión frontal y lateral (FCS vs SSC), aplique otra puerta en las células mKate2+ del 30% más brillantes para mantener el 15% superior.
- Amplíe las células marcadas con MT.
NOTA: Alternativamente, la selección clonal basada en altos niveles de tubulina-mKate2 se puede realizar bajo un microscopio de epifluorescencia.
2. Preparar las larvas de pez cebra para microinyección
- Generar huevos de pez cebra.
- Coloque tres machos y cuatro hembras de la cepa de pez cebra deseada en un tanque de apareamiento suplementado con canicas 4 días antes del xenotrasplante, a última hora de la tarde.
NOTA: Las líneas Tg(fli1a:gfp), Tg(gfap:gfp) o Tg(Huc:gfp) se utilizan para marcar vasos endógenos, células madre neurales/astrocitos y neuronas, respectivamente. - Recoja los huevos producidos por el desove inducido por el mármol a la mañana siguiente.
- Limpie los huevos transfiriéndolos a un tubo de centrífuga de 50 ml lleno de agua mineral27 complementado con lejía (0.004% final). Invierta suavemente el tubo durante 5 minutos. Lávese dos veces con agua mineral solamente.
- Transfiera los huevos a una placa de Petri que contenga el agua mineral suplementada con 0,28 mg / ml de azul de metileno.
- Retire los óvulos no fertilizados y con retraso en el desarrollo. Incubar los embriones a 28 °C.
- Coloque tres machos y cuatro hembras de la cepa de pez cebra deseada en un tanque de apareamiento suplementado con canicas 4 días antes del xenotrasplante, a última hora de la tarde.
- Crear larvas transparentes.
- Introducir N-feniltiourea (PTU) (0,003% final) al medio 8 h después, para evitar la pigmentación de melanina y asegurar la transparencia óptica. Mantenga la PTU en el medio para el resto del protocolo.
NOTA: Debido a que el tratamiento con PTU puede causar defectos de desarrollo, seleccione solo las larvas normalmente desarrolladas para el xenotrasplante. Como alternativa al tratamiento químico, se puede utilizar la cepa mutante de pez cebra casper (nácar y orbison roy doble mutante), en la que la pigmentación está ausente28. - Elevar la temperatura de incubación a 29 °C.
- Aumente la temperatura todos los días en 1 °C para que las larvas de 3 dpf alcancen los 32 °C el día de la inyección.
- Introducir N-feniltiourea (PTU) (0,003% final) al medio 8 h después, para evitar la pigmentación de melanina y asegurar la transparencia óptica. Mantenga la PTU en el medio para el resto del protocolo.
- Prepare la placa de microinyección.
- Preparar 20 mL de agarosa al 1% + 0,28 mg/mL de azul de metileno con agua mineral.
- Vierta la agarosa en una placa de Petri de 10 cm y aplique rápidamente el molde de plástico de microinyección boca abajo para crear zanjas en forma de V de 2,5 mm de ancho (Figura 2B).
NOTA: El molde de plástico está disponible comercialmente o se puede construir internamente siguiendo el diseño descrito en el Libro29 del pez cebra. - Retire con cuidado el molde de plástico cuando la agarosa se haya solidificado.
NOTA: Las placas de fundición de microinyección se pueden almacenar a 4 °C durante un máximo de 2 meses.
- Preparar las larvas para el xenotrasplante.
- El día de la inyección, detectar la expresión transgénica fluorescente seleccionada en las larvas de 3 dpf. Retire los animales no fluorescentes y de aspecto anormal.
- Decorionar las larvas manualmente con pinzas de relojero de punta fina. A 3 dpf, empuje o rasgue suavemente los coriones con dos pares de pinzas de punta fina para liberar a las larvas del corion.
NOTA: Alternativamente, el tratamiento enzimático con pronasa A se puede utilizar para decorionar larvas, generalmente a 24 hpf. - Mantener las larvas decorionadas en medio de agua mineral con azul de metileno (0,28 mg/mL) y PTU (0,003% final).
3. Procedimiento de xenotrasplante
- Prepare agujas de microinyección.
- Tome un capilar de vidrio de borosilicato sin filamento central y colóquelo en un extractor de agujas vertical.
- Usando los siguientes ajustes-aumentar 8.5 y calentador 3-estirar el capilar para convertirlo en una aguja de microinyección.
- Configure el microinyector.
- Cargue el aceite mineral en un microinyector manual. Retire las burbujas de aire.
- Enchufe un soporte capilar universal al microinyector y conéctelo firmemente a un micromanipulador mecánico (Figura 2A).
- Recolectar las células del glioblastoma.
NOTA: Los siguientes pasos se llevan a cabo en un gabinete de bioseguridad BSL2.- Preparar una placa de 10 cm de células de glioblastoma para que alcancen el 80% de confluencia el día del trasplante.
- (Opcional) Etiquete transitoriamente los núcleos celulares agregando Hoechst 35480 (200 ng / ml) a las células. Incubar durante 20 min a 37 °C en la incubadora de celdas humidificadas y lavar 2 veces con PBS.
- Saque la placa de células de la incubadora y lávela una vez con PBS. Separar las células añadiendo 1 ml de tripsina-EDTA al 0,05% e incubar durante 5-10 min a 37 °C en la incubadora de células hasta que todas las células estén completamente separadas.
NOTA: Este paso es crítico ya que una tripsinización deficiente dará como resultado que los agregados celulares permanezcan atrapados en la aguja. - Resuspender las células en 5 ml de medio celular de glioblastoma completo en un tubo de centrífuga de 50 ml. Añadir 45 ml de PBS helado y centrifugar a 134 × g durante 5 min.
- Deseche el sobrenadante y resuspenda las células con 1 ml de PBS helado pipeteando hacia arriba y hacia abajo a fondo.
NOTA: Este paso de disociación mecánica ayuda en gran medida a prevenir el riesgo de obstrucción en el capilar durante la microinyección. - Añadir 49 ml de PBS helado y centrifugar a 134 × g durante 5 min. Deseche el sobrenadante y resuspenda las células en 200 μL de PBS helado. Almacenar en hielo durante el procedimiento de trasplante.
- Microinyectar las células de glioblastoma en el mesencéfalo de las larvas de pez cebra.
- Llene una placa de fundición de microinyección con 6 ml de E3-medium30 suplementado con 160 mg / L de tricaína.
- Transfiera una docena de larvas decorionadas a la placa de microinyección. Una vez que no respondan al tacto, alinéelos en las zanjas de lado, con la cabeza hacia arriba y el saco vitelino empujado contra la pared de la zanja, con un pincel de tamaño 00 (Figura 2B, C).
- Resuspender las células del glioblastoma. Cargue 5 μL de células en el microcapilar utilizando puntas de microcarga e inserte el capilar en el soporte capilar universal.
- Coloque la placa de microinyección que contiene las larvas que no responden bajo el microscopio estereoscópico. Coloque la punta del microcapilar en el borde de la placa de microinyección utilizando las perillas del micromanipulador. Romperlo con un bisturí para crear un punto de entrada nítido, aproximadamente del tamaño del diámetro de una célula.
- Verifique que las células fluyan fuera del capilar haciendo correr suavemente aceite en el microinyector y hundiendo la punta de la aguja en el medio. Concentre las células en la punta del capilar para maximizar el número de células inyectadas por volumen expulsado y evite llenar el tejido cerebral con PBS (Figura 2C).
- Examine cuidadosamente las células que salen del microcapilar a medida que el aceite se introduce manualmente en el inyector. Defina empíricamente cuánto giro se necesita en la perilla manual para entregar de 20 a 50 celdas. Por lo general, si las células están lo suficientemente concentradas, un giro suave es suficiente para expulsar ~ 10 células.
NOTA: Si el líquido no fluye adecuadamente fuera del microcapilar, intente aflojar la unión del microcapilar en el soporte capilar. Al hacerlo, el aceite podría filtrarse y gotear a lo largo del capilar. - Acérquese la punta del capilar contra el tecto óptico izquierdo (OT), justo por encima de la vena cerebral media (MCeV, figura 2F).
- Presione suavemente el capilar contra las larvas hasta que la membrana de la piel se rompa (Figura 2D,E).
NOTA: No presione demasiado, ya que esto resultará en la inyección de las células demasiado profundas en el cerebro, donde la menor claridad óptica impedirá observar las MT en detalle. La técnica de imagen es posible para una profundidad que alcanza los 250-300 μm. Sin embargo, se recomienda no inyectar a más de 100 μm de profundidad desde la superficie de los peces. - Una vez que se alcanza una posición adecuada en el OT, expulsar las células. Observe cuidadosamente la punta del capilar para visualizar la corriente de células que van dentro del animal, asegurando así una inyección exitosa.
NOTA: Tenga cuidado de no inyectar en los ventrículos (Figura 2E). Una vez en los ventrículos, las células tienden a acumularse y atascarse en lugar de infiltrarse en el tejido (Figura 2I). La inyección de ventrículos se caracteriza por una inflamación intensa del cerebro y una diseminación observable de las células inyectadas al cerebro anterior y al cerebro posterior (Figura 2J). - Repita el procedimiento de los pasos 3.4.9-3.4.11 para tantos animales como sea necesario. Proceda rápidamente para evitar la aglutinación de células en el capilar.
NOTA: Dependiendo de qué tan rápido esté inyectando el experimentador, podría ser necesario un cambio de aguja cada 10 a 20 larvas. - Una vez que se complete el xenotrasplante, retire las larvas de la placa de microinyección y selecciónelas en una placa de 24 pocillos llena de agua de fuente mineral + PTU + medio azul de metileno.
- Validar la inyección exitosa observando las larvas bajo un microscopio estereoscópico fluorescente (Figura 2G). Seleccione solo xenoinjertos que contengan una sola masa tumoral formada por 20-50 células ubicadas en los 200 μm superiores (en z) del OT (Figura 2H vs inyección fallida en la Figura 2I-K).
NOTA: El rendimiento de los xenoinjertos localizados con éxito varía del 10% al principio a casi el 100% con la práctica. - Deje que las larvas se recuperen durante al menos 4 h a 32 °C antes de la obtención de imágenes.
NOTA: Agregar antibióticos en el medio no aumenta la tasa de supervivencia de las larvas. En esta etapa, si la microinyección se ha realizado correctamente, casi el 100% de los peces sobreviven.
4. Imágenes intravitales de los xenoinjertos de glioblastoma
- Monte las larvas para obtener imágenes en vivo.
NOTA: Las larvas pueden ser fotografiadas a partir de 4 h después de la inyección (hpi). Las imágenes en vivo de MT generalmente se realizan a partir de 20 hpi, cuando las células GBM invasivas han comenzado a extender las protuberancias y migrar lejos de la masa tumoral.- Prepare una solución de agarosa de bajo punto de fusión al 1%. Transfiera 500 μL de solución de agarosa de bajo punto de fusión hervida al 1% a un tubo de centrífuga de 1,5 ml y deje que se enfríe a 37 °C en un bloque de calor. Agregue tricaína (112 μg/mL) a la agarosa y mezcle bien.
- Transfiera de una a cuatro larvas xenoinjertadas en una placa de Petri de 3,5 cm llena de agua mineral + PTU + medio de metileno complementado con tricaína (112 μg / ml). Una vez que las larvas no respondan al tacto, transfiéralas cuidadosamente al tubo que contiene la agarosa y la tricaína con una pipeta de transferencia de punta fina.
NOTA: Mantenga el volumen de medio al mínimo para limitar la dilución de la agarosa. - Mezclar suavemente las larvas con la agarosa. Usando una pipeta de transferencia normal (bulbo grande), coloque las larvas mezcladas en la agarosa en el centro de un plato de imágenes de video de 3,5 cm con fondo de vidrio. Bajo un microscopio estereoscópico, coloque rápidamente las larvas sobre su espalda usando una punta de microcarga para manipular a los peces.
NOTA: Debido a que se utiliza un microscopio confocal de disco giratorio invertido para obtener imágenes cerebrales intravitales en este protocolo, las larvas se montan dorsalmente. Ajuste la posición de las larvas en consecuencia si utiliza un microscopio confocal vertical. - Retire la agarosa adicional para mantener la capa de agarosa más delgada posible. Una vez que la agarosa se haya solidificado, agregue 2.5 ml de agua de fuente mineral + PTU + 0.2x tricaine (medio de imagen) y continúe con el siguiente paso.
- Imágenes en vivo in vivo de la dinámica de MT en células invasoras de glioblastoma
NOTA: La calidad óptica de las imágenes depende en gran medida del rendimiento del microscopio que se utiliza. El protocolo está escrito para un microscopio confocal de disco giratorio invertido equipado con una cámara sCMOS (tamaño de píxel 6.5 μm, 2048 x 2044 píxeles), objetivo de larga distancia de trabajo y cámara ambiental con temperatura controlada.- Coloque la antena de imágenes de vídeo que contiene las larvas xenoinjertadas incrustadas en agarosa en la cámara ambiental de un microscopio confocal invertido, con la temperatura fijada en 32 °C. Encuentra las larvas en el plato de imágenes de video con un objetivo de 10x, utilizando una etapa XY motorizada.
- Presione ESC para bajar la torreta de objetivos, agregue aceite mineral a un objetivo de aceite 60x (1.4 NA, distancia de trabajo: 0.13 mm) y presione ESC para volver a la posición focal inicial.
- Observe las células invasoras de glioblastoma en el canal rojo (fuente láser de 561 nm, 20% de potencia láser, tiempo de exposición: 200 ms) y seleccione una celda con una red MT extendida y filamentos MT fácilmente distinguibles (Figura 3B).
- Establezca la configuración de la serie z. Utilizando una etapa piezoeléctrica de rango de 200 μm, seleccione las posiciones superior e inferior de la red MT: una pila z de 10-30 μm de profundidad es suficiente para visualizar la red de microtúbulos en la protuberancia de la célula migratoria, con un paso z-slice de 0,3 μm.
- Establezca la configuración de adquisición de lapso de tiempo para permitir un equilibrio óptimo entre la velocidad de adquisición, la profundidad de la pila z y la señal fluorescente para evitar el fotoblanqueo rápido. Adquiera imágenes de MT cada 5-10 s durante varios minutos. Adquiera y guarde el hiperstack 5D (x,y,z,t,c).
NOTA: Para evitar desviaciones en z durante la adquisición, utilice un microscopio equipado con un sistema de enfoque perfecto como estabilización de enfoque de hardware.
- (Opcional) Determinar los efectos de los agentes alteradores de microtúbulos (MTA) en los MT.
NOTA: Los siguientes pasos permiten probar los efectos de los MTA en una red MT en la migración de células de glioblastoma en tiempo real.- Retire suavemente el medio de imagen de la antena de imágenes de vídeo. No toque el fondo del plato, ya que se perderá la posición xyz.
- Preparar un nuevo medio de imagen que contenga el MTA a diferentes concentraciones. Agregue suavemente el medio que contiene MTA en el plato de imágenes de video gota a gota.
- Adquirir películas a largo plazo (2-16 h, una imagen cada 10-20 min) para observar los efectos de cada concentración del MTA en la red MT y la migración celular (Figura 4A).
- (Opcional) Lave el MTA retirando suavemente el medio y agregando 2.5 ml de medio de imagen fresco sin el MTA. Repita el procedimiento de lavado 3 veces para eliminar cualquier rastro de MTA en el medio.
- (Opcional) Adquiera una película a largo plazo similar a la de 4.3.3 (Figura 4B).
NOTA: Los pasos anteriores determinan la concentración mínima que altera la red MT sin afectar la supervivencia de las larvas. Los pasos de lavado definen si el efecto del medicamento es reversible.
- Evaluar el impacto de la MTA en la invasión del glioblastoma mediante imágenes secuenciales.
- Siga los pasos 4.1 a 4.2.1 4 h después de la microinyección.
NOTA: Esta parte del protocolo también se puede lograr con otras líneas celulares de glioblastoma marcadas con fluorescencia. Idealmente, co-etiquetar el GBM con una etiqueta citosólica y una etiqueta de núcleo para asegurar la detección de la morfología global de la célula. - Cambie a un objetivo de agua de 40x de larga distancia de trabajo (NA: 1.15, WD: 0.6 mm).
- Establezca el rango de la serie z para adquirir la región OT. Adquiera la pila z utilizando una cámara sCMOS de alta sensibilidad (tamaño de píxel 11 μm, 1,200 x 1,200 píxeles, eficiencia cuántica 95%).
NOTA: La pila z generalmente comienza en la parte más dorsal del OT (cerca de la superficie) y termina lo suficientemente profundo en el cerebro como para incluir toda la masa de células tumorales. - Retire la antena de imágenes de video del microscopio. Libere las larvas de la agarosa usando una punta de microcarga y empujando suavemente la agarosa alrededor del animal.
NOTA: Como las larvas de 3 dpf todavía son muy frágiles, tenga cuidado al retirarlas de la agarosa. - Una vez que el animal se libere de la agarosa, transfiérala suavemente a un solo pocillo de una placa de 24 pocillos llena de agua de fuente mineral + azul de metileno + medio PTU. Marque el pozo para identificar las larvas para su posterior obtención de imágenes.
- Añadir el MTA de interés en el medio a la concentración determinada previamente (paso 4.3.3). Refresque el medio suplementado con el medicamento todos los días. Repita el procedimiento de imagen de los pasos 4.4.1 a 4.4.5 todos los días durante 3-4 días.
- Siga los pasos 4.1 a 4.2.1 4 h después de la microinyección.
5. Análisis de imágenes
- Analice la dinámica de MT con complementos FIJI disponibles gratuitamente.
NOTA: Muchas revisiones y protocolos describen los métodos de análisis de dinámica MT en células31,32,33,34 y se pueden aplicar en esta etapa. Este protocolo se referirá brevemente a dos métodos para medir las propiedades dinámicas básicas de MT.- Abra la hiperpila 5D y genere una pila 4D donde los z-slices se hayan proyectado en un solo plano para crear una proyección de intensidad máxima (MIP) en z (Imagen | Pilas | Proyecto Z | Intensidad máxima) (Figura 3B).
- Abra la pila 4D MIP y realice un seguimiento manual del final de una MT basada en protuberancias utilizando la función de seguimiento manual en FIJI (Plugins | Seguimiento | Seguimiento manual). (Figura 3D). Extraiga los parámetros de la dinámica de MT, como la velocidad de crecimiento, la velocidad de contracción, la frecuencia de rescate y la frecuencia de catástrofe.
- Alternativamente, dibuje una línea segmentada de 10 píxeles de ancho a lo largo del MT para analizar (Figura 3B). Utilice la función Multi Kymograph (Analizar | Multi Kymograph) (Figura 3C) en FIJI. Observe y mida las fases de crecimiento de MT (G), la duración de las pausas (P) y la frecuencia de las catástrofes de MT.
- Análisis de la invasión del glioblastoma a largo plazo
NOTA: Este análisis requiere el uso de visualización y análisis 4D con software de bioimagen.- Convierta la pila z 4D sin procesar del paso 4.4.3 (4 hpi) al formato de software adecuado, utilizando el software File Converter.
- Abra el software e importe el archivo z-stack convertido en la vista Superpass (Figura 5A).
- Para segmentar las células tumorales y descartar la autofluorescencia irrelevante en el canal rojo, haga clic en Agregar nuevas superficies y siga el proceso de 5 pasos.
- Valide la configuración predeterminada haciendo clic en la siguiente flecha una vez que aparezca la ventana. Continúe con el paso 2/5.
NOTA: Si la señal fluorescente se adquiere en el canal 561, la autofluorescencia de la pigmentación residual en el ojo puede ser fuerte y alterar el proceso de segmentación automática. Esto es problemático si el xenoinjerto se encuentra cerca del ojo. En ese caso, la segmentación debe terminarse manualmente cortando y eliminando las señales celulares que no son de glioblastoma. - Vaya a Canal de origen | Canal 561. Suavizar la imagen (filtro gaussiano) añadiendo 1,50 μm en Detalle de superficies y añadiendo 2,5 μm para el diámetro de las esferas en fondo de sustracción. Haga clic en la flecha siguiente y continúe con el paso 3/5.
- Dependiendo de la intensidad de la señal, ajuste manualmente el umbral (resta de fondo) para incluir cada proceso celular. Continúe con el paso 4/5.
- Filtre la señal segmentada eliminando los eventos que no representan parte de una célula (por ejemplo, desechos, autofluorescencia). Haga clic en Tipo de filtro | volumen y ajuste el umbral manualmente para excluir todos los eventos debajo del volumen más pequeño que representa parte de una celda. Continúe con el paso 5/5.
NOTA: Si las señales de autofluorescencia son más grandes en volumen que la parte celular más pequeña, proceda de todos modos y elimine manualmente las señales no deseadas haciendo clic izquierdo y eliminándolas . - Descarte el paso de clasificación y finalice el asistente de segmentación haciendo clic en la flecha verde doble para terminar de crear una vista de superficie de las células tumorales (Figura 5B).
- Valide la configuración predeterminada haciendo clic en la siguiente flecha una vez que aparezca la ventana. Continúe con el paso 2/5.
- Si las células segmentadas no se tocan entre sí y no forman un objeto único, combínelas artificialmente para crear un objeto de masa de células tumorales. En resumen, haga clic en Estadísticas | valores detallados | específicos | volumen. Seleccione todos los eventos haciendo clic izquierdo en el superior y luego manteniendo presionada la tecla Mayús y haciendo clic izquierdo en el último. Desplácese para editar | selección | unificar.
- Definir el centroide de la masa celular tumoral. Haga clic en Agregar nuevos lugares | Omitir | de creación automática Agregar (el cursor se cruza con) | Centro del objeto. Mantenga presionada la tecla Mayús y haga clic izquierdo para crear el punto, que es el centroide de la masa de células tumorales segmentadas.
- Mida la distancia 3D entre cada célula GBM y el centroide de la masa tumoral. Para ello, cree una distancia al canal centroide permaneciendo en la vista Spot y seleccionando el icono de la herramienta | Transformación de distancia. Espere a que se cree una nueva distancia al canal centroide, junto con el canal 488 y el canal 561 (en azul, Figura 5C).
NOTA: La intensidad de cada vóxel en este canal corresponde a la distancia 3D entre el vóxel y el centroide de la masa celular tumoral. - Mida la distancia 3D al centroide de cada celda segmentada haciendo clic en Agregar nuevos puntos | Omitir | de creación automática Agregar (el cursor se cruza con) | Canal específico 561. Mantenga presionada la tecla Mayús y haga clic izquierdo en el área del núcleo celular. Realice esta tarea para cada celda (Figura 5D).
NOTA: Quite la vista Superficie para apreciar mejor la señal de fluorescencia de las celdas. Alternativamente, si está presente, use la señal del núcleo (señal de 405 nm o 647 nm) para una mejor precisión. - Haga clic en Estadísticas | | detallado Valores específicos | intensidad media Ch=distancia al centroide.
NOTA: El valor de la intensidad es la distancia 3D en μm entre el área del núcleo celular y el centroide. - Promedie estas intensidades para calcular el radio de la masa tumoral a 4 hpi. Repita el procedimiento para cada punto de tiempo del análisis (24 hpi, 48 hpi y 72 hpi).
NOTA: Solo mide las 10 o 20 células más diseminadas para evitar subestimar la invasión celular. De hecho, la compactación forzada de las células durante la inyección puede evitar que las células en el centro de la masa tumoral migren. - Calcule el índice de invasión (II) como la relación entre las distancias medias 3D a t = 24 hpi/48 hpi/72 hpi de las células más diseminadas sobre el radio medio de la masa tumoral en t = 4 hpi (Figura 5E).
Resultados
Para analizar el papel desempeñado por las MT durante la invasión in vivo de GBM, describimos aquí los principales pasos para realizar el marcado estable de MT en células GBM por infección lentiviral, xenotrasplante ortotópico de células GBM en larvas de pez cebra de 3 dpf, imágenes intravitales de alta resolución de la dinámica de MT, tratamiento con MTA y sus efectos sobre la invasión de GBM, y análisis de imágenes de la dinámica de MT e invasión in vivo (Figura 1). La dinámica de MT se mide construyendo quimografías a lo largo de MT en crecimiento y contracción (Figura 3C) o rastreando manualmente los bordes individuales de MT a lo largo del tiempo (Figura 3D). Un ejemplo de tratamiento farmacológico administrado en el medio larvario y su efecto reversible sobre la organización de la red MT se da en la Figura 4. El tratamiento con una dosis baja de nocodazol (200 nM) conduce a la contracción progresiva de la red MT y a la desaparición de la protrusión de las células de glioblastoma 4 h después (Figura 4A). El lavado del fármaco restauró la capacidad de las células de glioblastoma para formar protuberancias. Las células reanudaron la migración a lo largo de la vasculatura 12 h después del lavado (Figura 4B). Estos datos sugieren que el tratamiento con nocodazol de 200 nM es suficiente para interrumpir la red MT y bloquea rápidamente la invasión de células de glioblastoma in vivo. Un análisis de 3 días del mismo tratamiento en la invasión global de células de glioblastoma revela que el nocodazol 200 nM detiene la invasión de células de glioblastoma a largo plazo in vivo, sin afectar la salud general de los peces, en comparación con un control (Figura 4C).
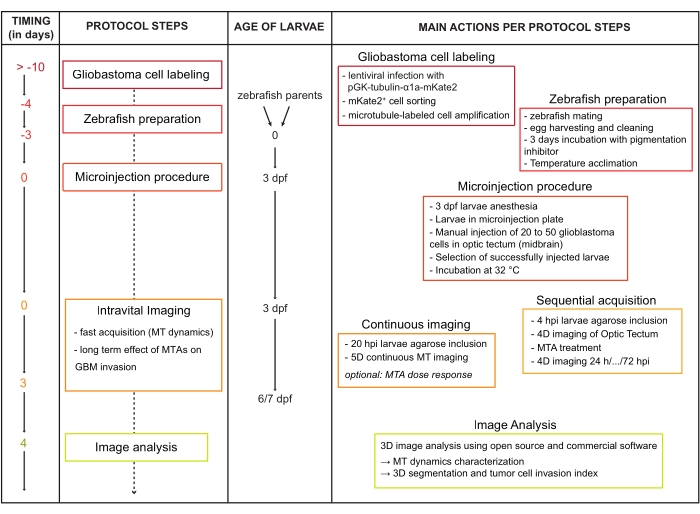
Figura 1: Diagrama de flujo de trabajo de protocolo. Abreviaturas: dpf = días después de la fertilización; HPI = horas después de la inyección; MT = microtúbulos; MTA = agente alterador de microtúbulos; GBM = glioblastoma multiforme. Haga clic aquí para ver una versión más grande de esta figura.
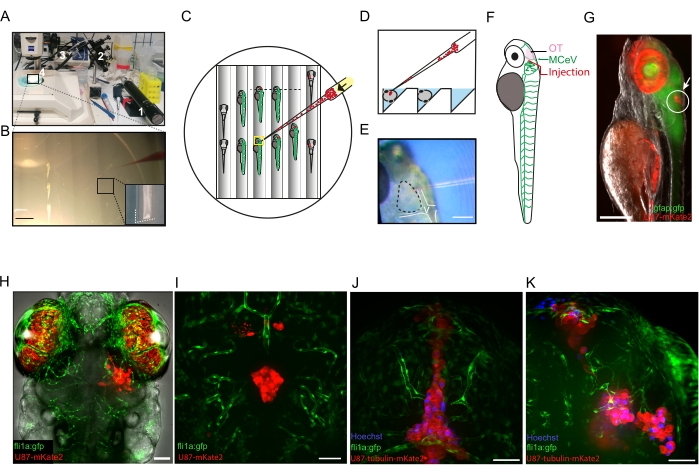
Figura 2: Microinyección de células de glioblastoma en cerebros de larvas de pez cebra de 3 dpf. A) Fotografía del equipo utilizado para el xenotrasplante: 1, microinyector de aceite; 2, micromanipulador mecánico; 3, soporte capilar universal; 4, capilar de vidrio. La placa de microinyección está bajo un microscopio estereoscópico. (B) Fotografía que muestra anestesiadas 3 larvas de pez cebra dfp alineadas en una zanja y listas para ser microinyectadas. La punta de un microcapilar cargado con un tinte rojo es visible a la derecha de la fotografía. Los detalles de las zanjas estampadas construidas en la placa de agarosa se ven en el recuadro en la esquina inferior derecha. Barra de escala = 3 mm. (C) Esquema de una placa de microinyección representativa. Las larvas listas para ser inyectadas se colocan lateralmente (centro de la placa). Tenga en cuenta que las células se concentran en la punta del microcapilar (flecha negra) antes de proceder a la inyección. Las larvas inyectadas se muestran a la derecha de la placa, colocadas ventralmente. (D) Esquema de un corte transversal en la placa de microinyección (a lo largo de la línea punteada negra en C) que muestra las zanjas donde se colocan las larvas durante la inyección. (E) Fotografía que muestra la punta del capilar lista para penetrar en el tectum óptico (línea punteada). Los ventrículos están delineados por las líneas blancas. Barra de escala = 150 μm. (F) Esquema de una larva fli1a:gfp de 3 dpf que expresa gfp en las células endoteliales, indicando la región OT donde se inyectan las células, justo por encima de la vena cerebral media. (G) Imagen de fluorescencia de una larva gfap:gfp de 3 dpf (gfp expresada en células madre neurales) colocada lateralmente después de la microinyección de células U87-mkate2 (círculo blanco y flecha blanca). La alta autofluorescencia en rojo es causada por los iridóforos en los ojos. Barra de escala = 100 μm. (H) Imagen de fluorescencia confocal de una larva fli1a:gfp inyectada con éxito a 16 hpi. Barra de escala: 50 μm. (I-K) Imágenes de fluorescencia confocal de larvas fli1a:gfp inyectadas sin éxito a 96 hpi (I) y 4 hpi (J,K). Las células GBM se han inyectado en ventrículos (I, J) o en múltiples focos en el cerebro (K). Barras de escala = 50 μm. Abreviaturas: dpf = días después de la fertilización; OT = tectum óptico; MCeV = vena cerebral media; GFP = proteína verde fluorescente; GFAP = proteína ácida fibrilar glial; HPI = horas después de la inyección. Haga clic aquí para ver una versión más grande de esta figura.
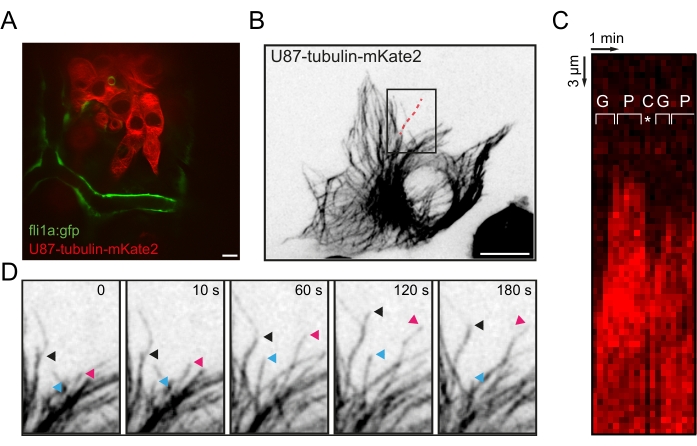
Figura 3: Visualización de la dinámica de los microtúbulos in vivo en células de glioblastoma. (A) Imagen de fluorescencia representativa de células U87 xenoinjertadas que expresan tubulina-α1-mkate2 en el OT de una larva de pez cebra fli1a:GFP a 20 hpi. (B) Imagen de fluorescencia proyectada de máxima intensidad de la red MT en una sola célula U87 xenoinjertada. (C) Kymograph a lo largo de la línea punteada roja en B, que muestra las fases de crecimiento, pausa y catástrofe de la inestabilidad dinámica de MT. (D) Secuencia de lapso de tiempo de la región en caja en B destacando el seguimiento de tres extremos MT +. Barras de escala = 10 μm. Abreviaturas: OT = tectum óptico; GFP = proteína verde fluorescente; HPI = horas después de la inyección; MT = microtúbulos; G = fase de crecimiento; P = fase de pausa; C = fase de catástrofe. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Visualización de los efectos del agente alterador de microtúbulos en la invasión del glioblastoma in vivo. (A) Secuencia de lapso de tiempo de células U87 que expresan tubulina-α1a-mkate2 en larvas de pez cebra tratadas con nocadazol (200 nM). Las flechas apuntan a la extremidad de la protuberancia en dos células diferentes que invaden el cerebro a lo largo de un vaso sanguíneo. Tenga en cuenta la retracción de la protuberancia tras el tratamiento con nocodazol. Barra de escala = 10 μm. (B) Secuencia de lapso de tiempo que representa el efecto del lavado de nocodazol en la invasión celular U87. A los 500 min después del lavado, la celda marcada con el asterisco blanco alarga una protuberancia basada en MT (flecha blanca), que permite su reanudación de la invasión a lo largo de un vaso sanguíneo. Barra de escala = 20 μm. (C) Representaciones 3D de un cerebro de larvas xenoinjertadas tratadas con DMSO o nocodazol (200 nM) durante 72 h. La señal de las células U87 se ha segmentado (en rojo) e integrado a la señal de fluorescencia fli1a-GFP (en blanco). Tenga en cuenta la disminución de la diseminación de las células U87 tratadas con nocodazol. Barra de escala = 30 μm. Abreviaturas: GFP = proteína verde fluorescente; HPI = horas después de la inyección; MT = microtúbulos. Haga clic aquí para ver una versión más grande de esta figura.
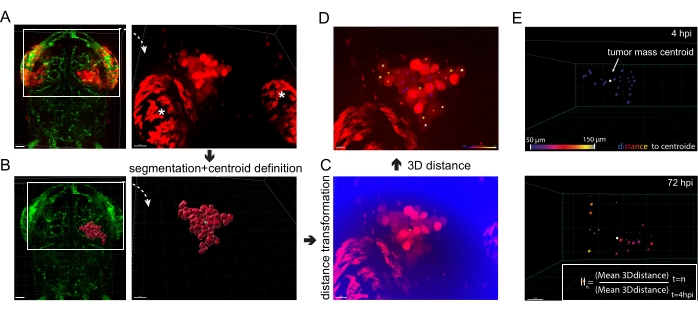
Figura 5: Análisis de imagen de invasión de glioblastoma in vivo . (A) Imágenes fluorescentes de células U87 xenoinjertadas que expresan mKate2 citosólica en larvas de pez cebra fli1a-GFP, 4 hpi. Los asteriscos blancos subrayan la autofluorescencia típica de los iridóforos oculares. Barra de escala = 40 μm. (B) Imagen fluorescente de larvas fli1a-GFP acopladas con la superficie segmentada correspondiente a la señal de células U87 en A. El centroide de la masa tumoral aparece verde. Barra de escala = 40 μm. (C) Imagen fluorescente que representa la señal del canal rojo en A y el canal "distancia al centroide" recientemente definido (en azul). Barra de escala = 30 μm. (D) Imagen de fluorescencia del canal rojo superpuesta con manchas de colores, cuyo color representa la distancia de la célula al centroide (en verde), siendo el violeta el más cercano al centroide y el blanco el más alejado. Barra de escala = 20 μm. (E) Un ejemplo de análisis secuencial de la invasión global de GBM. Las distancias 3D se determinan a 4 hpi y 72 hpi, y el índice de invasión (II) se calcula de acuerdo con la fórmula en la bandeja de entrada. Barra de escala = 20 μm. Abreviaturas: GFP = proteína verde fluorescente; HPI = horas después de la inyección. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Es probable que la obtención de imágenes de xenoinjertos tumorales a resolución unicelular se convierta en una herramienta indispensable para mejorar nuestra comprensión de la biología del GBM. Las imágenes en vivo en modelos PDX de ratón han llevado a valiosos descubrimientos sobre cómo GBM invade colectivamente el tejido cerebral18. Sin embargo, hasta la fecha, la resolución espaciotemporal no es lo suficientemente alta como para revelar la dinámica de las proteínas que controlan la invasión de GBM. Razonamos que al acoplar el injerto ortotópico de células GBM en larvas transparentes de pez cebra con imágenes intravitales de alta resolución, las proteínas citoesqueléticas como las MT podrían analizarse con suficiente detalle para analizar su dinámica durante la invasión in situ de GBM.
Los pasos críticos de la metodología se encuentran en la preparación de las células GBM y el procedimiento de microinyección. Las células insalubres e inadecuadamente disociadas se pegarán entre sí o a los bordes capilares y bloquearán el flujo de inyección. Además, las células deben estar suficientemente concentradas en el capilar para minimizar el volumen inyectado e implantarlas a granel. La inyección de un mayor volumen de células más diluidas dará lugar a múltiples focos tumorales, a veces entremezclados, cuyos índices invasivos se vuelven difíciles de medir. En nuestras manos, el manejo manual del microinyector a base de aceite permite un mejor control del flujo de inyección que un microinyector electrónico a base de aire a presión que se ha utilizado anteriormente en un modelosimilar 19. Esto es fundamental para prevenir el exceso de presión de flujo dentro del cerebro, evitando así el daño tisular posterior y la agregación ventricular de las células inyectadas.
Algunas limitaciones de este modelo incluyen la necesidad de realizar el experimento a temperaturas subóptimas para ambas especies. El pez cebra generalmente se cría a 28 ° C, mientras que las células humanas se cultivan a 37 ° C. Por encima de 32 °C, el desarrollo embrionario del pez cebra se altera y estos cambios pueden ser letales35. Sin embargo, de manera similar a lo que se hace en los modelos36 de xenoinjerto de pez cebra adultos, la aclimatación secuencial de las larvas de pez cebra a una temperatura de 32 °C aumenta la supervivencia de los animales trasplantados en comparación con el rápido cambio de temperatura posterior al trasplante de 28 °C a 32 °C. Sin embargo, el aumento de la temperatura conduce a un aumento de la muerte de animales de acuerdo con la sensibilidad de los embriones de pez cebra a temperaturas superiores a 32 °C35.
La interpretación de los datos de dinámica de MT in vivo debe hacerse cuidadosamente, ya que la dinámica de MT cambia cuando la temperatura desciende por debajo de 37 °C37. La medición in vitro paralela de la dinámica de MT a 37 °C y 32 °C en las mismas células GBM con el mismo tratamiento MTA ayudará a validar las diferencias observadas entre varias células GBM o entre tratamientos in vivo . Debería ayudar a confirmar que las diferencias no son causadas por la variación en la sensibilidad a la temperatura, sino por diferentes vías de regulación (para el análisis de comparación de GBM) o por el tratamiento MTA (para el análisis del efecto MTA). Esto será de interés si las heterogeneidades de la dinámica MT se vinculan a diferentes habilidades de invasión.
Otra limitación es la corta ventana de tiempo durante la cual la invasión puede ser monitoreada (72 a 96 h), impidiendo la medición de la plasticidad de la invasión impulsada por cambios potenciales en la dinámica de MT38. Después de 96 h, notamos una fuerte disminución en la invasión de células GBM. A los 6 días después de la inyección, el número de células GBM disminuyó rápidamente, presumiblemente debido a una respuesta inmune del huésped causada por la acumulación de neutrófilos y macrófagos en el microambiente tumoral39. Es probable que la administración de MTA a todo el cerebro afecte a las células huésped neuronales cercanas, que dependen de las MT para su actividad y cuya alteración podría afectar posteriormente la invasión de GBM40. Este enfoque debe complementarse con ensayos de shRNA u optogenética que restrinjan la alteración de MT a las células GBM, pero sigue siendo una buena plataforma para detectar nuevos compuestos antiinvasivos.
La inyección ortotópica de células GBM marcadas con MT en el cerebro del pez cebra es de particular interés para descifrar el papel de las MT durante la invasión de células cancerosas, ya que muy pocos modelos animales permiten imágenes subcelulares in situ de la migración de células cancerosas en su tejido de origen15. Hasta la fecha, los estudios de las funciones de MT durante la migración de GBM se basan principalmente en ensayos in vitro y ex vivo y carecen de validación in vivo 24,41,42,43. Junto con el derribo de genes de interés o un enfoque de detección basado en genes imparcial, el ensayo presentado aquí ayudará a revelar nuevos reguladores de MT que son importantes para la invasión de GBM in vivo.
Los GBM son tumores muy heterogéneos cuyas propiedades invasivas difieren mucho entre las muestras44. Comprender los mecanismos moleculares subyacentes a su diferente modo de invasión ayudará a definir tratamientos terapéuticos ad hoc para bloquear la diseminación del GBM. La medición sistemática del índice invasivo, el modo de invasión y las propiedades citoesqueléticas, como la dinámica de MT en varias muestras de GBM, revelará nuevas correlaciones entre los perfiles mutacionales genómicos frecuentes y los patrones de invasión celular que dependen de propiedades citoesqueléticas específicas. Revelar cómo estas mutaciones afectan el cambio en la dinámica de MT no solo aumentaría nuestro conocimiento sobre la regulación de MT durante la migración celular45,46, sino que también podría conducir a terapias antiinvasivas específicas para el paciente, tan esperadas.
La relativa facilidad de microinyección en el pez cebra combinada con el alto número de larvas disponibles y la facilidad de inyección de medicamentos hacen que este procedimiento sea adecuado para la medicina personalizada47,48. Además, en contraste con la imagen intravital de xenoinjertos de GBM en ratones, que solo ocurre en la parte superior de 500 μm de la corteza49,50, el uso de pez cebra permite la visualización de la infiltración de GBM en todo el SNC. El modelo presentado aquí cumple con los criterios para convertirse en una herramienta invaluable para el análisis rápido de las capacidades invasivas del glioblastoma y su respuesta a los tratamientos.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Estamos muy agradecidos al Dr. P. Herbomel (Institut Pasteur, Francia) y su laboratorio, especialmente Valérie Briolat, y Emma Colucci-Guyon por proporcionarnos las líneas de pez cebra y el molde de plástico para placas de microinyección, y por su valiosa experiencia en procedimientos experimentales de pez cebra. Agradecemos a UtechS Photonic BioImaging (C2RT, Institut Pasteur, apoyado por la Agencia Nacional de Investigación de Francia BioImaging, y ANR-10-INBS-04; Inversiones para el futuro). Este trabajo fue apoyado por la Ligue contre le cancer (EL2017. LNCC), el Centre National de la Recherche Scientifique y el Institut Pasteur y por las generosas donaciones de la Sra. Marguerite MICHEL y el Sr. Porquet.
Materiales
| Name | Company | Catalog Number | Comments |
| Glioblastoma cell culture | |||
| Foetal calf serum | Eurobio | CVFSVF00-01 | Reagent |
| MEM NEAA | Gibco | 11140-050 | Reagent |
| Modified Eagle's medium | Eurobio | CM1MEM18-01 | Reagent |
| Penicillin–streptomycin | Gibco | 15140-122 | Reagent |
| U-87 MG | ECACC | 89081402-1VL | Cells |
| Lenitivirus production | |||
| BD FACSAria III | BD bioscience | Instrument | |
| BD FACSDiva software v8.0 | BD bioscience | Software | |
| HEK-293T | Merck | 12022001 | Cells |
| pMD2.G | Addgene | Plasmid #12259 | Reagent |
| psPAX2 | Addgene | Plasmid #12260 | Reagent |
| Ultracentrifuge Optima XPN-80 | Beckman Coulter | Instrument | |
| Cell passaging and staining | |||
| dPBS | Gibco | 14190-094 | Chemical |
| Hoechst 34580 | Sigma-Aldrich | 63493 | Chemical |
| Trypsin-EDTA (0,05%) | Gibco | 25300-054 | Reagent |
| Zebrafish husbandry | |||
| Fluorescence stereomicroscope LEICA M165FC | LEICA | https://www.leica-microsystems.com/fr/produits/stereomicroscopes-et-macroscopes/informations-detaillees/leica-m165-fc/ | Instrument |
| Methylene Blue hydrate | Sigma-Aldrich | M4159 | Chemical |
| N-Phenylthiourea (PTU) | Sigma-Aldrich | P7629-25G | Chemical |
| Transfer Pipettes fine tips | Samco Scientific | 232 | Equipment |
| Transfer Pipettes Large Bulb3mL | Samco Scientific | 225 | Equipment |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | Cat#: A5040 | Chemical |
| Volvic Source Water | DUTSCHER DOMINIQUE SAS | 999556 | Reagent |
| Xenotransplantation | |||
| 24-well plate | TPP | 92024 | Equipment |
| Borosilicate glass capillaries (1.0 ODx0.58IDx150L mm) | Harvard Apparatus | (#30-0017 GC100-15 | Equipment |
| CellTram oil vario microinjector | Eppendorf | 5176000.025 | Instrument |
| Microloading pipet tips (Microloader) 20µL | Eppendorf | 5242956003 | Equipment |
| Micromanipulator | NARISHIGE | https://products.narishige-group.com/group1/injection/english.html | Equipment |
| Mineral Oil | Sigma | M8410-100ml | Equipment |
| Stereomicroscope | Olympus | KL 2500 LCD | Instrument |
| Universal capillary holder | Eppendorf | 5176190002 | Equipment |
| Vertical Pipette puller | KOPF (Roucaire) | Model 720 | Instrument |
| Intravital Imaging | |||
| 3.5cm glass-bottom videoimaging dish | MatTek Life Sciences, MA, USA | P35G-1,5-14-C | Equipment |
| Acquisition software: NIS-Elements-AR version 5.21 | Nikon | Software | |
| Heat-Block | Techne | DRI-BLOCK DB-2D | Equipment |
| Microscope head Nikon Ti2E | Nikon | Instrument | |
| sCMOS camera Prime 95B | Photometrics | Instrument | |
| sCMOS camera Orca Flash 4 | Hammatsu | Instrument | |
| Ultrapure Low melting point agarose | Invitrogen | 16520-050 | Chemical |
| Yokagawa CSU-W1 spinning disk unit | Hammatsu | Instrument | |
| Drug Treatment | |||
| DMSO | Sigma-Aldrich | D2650-100ML | Chemical |
| Nocodazole | Sigma-Aldrich | M1404-2MG | Chemical |
| Image Analysis | |||
| Imaris 9.5.1 software | Oxford Instruments | Software | |
| ImarisFileConverter 9.5.1 | Oxford Instruments | Software |
Referencias
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112 (4), 453-465 (2003).
- Etienne-Manneville, S. Microtubules in cell migration. Annual Review of Cell and Developmental Biology. 29, 471-499 (2013).
- Bouchet, B. P., Akhmanova, A. Microtubules in 3D cell motility. Journal of Cell Science. 130 (1), 39-50 (2017).
- Seetharaman, S., et al. Microtubules tune mechanosensitive cell responses. Nature Materials. 21 (3), 366-377 (2022).
- Etienne-Manneville, S. From signaling pathways to microtubule dynamics: the key players. Current Opinion in Cell Biology. 22 (1), 104-111 (2010).
- Garcin, C., Straube, A. Microtubules in cell migration. Essays in Biochemistry. 63 (5), 509-520 (2019).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Nature editorial. The 'war on cancer' isn't yet won. Nature. 601 (297), (2022).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Clark, A. G., Vignjevic, D. M. Modes of cancer cell invasion and the role of the microenvironment. Current Opinion in Cell Biology. 36, 13-22 (2015).
- Meyer, A. S., et al. 2D protrusion but not motility predicts growth factor-induced cancer cell migration in 3D collagen. Journal of Cell Biology. 197 (6), 721-729 (2012).
- Bouchet, B. P., et al. Mesenchymal cell invasion requires cooperative regulation of persistent microtubule growth by SLAIN2 and CLASP1. Developmental Cell. 39 (6), 708-723 (2016).
- Luthria, G., et al. In vivo microscopy reveals macrophage polarization locally promotes coherent microtubule dynamics in migrating cancer cells. Nature Commun. 11 (1), 3521(2020).
- Wen, P. Y., Kesari, S. Malignant gliomas in adults. New England Journal of Medicine. 359 (5), 492-507 (2008).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments. (86), e55108(2014).
- Osswald, M., et al. Brain tumour cells interconnect to a functional and resistant network. Nature. 528 (7580), 93-98 (2015).
- Astell, K. R., Sieger, D. Investigating microglia-brain tumor cell interactions in vivo in the larval zebrafish brain. Methods in Cell Biology. , 593-626 (2017).
- Zeng, A., et al. Identify a blood-brain barrier penetrating drug-TNB using zebrafish orthotopic glioblastoma xenograft model. Scientific Reports. 7 (1), 14372(2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Disease Models & Mechanisms. 9 (9), 1063-1065 (2016).
- Umans, R. A., Ten Kate, M., Pollock, C., Sontheimer, H. Fishing for contact: modeling perivascular glioma invasion in the zebrafish brain. ACS Pharmacology & Translational Science. 4 (4), 1295-1305 (2021).
- Lee, J. H., et al. Human glioblastoma arises from subventricular zone cells with low-level driver mutations. Nature. 560 (7717), 243-247 (2018).
- Pagano, A., et al. Epothilone B inhibits migration of glioblastoma cells by inducing microtubule catastrophes and affecting EB1 accumulation at microtubule plus ends. Biochemical Pharmacology. 84 (4), 432-443 (2012).
- Berges, R., et al. The novel tubulin-binding checkpoint activator BAL101553 inhibits EB1-dependent migration and invasion and promotes differentiation of glioblastoma stem-like cells. Molecular Cancer Therapeutics. 15 (11), 2740-2749 (2016).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Volvic source water mineral composition. Volvic. , Available from: https://www.volvic.co.uk/volcanic-water/composition (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Brachydanio rerio). The University of Oregon Press, Eugene. , Chapter 5 (2000).
- E3, M. Recipe E3 medium (for zebrafish embryos. , Cold Spring Harbor Protocols. (2011).
- Straube, A. How to measure microtubule dynamics. Methods in Molecular Biology. 777, 1-14 (2011).
- Honore, S., Braguer, D. Investigating microtubule dynamic instability using microtubule-targeting agents. Methods in Molecular Biology. 777, 245-260 (2011).
- Movsisyan, N., Pardo, L. A. Measurement of microtubule dynamics by spinning disk microscopy in monopolar mitotic spindles. Journal of Visualized Experiments. (153), e60478(2019).
- Serikbaeva, A., Tvorogova, A., Kauanova, S., Vorobjev, I. A. Analysis of microtubule dynamics heterogeneity in cell culture. Methods in Molecular Biology. 1745, 181-204 (2018).
- Schnurr, M. E., Yin, Y., Scott, G. R. Temperature during embryonic development has persistent effects on metabolic enzymes in the muscle of zebrafish. Journal of Experimental Biology. 217 (8), 1370-1380 (2014).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Translational Oncology. 14 (1), 100899(2021).
- Hamilton, L., Astell, K. R., Velikova, G., Sieger, D. A zebrafish live imaging model reveals differential responses of microglia toward glioblastoma cells in vivo. Zebrafish. 13 (6), 523-534 (2016).
- Gillespie, S., Monje, M. An active role for neurons in glioma progression: making sense of Scherer's structures. NeuroOncology. 20 (10), 1292-1299 (2018).
- Wolf, K. J., et al. A mode of cell adhesion and migration facilitated by CD44-dependent microtentacles. Proceedings of the National Academy of Sciences. 117 (21), 11432-11443 (2020).
- Zhou, Y. X., et al. Transcriptional upregulation of microtubule-associated protein 2 is involved in the protein kinase A-induced decrease in the invasiveness of glioma cells. Neuro-Oncology. 17 (12), 1578-1588 (2015).
- Monzo, P., et al. Mechanical confinement triggers glioma linear migration dependent on formin FHOD3. Molecular Biology of the Cell. 27 (8), 1246-1261 (2016).
- Vollmann-Zwerenz, A., Leidgens, V., Feliciello, G., Klein, C. A., Hau, P. Tumor cell invasion in glioblastoma. International Journal of Molecular Science. 21 (6), 1932(2020).
- Feng, H., et al. EGFRvIII stimulates glioma growth and invasion through PKA-dependent serine phosphorylation of Dock180. Oncogene. 33 (19), 2504-2512 (2014).
- Liu, R., et al. Cdk5-mediated regulation of the PIKE-A-Akt pathway and glioblastoma cell invasion. Proceedings of the National Academy of Sciences. 105 (21), 7570-7575 (2008).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trends in Cancer. 6 (7), 569-579 (2020).
- Baxendale, S., van Eeden, F., Wilkinson, R. The power of zebrafish in personalised medicine. Personalised Medicine: Lessons from Neurodegeneration to Cancer. 1007, 179-197 (2017).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Stanchi, F., Matsumoto, K., Gerhardt, H. Imaging glioma progression by intravital microscopy. Methods in Molecular Biology. 1862, 227-243 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados