Method Article
Live-Bildgebung der Mikrotubulidynamik in Glioblastomzellen, die in das Zebrafischgehirn eindringen
In diesem Artikel
Zusammenfassung
Wir berichten über eine Technik, die eine Live-Bildgebung der Mikrotubulidynamik in Glioblastomzellen (GBM) ermöglicht, die in ein Hirngewebe von Wirbeltieren eindringen. Die Kopplung der orthotopischen Injektion von fluoreszenzmarkierten GBM-Zellen in ein transparentes Zebrafischgehirn mit hochauflösender intravitaler Bildgebung ermöglicht die Messung der Dynamik des Zytoskeletts während der in situ Krebsinvasion.
Zusammenfassung
Mit einer düsteren mittleren Überlebenszeit in realen Populationen - zwischen 6 und 15 Monaten - ist das Glioblastom (GBM) der verheerendste bösartige Hirntumor. Das Behandlungsversagen ist hauptsächlich auf die Invasivität der GBM-Zellen zurückzuführen, was für die Notwendigkeit eines besseren Verständnisses der beweglichen Eigenschaften von GBM spricht. Um den molekularen Mechanismus zu untersuchen, der die GBM-Invasion unterstützt, sind neue physiologische Modelle erforderlich, die eine eingehende Charakterisierung der Proteindynamik während der Invasion ermöglichen. Diese Beobachtungen würden den Weg zur Entdeckung neuer Ziele ebnen, um die Tumorinfiltration zu blockieren und die Patientenergebnisse zu verbessern. Dieser Artikel berichtet, wie ein orthotopes Xenotransplantat von GBM-Zellen im Zebrafischgehirn subzelluläre intravitale Live-Bildgebung ermöglicht. Wir konzentrieren uns auf Mikrotubuli (MTs) und beschreiben ein Verfahren zur MT-Markierung in GBM-Zellen, zur Mikroinjektion von GBM-Zellen in das transparente Gehirn von Zebrafischlarven 3 Tage nach der Befruchtung (dpf), zur intravitalen Bildgebung von MTs in den sich ausbreitenden Xenotransplantaten, zur Veränderung der MT-Dynamik, um ihre Rolle während der GBM-Invasion zu bewerten, und zur Analyse der erfassten Daten.
Einleitung
Zellmotilität ist ein stereotyper Prozess, der die Etablierung der Polaritätsachse und krafterzeugende Umlagerungen des Zytoskeletts erfordert. Die Aktinpolymerisation und ihre Assoziation mit Myosin gelten als die Hauptursachen für protrusive und kontraktile Kräfte, die für die Zellbewegung erforderlich sind1. Mikrotubuli gelten als Hauptakteure der Zellpolarisation und der gerichteten Persistenz während der Migration2. In den letzten Jahren wurde auch gezeigt, dass MTs Vorsprünge erzeugen und stabilisieren, um mechanokompressive Kräfte während der Zellinvasion in 3D3 zu unterstützen. In jüngerer Zeit waren MTs direkt an der Mechanotransduktion an fokalen Adhäsionen und mechanosensitiver Migration beteiligt4. Die dynamische Instabilität, die die MT-plus-Enddynamik charakterisiert, besteht aus wiederholten Phasen der Polymerisation (Wachstum) und Depolymerisation (Schrumpfung), die durch eine Vielzahl von Mikrotubuli-bindenden Proteinen und intrazellulären Signalkaskaden gesteuert werden, wie sie von RHO-GTPasen 5,6,7 gesteuert werden. Die Rolle des MT-Netzwerks bei der Zellmigration und -invasion hat die Untersuchung der MT-Dynamik zu einem Schlüsselelement gemacht, um die Mechanismen des Immunzell-Homing, der Wundheilung und der Krebsinvasion besser zu verstehen.
Die Fähigkeit von Krebszellen, dem primären Tumorkern zu entkommen, sich im Gewebe auszubreiten und sekundäre Tumore zu erzeugen, ist ein entscheidender Schritt, um den globalen Erfolg im Krieg gegen den Krebs zu verhindern, der vor 50 Jahren erklärt wurde 8,9. Eine der größten Hürden war zu verstehen, wie Krebszellen aktiv in das Gewebe eindringen. Wichtige Invasionsmechanismen beruhen auf den gleichen Prinzipien wie diejenigen, die die Migration nicht-tumoröser Zellen steuern10. Es sind jedoch Besonderheiten der Krebszellmigration aufgetreten11, was die Notwendigkeit einer besseren Charakterisierung dieser Art der Migration auslöst. Insbesondere weil die Tumormikroumgebung als Schlüsselrolle bei der Krebsprogression12 erscheint, ist die Beobachtung und Analyse der Krebszellinvasion in einem relevanten physiologischen Kontext unerlässlich, um die Mechanismen der Krebszellverbreitung zu entschlüsseln.
MTs sind von zentraler Bedeutung für das Fortschreiten von Krebs, um sowohl die Proliferation als auch die Invasion aufrechtzuerhalten. Eine präzise Analyse der MT-Dynamik in situ kann helfen, MT-verändernde Substanzen (MTA) in beiden Prozessen zu identifizieren. Die MÜ-Dynamik variiert drastisch bei einer Änderung der Umgebung. In vitro verhindert die Behandlung mit MT-destabilisierenden Wirkstoffen wie Nocodazol die Bildung von Zellprotrusionen, wenn Zellen in Gele in 3D eingebettet sind, während sie wenig Einfluss auf die 2D-Zellmigration hat13,14. Obwohl technisch anspruchsvoll, ermöglichen Fortschritte in der intravitalen Bildgebung eine In-vivo-Analyse der MT-Dynamik während der Invasion von Krebszellen. Zum Beispiel zeigte die Beobachtung von MTs in subkutan xenotransplantierten Fibrosarkomzellen in Mäusen, dass tumorassoziierte Makrophagen die MT-Dynamik in Tumorzellen beeinflussen15. Diese Mausmodelle beinhalten jedoch umfangreiche chirurgische Eingriffe und bleiben für weniger zugängliche Krebsarten wie den hochinvasiven Hirntumor GBM unbefriedigend.
Trotz einer düsteren durchschnittlichen Überlebenszeit von 15 Monaten16 ist wenig über die Art der Verbreitung von GBM innerhalb des Hirnparenchyms oder die wichtigsten molekularen Elemente, die die GBM-Zellinvasion im Hirngewebe unterstützen, bekannt. Die Verbesserung des orthotopen Xenograft-Modells (PDX) der Maus und die Etablierung von Schädelfenstern boten neue Perspektiven für GBM-Zellinvasionsstudien17,18. Aufgrund der suboptimalen Bildgebungsqualität hat dieses Modell jedoch weitgehend longitudinale Bildgebung von oberflächlichen Xenotransplantaten erlaubt und wurde bisher nicht erfolgreich zur Untersuchung subzellulärer Bildgebung von Zytoskelettproteinen eingesetzt. Darüber hinaus wurden im Zuge der "3R"-Anordnung, den Einsatz von Nagetieren zu reduzieren und sie durch niedere Wirbeltiere zu ersetzen, alternative Modelle etabliert.
Unter Ausnutzung der primitiven Immunität, die bei Zebrafischlarven (Danio rerio) beobachtet wurde, wurde eine orthotope Injektion von GBM-Zellen in das Fischgehirn entwickelt 19,20,21. Die Injektion in die Nähe der Ventrikel im sich entwickelnden Mittelhirn rekapituliert den größten Teil der menschlichen GBM-Pathophysiologie21, und das gleiche bevorzugte Muster der GBM-Invasion wie bei der Kooption der menschlichen Gefäße wird beobachtet22. Dank der Transparenz der Fischlarven ermöglicht dieses Modell die Visualisierung von GBM-Zellen, die aus den periventrikulären Bereichen, in denen die meisten GBMs entstehen sollen, in das Gehirn eindringen23.
Da MTs für die GBM-Zellinvasion in vitro24,25 unerlässlich sind, ist eine bessere Charakterisierung der MT-Dynamik und die Identifizierung von Schlüsselregulatoren während der Zellinvasion erforderlich. Bisher haben die mit dem Zebrafisch-Orthotopenmodell generierten Daten jedoch keine subzelluläre Analyse der MT-Dynamik während des Invasionsprozesses berücksichtigt. Dieses Papier bietet ein Protokoll, um die MT-Dynamik in vivo zu untersuchen und ihre Rolle während der Invasion von Hirntumoren zu bestimmen. Nach stabiler Mikrotubuli-Markierung werden GBM-Zellen mit 3 dpf in die Gehirne von Zebrafischlarven mikroinjiziert und in Echtzeit mit hoher räumlich-zeitlicher Auflösung während ihrer Progression im Hirngewebe abgebildet. Die Live-Bildgebung von fluoreszierenden MTs ermöglicht die qualitative und quantitative Analyse der MT-Plus-End-Dynamik. Darüber hinaus ermöglicht dieses Modell, den Einfluss von MTAs auf die MT-Dynamik und die invasiven Eigenschaften von GBM-Zellen in Echtzeit zu bewerten. Dieses relativ nicht-invasive Protokoll in Kombination mit einer großen Anzahl von Larven, die gleichzeitig gehandhabt werden, und der einfachen Anwendung von Medikamenten (im Fischwasser) macht das Modell zu einem Vorteil für präklinische Tests.
Protokoll
Tierversuche wurden nach den Richtlinien der Europäischen Union für den Umgang mit Versuchstieren durchgeführt. Alle Protokolle wurden von der Ethikkommission für Tierversuche des Institut Pasteur - CEEA 89 und dem französischen Ministerium für Forschung und Bildung (Genehmigung #01265.03) genehmigt. Während der Injektionen oder Live-Bildgebungssitzungen wurden die Tiere mit Tricaine.At am Ende der experimentellen Verfahren betäubt, sie wurden durch eine anästhetische Überdosierung eingeschläfert. Weitere Informationen zu den in diesem Protokoll verwendeten Materialien, Geräten und Software finden Sie in der Materialtabelle . Der allgemeine Workflow des Protokolls wird in Abbildung 1 beschrieben.
1. Erzeugung von Glioblastom-Zellen, die stabil α-Tubulin-mKate2 exprimieren
HINWEIS: Die folgenden Schritte werden in einer Biosicherheitswerkbank BSL2+ durchgeführt.
- Herstellung lentiviraler Partikel, die mKate2-Tubulin exprimieren, unter Verwendung der Calciumphosphatmethode für die Transfektion von 7 × 106 HEK-293T-Zellen.
- In einem 1,5-ml-Mikrozentrifugenröhrchen werden 10 μg Verpackungsplasmid psPAX2 der 2. Generation, 5 μg virales Hüllplasmid pMD2.G und 10 μg des interessierenden Plasmids, pGK-mKate2-humanes Tubulin α1a mit 50 μL CaCl 2 (2,5 M Vorrat) hinzugefügt. Mit sterilem DNAse-freiemH2Oauf 500 μL einstellen.
HINWEIS: Es ist wichtig, CaCl2 zuletzt hinzuzufügen. - Mischen Sie, indem Sie das Röhrchen einige Male umdrehen und 20 Minuten bei Raumtemperatur (RT) inkubieren.
- Bereiten Sie während der Inkubation ein weiteres 1,5-ml-Mikrozentrifugenröhrchen mit 500 μL HEPES-gepufferter Kochsalzlösung (HBS) pH 7,0 (2x) vor.
- Nach 20 min die CaCl2/DNA-Mischung Tropfen für Tropfen in die HBS-Lösung (2x) geben. Mischen Sie, indem Sie die Röhre einige Male umdrehen. Inkubieren Sie für 12 min bei RT.
- Nach 12 Minuten das mit HBS gemischte CaCl2/DNA vorsichtig Tropfen für Tropfen auf eine 70% konfluente 10 cm Schale aus HEK-293T-Zellen geben.
- Lassen Sie die Zellen im befeuchteten Inkubator bei 37 °C mit 5%CO2 für 36-48 h.
- Sammeln Sie den Überstand und drehen Sie ihn bei 3.000 × g für 5 Minuten, um Zelltrümmer zu entfernen.
- Um die Viruspartikel zu konzentrieren, laden Sie den Überstand in ein Ultrazentrifugenröhrchen und schleudern Sie es bei 47.508 × g für 90 min bei 4 °C.
- Verwerfen Sie den Überstand und legen Sie das Röhrchen kopfüber auf Papier, um das Innere des Röhrchens zu trocknen.
- Fügen Sie 30 μL PBS auf das virale Pellet hinzu. Resuspendieren Sie das Pellet nicht. Bei 4 °C 2 h stehen lassen.
- Resuspendieren Sie die Viruspartikel vorsichtig, indem Sie auf und ab pipettieren. Vermeiden Sie es, Blasen zu bilden. Bei -80 °C lagern.
HINWEIS: Größere Mengen an Viruspartikeln können durch Transfizieren mehrerer Platten von HEK-2-93T-Zellen erzeugt werden.
- In einem 1,5-ml-Mikrozentrifugenröhrchen werden 10 μg Verpackungsplasmid psPAX2 der 2. Generation, 5 μg virales Hüllplasmid pMD2.G und 10 μg des interessierenden Plasmids, pGK-mKate2-humanes Tubulin α1a mit 50 μL CaCl 2 (2,5 M Vorrat) hinzugefügt. Mit sterilem DNAse-freiemH2Oauf 500 μL einstellen.
- Infizieren Sie Glioblastomzellen mit lentiviralen Partikeln.
HINWEIS: Dieses Protokoll wurde für kommerzielle Glioblastom-Zelllinien wie U-87 MG, U-373 MG oder T98 geschrieben. Um primäre patientenabgeleitete Glioblastomzellen zu verwenden, verwenden Sie eine spezifische Beschichtung der Platten und eines nicht serumbasiertenMediums 26.- Bereiten Sie eine 70% konfluente 10-cm-Schale mit U-87 MG-Glioblastomzellen vor, die in Eagles minimalem essentiellem Medium (MEM) gezüchtet werden, ergänzt mit 10% fetalem Kälberserum, Penicillin-Streptomycin (100 Einheiten/ml Endkonzentration für Penicillin und 100 μg/ml für Streptomycin) und nicht-essentiellen Aminosäuren (1x).
- Fügen Sie die Viruspartikel in einer Verdünnung von 1 zu 5.000 direkt auf die Zellen hinzu. Mit einem sanften Schwenk mischen. Lassen Sie die Viren die Zellen für nicht länger als 20 h infizieren.
- Entfernen Sie das virushaltige Medium und ersetzen Sie es durch ein frisches Kulturmedium. Lassen Sie den Ausdruck des markierten Tubulins für 48-72 h zu.
HINWEIS: Die folgenden Schritte sind in einer Biosicherheitswerkbank BSL2 durchzuführen. - FACS-Sortieren Sie die Zellen, um die hellsten 15% der mKate2+ -Zellen auszuwählen. Nachdem Sie Schmutz- und Dublettzellen mit der Vorwärts- und Seitenstreuung (FCS vs. SSC) entfernt haben, wenden Sie eine weitere Gating auf die hellsten 30% mKate2+ Zellen an, um die oberen 15% zu halten.
- Amplifizieren Sie die MT-markierten Zellen.
HINWEIS: Alternativ kann eine klonale Selektion basierend auf hohen Tubulin-mKate2-Spiegeln unter einem Epifluoreszenzmikroskop durchgeführt werden.
2. Zebrafischlarven für die Mikroinjektion vorbereiten
- Generieren Sie Zebrafischeier.
- Legen Sie drei Männchen und vier Weibchen des gewünschten Zebrafischstamms 4 Tage vor der Xenotransplantation am späten Nachmittag in ein mit Murmeln ergänztes Paarungsbecken.
HINWEIS: Die Tg(fli1a:gfp)-), Tg(gfap:gfp)- oder Tg(Huc:gfp)-Linien werden verwendet, um endogene Gefäße, neuronale Stammzellen / Astrozyten bzw. Neuronen zu markieren. - Sammle die Eier, die durch marmorinduziertes Laichen am Morgen danach entstanden sind.
- Reinigen Sie die Eier, indem Sie sie in ein 50-ml-Zentrifugenröhrchen geben, das mit Mineralwasser27 gefüllt ist, das mit Bleichmittel (0,004% endgültig) ergänzt ist. Drehen Sie die Röhre vorsichtig für 5 min um. Nur zweimal mit Mineralwasser waschen.
- Die Eier in eine Petrischale geben, die das mit 0,28 mg/ml Methylenblau ergänzte Mineralwasser enthält.
- Entfernen Sie die unbefruchteten und entwicklungshemmenden Eier. Die Embryonen werden bei 28 °C inkubiert.
- Legen Sie drei Männchen und vier Weibchen des gewünschten Zebrafischstamms 4 Tage vor der Xenotransplantation am späten Nachmittag in ein mit Murmeln ergänztes Paarungsbecken.
- Erstellen Sie transparente Larven.
- N-Phenylthioharnstoff (PTU) (0,003% endgültig) 8 h später in das Medium einführen, um Melaninpigmentierung zu verhindern und optische Transparenz zu gewährleisten. Halten Sie PTU für den Rest des Protokolls im Medium.
HINWEIS: Da die PTU-Behandlung Entwicklungsstörungen verursachen kann, wählen Sie nur die normal entwickelten Larven für die Xenotransplantation aus. Als Alternative zur chemischen Behandlung kann man den mutierten Zebrafischstamm Casper (Perlmutt- und Roy-Orbison-Doppelmutante) verwenden, bei dem keine Pigmentierung vorhanden ist28. - Die Inkubationstemperatur wird auf 29 °C erhöht.
- Erhöhen Sie die Temperatur jeden Tag um 1 °C, so dass die 3 dpf-Larven am Tag der Injektion 32 °C erreichen.
- N-Phenylthioharnstoff (PTU) (0,003% endgültig) 8 h später in das Medium einführen, um Melaninpigmentierung zu verhindern und optische Transparenz zu gewährleisten. Halten Sie PTU für den Rest des Protokolls im Medium.
- Bereiten Sie die Mikroinjektionsplatte vor.
- 20 ml 1% Agarose + 0,28 mg/ml Methylenblau mit Mineralwasser zubereiten.
- Gießen Sie die Agarose in eine 10 cm Petrischale und tragen Sie die Mikrospritzguss-Kunststoffform schnell verkehrt herum auf, um 2,5 mm breite V-förmige Gräben zu erzeugen (Abbildung 2B).
HINWEIS: Die Kunststoffform ist im Handel erhältlich oder kann im eigenen Haus nach dem im Zebrafischbuch29 beschriebenen Design gebaut werden. - Entfernen Sie vorsichtig die Kunststoffform, wenn die Agarose erstarrt ist.
HINWEIS: Mikroinjektionsgussplatten können bis zu 2 Monate bei 4 °C gelagert werden.
- Bereiten Sie die Larven für die Xenotransplantation vor.
- Am Tag der Injektion auf ausgewählte fluoreszierende Transgenexpression in den 3 dpf-Larven screenen. Entfernen Sie die nicht fluoreszierenden, abnormal aussehenden Tiere.
- Dechorionate die Larven manuell mit feinspitzen Uhrmacherzangen. Bei 3 dpf die Chorionen mit zwei Paar feiner Pinzetten vorsichtig aufstoßen oder aufreißen, um die Larven vom Chorion zu befreien.
HINWEIS: Alternativ kann eine enzymatische Behandlung mit Pronase A verwendet werden, um Larven zu dechorionieren, normalerweise bei 24 hpf. - Pflegen Sie die dechorionierten Larven in Mineralwassermedium mit Methylenblau (0,28 mg / ml) und PTU (0,003% endgültig).
3. Xenotransplantationsverfahren
- Mikroinjektionsnadeln vorbereiten.
- Nehmen Sie eine Borosilikatglaskapillare ohne zentrales Filament und legen Sie sie in einen vertikalen Nadelzieher.
- Mit den folgenden Einstellungen - 8,5 erhöhen und Heizung 3 - dehnen Sie die Kapillare, um sie in eine Mikroinjektionsnadel zu verwandeln.
- Richten Sie den Mikroinjektor ein.
- Mineralöl in einen manuellen Mikroinjektor laden. Entfernen Sie Luftblasen.
- Schließen Sie einen universellen Kapillarhalter an den Mikroinjektor an, und befestigen Sie ihn fest an einem mechanischen Mikromanipulator (Abbildung 2A).
- Ernten Sie die Glioblastomzellen.
HINWEIS: Die folgenden Schritte werden in einer Biosicherheitswerkbank BSL2 durchgeführt.- Bereiten Sie eine 10 cm dicke Platte mit Glioblastomzellen vor, so dass sie am Tag der Transplantation 80% Konfluenz erreichen.
- (Optional) Markieren Sie vorübergehend die Zellkerne, indem Sie Hoechst 35480 (200 ng / ml) zu den Zellen hinzufügen. 20 min bei 37 °C im befeuchteten Zellinkubator inkubieren und 2x mit PBS waschen.
- Nehmen Sie die Zellplatte aus dem Inkubator und waschen Sie sie einmal mit PBS. Lösen Sie die Zellen durch Zugabe von 1 ml 0,05% Trypsin-EDTA und Inkubieren für 5-10 min bei 37 °C im Zellinkubator, bis alle Zellen vollständig abgelöst sind.
HINWEIS: Dieser Schritt ist kritisch, da eine schlechte Trypsinisierung dazu führt, dass Zellaggregate in der Nadel stecken bleiben. - Resuspendieren Sie die Zellen in 5 ml vollständigem Glioblastom-Zellmedium in einem 50-ml-Zentrifugenröhrchen. 45 mL eiskaltes PBS zugeben und bei 134 × g für 5 min zentrifugieren.
- Verwerfen Sie den Überstand und resuspendieren Sie die Zellen mit 1 ml eiskaltem PBS, indem Sie gründlich auf und ab pipettieren.
HINWEIS: Dieser Schritt der mechanischen Dissoziation trägt wesentlich dazu bei, das Risiko einer Verstopfung in der Kapillare während der Mikroinjektion zu vermeiden. - 49 mL eiskaltes PBS zugeben und bei 134 × g für 5 min zentrifugieren. Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 200 μL eiskaltem PBS. Für die Dauer des Transplantationsvorgangs auf Eis lagern.
- Mikroinjizieren Sie die Glioblastomzellen in das Mittelhirn der Zebrafischlarven.
- Füllen Sie eine Mikroinjektionsgussplatte mit 6 mL E3-medium30 , ergänzt mit 160 mg/L Tricain.
- Übertragen Sie ein Dutzend dechorionierte Larven in die Mikroinjektionsplatte. Sobald Sie nicht mehr auf Berührung reagieren, richten Sie sie in den Gräben auf der Seite aus, den Kopf nach oben und drücken Sie den Dottersack mit einem Pinsel der Größe 00 gegen die Wand des Grabens (Abbildung 2B, C).
- Resuspendieren Sie die Glioblastomzellen. Laden Sie 5 μL Zellen mit Microloading-Spitzen in die Mikrokapillare und führen Sie die Kapillare in den universellen Kapillarhalter ein.
- Legen Sie die Mikroinjektionsplatte mit den nicht reagierenden Larven unter das Stereomikroskop. Legen Sie die Spitze der Mikrokapillare mit den Mikromanipulatorknöpfen auf den Rand der Mikroinjektionsplatte. Zerbrechen Sie es mit einem Skalpell, um einen scharfen Eintrittspunkt zu schaffen, der ungefähr der Größe des Durchmessers einer Zelle entspricht.
- Stellen Sie sicher, dass die Zellen aus der Kapillare fließen, indem Sie vorsichtig Öl in den Mikroinjektor laufen lassen und die Spitze der Nadel in das Medium tauchen. Konzentrieren Sie die Zellen an der Spitze der Kapillare, um die Anzahl der injizierten Zellen pro ausgestoßenem Volumen zu maximieren und das Füllen des Hirngewebes mit PBS zu vermeiden (Abbildung 2C).
- Untersuchen Sie sorgfältig die Zellen, die aus der Mikrokapillare kommen, während Öl manuell in den Injektor eingeführt wird. Definieren Sie empirisch, wie viel Umdrehung am manuellen Knopf erforderlich ist, um 20 bis 50 Zellen zu liefern. Wenn die Zellen konzentriert genug sind, reicht typischerweise eine sanfte Drehung aus, um ~ 10 Zellen auszustoßen.
HINWEIS: Wenn Flüssigkeit nicht richtig aus der Mikrokapillare fließt, versuchen Sie, die Befestigung der Mikrokapillare im Kapillarhalter zu lösen. Auf diese Weise kann Öl austreten und entlang der Kapillare nach unten tropfen. - Nähern Sie sich der Spitze der Kapillare gegen das linke Optic Tectum (OT), direkt über der mittleren Hirnvene (MCeV, Abbildung 2F).
- Drücken Sie die Kapillare vorsichtig gegen die Larven, bis die Hautmembran bricht (Abbildung 2D,E).
HINWEIS: Drücken Sie nicht zu stark, da dies dazu führt, dass die Zellen zu tief in das Gehirn injiziert werden, wo die geringere optische Klarheit die Beobachtung von MTs im Detail verhindert. Das bildgebende Verfahren ist für eine Tiefe von 250-300 μm möglich. Es wird jedoch empfohlen, nicht tiefer als 100 μm von der Fischoberfläche zu injizieren. - Sobald eine geeignete Position im OT erreicht ist, werfen Sie die Zellen aus. Beobachten Sie sorgfältig die Spitze der Kapillare, um den Zellstrom im Inneren des Tieres zu visualisieren und so eine erfolgreiche Injektion sicherzustellen.
HINWEIS: Achten Sie darauf, nicht in die Ventrikel zu injizieren (Abbildung 2E). In den Ventrikeln neigen die Zellen dazu, sich anzusammeln und stecken zu bleiben, anstatt das Gewebe zu infiltrieren (Abbildung 2I). Die Ventrikelinjektion ist gekennzeichnet durch eine starke Schwellung des Gehirns und eine beobachtbare Verbreitung der injizierten Zellen in das Vorder- und Hinterhirn (Abbildung 2J). - Wiederholen Sie den Vorgang aus den Schritten 3.4.9-3.4.11 für so viele Tiere wie erforderlich. Gehen Sie schnell vor, um ein Verklumpen von Zellen in der Kapillare zu verhindern.
HINWEIS: Je nachdem, wie schnell der Experimentator bei der Injektion ist, kann ein Nadelwechsel alle 10 bis 20 Larven erforderlich sein. - Sobald die Xenotransplantation abgeschlossen ist, entfernen Sie die Larven von der Mikroinjektionsplatte und wählen Sie sie in einer 24-Well-Platte aus, die mit Mineralwasser + PTU + Methylenblaumedium gefüllt ist.
- Validierung der erfolgreichen Injektion durch Beobachtung der Larven unter einem fluoreszierenden Stereomikroskop (Abbildung 2G). Wählen Sie nur Xenotransplantate aus, die eine einzelne Tumormasse enthalten, die aus 20-50 Zellen besteht, die sich in den oberen 200 μm (in z) des AT befinden (Abbildung 2H vs. erfolglose Injektion in Abbildung 2I-K).
HINWEIS: Die Ausbeute an erfolgreich lokalisierten Xenotransplantaten variiert von 10% zu Beginn bis fast 100% mit Übung. - Lassen Sie die Larven sich vor der Bildgebung mindestens 4 h bei 32 °C erholen.
HINWEIS: Die Zugabe von Antibiotika im Medium erhöht nicht die Überlebensrate der Larven. In diesem Stadium, wenn die Mikroinjektion korrekt durchgeführt wurde, überleben fast 100% der Fische.
4. Intravitale Bildgebung der Glioblastom-Xenotransplantate
- Montieren Sie die Larven für die Live-Bildgebung.
HINWEIS: Larven können ab 4 h nach der Injektion (hpi) abgebildet werden. Die Live-Bildgebung von MT wird normalerweise ab 20 hpi durchgeführt, wenn invasive GBM-Zellen begonnen haben, die Vorsprünge auszudehnen und von der Tumormasse wegzuwandern.- Bereiten Sie eine 1% niedrigschmelzende Agaroselösung vor. 500 μL gekochte 1%ige niedrigschmelzende Agaroselösung in ein 1,5 mL Zentrifugenröhrchen geben und auf einem Hitzeblock bei 37 °C abkühlen lassen. Tricain (112 μg/ml) zur Agarose geben und gut mischen.
- Übertragen Sie ein bis vier xenotransplantierte Larven in eine 3,5 cm Petrischale, die mit Mineralwasser + PTU + Methylenmedium gefüllt ist, ergänzt mit Tricain (112 μg / ml). Sobald die Larven nicht mehr auf Berührung reagieren, übertragen Sie sie vorsichtig in das Röhrchen, das die Agarose und das Tricain enthält, mit einer feinen Transferpipette.
HINWEIS: Halten Sie das Volumen des Mediums auf ein Minimum, um die Verdünnung der Agarose zu begrenzen. - Mischen Sie die Larven vorsichtig mit der Agarose. Legen Sie die in der Agarose gemischten Larven mit einer normalen (großen Glühbirne) Transferpipette auf die Mitte einer 3,5 cm langen Videoschale mit Glasboden. Positionieren Sie die Larven unter einem Stereomikroskop schnell auf dem Rücken mit einer Mikroladespitze, um den Fisch zu manipulieren.
HINWEIS: Da in diesem Protokoll ein inverses Spinning-Disk-Konfokalmikroskop für die intravitale Bildgebung des Gehirns verwendet wird, werden die Larven dorsal montiert. Passen Sie die Positionierung der Larven entsprechend an, wenn Sie ein aufrechtes konfokales Mikroskop verwenden. - Entfernen Sie zusätzliche Agarose, um die dünnste mögliche Agaroseschicht zu erhalten. Sobald die Agarose erstarrt ist, fügen Sie 2,5 ml Mineralwasser + PTU + 0,2x Tricain (Bildmedium) hinzu und fahren Sie mit dem nächsten Schritt fort.
- In vivo Live-Bildgebung der MT-Dynamik in eindringenden Glioblastomzellen
HINWEIS: Die optische Qualität der Bilder hängt stark von der Leistung des verwendeten Mikroskops ab. Das Protokoll wurde für ein inverses Spinning-Disk-Konfokalmikroskop geschrieben, das mit einer sCMOS-Kamera (Pixelgröße 6,5 μm, 2048 x 2044 Pixel), einem Objektiv mit großem Arbeitsabstand und einer temperaturgesteuerten Klimakammer ausgestattet ist.- Die Video-Bildgebungsschale mit den in Agarose eingebetteten Xenotransplantat-Larven wird bei einer Temperatur von 32 °C in die Klimakammer eines inversen konfokalen Mikroskops gestellt. Finden Sie die Larven in der Video-Imaging-Schale mit einem 10x-Objektiv mit einem motorisierten XY-Tisch.
- Drücken Sie ESC, um den Objektivturm abzusenken, fügen Sie Mineralöl auf ein 60-faches Ölobjektiv (1,4 NA, Arbeitsabstand: 0,13 mm) hinzu, und drücken Sie ESC, um zur ursprünglichen Fokusposition zurückzukehren.
- Beobachten Sie die eindringenden Glioblastomzellen im roten Kanal (561 nm Laserquelle, 20% Laserleistung, Belichtungszeit: 200 ms) und wählen Sie eine Zelle mit einem ausgebreiteten MT-Netzwerk und leicht unterscheidbaren MT-Filamenten aus (Abbildung 3B).
- Legen Sie die Einstellungen der Z-Serie fest. Wählen Sie mit einer Piezostufe im Bereich von 200 μm die obere und untere Position des MT-Netzwerks aus: Ein 10-30 μm tiefer Z-Stack reicht aus, um das Mikrotubuli-Netzwerk im Vorsprung der migrierenden Zelle mit einem Z-Schichtschritt von 0,3 μm zu visualisieren.
- Stellen Sie die Einstellungen für die Zeitraffererfassung ein, um ein optimales Gleichgewicht zwischen Aufnahmegeschwindigkeit, Z-Stack-Tiefe und Fluoreszenzsignal zu ermöglichen, um schnelles Photobleichen zu vermeiden. Nehmen Sie alle 5-10 s mehrere Minuten lang Bilder von MTs auf. Erfassen und speichern Sie den 5D-Hyperstack (x,y,z,t,c).
HINWEIS: Um Drifts in z während der Aufnahme zu vermeiden, verwenden Sie ein Mikroskop, das mit einem perfekten Fokussystem als Hardware-Fokusstabilisierung ausgestattet ist.
- (Optional) Bestimmen Sie die Auswirkungen der Mikrotubuli-verändernden Mittel (MTAs) auf MTs.
HINWEIS: Die folgenden Schritte ermöglichen es, die Auswirkungen der MTAs auf ein MT-Netzwerk bei der Migration von Glioblastomzellen in Echtzeit zu testen.- Entfernen Sie das Bildmedium vorsichtig aus der Videoschüssel. Berühren Sie nicht den Boden der Schale, da sonst die xyz-Position verloren geht.
- Bereiten Sie ein neues Bildmedium vor, das den MTA in verschiedenen Konzentrationen enthält. Geben Sie das MTA-haltige Medium vorsichtig Tropfen für Tropfen in die Video-Imaging-Schale.
- Nehmen Sie Langzeitfilme auf (2-16 h, ein Bild alle 10-20 min), um die Auswirkungen jeder Konzentration des MTA auf das MT-Netzwerk und die Zellmigration zu beobachten (Abbildung 4A).
- (Optional) Waschen Sie den MTA aus, indem Sie das Medium vorsichtig entfernen und 2,5 ml frisches Bildmedium ohne MTA hinzufügen. Wiederholen Sie den Auswaschvorgang 3x, um Spuren von MTA im Medium zu entfernen.
- (Optional) Erwerben Sie einen ähnlichen Langzeitfilm wie in 4.3.3 (Abbildung 4B).
HINWEIS: Die obigen Schritte bestimmen die minimale Konzentration, die das MT-Netzwerk verändert, ohne das Überleben der Larven zu beeinträchtigen. Die Auswaschschritte definieren, ob die Wirkung des Medikaments reversibel ist.
- Bewerten Sie die Auswirkungen der MTA auf die Invasion des Glioblastoms durch sequenzielle Bildgebung.
- Führen Sie die Schritte 4.1 bis 4.2.1 4 h nach der Mikroinjektion aus.
HINWEIS: Dieser Teil des Protokolls kann auch mit anderen fluoreszenzmarkierten Glioblastom-Zelllinien erreicht werden. Idealerweise wird das GBM mit einem zytosolischen Tag und einem Zellkern-Tag markiert, um die globale Morphologie der Zelle zu erkennen. - Schalten Sie auf ein 40-faches Wasserobjektiv mit großem Arbeitsabstand um (NA:1,15, WD: 0,6 mm).
- Legen Sie den Bereich der Z-Serie fest, um die OT-Region zu erfassen. Erfassen Sie den Z-Stack mit einer hochempfindlichen sCMOS-Kamera (Pixelgröße 11 μm, 1.200 x 1.200 Pixel, Quanteneffizienz 95%).
HINWEIS: Der z-Stack beginnt normalerweise am dorsalen Teil des OT (nahe der Oberfläche) und endet tief genug im Gehirn, um die gesamte Tumorzellmasse einzubeziehen. - Nehmen Sie die Videoschüssel aus dem Mikroskop. Befreien Sie die Larven von der Agarose, indem Sie eine Microloading-Spitze verwenden und die Agarose sanft um das Tier herum stoßen.
HINWEIS: Da 3 DPF-Larven noch sehr zerbrechlich sind, seien Sie vorsichtig, wenn Sie sie aus der Agarose entfernen. - Sobald das Tier von der Agarose befreit ist, geben Sie es vorsichtig in eine einzelne Vertiefung einer 24-Well-Platte, die mit Mineralwasser + Methylenblau + PTU-Medium gefüllt ist. Markieren Sie den Brunnen, um die Larven für die nachfolgende Bildgebung zu identifizieren.
- Fügen Sie den MTA von Interesse für das Medium bei der zuvor bestimmten Konzentration hinzu (Schritt 4.3.3). Erfrischen Sie das Medium, das jeden Tag mit dem Medikament ergänzt wird. Wiederholen Sie den bildgebenden Vorgang aus den Schritten 4.4.1 bis 4.4.5 täglich für 3-4 Tage.
- Führen Sie die Schritte 4.1 bis 4.2.1 4 h nach der Mikroinjektion aus.
5. Bildanalyse
- Analysieren Sie die MÜ-Dynamik mit frei verfügbaren FIJI-Plugins.
HINWEIS: Viele Reviews und Protokolle beschreiben die Methoden der MT-Dynamikanalyse in den Zellen31,32,33,34 und können in diesem Stadium angewendet werden. Dieses Protokoll bezieht sich kurz auf zwei Methoden zur Messung grundlegender dynamischer MT-Eigenschaften.- Öffnen Sie den 5D-Hyperstack und generieren Sie einen 4D-Stack, in dem die Z-Slices in einer einzigen Ebene projiziert wurden, um eine maximale Intensitätsprojektion (MIP) in z zu erstellen (Bild | Stapel | Z-Projekt | Max. Intensität) (Abbildung 3B).
- Öffnen Sie den 4D MIP-Stack und verfolgen Sie manuell das Ende einer protrusionsbasierten MT mit der manuellen Tracking-Funktion in FIJI (Plugins | Sendungsverfolgung | Manuelle Nachverfolgung). (Abbildung 3D). Extrahieren Sie die Parameter der MÜ-Dynamik wie Wachstumsgeschwindigkeit, Schrumpfungsgeschwindigkeit, Rettungsfrequenz und Katastrophenfrequenz.
- Alternativ können Sie eine segmentierte Linie von 10 Pixel Breite entlang der MT zeichnen, um sie zu analysieren (Abbildung 3B). Verwenden Sie die Multi-Kymograph-Funktion (Analyze | Multi Kymograph) (Abbildung 3C) in Fidschi. Beobachten und messen Sie die MT-Wachstumsphasen (G), die Länge der Pausen (P) und die Häufigkeit von MT-Katastrophen.
- Analyse der langfristigen Gluoblastom-Invasion
HINWEIS: Diese Analyse erfordert die Verwendung von 4D-Visualisierung und Analyse mit Bioimaging-Software.- Konvertieren Sie den rohen 4D z-Stack aus Schritt 4.4.3 (4 HPI) mit der File Converter Software in das entsprechende Softwareformat.
- Öffnen Sie die Software, und importieren Sie die konvertierte Z-Stack-Datei in die Surpass-Ansicht (Abbildung 5A).
- Um die Tumorzellen zu segmentieren und irrelevante Autofluoreszenz im roten Kanal zu verwerfen, klicken Sie auf Neue Oberflächen hinzufügen und folgen Sie dem 5-stufigen Prozess.
- Überprüfen Sie die Standardeinstellungen, indem Sie auf den nächsten Pfeil klicken, sobald das Fenster angezeigt wird. Fahren Sie mit Schritt 2/5 fort.
HINWEIS: Wenn das Fluoreszenzsignal im 561-Kanal erfasst wird, kann die Autofluoreszenz durch Restpigmentierung im Auge stark sein und den automatischen Segmentierungsprozess verändern. Dies ist problematisch, wenn sich das Xenograft in der Nähe des Auges befindet. In diesem Fall muss die Segmentierung manuell abgeschlossen werden, indem Nicht-Glioblastom-Zellsignale geschnitten und gelöscht werden. - Navigieren Sie zu Quellkanal | 561-Kanal. Glätten Sie das Bild (Gauß-Filter), indem Sie 1,50 μm in Oberflächendetails und 2,5 μm für den Durchmesser der Kugeln im Substract-Hintergrund hinzufügen. Klicken Sie auf den nächsten Pfeil und fahren Sie mit Schritt 3/5 fort.
- Passen Sie je nach Intensität des Signals den Schwellenwert (Hintergrundsubstraktion) manuell an, um jeden Zellprozess einzubeziehen. Fahren Sie mit Schritt 4/5 fort.
- Filtern Sie das segmentierte Signal, indem Sie die Ereignisse entfernen, die keinen Teil einer Zelle darstellen (z. B. Trümmer, Autofluoreszenz). Klicken Sie auf Filtertyp | Lautstärke und passen Sie den Schwellenwert manuell an, um alle Ereignisse unterhalb des kleinsten Volumens auszuschließen, das einen Teil einer Zelle darstellt. Fahren Sie mit Schritt 5/5 fort.
HINWEIS: Wenn die Autofluoreszenzsignale größer sind als der kleinste Zellteil, fahren Sie trotzdem fort und entfernen Sie die unerwünschten Signale manuell, indem Sie mit der linken Maustaste klicken und sie löschen . - Verwerfen Sie den Klassifizierungsschritt , und beenden Sie den Segmentierungsassistenten, indem Sie auf den doppelten grünen Pfeil klicken, um die Erstellung einer Oberflächenansicht der Tumorzellen abzuschließen (Abbildung 5B).
- Überprüfen Sie die Standardeinstellungen, indem Sie auf den nächsten Pfeil klicken, sobald das Fenster angezeigt wird. Fahren Sie mit Schritt 2/5 fort.
- Wenn sich die segmentierten Zellen nicht berühren und kein eindeutiges Objekt bilden, verschmelzen Sie sie künstlich, um ein Tumorzellmassenobjekt zu erzeugen. Kurz gesagt, klicken Sie auf Statistik | detaillierte | bestimmten Werte | Volumen. Wählen Sie alle Ereignisse aus, indem Sie mit der linken Maustaste auf das obere klicken und dann die Umschalttaste gedrückt halten und mit der linken Maustaste auf das letzte klicken. Navigieren Sie zu Bearbeiten | Auswahl | Vereinheitlichen.
- Definieren Sie den Schwerpunkt der Tumorzellmasse. Klicken Sie auf Neue Spots hinzufügen | Automatische Erstellung überspringen | Hinzufügen (Cursor schneidet mit) | Mittelpunkt des Objekts. Halten Sie die Umschalttaste gedrückt und klicken Sie mit der linken Maustaste, um den Punkt zu erstellen, der der Schwerpunkt der segmentierten Tumorzellmasse ist.
- Messen Sie den 3D-Abstand zwischen jeder GBM-Zelle und dem Schwerpunkt der Tumormasse. Erstellen Sie dazu einen Abstand zum Schwerpunktkanal , indem Sie in der Volltonansicht bleiben und das Werkzeugsymbol auswählen| Distanztransformation. Warten Sie, bis neben dem Kanal 488 und 561 ein neuer Abstand zum Schwerpunktkanal erstellt wurde (blau, Abbildung 5C).
HINWEIS: Die Intensität jedes Voxels in diesem Kanal entspricht dem 3D-Abstand zwischen dem Voxel und dem Schwerpunkt der Tumorzellmasse. - Messen Sie den 3D-Abstand zum Schwerpunkt jeder segmentierten Zelle, indem Sie auf Neue Punkte hinzufügen | Automatische Erstellung überspringen | Hinzufügen (Cursor schneidet mit) | Spezifischer Kanal 561. Halten Sie die Umschalttaste gedrückt und klicken Sie mit der linken Maustaste auf den Zellkernbereich. Führen Sie diese Aufgabe für jede Zelle aus (Abbildung 5D).
HINWEIS: Entfernen Sie die Oberflächenansicht , um das Fluoreszenzsignal der Zellen besser einschätzen zu können. Alternativ, falls vorhanden, können Sie das Kernsignal (405 nm oder 647 nm Signal) für eine bessere Genauigkeit verwenden. - Klicken Sie auf Statistik | Detaillierte | Spezifische Werte | Intensitätsmittelwert Ch=Abstand zum Schwerpunkt.
HINWEIS: Der Wert der Intensität ist der 3D-Abstand in μm zwischen dem Zellkernbereich und dem Schwerpunkt. - Mittelwert dieser Intensitäten, um den Radius der Tumormasse bei 4 hpi zu berechnen. Wiederholen Sie den Vorgang für jeden Zeitpunkt der Analyse (24 hpi, 48 hpi und 72 hpi).
HINWEIS: Messen Sie nur die 10 oder 20 am stärksten disseminierten Zellen, um eine Unterschätzung der Zellinvasion zu vermeiden. Tatsächlich kann die erzwungene Verdichtung der Zellen während der Injektion verhindern, dass Zellen im Zentrum der Tumormasse wandern. - Berechnen Sie den Invasionsindex (II) als Verhältnis zwischen den mittleren 3D-Abständen bei t = 24 hpi/48 hpi/72 hpi der am stärksten disseminierten Zellen über den mittleren Radius der Tumormasse bei t = 4 hpi (Abbildung 5E).
Ergebnisse
Um die Rolle von MTs während der in vivo GBM-Invasion zu analysieren, beschreiben wir hier die wichtigsten Schritte zur Durchführung einer stabilen MT-Markierung in GBM-Zellen durch lentivirale Infektion, orthotope Xenotransplantation von GBM-Zellen in 3 dpf Zebrafischlarven, hochauflösende intravitale Bildgebung der MT-Dynamik, MTA-Behandlung und ihre Auswirkungen auf die GBM-Invasion sowie Bildanalyse der MT-Dynamik und In-vivo-Invasion (Abbildung 1). Die MÜ-Dynamik wird entweder durch den Aufbau von Kymographen entlang wachsender und schrumpfender MTs (Abbildung 3C) oder durch manuelle Verfolgung einzelner MT-Kanten im Zeitverlauf gemessen (Abbildung 3D). Ein Beispiel für eine medikamentöse Behandlung, die im Larvenmedium verabreicht wird, und ihre reversible Wirkung auf die Organisation des MT-Netzwerks ist in Abbildung 4 dargestellt. Die Behandlung mit einer niedrigen Dosis von Nocodazol (200 nM) führt zu einer fortschreitenden Schrumpfung des MT-Netzwerks und zum Verschwinden der Glioblastom-Zellprotrusion 4 h später (Abbildung 4A). Das Auswaschen des Medikaments stellte die Fähigkeit der Glioblastomzellen zur Bildung von Vorsprüngen wieder her. Die Zellen wanderten 12 h nach dem Auswaschen wieder entlang des Gefäßsystems (Abbildung 4B). Diese Daten deuten darauf hin, dass die Behandlung mit 200 nM Nocodazol ausreicht, um das MT-Netzwerk zu stören und die Invasion von In-vivo-Glioblastomzellen schnell zu blockieren. Eine 3-tägige Analyse der gleichen Behandlung bei der globalen Glioblastom-Zellinvasion zeigt, dass Nocodazol 200 nM die langfristige Invasion von Glioblastom-Zellen in vivo stoppt, ohne die allgemeine Gesundheit der Fische im Vergleich zu einer Kontrolle zu beeinträchtigen (Abbildung 4C).
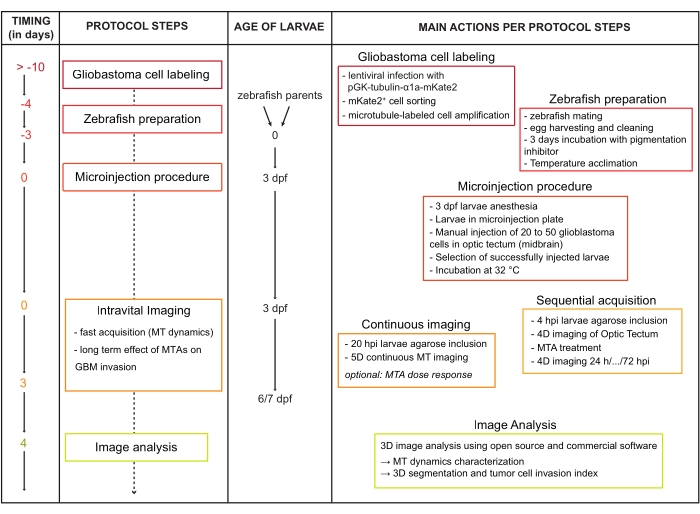
Abbildung 1: Protokoll-Workflow-Diagramm. Abkürzungen: dpf = Tage nach der Befruchtung; HPI = Stunden nach der Injektion; MT = Mikrotubuli; MTA = Mikrotubuli-veränderndes Mittel; GBM = Glioblastoma multiforme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
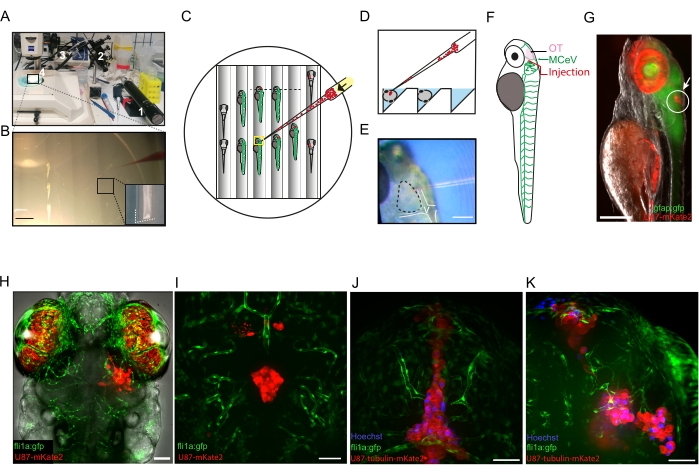
Abbildung 2: Mikroinjektion von Glioblastomzellen in 3 dpf Zebrafischlarvengehirne. (A) Foto der für die Xenotransplantation verwendeten Ausrüstung: 1, Öl-Mikroinjektor; 2, mechanischer Mikromanipulator; 3, universeller Kapillarhalter; 4, Glaskapillare. Die Mikroinjektionsplatte befindet sich unter einem Stereomikroskop. (B) Foto mit betäubten 3 dfp Zebrafischlarven, die in einem Graben ausgerichtet sind und bereit sind, mikroinjiziert zu werden. Die Spitze einer Mikrokapillare, die mit einem roten Farbstoff beladen ist, ist rechts auf dem Foto sichtbar. Details der gemusterten Gräben, die in die Agaroseplatte eingebaut sind, sind im Einsatz in der unteren rechten Ecke zu sehen. Maßstabsbalken = 3 mm. (C) Schema einer repräsentativen Mikroinjektionsplatte. Fertig zu injizierende Larven werden seitlich (Mitte der Platte) platziert. Beachten Sie, dass die Zellen an der Spitze der Mikrokapillare konzentriert sind (schwarzer Pfeil), bevor mit der Injektion fortgefahren wird. Injizierte Larven sind auf der rechten Seite der Platte gezeigt, ventral platziert. (D) Schema einer Querscheibe in der Mikroinjektionsplatte (entlang der schwarz gestrichelten Linie in C), die die Gräben zeigt, in denen die Larven während der Injektion platziert werden. (E) Foto, das die Spitze der Kapillare zeigt, die bereit ist, das optische Tectum zu durchdringen (gestrichelte Linie). Die Ventrikel sind durch die weißen Linien abgegrenzt. Maßstabsbalken = 150 μm. (F) Schema einer 3 dpf fli1a:gfp-Larve, die gfp in den Endothelzellen exprimiert, was die OT-Region angibt, in der die Zellen injiziert werden, direkt über der mittleren Hirnvene. (G) Fluoreszenzbild einer 3 dpf gfap:gfp-Larve (gfp exprimiert in neuralen Stammzellen), die seitlich nach Mikroinjektion von U87-mkate2-Zellen platziert wurde (weißer Kreis und weißer Pfeil). Eine hohe Autofluoreszenz in Rot wird durch die Iridophore in den Augen verursacht. Maßstabsbalken = 100 μm. (H) Konfokale Fluoreszenzaufnahme einer erfolgreich injizierten fli1a:gfp-Larve bei 16 hpi. Maßstabsbalken: 50 μm. (I-K) Konfokale Fluoreszenzaufnahmen erfolglos injizierter fli1a:gfp-Larven bei 96 hpi (I) und 4 hpi (J,K). GBM-Zellen wurden in Ventrikel (I,J) oder in multiple Herde im Gehirn (K) injiziert. Maßstabsbalken = 50 μm. Abkürzungen: dpf = Tage nach der Befruchtung; OT = optisches Tectum; MCeV = mittlere Hirnvene; GFP = grün fluoreszierendes Protein; gfap = Gliafibrilläres saures Protein; HPI = Stunden nach der Injektion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
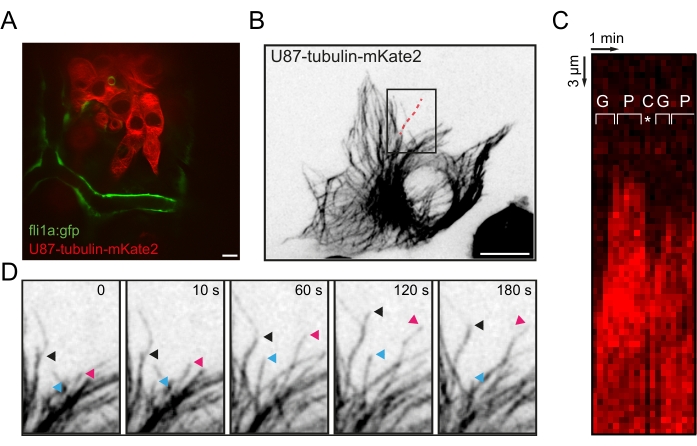
Abbildung 3: Visualisierung der in vivo Mikrotubulidynamik in Glioblastomzellen. (A) Repräsentatives Fluoreszenzbild von xenotransplantierten U87-Zellen, die Tubulin-α1-mkate2 im OT einer fli1a:GFP-Zebrafischlarve bei 20 hpi exprimieren. (B) Projiziertes Fluoreszenzbild der maximalen Intensität des MT-Netzwerks in einer einzelnen xenotransplantierten U87-Zelle. (C) Kymograph entlang der rot gestrichelten Linie in B, der das Wachstum, die Pause und die Katastrophenphasen der dynamischen Instabilität der MT zeigt. (D) Zeitraffersequenz des Box-Bereichs in B , die die Verfolgung von drei MT + -Enden hervorhebt. Maßstabsbalken = 10 μm. Abkürzungen: OT = optic tectum; GFP = grün fluoreszierendes Protein; HPI = Stunden nach der Injektion; MT = Mikrotubuli; G = Wachstumsphase; P = Pausenphase; C = Katastrophenphase. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Visualisierung der Auswirkungen des Mikrotubuli-Modifikationsmittels auf die Ligoblastom-Invasion in vivo. (A) Zeitraffersequenz von U87-Zellen, die Tubulin-α1a-mkate2 in Zebrafischlarven exprimieren, die mit Nocadazol (200 nM) behandelt wurden. Pfeile zeigen auf die Extremität des Vorsprungs in zwei verschiedenen Zellen, die entlang eines Blutgefäßes in das Gehirn eindringen. Beachten Sie die Retraktion des Vorsprungs bei Behandlung mit Nocodazol. Maßstabsbalken = 10 μm. (B) Zeitraffersequenz, die die Wirkung von Nocodazol-Auswaschung auf die U87-Zellinvasion darstellt. 500 Minuten nach dem Auswaschen verlängert die mit dem weißen Sternchen markierte Zelle einen MT-basierten Vorsprung (weißer Pfeil), der die Wiederaufnahme der Invasion entlang eines Blutgefäßes ermöglicht. Maßstabsbalken = 20 μm. (C) 3D-Darstellungen eines xenografierten Larvengehirns, das mit DMSO oder Nocodazol (200 nM) für 72 h behandelt wurde. Das Signal der U87-Zellen wurde segmentiert (in rot) und in das fli1a-GFP-Fluoreszenzsignal (in weiß) integriert. Beachten Sie die verminderte Verbreitung von U87-Zellen, die mit Nocodazol behandelt wurden. Maßstabsbalken = 30 μm. Abkürzungen: GFP = grün fluoreszierendes Protein; HPI = Stunden nach der Injektion; MT = Mikrotubuli. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
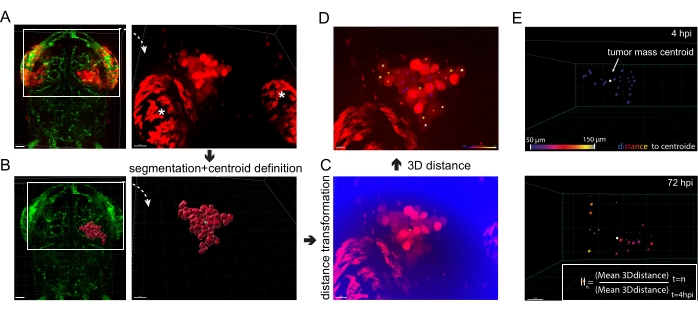
Abbildung 5: Bildanalyse der in vivo Glioblastom-Invasion . (A) Fluoreszierende Bilder von xenotransplantierten U87-Zellen, die zytosolisches mKate2 in fli1a-GFP-Zebrafischlarven exprimieren, 4 hpi. Weiße Sternchen unterstreichen die typische Autofluoreszenz von Augeniridophoren. Maßstabsbalken = 40 μm. (B) Fluoreszierendes Bild von fli1a-GFP-Larven gekoppelt mit der segmentierten Oberfläche, die dem Signal der U87-Zellen in A entspricht. Der Schwerpunkt der Tumormasse erscheint grün. Maßstabsbalken = 40 μm. (C) Fluoreszierendes Bild, das das Rotkanalsignal in A und den neu definierten Kanal "Abstand zum Schwerpunkt" (blau) darstellt. Maßstabsbalken = 30 μm. (D) Rotkanalfluoreszenzbild überlagert mit farbigen Flecken, deren Farbe den Abstand der Zelle zum Schwerpunkt (in grün) darstellt, wobei Violett dem Schwerpunkt am nächsten kommt und Weiß am weitesten voneinander entfernt ist. Maßstabsbalken = 20 μm. (E) Ein Beispiel für eine sequentielle Analyse der globalen GBM-Invasion. 3D-Entfernungen werden bei 4 hpi und 72 hpi ermittelt, und der Invasionsindex (II) wird nach der Formel im Posteingang berechnet. Maßstabsbalken = 20 μm. Abkürzungen: GFP = grün fluoreszierendes Protein; HPI = Stunden nach der Injektion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Die Bildgebung von Tumor-Xenotransplantaten mit Einzelzellauflösung wird wahrscheinlich zu einem unverzichtbaren Werkzeug, um unser Verständnis der GBM-Biologie zu verbessern. Live-Bildgebung in Maus-PDX-Modellen hat zu wertvollen Entdeckungen darüber geführt, wie GBM kollektiv in das Hirngewebe eindringt18. Bisher ist die raumzeitliche Auflösung jedoch nicht hoch genug, um die Dynamik von Proteinen aufzudecken, die die GBM-Invasion steuern. Wir argumentierten, dass durch die Kopplung der orthotopischen Transplantation von GBM-Zellen in transparenten Zebrafischlarven mit hochauflösender intravitaler Bildgebung Zytoskelettproteine wie MTs ausreichend detailliert analysiert werden könnten, um ihre Dynamik während der in situ GBM-Invasion zu analysieren.
Die kritischen Schritte der Methodik liegen in der Herstellung der GBM-Zellen und dem Mikroinjektionsverfahren. Ungesunde und unzureichend dissoziierte Zellen kleben zusammen oder an den Kapillarrändern und blockieren den Injektionsfluss. Darüber hinaus müssen die Zellen ausreichend in der Kapillare konzentriert sein, um das injizierte Volumen zu minimieren und sie in großen Mengen zu implantieren. Die Injektion eines höheren Volumens von stärker verdünnten Zellen führt zu multiplen, manchmal miteinander vermischten Tumorherden, deren invasive Indizes schwer zu messen sind. In unseren Händen ermöglicht die manuelle Handhabung des ölbasierten Mikroinjektors eine bessere Kontrolle des Einspritzflusses als ein druckluftbasierter elektronischer Mikroinjektor, der zuvor in einem ähnlichen Modell19 verwendet wurde. Dies ist entscheidend, um einen übermäßigen Strömungsdruck im Gehirn zu verhindern und dadurch nachfolgende Gewebeschäden und ventrikuläre Aggregationen der injizierten Zellen zu vermeiden.
Einige Einschränkungen dieses Modells umfassen die Notwendigkeit, das Experiment bei suboptimalen Temperaturen für beide Arten durchzuführen. Zebrafische werden normalerweise bei 28 °C aufgezogen, während menschliche Zellen bei 37 °C kultiviert werden. Über 32 °C ist die Entwicklung des Zebrafischembryos verändert und diese Veränderungen können tödlich sein35. Ähnlich wie bei adulten Zebrafisch-Xenograft-Modellen 36 erhöht die sequentielle Akklimatisierung der Zebrafischlarven auf eine Temperatur von 32 °C das Überleben der transplantierten Tiere im Vergleich zur schnellen Temperaturänderung nach der Transplantation von 28 °C auf32 °C. Eine weitere Erhöhung der Temperatur führt jedoch entsprechend der Empfindlichkeit von Zebrafischembryonen gegenüber Temperaturen über 32 °C35 zu einem erhöhten Tiersterben.
Die Interpretation der In-vivo-MT-Dynamikdaten muss sorgfältig erfolgen, da sich die MT-Dynamik ändert, wenn die Temperatur unter 37 °C37 fällt. Die parallele In-vitro-Messung der MT-Dynamik bei 37 °C und 32 °C in denselben GBM-Zellen mit derselben MTA-Behandlung wird dazu beitragen, die Unterschiede zwischen verschiedenen GBM-Zellen oder zwischen In-vivo-Behandlungen zu validieren. Es sollte helfen zu bestätigen, dass die Unterschiede nicht durch Variationen der Temperaturempfindlichkeit verursacht werden, sondern durch unterschiedliche Regulationswege (für GBM-Vergleichsanalysen) oder durch MTA-Behandlung (für MTA-Effektanalyse). Dies wird von Interesse sein, wenn die Heterogenitäten der MÜ-Dynamik mit unterschiedlichen Invasionsfähigkeiten verknüpft sind.
Eine weitere Einschränkung ist das kurze Zeitfenster, in dem die Invasion überwacht werden kann (72 bis 96 h), wodurch die Messung der Invasionsplastizität aufgrund potenzieller Änderungen der MT-Dynamik verhindertwird 38. Nach 96 h bemerkten wir eine starke Abnahme der GBM-Zellinvasion. 6 Tage nach der Injektion nahm die Anzahl der GBM-Zellen rapide ab, vermutlich aufgrund einer Immunantwort des Wirts, die durch die Ansammlung von Neutrophilen und Makrophagen in der Tumormikroumgebung verursacht wurde39. Die Abgabe von MTAs an das gesamte Gehirn wirkt sich wahrscheinlich auf nahe gelegene neuronale Wirtszellen aus, die für ihre Aktivität auf MTs angewiesen sind und deren Veränderung anschließend die GBM-Invasion beeinflussen könnte40. Dieser Ansatz muss durch shRNA- oder optogenetische Assays ergänzt werden, die die MT-Veränderung auf die GBM-Zellen beschränken, bleibt aber eine gute Plattform, um nach neuen antiinvasiven Verbindungen zu suchen.
Die orthotopische Injektion von MT-markierten GBM-Zellen im Zebrafischgehirn ist von besonderem Interesse, um die Rolle von MTs während der Invasion von Krebszellen zu entschlüsseln, da nur sehr wenige Tiermodelle eine subzelluläre In-situ-Bildgebung der Krebszellmigration in ihrem Ursprungsgewebe erlauben15. Bisher stützen sich Studien zu MÜ-Funktionen während der GBM-Migration hauptsächlich auf In-vitro- und Ex-vivo-Assays und es fehlt eine In-vivo-Validierung 24,41,42,43. In Verbindung mit einem Gene-of-Interest-Knockdown oder einem unvoreingenommenen genbasierten Screening-Ansatz wird der hier vorgestellte Assay dazu beitragen, neue MT-Regulatoren aufzudecken, die für die GBM-Invasion in vivo wichtig sind.
GBMs sind sehr heterogene Tumoren, deren invasive Eigenschaften sich zwischen den Proben stark unterscheiden44. Das Verständnis der molekularen Mechanismen, die ihrer unterschiedlichen Art der Invasion zugrunde liegen, wird dazu beitragen, therapeutische Ad-hoc-Behandlungen zu definieren, um die GBM-Verbreitung zu blockieren. Die systematische Messung des invasiven Index, der Art der Invasion und der zytoskelettalen Eigenschaften wie der MT-Dynamik in verschiedenen GBM-Proben wird neue Korrelationen zwischen häufigen genomischen Mutationsprofilen und Zellinvasionsmustern aufdecken, die auf spezifischen Zytoskeletteigenschaften beruhen. Die Aufdeckung, wie sich diese Mutationen auf die Veränderung der MÜ-Dynamik auswirken, würde nicht nur unser Wissen über die MT-Regulation während der Zellmigration erweitern45,46, sondern könnte auch zu lang erwarteten patientenspezifischen, antiinvasiven Therapeutika führen.
Die relative Leichtigkeit der Mikroinjektion in Zebrafische in Kombination mit der hohen Anzahl verfügbarer Larven und der Leichtigkeit der Injektion von Medikamenten machen dieses Verfahren für die personalisierte Medizin geeignet47,48. Im Gegensatz zur intravitalen Bildgebung von GBM-Xenotransplantaten bei Mäusen, die nur im oberen 500 μm Teil des Kortex49,50 auftritt, ermöglicht die Verwendung von Zebrafischen die Visualisierung der GBM-Infiltration im gesamten ZNS. Das hier vorgestellte Modell erfüllt die Kriterien, um ein unschätzbares Werkzeug für die schnelle Analyse der invasiven Fähigkeiten des Glioblastoms und seines Ansprechens auf Behandlungen zu werden.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken Dr. P. Herbomel (Institut Pasteur, Frankreich) und seinem Labor, insbesondere Valérie Briolat, und Emma Colucci-Guyon für die Bereitstellung der Zebrafischlinien und der Kunststoffform für Mikroinjektionsplatten sowie für ihr wertvolles Know-how über experimentelle Verfahren von Zebrafischen. Wir danken dem UtechS Photonic BioImaging (C2RT, Institut Pasteur, unterstützt von der französischen National Research Agency France BioImaging, und ANR-10-INBS-04; Investitionen in die Zukunft). Diese Arbeit wurde von der Ligue contre le cancer (EL2017. LNCC), dem Centre National de la Recherche Scientific und dem Institut Pasteur sowie durch die großzügigen Spenden von Frau Marguerite MICHEL und Herrn Porquet.
Materialien
| Name | Company | Catalog Number | Comments |
| Glioblastoma cell culture | |||
| Foetal calf serum | Eurobio | CVFSVF00-01 | Reagent |
| MEM NEAA | Gibco | 11140-050 | Reagent |
| Modified Eagle's medium | Eurobio | CM1MEM18-01 | Reagent |
| Penicillin–streptomycin | Gibco | 15140-122 | Reagent |
| U-87 MG | ECACC | 89081402-1VL | Cells |
| Lenitivirus production | |||
| BD FACSAria III | BD bioscience | Instrument | |
| BD FACSDiva software v8.0 | BD bioscience | Software | |
| HEK-293T | Merck | 12022001 | Cells |
| pMD2.G | Addgene | Plasmid #12259 | Reagent |
| psPAX2 | Addgene | Plasmid #12260 | Reagent |
| Ultracentrifuge Optima XPN-80 | Beckman Coulter | Instrument | |
| Cell passaging and staining | |||
| dPBS | Gibco | 14190-094 | Chemical |
| Hoechst 34580 | Sigma-Aldrich | 63493 | Chemical |
| Trypsin-EDTA (0,05%) | Gibco | 25300-054 | Reagent |
| Zebrafish husbandry | |||
| Fluorescence stereomicroscope LEICA M165FC | LEICA | https://www.leica-microsystems.com/fr/produits/stereomicroscopes-et-macroscopes/informations-detaillees/leica-m165-fc/ | Instrument |
| Methylene Blue hydrate | Sigma-Aldrich | M4159 | Chemical |
| N-Phenylthiourea (PTU) | Sigma-Aldrich | P7629-25G | Chemical |
| Transfer Pipettes fine tips | Samco Scientific | 232 | Equipment |
| Transfer Pipettes Large Bulb3mL | Samco Scientific | 225 | Equipment |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | Cat#: A5040 | Chemical |
| Volvic Source Water | DUTSCHER DOMINIQUE SAS | 999556 | Reagent |
| Xenotransplantation | |||
| 24-well plate | TPP | 92024 | Equipment |
| Borosilicate glass capillaries (1.0 ODx0.58IDx150L mm) | Harvard Apparatus | (#30-0017 GC100-15 | Equipment |
| CellTram oil vario microinjector | Eppendorf | 5176000.025 | Instrument |
| Microloading pipet tips (Microloader) 20µL | Eppendorf | 5242956003 | Equipment |
| Micromanipulator | NARISHIGE | https://products.narishige-group.com/group1/injection/english.html | Equipment |
| Mineral Oil | Sigma | M8410-100ml | Equipment |
| Stereomicroscope | Olympus | KL 2500 LCD | Instrument |
| Universal capillary holder | Eppendorf | 5176190002 | Equipment |
| Vertical Pipette puller | KOPF (Roucaire) | Model 720 | Instrument |
| Intravital Imaging | |||
| 3.5cm glass-bottom videoimaging dish | MatTek Life Sciences, MA, USA | P35G-1,5-14-C | Equipment |
| Acquisition software: NIS-Elements-AR version 5.21 | Nikon | Software | |
| Heat-Block | Techne | DRI-BLOCK DB-2D | Equipment |
| Microscope head Nikon Ti2E | Nikon | Instrument | |
| sCMOS camera Prime 95B | Photometrics | Instrument | |
| sCMOS camera Orca Flash 4 | Hammatsu | Instrument | |
| Ultrapure Low melting point agarose | Invitrogen | 16520-050 | Chemical |
| Yokagawa CSU-W1 spinning disk unit | Hammatsu | Instrument | |
| Drug Treatment | |||
| DMSO | Sigma-Aldrich | D2650-100ML | Chemical |
| Nocodazole | Sigma-Aldrich | M1404-2MG | Chemical |
| Image Analysis | |||
| Imaris 9.5.1 software | Oxford Instruments | Software | |
| ImarisFileConverter 9.5.1 | Oxford Instruments | Software |
Referenzen
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112 (4), 453-465 (2003).
- Etienne-Manneville, S. Microtubules in cell migration. Annual Review of Cell and Developmental Biology. 29, 471-499 (2013).
- Bouchet, B. P., Akhmanova, A. Microtubules in 3D cell motility. Journal of Cell Science. 130 (1), 39-50 (2017).
- Seetharaman, S., et al. Microtubules tune mechanosensitive cell responses. Nature Materials. 21 (3), 366-377 (2022).
- Etienne-Manneville, S. From signaling pathways to microtubule dynamics: the key players. Current Opinion in Cell Biology. 22 (1), 104-111 (2010).
- Garcin, C., Straube, A. Microtubules in cell migration. Essays in Biochemistry. 63 (5), 509-520 (2019).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Nature editorial. The 'war on cancer' isn't yet won. Nature. 601 (297), (2022).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Clark, A. G., Vignjevic, D. M. Modes of cancer cell invasion and the role of the microenvironment. Current Opinion in Cell Biology. 36, 13-22 (2015).
- Meyer, A. S., et al. 2D protrusion but not motility predicts growth factor-induced cancer cell migration in 3D collagen. Journal of Cell Biology. 197 (6), 721-729 (2012).
- Bouchet, B. P., et al. Mesenchymal cell invasion requires cooperative regulation of persistent microtubule growth by SLAIN2 and CLASP1. Developmental Cell. 39 (6), 708-723 (2016).
- Luthria, G., et al. In vivo microscopy reveals macrophage polarization locally promotes coherent microtubule dynamics in migrating cancer cells. Nature Commun. 11 (1), 3521(2020).
- Wen, P. Y., Kesari, S. Malignant gliomas in adults. New England Journal of Medicine. 359 (5), 492-507 (2008).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments. (86), e55108(2014).
- Osswald, M., et al. Brain tumour cells interconnect to a functional and resistant network. Nature. 528 (7580), 93-98 (2015).
- Astell, K. R., Sieger, D. Investigating microglia-brain tumor cell interactions in vivo in the larval zebrafish brain. Methods in Cell Biology. , 593-626 (2017).
- Zeng, A., et al. Identify a blood-brain barrier penetrating drug-TNB using zebrafish orthotopic glioblastoma xenograft model. Scientific Reports. 7 (1), 14372(2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Disease Models & Mechanisms. 9 (9), 1063-1065 (2016).
- Umans, R. A., Ten Kate, M., Pollock, C., Sontheimer, H. Fishing for contact: modeling perivascular glioma invasion in the zebrafish brain. ACS Pharmacology & Translational Science. 4 (4), 1295-1305 (2021).
- Lee, J. H., et al. Human glioblastoma arises from subventricular zone cells with low-level driver mutations. Nature. 560 (7717), 243-247 (2018).
- Pagano, A., et al. Epothilone B inhibits migration of glioblastoma cells by inducing microtubule catastrophes and affecting EB1 accumulation at microtubule plus ends. Biochemical Pharmacology. 84 (4), 432-443 (2012).
- Berges, R., et al. The novel tubulin-binding checkpoint activator BAL101553 inhibits EB1-dependent migration and invasion and promotes differentiation of glioblastoma stem-like cells. Molecular Cancer Therapeutics. 15 (11), 2740-2749 (2016).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Volvic source water mineral composition. Volvic. , Available from: https://www.volvic.co.uk/volcanic-water/composition (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Brachydanio rerio). The University of Oregon Press, Eugene. , Chapter 5 (2000).
- E3, M. Recipe E3 medium (for zebrafish embryos. , Cold Spring Harbor Protocols. (2011).
- Straube, A. How to measure microtubule dynamics. Methods in Molecular Biology. 777, 1-14 (2011).
- Honore, S., Braguer, D. Investigating microtubule dynamic instability using microtubule-targeting agents. Methods in Molecular Biology. 777, 245-260 (2011).
- Movsisyan, N., Pardo, L. A. Measurement of microtubule dynamics by spinning disk microscopy in monopolar mitotic spindles. Journal of Visualized Experiments. (153), e60478(2019).
- Serikbaeva, A., Tvorogova, A., Kauanova, S., Vorobjev, I. A. Analysis of microtubule dynamics heterogeneity in cell culture. Methods in Molecular Biology. 1745, 181-204 (2018).
- Schnurr, M. E., Yin, Y., Scott, G. R. Temperature during embryonic development has persistent effects on metabolic enzymes in the muscle of zebrafish. Journal of Experimental Biology. 217 (8), 1370-1380 (2014).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Translational Oncology. 14 (1), 100899(2021).
- Hamilton, L., Astell, K. R., Velikova, G., Sieger, D. A zebrafish live imaging model reveals differential responses of microglia toward glioblastoma cells in vivo. Zebrafish. 13 (6), 523-534 (2016).
- Gillespie, S., Monje, M. An active role for neurons in glioma progression: making sense of Scherer's structures. NeuroOncology. 20 (10), 1292-1299 (2018).
- Wolf, K. J., et al. A mode of cell adhesion and migration facilitated by CD44-dependent microtentacles. Proceedings of the National Academy of Sciences. 117 (21), 11432-11443 (2020).
- Zhou, Y. X., et al. Transcriptional upregulation of microtubule-associated protein 2 is involved in the protein kinase A-induced decrease in the invasiveness of glioma cells. Neuro-Oncology. 17 (12), 1578-1588 (2015).
- Monzo, P., et al. Mechanical confinement triggers glioma linear migration dependent on formin FHOD3. Molecular Biology of the Cell. 27 (8), 1246-1261 (2016).
- Vollmann-Zwerenz, A., Leidgens, V., Feliciello, G., Klein, C. A., Hau, P. Tumor cell invasion in glioblastoma. International Journal of Molecular Science. 21 (6), 1932(2020).
- Feng, H., et al. EGFRvIII stimulates glioma growth and invasion through PKA-dependent serine phosphorylation of Dock180. Oncogene. 33 (19), 2504-2512 (2014).
- Liu, R., et al. Cdk5-mediated regulation of the PIKE-A-Akt pathway and glioblastoma cell invasion. Proceedings of the National Academy of Sciences. 105 (21), 7570-7575 (2008).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trends in Cancer. 6 (7), 569-579 (2020).
- Baxendale, S., van Eeden, F., Wilkinson, R. The power of zebrafish in personalised medicine. Personalised Medicine: Lessons from Neurodegeneration to Cancer. 1007, 179-197 (2017).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Stanchi, F., Matsumoto, K., Gerhardt, H. Imaging glioma progression by intravital microscopy. Methods in Molecular Biology. 1862, 227-243 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten