Method Article
侵入斑马鱼大脑的胶质母细胞瘤细胞微管动力学的实时成像
摘要
我们报告了一种允许对侵入脊椎动物脑组织的胶质母细胞瘤(GBM)细胞中的微管动力学进行实时成像的技术。将荧光标记的GBM细胞的原位注射耦合到具有高分辨率活体成像的透明斑马鱼脑中,可以在 原位 癌症侵袭期间测量细胞骨架动力学。
摘要
胶质母细胞瘤(GBM)在实际人群中中生存时间令人沮丧 - 在6至15个月之间 - 是最具破坏性的恶性脑肿瘤。治疗失败主要是由于GBM细胞的侵袭性,这说明了需要更好地了解GBM运动特性。为了研究支持GBM侵袭的分子机制,需要新的生理模型,能够深入表征侵袭过程中的蛋白质动力学。这些观察结果将为发现阻断肿瘤浸润和改善患者预后的新靶点铺平道路。本文报道了斑马鱼大脑中GBM细胞的原位异种移植如何允许亚细胞活体活体成像。专注于微管(MTs),我们描述了GBM细胞中MT标记的程序,在受精后3天(dpf)斑马鱼幼虫的透明大脑中微注射GBM细胞,在播散异种移植物中对MT进行活体成像,改变MT动力学以评估它们在GBM入侵期间的作用,并分析获得的数据。
引言
细胞运动是一个刻板的过程,需要极性轴的建立和产生力的细胞骨架重排。肌动蛋白聚合及其与肌球蛋白的关联被认为是细胞运动所需的突出和收缩力的主要贡献者1。微管被认为是迁移过程中细胞极化和定向持久性的主要参与者2。近年来,MTs也被证明可以产生和稳定突起,以支持3D3细胞侵袭期间的机械压缩力。最近,MTs直接参与了粘连和机械敏感迁移的机械转导4。表征MT-plus末端动力学的动态不稳定性由聚合(生长)和解聚(收缩)的重复阶段组成,这些阶段由大量的微管结合蛋白和细胞内信号级联控制,例如由RHO-GTPase5,6,7控制的那些。MT网络在细胞迁移和侵袭中的作用使得MT动力学的研究成为更好地了解免疫细胞归巢,伤口愈合和癌症侵袭机制的关键因素。
癌细胞逃离原发性肿瘤核心、在组织中扩散并产生继发性肿瘤的能力是防止全球在 50 年前宣布的抗癌战争中取得成功的关键一步8,9.最大的障碍之一是了解癌细胞如何主动侵入组织。关键侵袭机制依赖于与控制非肿瘤细胞迁移相同的原理10。然而,癌细胞迁移特异性已经出现11,引发了对这种类型的迁移进行更好表征的需求。具体来说,由于肿瘤微环境似乎是癌症进展的关键参与者12,因此在相关的生理背景下观察和分析癌细胞侵袭对于揭示癌细胞播散的机制至关重要。
MT是癌症进展的核心,以维持增殖和侵袭。原 位 MT动力学的精确分析有助于识别两个过程中的MT改变剂(MTA)。MT动态会随着环境的变化而发生巨大变化。在 体外,当细胞以3D形式包埋在凝胶中时,用MT去稳定剂(如诺考达唑)处理可防止细胞突起形成,而对2D细胞迁移几乎没有影响13,14。尽管技术上具有挑战性,但活体成像的进步允许在癌细胞侵袭期间对MT动力学进行 体内 分析。例如,在小鼠皮下异种移植纤维肉瘤细胞中对MT的观察表明,肿瘤相关巨噬细胞影响肿瘤细胞中的MT动力学15。然而,这些小鼠模型涉及广泛的外科手术,并且对于不易接近的癌症(例如高度侵袭性脑肿瘤GBM)仍然不满意。
尽管15个月的平均生存时间令人沮丧16,但人们对GBM在脑实质内的传播方式或维持GBM细胞侵袭脑组织的关键分子元素知之甚少。小鼠原位异种移植(PDX)模型的改进和颅窗的建立为GBM细胞侵袭研究提供了新的前景17,18。然而,由于成像质量欠佳,该模型主要允许对浅表异种移植物进行纵向成像,并且迄今为止尚未成功用于研究细胞骨架蛋白的亚细胞成像。此外,在"3R"禁令减少使用啮齿动物并用低等脊椎动物取而代之之后,已经建立了替代模式。
利用在斑马鱼(Danio rerio)幼虫中观察到的原始免疫力,在鱼脑中原位注射GBM细胞19,20,21。在发育中的中脑心室附近注射概括了大部分人类GBM病理生理学21,并且观察到与人类血管共同选择相同的GBM侵袭首选模式22。由于鱼幼虫的透明度,该模型允许可视化GBM细胞从大多数GBM产生的脑室周围区域侵入大脑23。
由于MT对于体外GBM细胞侵袭至关重要24,25,因此需要更好地表征MT动力学并鉴定细胞侵袭期间的关键调节因子。然而,迄今为止,斑马鱼原位模型生成的数据尚未包括入侵过程中MT动力学的亚细胞分析。本文提供了一种方案来研究体内MT动力学并确定其在脑癌侵袭中的作用。在稳定的微管标记之后,GBM细胞在斑马鱼幼虫的大脑中以3dpf的速度显微注射,并在脑组织中的进展过程中以高时空分辨率实时成像。荧光MT的实时成像允许对MT加端动力学进行定性和定量分析。此外,该模型可以实时评估MTA对MT动力学和GBM细胞侵袭特性的影响。这种相对非侵入性的方案与一次处理的大量幼虫以及药物应用的便利性(在鱼水中)相结合,使该模型成为临床前测试的资产。
研究方案
动物实验是根据欧盟处理实验动物的准则进行的。所有协议均由巴斯德研究所动物实验伦理委员会 - CEEA 89 和法国研究与教育部批准(许可证 #01265.03)。在注射或实时成像过程中,动物在实验程序结束时 Tricaine.At 麻醉,它们被麻醉剂过量安乐死。有关此协议中使用的材料、设备和软件的详细信息,请参阅 材料表 。该协议的一般工作流程如图 1 所示。
1. 产生稳定表达α-微管蛋白-mKate的胶质母细胞瘤细胞2
注意:以下步骤在生物安全柜BSL2 +中执行。
- 使用磷酸钙方法产生表达mKate2-微管蛋白的慢病毒颗粒,用于转染7×106 HEK-293T细胞。
- 在 1.5 mL 微量离心管中,加入 10 μg 第2 代包装 质粒 psPAX2、5 μg 病毒包膜质粒 pMD2.G 和 10 μg 目标质粒 pGK-mKate2-人微管蛋白 α1a 和 50 μL CaCl 2(2.5 M 储备液)。用无菌无 DNA 酶 H2O 调节至 500 μL。
注意:最后添加 CaCl2 很重要。 - 通过倒置管几次混合并在室温(RT)下孵育20分钟。
- 在孵育期间,用 500 μL HEPES 缓冲盐水 (HBS)(pH 7.0 (2x) 制备另一个 1.5 mL 微量离心管。
- 20分钟后,将CaCl2 / DNA混合物逐滴添加到HBS(2x)溶液中。通过将试管倒置几次来混合。在室温下孵育12分钟。
- 12分钟后,轻轻地将与HBS混合的CaCl2 / DNA直接添加到70%汇合的10cmHEK-293T细胞培养皿中,一滴一滴。
- 将细胞留在37°C加5%CO2 的加湿培养箱中36-48小时。
- 收集上清液并以3,000× g 旋转5分钟以除去细胞碎片。
- 为了浓缩病毒颗粒,将上清液加载到超速离心管中,并在4°C下以47,508× g 旋转90分钟。
- 弃去上清液并将管倒置在纸上以干燥管内。
- 将 30 μL PBS 加入病毒沉淀中。不要重悬颗粒。在4°C放置2小时。
- 通过上下移液轻轻重悬病毒颗粒。避免制造气泡。储存在-80°C。
注意:通过转染HEK-2-93T细胞的多个板可以产生更多的病毒颗粒。
- 在 1.5 mL 微量离心管中,加入 10 μg 第2 代包装 质粒 psPAX2、5 μg 病毒包膜质粒 pMD2.G 和 10 μg 目标质粒 pGK-mKate2-人微管蛋白 α1a 和 50 μL CaCl 2(2.5 M 储备液)。用无菌无 DNA 酶 H2O 调节至 500 μL。
- 用慢病毒颗粒感染胶质母细胞瘤细胞。
注意:本协议适用于商业胶质母细胞瘤细胞系,如U-87 MG,U-373 MG或T98。为了使用原发性患者来源的胶质母细胞瘤细胞,请使用板和非血清基培养基26的特定涂层。- 准备一个 70% 汇合的 10 cm U-87 MG 胶质母细胞瘤细胞培养皿,这些细胞在 Eagle 的最低必需培养基 (MEM) 中生长,并补充有 10% 胎牛血清、青霉素-链霉素(青霉素的最终浓度为 100 单位/mL,链霉素为 100 μg/mL)和非必需氨基酸 (1x)。
- 以1/5,000稀释度将病毒颗粒直接添加到细胞上。轻轻漩涡混合。让病毒感染细胞不超过20小时。
- 去除含病毒的培养基并用新鲜培养基代替。允许标记微管蛋白的表达48-72小时。
注意:以下步骤将在生物安全柜BSL2中执行。 - 对细胞进行FACS分类,以选择最亮的15%的mKate2+ 细胞。使用前向和侧向散射(FCS vs SSC)门控去除碎片和双联细胞后,在最亮的30%mKate2 + 细胞上应用另一个门控以保持顶部15%。
- 扩增MT标记的细胞。
注意:或者,可以在落射荧光显微镜下进行基于高水平微管蛋白-mKate2的克隆选择。
2.准备斑马鱼幼虫进行显微注射
- 产生斑马鱼卵。
- 在异种移植前 4 天,下午晚些时候,将所需斑马鱼品系的三只雄性和四只雌性放入补充有弹珠的交配水箱中。
注意:Tg(fli1a:gfp),Tg(gfap:gfp)或Tg(Huc:gfp)系分别用于标记内源性血管,神经干细胞/星形胶质细胞和神经元。 - 第二天早上收集大理石诱导产卵产生的卵。
- 通过将鸡蛋转移到装有补充有漂白剂的矿泉水27 (最终为 0.004%)的 50 mL 离心管中来清洁鸡蛋。轻轻倒置管子5分钟。仅用矿泉水清洗两次。
- 将鸡蛋转移到含有补充有0.28mg / mL亚甲蓝的矿泉水的培养皿中。
- 取出未受精和发育停滞的卵子。将胚胎在28°C孵育。
- 在异种移植前 4 天,下午晚些时候,将所需斑马鱼品系的三只雄性和四只雌性放入补充有弹珠的交配水箱中。
- 创造透明的幼虫。
- 8小时后将N-苯基硫脲(PTU)(0.003%最终)引入培养基中,以防止黑色素色素沉着并确保光学透明。在协议的其余部分将 PTU 保留在介质中。
注意:由于PTU治疗会导致发育缺陷,因此仅选择正常发育的幼虫进行异种移植。作为化学处理的替代方案,可以使用突变斑马鱼菌株casper(珍珠层和罗伊奥比森双突变体),其中没有色素沉着28。 - 将孵育温度提高到29°C。
- 每天将温度升高1°C,使3 dpf幼虫在注射当天达到32°C。
- 8小时后将N-苯基硫脲(PTU)(0.003%最终)引入培养基中,以防止黑色素色素沉着并确保光学透明。在协议的其余部分将 PTU 保留在介质中。
- 准备显微注射板。
- 用矿泉水制备 20 mL 1% 琼脂糖 + 0.28 mg/mL 亚甲蓝。
- 将琼脂糖倒入10厘米培养皿中,并快速将显微注射塑料模具倒置以创建2.5毫米宽的V形沟槽(图2B)。
注意:塑料模具可市售,也可以按照斑马鱼第29 册中描述的设计在内部制造。 - 当琼脂糖凝固时,小心地取出塑料模具。
注意:显微注射铸板可以在4°C下储存长达2个月。
- 准备幼虫进行异种移植。
- 在注射当天,筛选3 dpf幼虫中选定的荧光转基因表达。去除无荧光、外观异常的动物。
- 用细尖制表钳手动去除幼虫。在 3 dpf 下,用两对细尖镊子轻轻戳或撕开绒毛膜,以将幼虫从绒毛膜中释放出来。
注意:或者,蛋白酶A的酶处理可用于去绒毛脱毛幼虫,通常在24 hpf。 - 在含有亚甲蓝(0.28 mg / mL)和PTU(0.003%最终)的矿泉水培养基中维持去皮幼虫。
3. 异种移植手术
- 准备显微注射针。
- 取一个没有中心灯丝的硼硅酸盐玻璃毛细管,并将其放入垂直拉针器中。
- 使用以下设置-增加8.5和加热器3-拉伸毛细管以将其变成显微注射针。
- 设置显微注射器。
- 在手动微量注射器中装入矿物油。去除气泡。
- 将通用毛细管支架插入显微注射器,并将其牢固地连接到机械显微操纵器(图2A)。
- 收获胶质母细胞瘤细胞。
注意:以下步骤在生物安全柜BSL2中进行。- 准备一块10厘米的胶质母细胞瘤细胞板,使它们在移植当天达到80%汇合。
- (可选)通过向细胞中添加 Hoechst 35480 (200 ng/mL) 来瞬时标记细胞核。在加湿的细胞培养箱中于37°C孵育20分钟,并用PBS洗涤2次。
- 将细胞板从培养箱中取出,并用PBS洗涤一次。通过加入1mL的0.05%胰蛋白酶-EDTA并在细胞培养箱中于37°C孵育5-10分钟,直到所有细胞完全分离,从而分离细胞。
注意:此步骤至关重要,因为胰蛋白酶消化不良会导致细胞聚集体滞留在针头中。 - 将细胞重悬于 50 mL 离心管中的 5 mL 完全胶质母细胞瘤细胞培养基中。加入 45 mL 冰冷的 PBS,并以 134 × g 离心 5 分钟。
- 弃去上清液,并通过彻底上下移液,用 1 mL 冰冷的 PBS 重悬细胞。
注意:机械解离的这一步极大地有助于防止显微注射过程中毛细管堵塞的风险。 - 加入 49 mL 冰冷的 PBS,并以 134 × g 离心 5 分钟。弃去上清液并将细胞重悬于 200 μL 冰冷的 PBS 中。在移植过程中储存在冰上。
- 将胶质母细胞瘤细胞微注射到斑马鱼幼虫中脑中。
- 用 6 mL 补充有 160 mg/L 曲卡因的 E3-培养基30 填充显微注射铸板。
- 将十几个去皮的幼虫转移到显微注射板中。一旦对触摸没有反应,将它们侧放在沟渠中,抬起头,用 00 号油漆刷将卵黄囊推到沟槽壁上(图 2B,C)。
- 重悬胶质母细胞瘤细胞。使用微量加载吸头将 5 μL 细胞加载到微毛细管中,并将毛细管插入通用毛细管支架中。
- 将含有无反应幼虫的显微注射板置于体视显微镜下。使用显微操纵器旋钮将微毛细管的尖端放在显微注射板的边界上。用手术刀打破它,创建一个尖锐的入口点,大约相当于细胞直径的大小。
- 通过在微量注射器中轻轻运行油并将针尖插入培养基来验证细胞是否流出毛细管。将细胞集中在毛细血管的尖端,以最大限度地提高每体积喷射的注射细胞数量,并避免用PBS填充脑组织(图2C)。
- 仔细检查从微毛细管出来的细胞,因为油被手动引入注射器。根据经验定义手动旋钮上需要转动多少圈才能输送 20 到 50 个细胞。通常,如果细胞足够浓缩,轻轻转动就足以弹出~10个细胞。
注意:如果液体不能正确流出微毛细管,请尝试松开毛细管支架中微毛细管的附件。通过这样做,油可能会泄漏并沿着毛细管滴落。 - 将毛细血管的尖端靠在大脑中静脉上方的左侧视锥(OT)(MCeV, 图2F)。
- 轻轻地将毛细血管按压在幼虫上,直到皮肤膜破裂(图2D,E)。
注意:不要用力过猛,因为这会导致细胞在大脑中注射太深,较低的光学清晰度将阻止详细观察 MT。成像技术可以达到250-300μm的深度。但是,建议不要从鱼表面注入超过100μm的深度。 - 一旦到达OT中的合适位置,即可弹出细胞。仔细观察毛细管的尖端,以可视化进入动物体内的细胞流,从而确保成功注射。
注意:注意不要注射到心室(图2E)。一旦进入脑室,细胞往往会积聚并卡住,而不是浸润组织(图2I)。心室注射的特征是大脑剧烈肿胀和注射细胞可观察到向前脑和后脑的扩散(图2J)。 - 根据需要对任意数量的动物重复步骤3.4.9-3.4.11中的步骤。快速进行以防止毛细血管中的细胞聚集。
注意:根据实验者注射的速度,每10到20只幼虫可能需要更换针头。 - 异种移植完成后,从显微注射板中取出幼虫,并在装有矿泉水 + PTU + 亚甲蓝培养基的 24 孔板中将它们挑出。
- 通过在荧光立体显微镜下观察幼虫来验证成功注射(图2G)。仅选择含有由位于OT顶部200μm(z)的20-50个细胞形成的单个肿瘤肿块的异种移植物(图2H与图2I-K中的失败注射)。
注意:成功定位异种移植物的产量从开始时的10%到实践的几乎100%不等。 - 在成像前让幼虫在32°C下恢复至少4小时。
注意:在培养基中添加抗生素不会增加幼虫的存活率。在这个阶段,如果正确进行显微注射,几乎100%的鱼存活。
4.胶质母细胞瘤异种移植物的活体成像
- 安装幼虫进行实时成像。
注意:幼虫可以在注射后4小时(hpi)成像。MT的实时成像通常从20 hpi进行,此时侵袭性GBM细胞已经开始延伸突起并远离肿瘤肿块。- 制备1%低熔点琼脂糖溶液。将 500 μL 煮沸的 1% 低熔点琼脂糖溶液转移到 1.5 mL 离心管中,并在加热块上使其在 37 °C 下冷却。向琼脂糖中加入三卡因(112 μg/mL)并充分混合。
- 将一至四个异种移植幼虫转移到装有矿泉水 + PTU + 亚甲基培养基并补充有三卡因 (112 μg/mL) 的 3.5 cm 培养皿中。一旦幼虫对触摸没有反应,使用细尖移液管将它们小心地转移到含有琼脂糖和三卡因的管中。
注意:将培养基的体积保持在最低限度,以限制琼脂糖的稀释。 - 将幼虫与琼脂糖轻轻混合。使用普通(大灯泡)转移移液管,将琼脂糖中混合的幼虫放在玻璃底3.5厘米视频成像培养皿的中心。在体视显微镜下,使用微加载尖端快速将幼虫放在其背上以操纵鱼。
注意:由于在该协议中,倒转转盘共聚焦显微镜用于活体脑成像,因此幼虫安装在背侧。如果使用正置共聚焦显微镜,请相应地调整幼虫的位置。 - 去除多余的琼脂糖以保持最薄的琼脂糖层。琼脂糖凝固后,加入 2.5 mL 矿泉水 + PTU + 0.2x 三卡因(成像介质),然后进行下一步。
- 侵袭胶质母细胞瘤细胞中MT动力学的体内实时成像
注意:图像的光学质量在很大程度上取决于所用显微镜的性能。该协议是为配备sCMOS相机(像素大小6.5μm,2048 x 2044像素),长工作距离物镜和温控环境室的倒转转盘共聚焦显微镜编写的。- 将含有琼脂糖嵌入异种移植幼虫的视频成像培养皿放入倒置共聚焦显微镜的环境室中,温度设置为32°C。 使用电动XY载物台,用10倍物镜在视频成像培养皿中找到幼虫。
- 按ESC降低物镜转盘,将矿物油添加到60倍油物镜(1.4 NA,工作距离:0.13 mm)上,然后按ESC返回初始焦点位置。
- 观察红色通道(561 nm激光源,20%激光功率,时间曝光:200 ms)中的入侵胶质母细胞瘤细胞,并选择具有扩散的MT网络和易于区分的MT细丝的细胞(图3B)。
- 设置 z 系列设置。使用200μm范围的压电平台,选择MT网络的顶部和底部位置:10-30μm深的z堆栈足以可视化迁移细胞突起中的微管网络,z切片步长为0.3μm。
- 设置延时采集设置,以便在采集速度、z-stack深度和荧光信号之间实现最佳平衡,以避免快速光漂白。每5-10秒获取一次MT的图像,持续几分钟。获取并保存 5D (x,y,z,t,c) 超堆栈。
注意:为避免采集过程中z轴漂移,请使用配备完美对焦系统的显微镜作为硬件对焦稳定功能。
- (可选)确定微管改变剂 (MTA) 对 MTA 的影响。
注意:以下步骤允许实时测试MTA对MT网络在迁移胶质母细胞瘤细胞中的影响。- 轻轻地从视频成像培养皿中取出成像介质。不要触摸盘子的底部,因为 xyz 位置会丢失。
- 制备含有不同浓度MTA的新成像介质。将含有MTA的培养基逐滴轻轻地添加到视频成像培养皿中。
- 获取长期电影(2-16小时,每10-20分钟一张图像)以观察每种浓度的MTA对MT网络和细胞迁移的影响(图4A)。
- (可选)通过轻轻取出培养基并加入 2.5 mL 不含 MTA 的新鲜成像培养基来洗去 MTA。重复冲洗过程3次以清除介质中的任何MTA痕迹。
- (可选)获取与 4.3.3 中类似的长期电影(图 4B)。
注意:上述步骤确定了在不影响幼虫存活的情况下改变MT网络的最小浓度。清除步骤定义了药物的作用是否可逆。
- 通过顺序成像评估 MTA 对胶质母细胞瘤浸润的影响。
- 显微注射后4小时,按照步骤4.1至4.2.1进行操作。
注意:协议的这一部分也可以通过其他荧光标记的胶质母细胞瘤细胞系来实现。理想情况下,用胞质标签和细胞核标签共同标记GBM,以确保检测细胞的整体形态。 - 切换到长工作距离40倍水镜(数值孔径:1.15,工作范围:0.6毫米)。
- 设置 z 系列范围以获取 OT 区域。使用高灵敏度sCMOS相机(像素尺寸11μm,1,200 x 1,200像素,量子效率95%)获取z-stack。
注意:z堆栈通常从OT的最背侧部分(靠近表面)开始,并在大脑中足够深地结束,以包括整个肿瘤细胞团。 - 从显微镜上取下视频成像盘。通过使用微量加载尖端并轻轻戳动物周围的琼脂糖,将幼虫从琼脂糖中释放出来。
注意:由于 3 dpf 幼虫仍然非常脆弱,因此从琼脂糖中取出时要小心。 - 一旦动物从琼脂糖中解脱出来,轻轻地将其转移到装有矿泉源水+亚甲蓝+ PTU培养基的24孔板的单孔中。标记孔以识别幼虫以进行后续成像。
- 在培养基中加入先前确定的浓度(步骤4.3.3)的目标MTA。每天刷新补充药物的培养基。每天重复步骤4.4.1至4.4.5的成像过程,持续3-4天。
- 显微注射后4小时,按照步骤4.1至4.2.1进行操作。
5. 图像分析
- 使用免费提供的斐济插件分析MT动态。
注意:许多评论和协议描述了细胞31,32,33,34中的MT动力学分析方法,可以在此阶段应用。该协议将简要介绍两种测量基本MT动态特性的方法。- 打开 5D 超堆栈并生成一个 4D 堆栈,其中 z 切片已投影到单个平面中,以创建 z 中的最大强度投影 (MIP)(图像|堆栈|Z 项目 |最大强度)(图3B)。
- 打开 4D MIP 堆栈,并使用斐济中的手动跟踪功能手动跟踪基于突出的 MT 的末端(插件|跟踪|手动跟踪)。(图 3D)。提取MT动力学的生长速度、收缩速度、救援频率、灾变频率等参数。
- 或者,沿MT绘制一条10像素宽的分段线进行分析(图3B)。使用 多 Kymograph 函数(分析|多基莫图)(图3C)在斐济。观察并测量MT的生长阶段(G),暂停的长度(P)和MT灾难的频率。
- 长期胶质母细胞瘤侵袭分析
注意:此分析需要使用生物成像软件进行 4D 可视化和分析。- 使用文件转换器软件将步骤 4.4.3 (4 hpi) 中的原始 4D z 堆栈转换为适当的软件格式。
- 打开软件并在 超越视图中 导入转换后的 z 堆栈文件(图 5A)。
- 要分割肿瘤细胞并丢弃红色通道中不相关的自发荧光,请单击添加新 表面 并按照 5 步过程进行操作。
- 弹出窗口后,通过单击 下一个 箭头来验证默认设置。继续执行步骤 2/5。
注意:如果在561通道中获取荧光信号,则眼睛中残留色素沉着的自发荧光可能会很强,并改变自动分割过程。如果异种移植物靠近眼睛,这是有问题的。在这种情况下,分割必须通过剪切和删除非胶质母细胞瘤细胞信号手动完成。 - 导航到源通道| 561 通道。通过在"表面细节"中添加 1.50 μm,并在"减去背景"中为球体直径添加 2.5 μm,来平滑图像(高斯滤镜)。单击下一个箭头并继续执行步骤 3/5。
- 根据信号的强度,手动调整 阈值 (背景减法)以包括每个单元格过程。继续执行步骤 4/5。
- 通过去除不代表细胞一部分的事件(例如碎片、自发荧光)来过滤分割信号。单击 |音量的过滤器类型 并手动调整阈值以排除代表单元格部分的最小体积以下的所有事件。继续执行步骤 5/5。
注意:如果自发荧光信号的体积大于最小的细胞部分,请继续并通过 左键单击 并删除它们来手动 删除 不需要的信号。 - 放弃 分类步骤 并通过单击 双绿色 箭头完成分割向导,以完成肿瘤细胞的 表面 视图的创建(图5B)。
- 弹出窗口后,通过单击 下一个 箭头来验证默认设置。继续执行步骤 2/5。
- 如果分割的细胞没有相互接触并且没有形成唯一的物体,则人工合并它们以创建肿瘤细胞团状物体。简而言之,单击 统计数据|详细|特定值|交易量。通过 左键单击 顶部事件,然后按住 Shift 键并单击最后一个事件来选择所有事件。导航到 编辑|选择|统一。
- 定义肿瘤细胞团的质心。点击 添加新景点|跳过自动创建|添加(光标相交)|对象的中心。按住 shift 键并左键单击以创建斑点,该斑点是分段肿瘤细胞团的质心。
- 测量每个GBM细胞与肿瘤肿块质心之间的3D距离。为此,请通过保留在"点"视图上并选择工具图标|来创建到质心通道的距离距离变换。等待创建到质心通道的新距离,以及 488 和 561 通道(蓝色,图 5C)。
注意:此通道中每个体素的强度对应于体素到肿瘤细胞团质心之间的3D距离。 - 通过单击添加新 斑点|来测量到每个分割单元格的质心的 3D 距离跳过自动创建|添加(光标相交)|特定频道 561。按住 shift 键并左键单击细胞核区域。对每个单元格执行此任务(图5D)。
注意:删除 表面 视图以更好地欣赏细胞的荧光信号。或者,如果存在,请使用原子核信号(405 nm 或 647 nm 信号)以获得更高的精度。 - 点击 统计|详细|具体值|强度平均值 Ch=到质心的距离。
注意:强度值是细胞核区域和质心之间的3D距离(以μm为单位)。 - 平均这些强度以计算4 hpi处肿瘤肿块的半径。对分析的每个时间点(24 hpi、48 hpi 和 72 hpi)重复该过程。
注意:仅测量10或20个播散最多的细胞,以避免低估细胞侵袭。事实上,注射过程中细胞的强制压实可能会阻止肿瘤团中心的细胞迁移。 - 计算侵袭指数(II)作为t = 24 hpi / 48 hpi / 72 hpi处大多数播散细胞在t = 4 hpi处肿瘤质量平均半径上的平均3D距离之间的比率(图5E)。
结果
为了分析MTs在体内GBM侵袭中的作用,我们在这里描述了通过慢病毒感染在GBM细胞中进行稳定MT标记的主要步骤,3 dpf斑马鱼幼虫中GBM细胞的原位异种移植,MT动力学的高分辨率活体成像,MTA处理及其对GBM侵袭的影响,以及MT动力学和体内侵袭的图像分析(图1)。 MT动态是通过沿着增长和收缩的MT构建kymograph来测量的(图3C),或者通过随着时间的推移手动跟踪单个MT边缘(图3D)。图4给出了在幼虫培养基中进行药物治疗的示例及其对MT网络组织的可逆影响。用低剂量诺考达唑(200nM)治疗导致MT网络的进行性收缩和4小时后胶质母细胞瘤细胞突起的消失(图4A)。洗掉药物恢复了胶质母细胞瘤细胞形成突起的能力。洗脱后12小时,细胞恢复沿脉管系统迁移(图4B)。这些数据表明,用200nM诺考达唑治疗足以破坏MT网络并迅速阻断体内胶质母细胞瘤细胞侵袭。对全球胶质母细胞瘤细胞侵袭的相同治疗进行为期3天的分析表明,与对照组相比,诺考达唑200 nM可阻止体内长期胶质母细胞瘤细胞侵袭,而不会影响鱼的总体健康状况(图4C)。
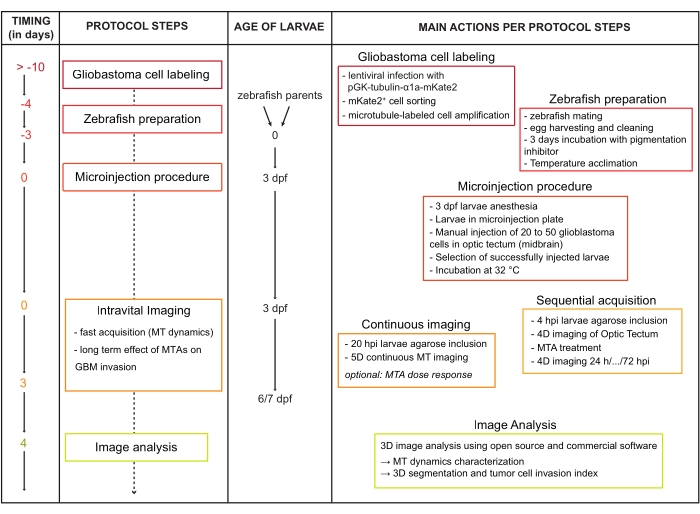
图 1:协议工作流程图。缩写:dpf = 受精后天数;HPI = 注射后数小时;MT = 微管;MTA = 微管改变剂;GBM = 多形性胶质母细胞瘤。请点击此处查看此图的大图。
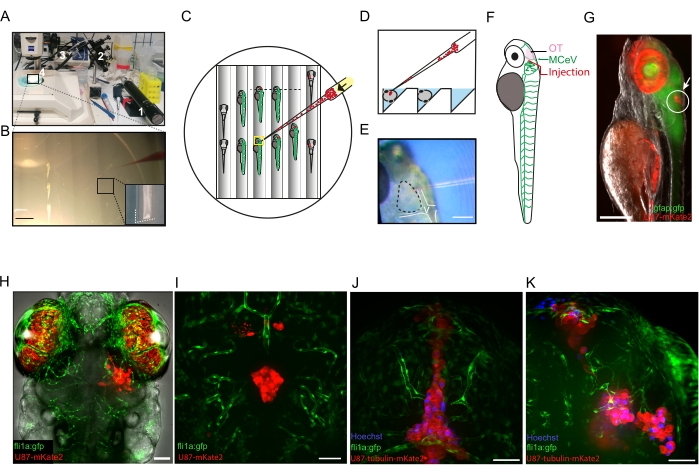
图 2:将胶质母细胞瘤细胞微注射到 3 个 dpf 斑马鱼幼虫脑中。 (一)异种移植设备照片: 1、油显微注射器;2、机械显微机械手;3、万能毛细管支架;4、玻璃毛细管。显微注射板在体视显微镜下。(B) 照片显示麻醉的3只dfp斑马鱼幼虫排列在沟渠中并准备进行显微注射。装有红色染料的微毛细管的尖端在照片右侧可见。琼脂糖板中构建的图案沟槽的详细信息在右下角的插图中可见。比例尺 = 3 mm。 (C)代表性显微注射板的方案。准备注射的幼虫横向放置(板的中心)。请注意,在进行注射之前,细胞集中在微毛细管的尖端(黑色箭头)。注射的幼虫显示在板的右侧,放置在腹侧。(D)显微注射板中的横向切片(沿C中的黑色虚线)示意图,显示了注射过程中放置幼虫的沟渠。(E)显示毛细管尖端准备穿透视顶的照片(虚线)。心室由白线划定。比例尺 = 150 μm。 (F) 在内皮细胞中表达 GFP 的 3 dpf fli1a:gfp 幼虫的方案,指示细胞被注射的 OT 区域,就在大脑中静脉上方。(G) 显微注射 U87-mkate2 细胞(白色圆圈和白色箭头)后横向放置的 3 dpf gfap:gfp 幼虫(在神经干细胞中表达的 gfp)的荧光图像。红色的高自发荧光是由眼睛中的虹膜细胞引起的。比例尺 = 100 μm。 (H) 成功注射的 fli1a:gfp 幼虫的共聚焦荧光图像,浓度为 16 hpi。比例尺:50 μm。 (I-K) 未成功注射的 fli1a:gfp 幼虫的共聚焦荧光图像,分别为 96 hpi (I) 和 4 hpi (J,K)。GBM细胞已被注射到脑室(I,J)或大脑的多个病灶(K)中。比例尺 = 50 μm。缩写:dpf = 受精后天数;OT = 视顶;MCeV = 大脑中静脉;GFP = 绿色荧光蛋白;GFAP=神经胶质纤维酸性蛋白;HPI = 注射后数小时。请点击此处查看此图的大图。
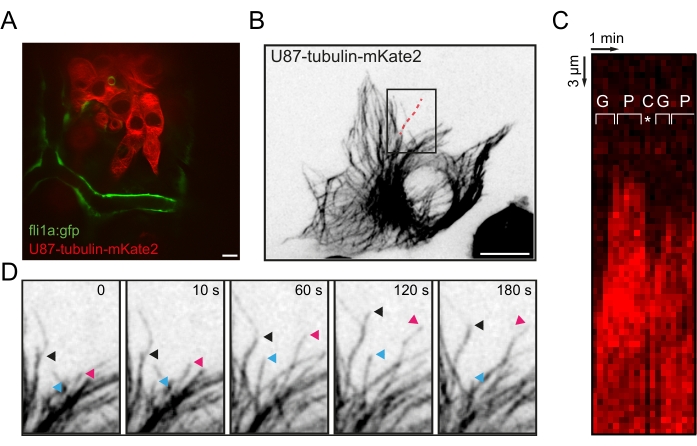
图3:可视化胶质母细胞瘤细胞中的 体内 微管动力学。 (A) 在 20 hpi 的 fli1a:GFP 斑马鱼幼虫的 OT 中表达微管蛋白-α1-mkate2 的异种移植 U87 细胞的代表性荧光图像。(B)单个异种移植U87细胞中MT网络的最大强度投影荧光图像。(C)沿 B中红色虚线的Kymograph,显示了MT动态不稳定的生长,暂停和灾难阶段。(D) B 中盒装区域的延时序列,突出显示三个MT +末端的跟踪。比例尺 = 10 μm。缩写:OT = 视顶;GFP = 绿色荧光蛋白;HPI = 注射后数小时;MT = 微管;G = 生长期;P = 暂停阶段;C = 灾难阶段。 请点击此处查看此图的大图。

图 4:可视化微管改变剂对 体内胶质母细胞瘤侵袭的影响。 (A)用诺卡唑(200nM)处理的斑马鱼幼虫中表达微管蛋白-α1a-mkate2的U87细胞的延时序列。箭头指向沿着血管侵入大脑的两个不同细胞中突起的末端。注意用诺考达唑治疗时突出物的回缩。比例尺 = 10 μm。 (B)代表诺考达唑洗脱对U87细胞侵袭的影响的延时序列。在洗脱后500分钟,标有白色星号的细胞拉长了一个基于MT的突起(白色箭头),这允许其沿着血管恢复侵袭。比例尺= 20μm。 (C)用DMSO或诺考达唑(200nM)处理72小时的异种移植幼虫脑的3D表示。U87细胞信号已被分割(红色)并整合到fli1a-GFP荧光信号中(白色)。注意用诺考达唑处理的U87细胞的播散减少。比例尺 = 30 μm。缩写:GFP = 绿色荧光蛋白;HPI = 注射后数小时;MT = 微管。 请点击此处查看此图的大图。
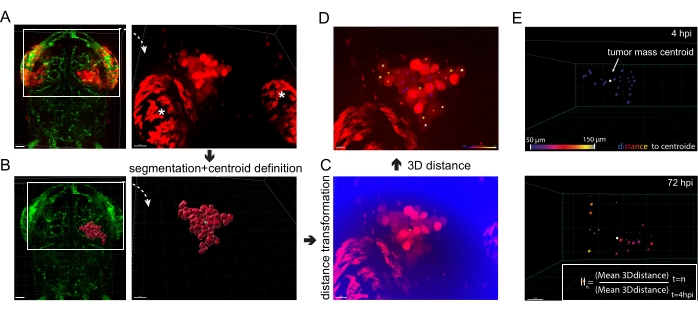
图5: 体内 胶质母细胞瘤侵袭的图像分析。 (A)在fli1a-GFP斑马鱼幼虫中表达胞质mKate2的异种移植U87细胞的荧光图像,4 hpi。白色星号强调眼睛虹膜团的典型自发荧光。比例尺 = 40 μm。 (B)fli1a-GFP幼虫的荧光图像与 对应于A中U87细胞信号的分段表面耦合。肿瘤肿块的质心呈绿色。比例尺 = 40 μm。 (C)荧光图像表示 A 中的红色通道信号和新定义的"到质心的距离"通道(蓝色)。比例尺 = 30 μm。 (D)红色通道荧光图像与彩色斑点叠加,其颜色表示细胞到质心的距离(绿色),紫色最接近质心,白色最远。比例尺 = 20 μm。 (E)全球GBM入侵顺序分析的一个例子。3D距离在4 hpi和72 hpi下确定,入侵指数(II)根据收件箱中的公式计算。比例尺 = 20 μm。缩写:GFP = 绿色荧光蛋白;HPI = 注射后数小时。 请点击此处查看此图的大图。
讨论
以单细胞分辨率对肿瘤异种移植物进行成像很可能成为提高我们对GBM生物学理解的不可或缺的工具。小鼠PDX模型中的实时成像导致了关于GBM如何集体侵入脑组织的宝贵发现18。然而,迄今为止,时空分辨率还不足以揭示控制GBM侵袭的蛋白质的动力学。我们推断,通过将透明斑马鱼幼虫中GBM细胞的原位移植与高分辨率活体成像相结合,可以足够详细地分析细胞骨架蛋白(如MTs)以分析其在 原位 GBM入侵期间的动力学。
该方法的关键步骤在于GBM细胞的制备和显微注射程序。不健康和未充分解离的细胞会粘在一起或粘在毛细血管边界上并阻止注射流动。此外,细胞需要充分集中在毛细血管中,以最小化注射体积并大量植入。注射更多体积的稀释细胞将导致多个,有时是混合的肿瘤病灶,其侵袭性指数变得难以测量。在我们手中,手动处理油基微量注射器可以比以前在类似型号中使用的加压空气基电子微量注射器更好地控制注射流量19。这对于防止大脑内流动压力过大至关重要,从而避免随后的组织损伤和注射细胞的心室聚集。
该模型的一些局限性包括必须在次优温度下对两个物种进行实验。斑马鱼通常在28°C下养殖,而人体细胞在37°C下培养。 在32°C以上,斑马鱼胚胎发育被改变,这些变化可能是致命的35。然而,与成年斑马鱼异种移植模型36所做的类似,与移植后温度从28°C到32°C的快速变化相比,将斑马鱼幼虫依次适应32°C的温度可提高移植动物的存活率。 然而,根据斑马鱼胚胎对32°C以上温度的敏感性,温度升高进一步导致动物死亡增加35。
解释 体内 MT动力学数据必须仔细完成,因为当温度降至37°C以下时MT动力学变化37。在具有相同MTA处理的相同GBM细胞中,在37°C和32°C下平行体 外 测量MT动力学将有助于验证各种GBM细胞之间或 体内 处理之间的差异。它应该有助于确认差异不是由温度敏感性的变化引起的,而是由不同的调节途径(用于GBM比较分析)或MTA处理(用于MTA效应分析)引起的。如果MT动力学异质性与不同的入侵能力有关,这将很有趣。
另一个限制是可以监测入侵的时间窗口短(72至96小时),从而阻止了由MT动力学38的潜在变化驱动的入侵塑性测量。96小时后,我们注意到GBM细胞侵袭急剧减少。注射后6天,GBM细胞数量迅速下降,可能是由于中性粒细胞和巨噬细胞在肿瘤微环境中的积累引起的宿主免疫应答39。将MTA输送到整个大脑可能会影响附近的神经元宿主细胞,这些细胞依赖于MT的活动,其改变可能随后影响GBM侵袭40。这种方法需要辅以shRNA或光遗传学测定,以限制MT对GBM细胞的改变,但仍然是筛选新的抗侵入性化合物的良好平台。
在斑马鱼脑中原位注射MT标记的GBM细胞对于破译MT在癌细胞侵袭中的作用特别感兴趣,因为很少有动物模型允许在其起源组织中对癌细胞迁移进行原位亚细胞成像15。迄今为止,GBM迁移过程中MT功能的研究主要依赖于体外和离体测定,缺乏体内验证24,41,42,43。结合目的基因敲低或基于基因的无偏筛选方法,这里介绍的测定将有助于揭示对GBM体内侵袭很重要的新MT调节因子。
GBM是高度异质的肿瘤,其侵袭性在标本之间差异很大44。了解其不同侵袭模式背后的分子机制将有助于确定阻止GBM传播的 临时 治疗方法。系统测量各种GBM样品中的侵袭指数,侵袭模式和细胞骨架特性(例如MT动力学)将揭示频繁的基因组突变谱与依赖于特定细胞骨架特性的细胞侵袭模式之间的新相关性。揭示这些突变如何影响MT动力学的变化,不仅可以增加我们对细胞迁移过程中MT调节的了解45,46 ,而且还可能导致期待已久的患者特异性抗侵入性疗法。
斑马鱼显微注射相对容易,加上可用的大量幼虫和药物注射的便利性,使该程序适用于个性化医疗47,48。此外,与仅发生在皮层49,50的上部500μm部分的小鼠GBM异种移植物的活体成像相反,使用斑马鱼可以可视化整个CNS中的GBM浸润。这里介绍的模型符合标准,成为快速分析胶质母细胞瘤侵袭能力及其对治疗反应的宝贵工具。
披露声明
作者没有利益冲突需要披露。
致谢
我们非常感谢P. Herbomel博士(法国巴斯德研究所)和他的实验室,特别是Valérie Briolat和Emma Colucci-Guyon为我们提供斑马鱼生产线和显微注射板的塑料模具,以及他们在斑马鱼实验程序方面的宝贵专业知识。我们非常感谢UtechS光子生物成像(C2RT,巴斯德研究所,由法国国家研究机构法国生物成像和ANR-10-INBS-04支持;对未来的投资)。这项工作得到了Ligue contre le cancer(EL2017。LNCC)、国家科学研究中心和巴斯德研究所,以及玛格丽特·米歇尔夫人和波尔凯先生的慷慨捐赠。
材料
| Name | Company | Catalog Number | Comments |
| Glioblastoma cell culture | |||
| Foetal calf serum | Eurobio | CVFSVF00-01 | Reagent |
| MEM NEAA | Gibco | 11140-050 | Reagent |
| Modified Eagle's medium | Eurobio | CM1MEM18-01 | Reagent |
| Penicillin–streptomycin | Gibco | 15140-122 | Reagent |
| U-87 MG | ECACC | 89081402-1VL | Cells |
| Lenitivirus production | |||
| BD FACSAria III | BD bioscience | Instrument | |
| BD FACSDiva software v8.0 | BD bioscience | Software | |
| HEK-293T | Merck | 12022001 | Cells |
| pMD2.G | Addgene | Plasmid #12259 | Reagent |
| psPAX2 | Addgene | Plasmid #12260 | Reagent |
| Ultracentrifuge Optima XPN-80 | Beckman Coulter | Instrument | |
| Cell passaging and staining | |||
| dPBS | Gibco | 14190-094 | Chemical |
| Hoechst 34580 | Sigma-Aldrich | 63493 | Chemical |
| Trypsin-EDTA (0,05%) | Gibco | 25300-054 | Reagent |
| Zebrafish husbandry | |||
| Fluorescence stereomicroscope LEICA M165FC | LEICA | https://www.leica-microsystems.com/fr/produits/stereomicroscopes-et-macroscopes/informations-detaillees/leica-m165-fc/ | Instrument |
| Methylene Blue hydrate | Sigma-Aldrich | M4159 | Chemical |
| N-Phenylthiourea (PTU) | Sigma-Aldrich | P7629-25G | Chemical |
| Transfer Pipettes fine tips | Samco Scientific | 232 | Equipment |
| Transfer Pipettes Large Bulb3mL | Samco Scientific | 225 | Equipment |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | Cat#: A5040 | Chemical |
| Volvic Source Water | DUTSCHER DOMINIQUE SAS | 999556 | Reagent |
| Xenotransplantation | |||
| 24-well plate | TPP | 92024 | Equipment |
| Borosilicate glass capillaries (1.0 ODx0.58IDx150L mm) | Harvard Apparatus | (#30-0017 GC100-15 | Equipment |
| CellTram oil vario microinjector | Eppendorf | 5176000.025 | Instrument |
| Microloading pipet tips (Microloader) 20µL | Eppendorf | 5242956003 | Equipment |
| Micromanipulator | NARISHIGE | https://products.narishige-group.com/group1/injection/english.html | Equipment |
| Mineral Oil | Sigma | M8410-100ml | Equipment |
| Stereomicroscope | Olympus | KL 2500 LCD | Instrument |
| Universal capillary holder | Eppendorf | 5176190002 | Equipment |
| Vertical Pipette puller | KOPF (Roucaire) | Model 720 | Instrument |
| Intravital Imaging | |||
| 3.5cm glass-bottom videoimaging dish | MatTek Life Sciences, MA, USA | P35G-1,5-14-C | Equipment |
| Acquisition software: NIS-Elements-AR version 5.21 | Nikon | Software | |
| Heat-Block | Techne | DRI-BLOCK DB-2D | Equipment |
| Microscope head Nikon Ti2E | Nikon | Instrument | |
| sCMOS camera Prime 95B | Photometrics | Instrument | |
| sCMOS camera Orca Flash 4 | Hammatsu | Instrument | |
| Ultrapure Low melting point agarose | Invitrogen | 16520-050 | Chemical |
| Yokagawa CSU-W1 spinning disk unit | Hammatsu | Instrument | |
| Drug Treatment | |||
| DMSO | Sigma-Aldrich | D2650-100ML | Chemical |
| Nocodazole | Sigma-Aldrich | M1404-2MG | Chemical |
| Image Analysis | |||
| Imaris 9.5.1 software | Oxford Instruments | Software | |
| ImarisFileConverter 9.5.1 | Oxford Instruments | Software |
参考文献
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112 (4), 453-465 (2003).
- Etienne-Manneville, S. Microtubules in cell migration. Annual Review of Cell and Developmental Biology. 29, 471-499 (2013).
- Bouchet, B. P., Akhmanova, A. Microtubules in 3D cell motility. Journal of Cell Science. 130 (1), 39-50 (2017).
- Seetharaman, S., et al. Microtubules tune mechanosensitive cell responses. Nature Materials. 21 (3), 366-377 (2022).
- Etienne-Manneville, S. From signaling pathways to microtubule dynamics: the key players. Current Opinion in Cell Biology. 22 (1), 104-111 (2010).
- Garcin, C., Straube, A. Microtubules in cell migration. Essays in Biochemistry. 63 (5), 509-520 (2019).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Nature editorial. The 'war on cancer' isn't yet won. Nature. 601 (297), (2022).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Clark, A. G., Vignjevic, D. M. Modes of cancer cell invasion and the role of the microenvironment. Current Opinion in Cell Biology. 36, 13-22 (2015).
- Meyer, A. S., et al. 2D protrusion but not motility predicts growth factor-induced cancer cell migration in 3D collagen. Journal of Cell Biology. 197 (6), 721-729 (2012).
- Bouchet, B. P., et al. Mesenchymal cell invasion requires cooperative regulation of persistent microtubule growth by SLAIN2 and CLASP1. Developmental Cell. 39 (6), 708-723 (2016).
- Luthria, G., et al. In vivo microscopy reveals macrophage polarization locally promotes coherent microtubule dynamics in migrating cancer cells. Nature Commun. 11 (1), 3521(2020).
- Wen, P. Y., Kesari, S. Malignant gliomas in adults. New England Journal of Medicine. 359 (5), 492-507 (2008).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments. (86), e55108(2014).
- Osswald, M., et al. Brain tumour cells interconnect to a functional and resistant network. Nature. 528 (7580), 93-98 (2015).
- Astell, K. R., Sieger, D. Investigating microglia-brain tumor cell interactions in vivo in the larval zebrafish brain. Methods in Cell Biology. , 593-626 (2017).
- Zeng, A., et al. Identify a blood-brain barrier penetrating drug-TNB using zebrafish orthotopic glioblastoma xenograft model. Scientific Reports. 7 (1), 14372(2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Disease Models & Mechanisms. 9 (9), 1063-1065 (2016).
- Umans, R. A., Ten Kate, M., Pollock, C., Sontheimer, H. Fishing for contact: modeling perivascular glioma invasion in the zebrafish brain. ACS Pharmacology & Translational Science. 4 (4), 1295-1305 (2021).
- Lee, J. H., et al. Human glioblastoma arises from subventricular zone cells with low-level driver mutations. Nature. 560 (7717), 243-247 (2018).
- Pagano, A., et al. Epothilone B inhibits migration of glioblastoma cells by inducing microtubule catastrophes and affecting EB1 accumulation at microtubule plus ends. Biochemical Pharmacology. 84 (4), 432-443 (2012).
- Berges, R., et al. The novel tubulin-binding checkpoint activator BAL101553 inhibits EB1-dependent migration and invasion and promotes differentiation of glioblastoma stem-like cells. Molecular Cancer Therapeutics. 15 (11), 2740-2749 (2016).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Volvic source water mineral composition. Volvic. , Available from: https://www.volvic.co.uk/volcanic-water/composition (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Brachydanio rerio). The University of Oregon Press, Eugene. , Chapter 5 (2000).
- E3, M. Recipe E3 medium (for zebrafish embryos. , Cold Spring Harbor Protocols. (2011).
- Straube, A. How to measure microtubule dynamics. Methods in Molecular Biology. 777, 1-14 (2011).
- Honore, S., Braguer, D. Investigating microtubule dynamic instability using microtubule-targeting agents. Methods in Molecular Biology. 777, 245-260 (2011).
- Movsisyan, N., Pardo, L. A. Measurement of microtubule dynamics by spinning disk microscopy in monopolar mitotic spindles. Journal of Visualized Experiments. (153), e60478(2019).
- Serikbaeva, A., Tvorogova, A., Kauanova, S., Vorobjev, I. A. Analysis of microtubule dynamics heterogeneity in cell culture. Methods in Molecular Biology. 1745, 181-204 (2018).
- Schnurr, M. E., Yin, Y., Scott, G. R. Temperature during embryonic development has persistent effects on metabolic enzymes in the muscle of zebrafish. Journal of Experimental Biology. 217 (8), 1370-1380 (2014).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Translational Oncology. 14 (1), 100899(2021).
- Hamilton, L., Astell, K. R., Velikova, G., Sieger, D. A zebrafish live imaging model reveals differential responses of microglia toward glioblastoma cells in vivo. Zebrafish. 13 (6), 523-534 (2016).
- Gillespie, S., Monje, M. An active role for neurons in glioma progression: making sense of Scherer's structures. NeuroOncology. 20 (10), 1292-1299 (2018).
- Wolf, K. J., et al. A mode of cell adhesion and migration facilitated by CD44-dependent microtentacles. Proceedings of the National Academy of Sciences. 117 (21), 11432-11443 (2020).
- Zhou, Y. X., et al. Transcriptional upregulation of microtubule-associated protein 2 is involved in the protein kinase A-induced decrease in the invasiveness of glioma cells. Neuro-Oncology. 17 (12), 1578-1588 (2015).
- Monzo, P., et al. Mechanical confinement triggers glioma linear migration dependent on formin FHOD3. Molecular Biology of the Cell. 27 (8), 1246-1261 (2016).
- Vollmann-Zwerenz, A., Leidgens, V., Feliciello, G., Klein, C. A., Hau, P. Tumor cell invasion in glioblastoma. International Journal of Molecular Science. 21 (6), 1932(2020).
- Feng, H., et al. EGFRvIII stimulates glioma growth and invasion through PKA-dependent serine phosphorylation of Dock180. Oncogene. 33 (19), 2504-2512 (2014).
- Liu, R., et al. Cdk5-mediated regulation of the PIKE-A-Akt pathway and glioblastoma cell invasion. Proceedings of the National Academy of Sciences. 105 (21), 7570-7575 (2008).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trends in Cancer. 6 (7), 569-579 (2020).
- Baxendale, S., van Eeden, F., Wilkinson, R. The power of zebrafish in personalised medicine. Personalised Medicine: Lessons from Neurodegeneration to Cancer. 1007, 179-197 (2017).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Stanchi, F., Matsumoto, K., Gerhardt, H. Imaging glioma progression by intravital microscopy. Methods in Molecular Biology. 1862, 227-243 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。