Method Article
Imagerie en direct de la dynamique des microtubules dans les cellules de glioblastome envahissant le cerveau du poisson zèbre
Dans cet article
Résumé
Nous rapportons une technique permettant l’imagerie en direct de la dynamique des microtubules dans les cellules de glioblastome (GBM) envahissant un tissu cérébral de vertébrés. Le couplage de l’injection orthotopique de cellules GBM marquées par fluorescence dans un cerveau de poisson-zèbre transparent avec une imagerie intravitale à haute résolution permet de mesurer la dynamique du cytosquelette lors de l’invasion in situ du cancer.
Résumé
Avec un temps de survie médian lamentable dans les populations réelles - entre 6 et 15 mois - le glioblastome (GBM) est la tumeur cérébrale maligne la plus dévastatrice. L’échec du traitement est principalement dû au caractère invasif des cellules GBM, ce qui témoigne de la nécessité d’une meilleure compréhension des propriétés mobiles du GBM. Pour étudier le mécanisme moléculaire soutenant l’invasion du GBM, de nouveaux modèles physiologiques permettant une caractérisation approfondie de la dynamique des protéines pendant l’invasion sont nécessaires. Ces observations ouvriraient la voie à la découverte de nouvelles cibles pour bloquer l’infiltration tumorale et améliorer les résultats pour les patients. Cet article rapporte comment une xénogreffe orthotopique de cellules GBM dans le cerveau du poisson zèbre permet l’imagerie vivante intravitale subcellulaire. En nous concentrant sur les microtubules (MT), nous décrivons une procédure de marquage MT dans les cellules GBM, la microinjection de cellules GBM dans le cerveau transparent de larves de poisson zèbre 3 jours après la fécondation (dpf), l’imagerie intravitale des MT dans les xénogreffes disséminées, la modification de la dynamique MT pour évaluer leur rôle lors de l’invasion GBM et l’analyse des données acquises.
Introduction
La motilité cellulaire est un processus stéréotypé nécessitant l’établissement d’un axe de polarité et des réarrangements cytosquelettiques générateurs de force. La polymérisation de l’actine et son association avec la myosine sont reconnues comme les principaux contributeurs aux forces protrusives et contractiles nécessaires au mouvement cellulaire1. Les microtubules sont considérés comme les principaux acteurs de la polarisation cellulaire et de la persistance directionnelle pendant la migration2. Ces dernières années, il a également été démontré que les MT créent et stabilisent des protubérances pour soutenir les forces mécanocompressives lors de l’invasion cellulaire en 3D3. Plus récemment, les MT ont été directement impliquées dans la mécanotransduction aux adhérences focales et la migration mécanosensible4. L’instabilité dynamique qui caractérise la dynamique terminale MT-plus est constituée de phases répétées de polymérisation (croissance) et de dépolymérisation (retrait), qui sont contrôlées par une pléthore de protéines de liaison aux microtubules et de cascades de signalisation intracellulaires, telles que celles régies par les RHO-GTPases 5,6,7. Le rôle du réseau MT dans la migration et l’invasion cellulaire a fait de l’étude de la dynamique de la MT un élément clé pour mieux comprendre les mécanismes de la localisation des cellules immunitaires, de la cicatrisation des plaies et de l’invasion du cancer.
La capacité des cellules cancéreuses à s’échapper du noyau tumoral primaire, à se propager dans les tissus et à générer des tumeurs secondaires est une étape cruciale pour empêcher le succès mondial dans la guerre contre le cancer déclarée il y a 50 ans 8,9. L’un des plus grands obstacles a été de comprendre comment les cellules cancéreuses envahissent activement le tissu. Les principaux mécanismes d’invasion reposent sur les mêmes principes que ceux régissant la migration des cellules non tumorales10. Cependant, des spécificités de migration des cellules cancéreuses ontémergé11, déclenchant la nécessité d’une meilleure caractérisation de ce type de migration. Plus précisément, parce que le microenvironnement tumoral apparaît comme un acteur clé de la progression du cancer12, l’observation et l’analyse de l’invasion des cellules cancéreuses dans un contexte physiologique pertinent sont essentielles pour démêler les mécanismes de dissémination des cellules cancéreuses.
Les MT sont essentielles à la progression du cancer, pour soutenir à la fois la prolifération et l’invasion. Une analyse précise de la dynamique de la MT in situ peut aider à identifier les agents altérant la MT (MTA) dans les deux processus. La dynamique de la traduction automatique varie considérablement en fonction d’un changement d’environnement. In vitro, le traitement avec des agents déstabilisants MT tels que le nocodazole empêche la formation de saillies cellulaires lorsque les cellules sont intégrées dans des gels en 3D, alors qu’il a peu d’effet sur la migration cellulaire 2D13,14. Bien que techniquement difficiles, les progrès de l’imagerie intravitale permettent une analyse in vivo de la dynamique de la MT pendant l’invasion des cellules cancéreuses. Par exemple, l’observation des MT dans les cellules de fibrosarcome xénogreffées par voie sous-cutanée chez la souris a révélé que les macrophages associés aux tumeurs affectent la dynamique de la MT dans les cellules tumorales15. Cependant, ces modèles murins impliquent des procédures chirurgicales étendues et restent insatisfaisants pour les cancers moins accessibles, tels que la tumeur cérébrale hautement invasive, GBM.
Malgré un temps de survie moyen lamentable de 15 mois16, on sait peu de choses sur le mode de dissémination du GBM dans le parenchyme cérébral ou sur les éléments moléculaires clés soutenant l’invasion des cellules GBM dans le tissu cérébral. L’amélioration du modèle de xénogreffe orthotopique de souris (PDX) et l’établissement de fenêtres crâniennes ont offert de nouvelles perspectives pour les études d’invasion cellulaire GBM17,18. Cependant, en raison de la qualité d’imagerie sous-optimale, ce modèle a principalement permis l’imagerie longitudinale de xénogreffes superficielles et n’a pas été utilisé avec succès pour étudier l’imagerie subcellulaire des protéines du cytosquelette jusqu’à présent. De plus, à la suite de l’injonction des « 3R » visant à réduire l’utilisation des rongeurs et à les remplacer par des vertébrés inférieurs, des modèles alternatifs ont été établis.
Profitant de l’immunité primitive observée chez les larves de poisson zèbre (Danio rerio), l’injection orthotopique de cellules GBM dans le cerveau des poissons a été développée 19,20,21. L’injection au voisinage des ventricules dans le mésencéphale en développement récapitule la majeure partie de la physiopathologie du GBM humain21, et le même schéma préféré d’invasion du GBM que chez les humains - cooptation des vaisseaux - est observé22. Grâce à la transparence des larves de poissons, ce modèle permet de visualiser les cellules GBM envahissant le cerveau à partir des zones péri-ventriculaires où la plupart des GBM apparaîtraient23.
Étant donné que les MT sont essentielles pour l’invasion cellulaire du GBM in vitro24,25, une meilleure caractérisation de la dynamique de la magnétothérapie et l’identification des régulateurs clés pendant l’invasion cellulaire sont nécessaires. Cependant, à ce jour, les données générées avec le modèle orthotopique du poisson zèbre n’ont pas inclus l’analyse subcellulaire de la dynamique de la magnétoscopie pendant le processus d’invasion. Cet article fournit un protocole pour étudier la dynamique de la MT in vivo et déterminer son rôle lors de l’invasion du cancer du cerveau. Après un marquage stable des microtubules, les cellules GBM sont microinjectées à 3 dpf dans le cerveau des larves de poisson zèbre et imagées en temps réel à haute résolution spatio-temporelle au cours de leur progression dans le tissu cérébral. L’imagerie en direct des MT fluorescentes permet l’analyse qualitative et quantitative de la dynamique de la MT plus-end. De plus, ce modèle permet d’évaluer en temps réel l’effet des MTA sur la dynamique de la MT et sur les propriétés invasives des cellules GBM. Ce protocole relativement non invasif combiné à un grand nombre de larves manipulées à la fois et à la facilité d’application du médicament (dans l’eau des poissons) fait du modèle un atout pour les essais précliniques.
Protocole
Les expériences sur les animaux ont été menées conformément aux directives de l’Union européenne pour la manipulation des animaux de laboratoire. Tous les protocoles ont été approuvés par le Comité d’éthique pour l’expérimentation animale de l’Institut Pasteur - CEEA 89 et le ministère Français de la Recherche et de l’Éducation (permis #01265.03). Lors d’injections ou de séances d’imagerie en direct, les animaux ont été anesthésiés Tricaine.At la fin des procédures expérimentales, ils ont été euthanasiés par surdosage anesthésique. Consultez le tableau des matériaux pour plus de détails sur les matériaux, l’équipement et les logiciels utilisés dans ce protocole. Le flux de travail général du protocole est décrit à la figure 1.
1. Génération de cellules de glioblastome exprimant de façon stable α-tubuline-mKate2
REMARQUE: Les étapes suivantes sont effectuées dans une armoire de biosécurité BSL2+.
- Produire des particules lentivirales exprimant la tbuline mKate2-en utilisant la méthode au phosphate de calcium pour la transfection de 7 × 106 cellules HEK-293T.
- Dans un tube microcentrifuge de 1,5 mL, ajouter 10 μg de plasmide d’emballage psPAX2 de 2e génération, 5 μg de plasmide d’enveloppe virale pMD2.G et 10 μg du plasmide d’intérêt, pGK-mKate2-tubuline humaine α1a avec 50 μLde CaCl 2 (2,5 M stock). Ajuster à 500 μL avec duH2Ostérile sans ADNase.
REMARQUE: Il est important d’ajouter CaCl2 en dernier. - Mélanger en retournant le tube plusieurs fois et incuber pendant 20 min à température ambiante (RT).
- Pendant l’incubation, préparer un autre tube microcentrifuge de 1,5 mL avec 500 μL de solution saline tamponnée HEPES (HBS), pH 7,0 (2x).
- Après 20 min, ajouter le mélange CaCl2/ADN goutte à goutte dans la solution HBS (2x). Mélanger en inversant le tube plusieurs fois. Incuber pendant 12 min à TA.
- Après 12 min, ajouter doucement le CaCl2/ADN mélangé avec HBS directement sur une boîte confluente à 70% de cellules HEK-293T de 10 cm, goutte à goutte.
- Laisser les cellules dans l’incubateur humidifié à 37 °C avec 5% de CO2 pendant 36-48 h.
- Recueillir le surnageant et le faire tourner vers le bas à 3 000 × g pendant 5 minutes pour éliminer les débris cellulaires.
- Pour concentrer les particules virales, chargez le surnageant dans un tube à ultracentrifugation et faites-le tourner vers le bas à 47 508 × g pendant 90 min à 4 °C.
- Jetez le surnageant et placez le tube à l’envers sur du papier pour sécher l’intérieur du tube.
- Ajouter 30 μL de PBS sur la pastille virale. Ne pas remettre le granulé en suspension. Laisser à 4 °C pendant 2 h.
- Remettez doucement les particules virales en train de pipeter de haut en bas. Évitez de faire des bulles. Conserver à -80 °C.
REMARQUE: De plus grandes quantités de particules virales peuvent être produites en transfectant plusieurs plaques de cellules HEK-2-93T.
- Dans un tube microcentrifuge de 1,5 mL, ajouter 10 μg de plasmide d’emballage psPAX2 de 2e génération, 5 μg de plasmide d’enveloppe virale pMD2.G et 10 μg du plasmide d’intérêt, pGK-mKate2-tubuline humaine α1a avec 50 μLde CaCl 2 (2,5 M stock). Ajuster à 500 μL avec duH2Ostérile sans ADNase.
- Infecter les cellules de glioblastome avec des particules lentivirales.
REMARQUE: Ce protocole est écrit pour les lignées cellulaires de glioblastome commerciales telles que U-87 MG, U-373 MG ou T98. Pour utiliser des cellules de glioblastome primaires dérivées du patient, utiliser un revêtement spécifique des plaques et un milieu non à base de sérum26.- Préparer une boîte confluente de 10 cm à 70 % de cellules de glioblastome U-87 MG cultivées dans le milieu essentiel minimal (MEM) d’Eagle, complétée par 10 % de sérum de veau fœtal, de pénicilline-streptomycine (concentration finale de 100 unités/mL pour la pénicilline et 100 μg/mL pour la streptomycine) et d’acides aminés non essentiels (1x).
- Ajouter les particules virales à une dilution de 1 sur 5 000 directement sur les cellules. Mélanger avec un léger tourbillon. Laissez les virus infecter les cellules pendant 20 heures au maximum.
- Retirez le milieu contenant le virus et remplacez-le par un milieu de culture frais. Laisser l’expression de la tubuline marquée pendant 48-72 h.
NOTE: Les étapes suivantes doivent être effectuées dans une armoire de biosécurité BSL2. - FACS-trier les cellules pour sélectionner les 15% les plus brillants de cellules mKate2+ . Après avoir enlevé les débris et les cellules doublet à l’aide de la diffusion avant et latérale (FCS vs SSC), appliquez un autre gating sur les cellules mKate2+ les plus brillantes à 30 % pour conserver les 15 % supérieurs.
- Amplifiez les cellules marquées par MT.
NOTE: Alternativement, la sélection clonale basée sur des niveaux élevés de tubuline-mKate2 peut être effectuée sous un microscope à épifluorescence.
2. Préparer les larves de poisson zèbre pour la micro-injection
- Générez des œufs de poisson zèbre.
- Placez trois mâles et quatre femelles de la souche de poisson-zèbre désirée dans un bassin d’accouplement complété par des billes 4 jours avant la xénotransplantation, en fin d’après-midi.
REMARQUE: Les lignes Tg(fli1a:gfp), Tg(gfap:gfp) ou Tg(Huc:gfp) sont utilisées pour marquer les vaisseaux endogènes, les cellules souches neurales / astrocytes et les neurones, respectivement. - Récoltez les œufs produits par le frai induit par le marbre le lendemain matin.
- Nettoyez les œufs en les transférant dans un tube à centrifuger de 50 ml rempli d’eau minérale27 additionnée d’eau de Javel (0,004 % final). Retourner doucement le tube pendant 5 min. Laver deux fois avec de l’eau minérale seulement.
- Transférer les œufs dans une boîte de Pétri contenant de l’eau minérale additionnée de 0,28 mg/mL de bleu de méthylène.
- Retirez les œufs non fécondés et dont le développement est arrêté. Incuber les embryons à 28 °C.
- Placez trois mâles et quatre femelles de la souche de poisson-zèbre désirée dans un bassin d’accouplement complété par des billes 4 jours avant la xénotransplantation, en fin d’après-midi.
- Créez des larves transparentes.
- Introduire la N-phénylthiourée (PTU) (0,003% final) dans le milieu 8 h plus tard, pour prévenir la pigmentation de la mélanine et assurer la transparence optique. Gardez le PTU dans le milieu pour le reste du protocole.
REMARQUE : Étant donné que le traitement par PTU peut causer des anomalies du développement, ne sélectionner que les larves normalement développées pour la xénotransplantation. Comme alternative au traitement chimique, on peut utiliser la souche mutante de poisson-zèbre casper (double mutant nacre et roy orbison), dans laquelle la pigmentation est absente28. - Augmenter la température d’incubation à 29 °C.
- Augmenter la température chaque jour de 1 °C afin que les larves de 3 dpf atteignent 32 °C le jour de l’injection.
- Introduire la N-phénylthiourée (PTU) (0,003% final) dans le milieu 8 h plus tard, pour prévenir la pigmentation de la mélanine et assurer la transparence optique. Gardez le PTU dans le milieu pour le reste du protocole.
- Préparez la plaque de micro-injection.
- Préparer 20 mL d’agarose à 1 % + 0,28 mg/mL de bleu de méthylène avec de l’eau minérale.
- Versez l’agarose dans une boîte de Petri de 10 cm et appliquez rapidement le moule en plastique de micro-injection à l’envers pour créer des tranchées en forme de V de 2,5 mm de large (Figure 2B).
REMARQUE: Le moule en plastique est disponible dans le commerce ou peut être construit en interne selon la conception décrite dans le livre29 du poisson zèbre. - Retirez soigneusement le moule en plastique lorsque l’agarose s’est solidifiée.
REMARQUE: Les plaques moulées à micro-injection peuvent être conservées à 4 ° C jusqu’à 2 mois.
- Préparer les larves pour la xénotransplantation.
- Le jour de l’injection, dépister l’expression du transgène fluorescent sélectionné chez les 3 larves de dpf. Enlevez les animaux non fluorescents et d’apparence anormale.
- Déchorionner les larves manuellement avec des pinces d’horloger à pointe fine. À 3 dpf, percez ou déchirez doucement les chorions avec deux paires de pinces à pointe fine pour libérer les larves du chorion.
REMARQUE: Alternativement, un traitement enzymatique avec la pronase A peut être utilisé pour déchorioner les larves, généralement à 24 hpf. - Maintenir les larves déchorionnées dans un milieu d’eau minérale avec du bleu de méthylène (0,28 mg/mL) et du PTU (0,003 % final).
3. Procédure de xénotransplantation
- Préparez des aiguilles de micro-injection.
- Prenez un capillaire en verre borosilicaté sans filament central et placez-le dans un extracteur d’aiguille vertical.
- En utilisant les réglages suivants - augmenter 8,5 et chauffer 3 - étirer le capillaire pour le transformer en aiguille de micro-injection.
- Configurez le micro-injecteur.
- Charger l’huile minérale dans un micro-injecteur manuel. Enlevez les bulles d’air.
- Branchez un support capillaire universel au micro-injecteur et fixez-le fermement à un micromanipulateur mécanique (Figure 2A).
- Récolter les cellules du glioblastome.
REMARQUE : Les étapes suivantes sont effectuées dans une enceinte de biosécurité BSL2.- Préparez une plaque de 10 cm de cellules de glioblastome afin qu’elles atteignent 80% de confluence le jour de la transplantation.
- (Facultatif) Marquez transitoirement les noyaux cellulaires en ajoutant Hoechst 35480 (200 ng / mL) aux cellules. Incuber pendant 20 min à 37 °C dans l’incubateur cellulaire humidifié et laver 2x avec du PBS.
- Sortez la plaque de cellules de l’incubateur et lavez-la une fois avec du PBS. Détacher les cellules en ajoutant 1 mL de trypsine-EDTA à 0,05 % et en incubant pendant 5 à 10 minutes à 37 °C dans l’incubateur cellulaire jusqu’à ce que toutes les cellules soient complètement détachées.
REMARQUE: Cette étape est essentielle car une mauvaise trypsinisation entraînera le blocage des agrégats cellulaires dans l’aiguille. - Resuspendre les cellules dans 5 mL de milieu cellulaire de glioblastome complet dans un tube à centrifuger de 50 mL. Ajouter 45 ml de PBS glacé et centrifuger à 134 × g pendant 5 min.
- Jeter le surnageant et remettre les cellules en suspension avec 1 mL de PBS glacé en les pipitant de haut en bas soigneusement.
NOTE: Cette étape de dissociation mécanique aide grandement à prévenir le risque de colmatage dans le capillaire lors de la micro-injection. - Ajouter 49 ml de PBS glacé et centrifuger à 134 × g pendant 5 min. Jeter le surnageant et remettre les cellules en suspension dans 200 μL de PBS glacé. Conserver sur de la glace pendant toute la durée de la procédure de transplantation.
- Microinjecter les cellules du glioblastome dans le mésencéphale des larves de poisson zèbre.
- Remplir une plaque moulée de microinjection avec 6 mL de E3-milieu30 complété par 160 mg/L de tricaïne.
- Transférer une douzaine de larves déchorionnées dans la plaque de micro-injection. Une fois qu’ils ne répondent pas au toucher, alignez-les dans les tranchées sur le côté, la tête haute, et le sac vitellin poussé contre le mur de la tranchée, avec un pinceau de taille 00 (Figure 2B,C).
- Remettez les cellules du glioblastome en suspension. Chargez 5 μL de cellules dans le microcapillaire à l’aide d’embouts de microcharge et insérez le capillaire dans le support capillaire universel.
- Placez la plaque de microinjection contenant les larves qui ne répondent pas sous le stéréomicroscope. Placez l’extrémité du microcapillaire sur le bord de la plaque de micro-injection à l’aide des boutons du micromanipulateur. Casser avec un scalpel pour créer un point d’entrée pointu, à peu près de la taille du diamètre d’une cellule.
- Vérifiez que les cellules s’écoulent hors du capillaire en faisant couler doucement de l’huile dans le micro-injecteur et en plongeant l’extrémité de l’aiguille dans le milieu. Concentrez les cellules à l’extrémité du capillaire pour maximiser le nombre de cellules injectées par volume éjecté et éviter de remplir le tissu cérébral avec du PBS (Figure 2C).
- Examinez attentivement les cellules qui sortent du microcapillaire lorsque l’huile est introduite manuellement dans l’injecteur. Définissez empiriquement le tour nécessaire sur le bouton manuel pour fournir 20 à 50 cellules. En règle générale, si les cellules sont suffisamment concentrées, un tour doux suffit pour éjecter ~10 cellules.
REMARQUE: Si le liquide ne s’écoule pas correctement hors du microcapillaire, essayez de desserrer la fixation du microcapillaire dans le support capillaire. Ce faisant, l’huile pourrait fuir et s’égoutter le long du capillaire. - Approchez l’extrémité du capillaire contre le tectum optique gauche (OT), juste au-dessus de la veine cérébrale moyenne (MCeV, Figure 2F).
- Pressez doucement le capillaire contre les larves jusqu’à ce que la membrane cutanée se brise (Figure 2D,E).
REMARQUE: Ne poussez pas trop fort car cela entraînerait l’injection des cellules trop profondément dans le cerveau où la clarté optique inférieure empêchera d’observer les MT en détail. La technique d’imagerie est possible pour une profondeur atteignant 250-300 μm. Cependant, il est recommandé de ne pas injecter à plus de 100 μm de profondeur de la surface du poisson. - Une fois qu’une position appropriée dans l’OT est atteinte, éjectez les cellules. Observez attentivement l’extrémité du capillaire pour visualiser le flux de cellules entrant à l’intérieur de l’animal, assurant ainsi une injection réussie.
REMARQUE : Veillez à ne pas injecter dans les ventricules (Figure 2E). Une fois dans les ventricules, les cellules ont tendance à s’accumuler et à rester coincées au lieu de s’infiltrer dans le tissu (Figure 2I). L’injection ventriculaire est caractérisée par un gonflement intense du cerveau et une dissémination observable des cellules injectées dans le cerveau antérieur et le cerveau postérieur (Figure 2J). - Répétez la procédure des étapes 3.4.9 à 3.4.11 pour autant d’animaux que nécessaire. Procéder rapidement pour éviter l’agglutination des cellules dans le capillaire.
REMARQUE: Selon la vitesse à laquelle l’expérimentateur s’injecte, un changement d’aiguille peut être nécessaire toutes les 10 à 20 larves. - Une fois la xénotransplantation terminée, retirer les larves de la plaque de microinjection et les isoler dans une plaque de 24 puits remplie d’eau de source minérale + PTU + milieu bleu de méthylène.
- Valider la réussite de l’injection en observant les larves sous un stéréomicroscope fluorescent (Figure 2G). Sélectionner uniquement les xénogreffes contenant une seule masse tumorale formée de 20 à 50 cellules situées dans les 200 μm supérieurs (en z) de l’OT (Figure 2H vs injection infructueuse sur la Figure 2I-K).
NOTE: Le rendement des xénogreffes localisées avec succès varie de 10% au début à presque 100% avec la pratique. - Laisser les larves récupérer pendant au moins 4 h à 32 °C avant l’imagerie.
REMARQUE: L’ajout d’antibiotiques dans le milieu n’augmente pas le taux de survie des larves. À ce stade, si la micro-injection a été correctement effectuée, près de 100% des poissons survivent.
4. Imagerie intravitale des xénogreffes de glioblastome
- Montez les larves pour l’imagerie en direct.
REMARQUE: Les larves peuvent être imagées à partir de 4 heures après l’injection (hpi). L’imagerie en direct de la MT est généralement réalisée à partir de 20 hpi, lorsque les cellules GBM invasives ont commencé à étendre les saillies et à migrer loin de la masse tumorale.- Préparer une solution d’agarose à bas point de fusion à 1 %. Transvaser 500 μL de solution d’agarose bouillie à bas point de fusion à 1 % dans un tube à centrifuger de 1,5 mL et laisser refroidir à 37 °C sur un bloc thermique. Ajouter la tricaïne (112 μg/mL) à l’agarose et bien mélanger.
- Transférer une à quatre larves xénogreffées dans une boîte de Petri de 3,5 cm remplie d’eau minérale + PTU + milieu méthylène complété par de la tricaïne (112 μg/mL). Une fois que les larves ne répondent pas au toucher, transférez-les soigneusement dans le tube contenant l’agarose et la tricaïne à l’aide d’une pipette de transfert à pointe fine.
NOTE: Maintenir le volume de milieu au minimum pour limiter la dilution de l’agarose. - Mélangez délicatement les larves avec l’agarose. À l’aide d’une pipette de transfert normale (grande ampoule), placer les larves mélangées dans l’agarose au centre d’une antenne parabolique d’imagerie vidéo à fond de verre de 3,5 cm. Sous un stéréomicroscope, positionnez rapidement les larves sur son dos à l’aide d’une pointe de microchargement pour manipuler le poisson.
REMARQUE: Parce qu’un microscope confocal à disque rotatif inversé est utilisé pour l’imagerie cérébrale intravitale dans ce protocole, les larves sont montées dorsalement. Ajustez le positionnement des larves en conséquence si vous utilisez un microscope confocal vertical. - Enlevez l’agarose supplémentaire pour maintenir la couche d’agarose la plus mince possible. Une fois l’agarose solidifiée, ajouter 2,5 mL d’eau de source minérale + PTU + 0,2x tricaïne (milieu imageur) et passer à l’étape suivante.
- Imagerie in vivo en direct de la dynamique de la MT dans les cellules envahissantes du glioblastome
REMARQUE: La qualité optique des images dépend grandement de la performance du microscope utilisé. Le protocole est écrit pour un microscope confocal à disque rotatif inversé équipé d’une caméra sCMOS (taille des pixels 6,5 μm, 2048 x 2044 pixels), d’un objectif à longue distance de travail et d’une chambre environnementale à température contrôlée.- Placer la boîte d’imagerie vidéo contenant les larves xénogreffées incrustées d’agarose dans la chambre environnementale d’un microscope confocal inversé, à une température réglée à 32 °C. Trouvez les larves dans la parabole d’imagerie vidéo avec un objectif 10x, à l’aide d’une scène XY motorisée.
- Appuyez sur l’ESC pour abaisser la tourelle des objectifs, ajoutez de l’huile minérale sur un objectif d’huile 60x (1,4 NA, distance de travail : 0,13 mm) et appuyez sur ESC pour revenir à la position focale initiale.
- Observez les cellules envahissantes du glioblastome dans le canal rouge (source laser 561 nm, puissance laser de 20 %, temps d’exposition : 200 ms) et sélectionnez une cellule avec un réseau de MT étalé et des filaments de MT facilement discernables (Figure 3B).
- Définissez les paramètres de la série z. À l’aide d’un étage piézoélectrique de 200 μm, sélectionnez les positions supérieure et inférieure du réseau MT : une pile z de 10 à 30 μm de profondeur suffit pour visualiser le réseau de microtubules dans la saillie de la cellule migrante, avec un pas de tranche z de 0,3 μm.
- Définissez les paramètres d’acquisition time-lapse pour permettre un équilibre optimal entre la vitesse d’acquisition, la profondeur de la pile z et le signal fluorescent afin d’éviter un photoblanchiment rapide. Obtenez des images de MT toutes les 5-10 s pendant plusieurs minutes. Acquérir et enregistrer l’hyperpile 5D (x,y,z,t,c).
REMARQUE: Pour éviter les dérives en z lors de l’acquisition, utilisez un microscope équipé d’un système de mise au point parfait comme stabilisation matérielle de la mise au point.
- (Facultatif) Déterminer les effets des agents altérant les microtubules (ATM) sur les MT.
REMARQUE: Les étapes suivantes permettent de tester les effets des MTA sur un réseau de MT dans la migration des cellules de glioblastome en temps réel.- Retirez délicatement le support d’imagerie de l’antenne d’imagerie vidéo. Ne touchez pas le fond du plat, car la position xyz sera perdue.
- Préparer un nouveau milieu d’imagerie contenant le MTA à différentes concentrations. Ajouter doucement le support contenant du MTA dans la parabole d’imagerie vidéo goutte à goutte.
- Acquérir des films à long terme (2-16 h, une image toutes les 10-20 min) pour observer les effets de chaque concentration de MTA sur le réseau de MT et la migration cellulaire (Figure 4A).
- (Facultatif) Lavez l’AMT en retirant doucement le milieu et en ajoutant 2,5 ml de milieu d’imagerie frais sans le MTA. Répétez la procédure de lavage 3x pour éliminer toute trace de MTA dans le milieu.
- (Facultatif) Acquérir un film à long terme similaire à celui de la section 4.3.3 (figure 4B).
REMARQUE : Les étapes ci-dessus déterminent la concentration minimale modifiant le réseau MT sans affecter la survie des larves. Les étapes de lavage définissent si l’effet du médicament est réversible.
- Évaluer l’impact de la MTA sur l’invasion du glioblastome par imagerie séquentielle.
- Suivez les étapes 4.1 à 4.2.1 4 h après la micro-injection.
REMARQUE: Cette partie du protocole peut également être réalisée avec d’autres lignées cellulaires de glioblastome marquées par fluorescence. Idéalement, co-marquer le GBM avec une étiquette cytosolique et une étiquette de noyau pour assurer la détection de la morphologie globale de la cellule. - Passez à un objectif d’eau 40x longue distance (NA: 1,15, WD: 0,6 mm).
- Définissez la gamme z-series pour acquérir la région OT. Acquérir le z-stack à l’aide d’une caméra sCMOS haute sensibilité (taille des pixels 11 μm, 1 200 x 1 200 pixels, efficacité quantique 95%).
REMARQUE: La pile z commence généralement à la partie la plus dorsale de l’OT (près de la surface) et se termine assez profondément dans le cerveau pour inclure toute la masse cellulaire tumorale. - Retirez l’antenne parabolique d’imagerie vidéo du microscope. Libérez les larves de l’agarose à l’aide d’une pointe de microchargement et en piquant doucement l’agarose autour de l’animal.
NOTE: Comme les larves de 3 dpf sont encore très fragiles, soyez prudent lorsque vous les retirez de l’agarose. - Une fois que l’animal est libéré de l’agarose, transférez-le doucement dans un seul puits d’une plaque de 24 puits remplie d’eau de source minérale + bleu de méthylène + milieu PTU. Marquez le puits pour identifier les larves en vue d’une imagerie ultérieure.
- Ajouter l’ATM d’intérêt dans le milieu à la concentration déterminée précédemment (étape 4.3.3). Rafraîchir le milieu complété avec le médicament tous les jours. Répétez la procédure d’imagerie des étapes 4.4.1 à 4.4.5 tous les jours pendant 3-4 jours.
- Suivez les étapes 4.1 à 4.2.1 4 h après la micro-injection.
5. Analyse d’images
- Analysez la dynamique de la traduction automatique avec des plugins FIJI disponibles gratuitement.
NOTE: De nombreuses revues et protocoles décrivent les méthodes d’analyse de la dynamique MT dans les cellules31,32,33,34 et peuvent être appliqués à ce stade. Ce protocole fera brièvement référence à deux méthodes pour mesurer les propriétés dynamiques de base de la traduction automatique.- Ouvrez l’hyperpile 5D et générez une pile 4D où les z-slices ont été projetées dans un seul plan pour créer une projection d’intensité maximale (MIP) en z (Image | Piles | Projet Z | Intensité maximale) (figure 3B).
- Ouvrez la pile MIP 4D et suivez manuellement la fin d’une traduction automatique basée sur la saillie à l’aide de la fonction de suivi manuel dans FIJI (Plugins | Suivi | Suivi manuel). (Figure 3D). Extrayez les paramètres de la dynamique MT tels que la vitesse de croissance, la vitesse de retrait, la fréquence de sauvetage et la fréquence des catastrophes.
- Vous pouvez également tracer une ligne segmentée de 10 pixels de large le long de la MT à analyser (Figure 3B). Utilisez la fonction Multi Kymograph (Analyser | Multi Kymographe) (Figure 3C) dans FIJI. Observez et mesurez les phases de croissance de la MT (G), la durée des pauses (P) et la fréquence des catastrophes de MT.
- Analyse de l’invasion à long terme du glioblastome
REMARQUE: Cette analyse nécessite l’utilisation de la visualisation et de l’analyse 4D avec un logiciel de bioimagerie.- Convertissez la pile z 4D brute de l’étape 4.4.3 (4 hpi) dans le format logiciel approprié, à l’aide du logiciel File Converter.
- Ouvrez le logiciel et importez le fichier z-stack converti dans la vue Surpass (Figure 5A).
- Pour segmenter les cellules tumorales et éliminer l’autofluorescence non pertinente dans le canal rouge, cliquez sur Ajouter de nouvelles surfaces et suivez le processus en 5 étapes.
- Validez les paramètres par défaut en cliquant sur la flèche suivante une fois que la fenêtre apparaît. Passez à l’étape 2/5.
REMARQUE: Si le signal fluorescent est acquis dans le canal 561, l’autofluorescence de la pigmentation résiduelle dans l’œil peut être forte et modifier le processus de segmentation automatique. Ceci est problématique si la xénogreffe est située près de l’œil. Dans ce cas, la segmentation doit être terminée manuellement en coupant et en supprimant les signaux de cellules autres que le glioblastome. - Accédez à Canal source | canal 561. Lissez l’image (filtre gaussien) en ajoutant 1,50 μm dans Détails des surfaces et en ajoutant 2,5 μm pour le diamètre des sphères dans l’arrière-plan Soustraire. Cliquez sur la flèche suivante et passez à l’étape 3/5.
- En fonction de l’intensité du signal, ajustez manuellement le seuil (soustraction d’arrière-plan) pour inclure chaque processus cellulaire. Passez à l’étape 4/5.
- Filtrez le signal segmenté en supprimant les événements qui ne représentent pas une partie d’une cellule (par exemple, les débris, l’autofluorescence). Cliquez sur Type de filtre | volume et ajustez le seuil manuellement pour exclure tous les événements sous le plus petit volume représentant une partie d’une cellule. Passez à l’étape 5/5.
REMARQUE: Si les signaux d’autofluorescence sont plus volumineux que la plus petite partie de cellule, procédez quand même et supprimez manuellement les signaux indésirables en cliquant avec le bouton gauche de la souris et en les supprimant . - Supprimez l’étape de classification et terminez l’assistant de segmentation en cliquant sur la double flèche verte pour terminer la création d’une vue de surface des cellules tumorales (Figure 5B).
- Validez les paramètres par défaut en cliquant sur la flèche suivante une fois que la fenêtre apparaît. Passez à l’étape 2/5.
- Si les cellules segmentées ne se touchent pas et ne forment pas un objet unique, fusionnez-les artificiellement pour créer un objet de masse de cellules tumorales. En bref, cliquez sur Statistiques | des valeurs détaillées | spécifiques | volume. Sélectionnez tous les événements en cliquant avec le bouton gauche de la souris sur celui du haut, puis en maintenant la touche Maj enfoncée et en cliquant avec le bouton gauche sur le dernier. Naviguez pour modifier | sélection | unifier.
- Définir le centroïde de la masse cellulaire tumorale. Cliquez sur Ajouter de nouveaux spots | Ignorer la création automatique | Ajouter (le curseur croise avec) | Centre de l’objet. Maintenez la touche Maj enfoncée et faites un clic gauche pour créer la tache , qui est le centroïde de la masse cellulaire tumorale segmentée.
- Mesurer la distance 3D entre chaque cellule GBM et le centroïde de la masse tumorale. Pour ce faire, créez une distance au canal centroïde en restant sur la vue Spot et en sélectionnant l’icône de l’outil | Transformation de distance. Attendez qu’une nouvelle distance au canal centroïde soit créée, à côté du canal 488 et du canal 561 (en bleu, Figure 5C).
REMARQUE: L’intensité de chaque voxel dans ce canal correspond à la distance 3D entre le voxel et le centroïde de la masse cellulaire tumorale. - Mesurez la distance 3D au centroïde de chaque cellule segmentée en cliquant sur Ajouter de nouveaux spots | Ignorer la création automatique | Ajouter (le curseur croise avec) | Canal spécifique 561. Maintenez la touche Maj enfoncée et faites un clic gauche sur la zone du noyau cellulaire. Effectuez cette tâche pour chaque cellule (Figure 5D).
Remarque : Supprimez la vue Surface pour mieux apprécier le signal de fluorescence des cellules. Alternativement, le cas échéant, utilisez le signal du noyau (signal de 405 nm ou 647 nm) pour une meilleure précision. - Cliquez sur Statistiques | | détaillées Valeurs spécifiques | intensité moyenne Ch=distance au centroïde.
REMARQUE: La valeur de l’intensité est la distance 3D en μm entre la zone du noyau cellulaire et le centroïde. - Faites la moyenne de ces intensités pour calculer le rayon de la masse tumorale à 4 hpi. Répétez la procédure pour chaque point temporel de l’analyse (24 hpi, 48 hpi et 72 hpi).
REMARQUE: Ne mesurez que les 10 ou 20 cellules les plus disséminées pour éviter de sous-estimer l’invasion cellulaire. En effet, le compactage forcé des cellules lors de l’injection peut empêcher les cellules situées au centre de la masse tumorale de migrer. - Calculer l’indice d’invasion (II) comme le rapport entre les distances 3D moyennes à t = 24 hpi/48 hpi/72 hpi des cellules les plus disséminées sur le rayon moyen de la masse tumorale à t = 4 hpi (Figure 5E).
Résultats
Pour analyser le rôle joué par les MT lors de l’invasion in vivo du GBM, nous décrivons ici les principales étapes pour effectuer un marquage MT stable dans les cellules GBM par infection lentivirale, la xénotransplantation orthotopique de cellules GBM chez 3 larves de poisson-zèbre dpf, l’imagerie intravitale à haute résolution de la dynamique MT, le traitement MTA et ses effets sur l’invasion GBM, et l’analyse d’images de la dynamique MT et de l’invasion in vivo (Figure 1). La dynamique de la traduction automatique est mesurée soit en construisant des kymographes le long des magnétogrammes croissants et rétrécissants (figure 3C), soit en suivant manuellement les arêtes individuelles de la traduction automatique au fil du temps (figure 3D). Un exemple de traitement médicamenteux administré dans le milieu larvaire et son effet réversible sur l’organisation du réseau de MT est donné à la figure 4. Le traitement par une faible dose de nocodazole (200 nM) entraîne un rétrécissement progressif du réseau de MT et la disparition de la saillie des cellules du glioblastome 4 h plus tard (Figure 4A). Le lavage du médicament a restauré la capacité des cellules de glioblastome à former des protubérances. Les cellules ont repris leur migration le long du système vasculaire 12 h après le lavage (Figure 4B). Ces données suggèrent que le traitement par 200 nM de nocodazole est suffisant pour perturber le réseau de MT et bloquer rapidement l’invasion cellulaire in vivo du glioblastome. Une analyse de 3 jours du même traitement sur l’invasion cellulaire globale du glioblastome révèle que le nocodazole 200 nM arrête l’invasion cellulaire du glioblastome à long terme in vivo, sans affecter la santé générale du poisson, par rapport à un témoin (Figure 4C).
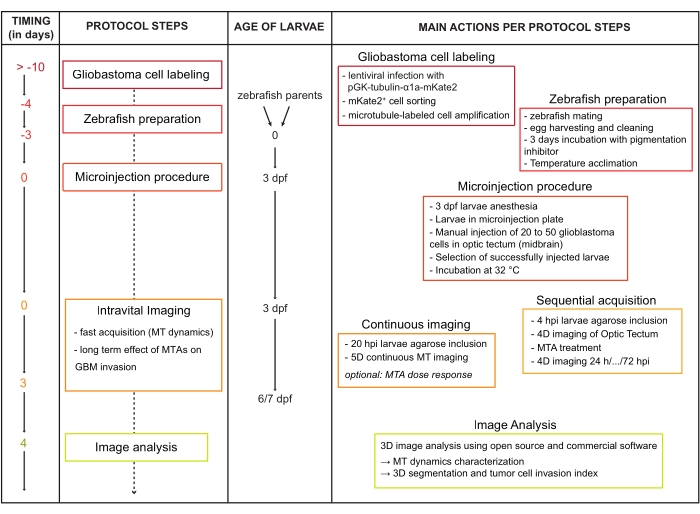
Figure 1 : Diagramme de flux de travail de protocole. Abréviations : dpf = jours après la fécondation; IPH = heures après l’injection; MT = microtubule; MTA = agent altérant les microtubules; GBM = glioblastome multiforme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
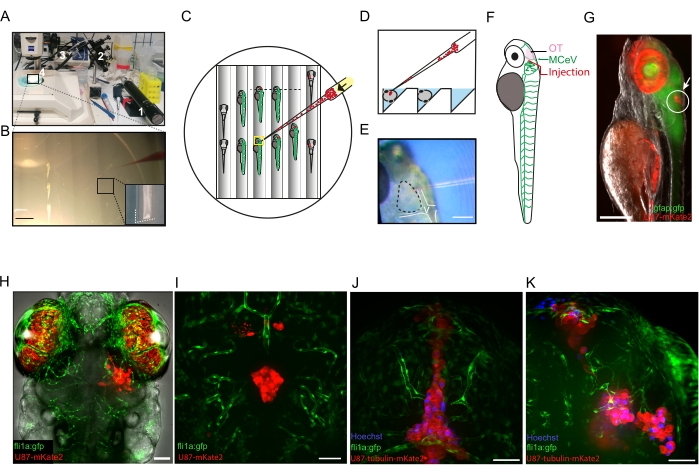
Figure 2 : Microinjection de cellules de glioblastome dans le cerveau de 3 larves de poisson zèbre dpf. A) Photographie du matériel utilisé pour la xénotransplantation : 1, micro-injecteur d’huile; 2, micromanipulateur mécanique; 3, support capillaire universel; 4, capillaire en verre. La plaque de micro-injection est sous stéréomicroscope. (B) Photographie montrant 3 larves de poisson-zèbre anesthésiées dfp alignées dans une tranchée et prêtes à être microinjectées. La pointe d’un microcapillaire chargé d’un colorant rouge est visible à droite de la photographie. Les détails des tranchées à motifs construites dans la plaque d’agarose sont visibles dans l’encart dans le coin inférieur droit. Barre d’échelle = 3 mm. (C) Schéma d’une plaque de microinjection représentative. Les larves prêtes à être injectées sont placées latéralement (centre de la plaque). Notez que les cellules sont concentrées à l’extrémité du microcapillaire (flèche noire) avant de procéder à l’injection. Les larves injectées sont montrées à droite de la plaque, placées ventralement. (D) Schéma d’une tranche transversale dans la plaque de micro-injection (le long de la ligne pointillée noire en C) montrant les tranchées où les larves sont placées pendant l’injection. (E) Photographie montrant l’extrémité du capillaire prête à pénétrer le tectum optique (ligne pointillée). Les ventricules sont délimités par les lignes blanches. Barre d’échelle = 150 μm. (F) Schéma d’une larve de 3 dpf fli1a:gfp exprimant gfp dans les cellules endothéliales, indiquant la région OT où les cellules sont injectées, juste au-dessus de la veine cérébrale moyenne. (G) Image de fluorescence d’une larve gfap:gfp de 3 dpf (gfp exprimée en cellules souches neurales) placée latéralement après micro-injection de cellules U87-mkate2 (cercle blanc et flèche blanche). Une autofluorescence élevée en rouge est causée par les iridophores dans les yeux. Barre d’échelle = 100 μm. (H) Image confocale de fluorescence d’une larve fli1a:GFP injectée avec succès à 16 hpi. Barre d’échelle: 50 μm. (I-K) Images confocales de fluorescence de larves fli1a:gfp injectées sans succès à 96 hpi (I) et 4 hpi (J,K). Des cellules GBM ont été injectées dans des ventricules (I, J) ou dans plusieurs foyers du cerveau (K). Barres d’échelle = 50 μm. Abréviations : dpf = jours après la fécondation; OT = tectum optique; MCeV = veine cérébrale moyenne; GFP = protéine fluorescente verte; GFAP = protéine acide fibrillaire gliale; IPH = heures après l’injection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
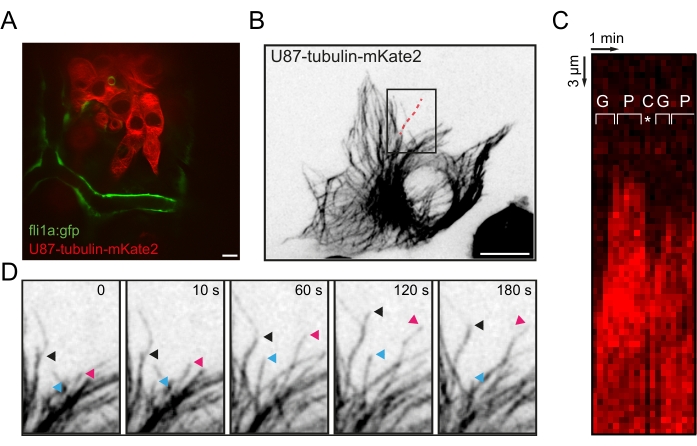
Figure 3 : Visualisation de la dynamique des microtubules in vivo dans les cellules de glioblastome. (A) Image de fluorescence représentative de cellules U87 xénogreffées exprimant la tubuline-α1-mkate2 dans l’OT d’une larve de poisson-zèbre fli1a:GFP à 20 hpi. (B) Image de fluorescence projetée à intensité maximale du réseau MT dans une seule cellule U87 xénogreffée. (C) Kymographe le long de la ligne pointillée rouge en B, montrant les phases de croissance, de pause et de catastrophe de l’instabilité dynamique MT. (D) Séquence accélérée de la région encadrée en B mettant en évidence le suivi de trois extrémités MT +. Barres d’échelle = 10 μm. Abréviations : OT = tectum optique; GFP = protéine fluorescente verte; IPH = heures après l’injection; MT = microtubule; G = phase de croissance; P = phase de pause; C = phase de catastrophe. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Visualisation des effets de l’agent altérant les microtubules sur l’invasion du glioblastome in vivo. (A) Séquence accélérée de cellules U87 exprimant la tubuline-α1a-mkate2 chez des larves de poisson zèbre traitées au nocadazole (200 nM). Les flèches pointent vers l’extrémité de la saillie dans deux cellules différentes envahissant le cerveau le long d’un vaisseau sanguin. Notez la rétraction de la saillie lors du traitement par le nocodazole. Barre d’échelle = 10 μm. (B) Séquence accélérée représentant l’effet du lavage du nocodazole sur l’invasion cellulaire U87. 500 min après le lavage, la cellule marquée de l’astérisque blanc allonge une saillie à base de MT (flèche blanche), ce qui permet sa reprise de l’invasion le long d’un vaisseau sanguin. Barre d’échelle = 20 μm. (C) Représentations 3D d’un cerveau de larves xénogreffées traitées au DMSO ou au nocodazole (200 nM) pendant 72 h. Le signal des cellules U87 a été segmenté (en rouge) et intégré au signal de fluorescence fli1a-GFP (en blanc). Notez la diminution de la dissémination des cellules U87 traitées au nocodazole. Barre d’échelle = 30 μm. Abréviations : GFP = protéine fluorescente verte; IPH = heures après l’injection; MT = microtubule. Veuillez cliquer ici pour voir une version agrandie de cette figure.
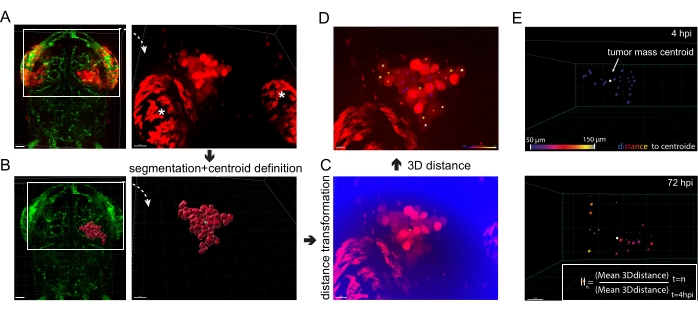
Figure 5 : Analyse de l’image de l’invasion in vivo du glioblastome. (A) Images fluorescentes de cellules U87 xénogreffées exprimant mKate2 cytosolique chez des larves de poisson-zèbre fli1a-GFP, 4 hpi. Des astérisques blancs soulignent l’autofluorescence typique des iridophores oculaires. Barre d’échelle = 40 μm. (B) Image fluorescente des larves fli1a-GFP couplées à la surface segmentée correspondant au signal des cellules U87 dans A. Le centroïde de la masse tumorale apparaît vert. Barre d’échelle = 40 μm. (C) Image fluorescente représentant le signal du canal rouge en A et le canal nouvellement défini « distance au centroïde » (en bleu). Barre d’échelle = 30 μm. (D) Image de fluorescence du canal rouge superposée à des taches colorées, dont la couleur représente la distance de la cellule au centroïde (en vert), le violet étant le plus proche du centroïde et le blanc étant le plus éloigné. Barre d’échelle = 20 μm. (E) Un exemple d’analyse séquentielle de l’invasion mondiale du GBM. Les distances 3D sont déterminées à 4 hpi et 72 hpi, et l’indice d’invasion (II) est calculé selon la formule dans la boîte de réception. Barre d’échelle = 20 μm. Abréviations : GFP = protéine fluorescente verte; IPH = heures après l’injection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’imagerie des xénogreffes tumorales à une résolution unicellulaire est susceptible de devenir un outil indispensable pour améliorer notre compréhension de la biologie du GBM. L’imagerie en direct dans des modèles PDX murins a conduit à des découvertes précieuses sur la façon dont le GBM envahit collectivement le tissu cérébral18. Cependant, à ce jour, la résolution spatio-temporelle n’est pas assez élevée pour révéler la dynamique des protéines contrôlant l’invasion du GBM. Nous avons estimé qu’en couplant l’engendrement orthotopique des cellules GBM dans les larves de poisson-zèbre transparent avec l’imagerie intravitale à haute résolution, les protéines cytosquelettiques telles que les MT pourraient être analysées suffisamment en détail pour analyser leur dynamique lors de l’invasion in situ du GBM.
Les étapes critiques de la méthodologie résident dans la préparation des cellules GBM et la procédure de micro-injection. Les cellules malsaines et insuffisamment dissociées colleront ensemble ou aux bords capillaires et bloqueront le flux d’injection. De plus, les cellules doivent être suffisamment concentrées dans le capillaire pour minimiser le volume injecté et les implanter en vrac. L’injection d’un volume plus élevé de cellules plus diluées entraînera des foyers tumoraux multiples, parfois mélangés, dont les indices invasifs deviennent difficiles à mesurer. Dans nos mains, la manipulation manuelle du micro-injecteur à base d’huile permet un meilleur contrôle du débit d’injection qu’un micro-injecteur électronique à base d’air sous pression qui a été utilisé précédemment dans un modèle similaire19. Ceci est essentiel pour prévenir l’excès de pression d’écoulement à l’intérieur du cerveau, évitant ainsi les lésions tissulaires ultérieures et l’agrégation ventriculaire des cellules injectées.
Certaines limites de ce modèle incluent la nécessité d’effectuer l’expérience à des températures sous-optimales pour les deux espèces. Le poisson zèbre est généralement élevé à 28 °C, tandis que les cellules humaines sont cultivées à 37 °C. Au-dessus de 32 °C, le développement embryonnaire du poisson zèbre est altéré et ces changements peuvent être mortels35. Cependant, à l’instar de ce qui se fait dans les modèles de xénogreffe de poisson zèbre adulte 36, l’acclimatation séquentielle séquentielle des larves de poisson zèbre à une température de 32 °C augmente la survie des animaux transplantés par rapport au changement rapide de température après la transplantation de 28 °C à32 °C. Cependant, l’augmentation de la température entraîne une augmentation de la mortalité animale en fonction de la sensibilité des embryons de poisson zèbre à des températures supérieures à 32 °C35.
L’interprétation des données de dynamique MT in vivo doit être effectuée avec prudence car la dynamique MT change lorsque la température descend en dessous de 37 °C37. La mesure in vitro parallèle de la dynamique MT à 37 °C et 32 °C dans les mêmes cellules GBM avec le même traitement MTA aidera à valider les différences observées entre diverses cellules GBM ou entre les traitements in vivo . Elle devrait aider à confirmer que les différences ne sont pas causées par une variation de la sensibilité à la température, mais par différentes voies de régulation (pour l’analyse comparative du GBM) ou par le traitement par ATM (pour l’analyse de l’effet de l’ATM). Cela sera intéressant si les hétérogénéités de la dynamique de la MT sont liées à différentes capacités d’invasion.
Une autre limitation est la courte fenêtre temporelle pendant laquelle l’invasion peut être surveillée (72 à 96 h), empêchant la mesure de la plasticité de l’invasion entraînée par les changements potentiels de la dynamique MT38. Après 96 h, nous avons remarqué une forte diminution de l’invasion des cellules GBM. 6 jours après l’injection, le nombre de cellules GBM a diminué rapidement, probablement en raison d’une réponse immunitaire de l’hôte causée par l’accumulation de neutrophiles et de macrophages dans le microenvironnement tumoral39. L’administration de MTA à l’ensemble du cerveau est susceptible d’affecter les cellules hôtes neuronales voisines, qui dépendent des MT pour leur activité et dont l’altération pourrait par la suite affecter l’invasion du GBM40. Cette approche doit être complétée par des tests shRNA ou optogénétiques limitant l’altération de la MT aux cellules GBM, mais reste une bonne plate-forme pour dépister de nouveaux composés anti-invasifs.
L’injection orthotopique de cellules GBM marquées MT dans le cerveau du poisson zèbre est particulièrement intéressante pour déchiffrer le rôle des MT lors de l’invasion des cellules cancéreuses, car très peu de modèles animaux permettent l’imagerie subcellulaire in situ de la migration des cellules cancéreuses dans leur tissu d’origine15. À ce jour, les études des fonctions de MT pendant la migration du GBM reposent principalement sur des essais in vitro et ex vivo et manquent de validation in vivo 24,41,42,43. Couplé à l’élimination des gènes d’intérêt ou à une approche de criblage non biaisée basée sur les gènes, le test présenté ici aidera à révéler de nouveaux régulateurs de MT qui sont importants pour l’invasion du GBM in vivo.
Les GBM sont des tumeurs très hétérogènes dont les propriétés invasives diffèrent grandement d’un spécimen à l’autre44. Comprendre les mécanismes moléculaires sous-jacents à leurs différents modes d’invasion aidera à définir des traitements thérapeutiques ad hoc pour bloquer la dissémination du GBM. La mesure systématique de l’indice invasif, du mode d’invasion et des propriétés du cytosquelette telles que la dynamique de la MT dans divers échantillons de GBM révélera de nouvelles corrélations entre les profils mutationnels génomiques fréquents et les modèles d’invasion cellulaire reposant sur des propriétés cytosquelettiques spécifiques. Révéler comment ces mutations affectent le changement de la dynamique de la MT ajouterait non seulement à nos connaissances sur la régulation de la MT pendant la migration cellulaire45,46, mais pourrait également conduire à des thérapies anti-invasives spécifiques au patient attendues depuis longtemps.
La facilité relative de micro-injection chez le poisson zèbre combinée au nombre élevé de larves disponibles et à la facilité d’injection de médicaments rendent cette procédure adaptée à la médecine personnalisée47,48. De plus, contrairement à l’imagerie intravitale des xénogreffes GBM chez la souris, qui ne se produit que dans la partie supérieure de 500 μm du cortex49,50, l’utilisation du poisson zèbre permet de visualiser l’infiltration du GBM dans l’ensemble du SNC. Le modèle présenté ici répond aux critères pour devenir un outil précieux pour l’analyse rapide des capacités invasives du glioblastome et de sa réponse aux traitements.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous sommes extrêmement reconnaissants au Dr P. Herbomel (Institut Pasteur, France) et à son laboratoire, en particulier Valérie Briolat et Emma Colucci-Guyon de nous avoir fourni les lignes de poisson zèbre et le moule en plastique pour les plaques de micro-injection, et pour leur précieuse expertise sur les procédures expérimentales du poisson zèbre. Nous remercions l’UtechS Photonic BioImaging (C2RT), Institut Pasteur, soutenu par l’Agence Nationale de la Recherche France BioImaging Français, et ANR-10-INBS-04 ; investissements pour l’avenir). Ce travail a été soutenu par la Ligue contre le cancer (EL2017. LNCC), le Centre National de la Recherche Scientifique, et l’Institut Pasteur et par les généreux dons de Mme Marguerite MICHEL et M. Porquet.
matériels
| Name | Company | Catalog Number | Comments |
| Glioblastoma cell culture | |||
| Foetal calf serum | Eurobio | CVFSVF00-01 | Reagent |
| MEM NEAA | Gibco | 11140-050 | Reagent |
| Modified Eagle's medium | Eurobio | CM1MEM18-01 | Reagent |
| Penicillin–streptomycin | Gibco | 15140-122 | Reagent |
| U-87 MG | ECACC | 89081402-1VL | Cells |
| Lenitivirus production | |||
| BD FACSAria III | BD bioscience | Instrument | |
| BD FACSDiva software v8.0 | BD bioscience | Software | |
| HEK-293T | Merck | 12022001 | Cells |
| pMD2.G | Addgene | Plasmid #12259 | Reagent |
| psPAX2 | Addgene | Plasmid #12260 | Reagent |
| Ultracentrifuge Optima XPN-80 | Beckman Coulter | Instrument | |
| Cell passaging and staining | |||
| dPBS | Gibco | 14190-094 | Chemical |
| Hoechst 34580 | Sigma-Aldrich | 63493 | Chemical |
| Trypsin-EDTA (0,05%) | Gibco | 25300-054 | Reagent |
| Zebrafish husbandry | |||
| Fluorescence stereomicroscope LEICA M165FC | LEICA | https://www.leica-microsystems.com/fr/produits/stereomicroscopes-et-macroscopes/informations-detaillees/leica-m165-fc/ | Instrument |
| Methylene Blue hydrate | Sigma-Aldrich | M4159 | Chemical |
| N-Phenylthiourea (PTU) | Sigma-Aldrich | P7629-25G | Chemical |
| Transfer Pipettes fine tips | Samco Scientific | 232 | Equipment |
| Transfer Pipettes Large Bulb3mL | Samco Scientific | 225 | Equipment |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | Cat#: A5040 | Chemical |
| Volvic Source Water | DUTSCHER DOMINIQUE SAS | 999556 | Reagent |
| Xenotransplantation | |||
| 24-well plate | TPP | 92024 | Equipment |
| Borosilicate glass capillaries (1.0 ODx0.58IDx150L mm) | Harvard Apparatus | (#30-0017 GC100-15 | Equipment |
| CellTram oil vario microinjector | Eppendorf | 5176000.025 | Instrument |
| Microloading pipet tips (Microloader) 20µL | Eppendorf | 5242956003 | Equipment |
| Micromanipulator | NARISHIGE | https://products.narishige-group.com/group1/injection/english.html | Equipment |
| Mineral Oil | Sigma | M8410-100ml | Equipment |
| Stereomicroscope | Olympus | KL 2500 LCD | Instrument |
| Universal capillary holder | Eppendorf | 5176190002 | Equipment |
| Vertical Pipette puller | KOPF (Roucaire) | Model 720 | Instrument |
| Intravital Imaging | |||
| 3.5cm glass-bottom videoimaging dish | MatTek Life Sciences, MA, USA | P35G-1,5-14-C | Equipment |
| Acquisition software: NIS-Elements-AR version 5.21 | Nikon | Software | |
| Heat-Block | Techne | DRI-BLOCK DB-2D | Equipment |
| Microscope head Nikon Ti2E | Nikon | Instrument | |
| sCMOS camera Prime 95B | Photometrics | Instrument | |
| sCMOS camera Orca Flash 4 | Hammatsu | Instrument | |
| Ultrapure Low melting point agarose | Invitrogen | 16520-050 | Chemical |
| Yokagawa CSU-W1 spinning disk unit | Hammatsu | Instrument | |
| Drug Treatment | |||
| DMSO | Sigma-Aldrich | D2650-100ML | Chemical |
| Nocodazole | Sigma-Aldrich | M1404-2MG | Chemical |
| Image Analysis | |||
| Imaris 9.5.1 software | Oxford Instruments | Software | |
| ImarisFileConverter 9.5.1 | Oxford Instruments | Software |
Références
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112 (4), 453-465 (2003).
- Etienne-Manneville, S. Microtubules in cell migration. Annual Review of Cell and Developmental Biology. 29, 471-499 (2013).
- Bouchet, B. P., Akhmanova, A. Microtubules in 3D cell motility. Journal of Cell Science. 130 (1), 39-50 (2017).
- Seetharaman, S., et al. Microtubules tune mechanosensitive cell responses. Nature Materials. 21 (3), 366-377 (2022).
- Etienne-Manneville, S. From signaling pathways to microtubule dynamics: the key players. Current Opinion in Cell Biology. 22 (1), 104-111 (2010).
- Garcin, C., Straube, A. Microtubules in cell migration. Essays in Biochemistry. 63 (5), 509-520 (2019).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Nature editorial. The 'war on cancer' isn't yet won. Nature. 601 (297), (2022).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331 (6024), 1559-1564 (2011).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Clark, A. G., Vignjevic, D. M. Modes of cancer cell invasion and the role of the microenvironment. Current Opinion in Cell Biology. 36, 13-22 (2015).
- Meyer, A. S., et al. 2D protrusion but not motility predicts growth factor-induced cancer cell migration in 3D collagen. Journal of Cell Biology. 197 (6), 721-729 (2012).
- Bouchet, B. P., et al. Mesenchymal cell invasion requires cooperative regulation of persistent microtubule growth by SLAIN2 and CLASP1. Developmental Cell. 39 (6), 708-723 (2016).
- Luthria, G., et al. In vivo microscopy reveals macrophage polarization locally promotes coherent microtubule dynamics in migrating cancer cells. Nature Commun. 11 (1), 3521(2020).
- Wen, P. Y., Kesari, S. Malignant gliomas in adults. New England Journal of Medicine. 359 (5), 492-507 (2008).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments. (86), e55108(2014).
- Osswald, M., et al. Brain tumour cells interconnect to a functional and resistant network. Nature. 528 (7580), 93-98 (2015).
- Astell, K. R., Sieger, D. Investigating microglia-brain tumor cell interactions in vivo in the larval zebrafish brain. Methods in Cell Biology. , 593-626 (2017).
- Zeng, A., et al. Identify a blood-brain barrier penetrating drug-TNB using zebrafish orthotopic glioblastoma xenograft model. Scientific Reports. 7 (1), 14372(2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Disease Models & Mechanisms. 9 (9), 1063-1065 (2016).
- Umans, R. A., Ten Kate, M., Pollock, C., Sontheimer, H. Fishing for contact: modeling perivascular glioma invasion in the zebrafish brain. ACS Pharmacology & Translational Science. 4 (4), 1295-1305 (2021).
- Lee, J. H., et al. Human glioblastoma arises from subventricular zone cells with low-level driver mutations. Nature. 560 (7717), 243-247 (2018).
- Pagano, A., et al. Epothilone B inhibits migration of glioblastoma cells by inducing microtubule catastrophes and affecting EB1 accumulation at microtubule plus ends. Biochemical Pharmacology. 84 (4), 432-443 (2012).
- Berges, R., et al. The novel tubulin-binding checkpoint activator BAL101553 inhibits EB1-dependent migration and invasion and promotes differentiation of glioblastoma stem-like cells. Molecular Cancer Therapeutics. 15 (11), 2740-2749 (2016).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Volvic source water mineral composition. Volvic. , Available from: https://www.volvic.co.uk/volcanic-water/composition (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Brachydanio rerio). The University of Oregon Press, Eugene. , Chapter 5 (2000).
- E3, M. Recipe E3 medium (for zebrafish embryos. , Cold Spring Harbor Protocols. (2011).
- Straube, A. How to measure microtubule dynamics. Methods in Molecular Biology. 777, 1-14 (2011).
- Honore, S., Braguer, D. Investigating microtubule dynamic instability using microtubule-targeting agents. Methods in Molecular Biology. 777, 245-260 (2011).
- Movsisyan, N., Pardo, L. A. Measurement of microtubule dynamics by spinning disk microscopy in monopolar mitotic spindles. Journal of Visualized Experiments. (153), e60478(2019).
- Serikbaeva, A., Tvorogova, A., Kauanova, S., Vorobjev, I. A. Analysis of microtubule dynamics heterogeneity in cell culture. Methods in Molecular Biology. 1745, 181-204 (2018).
- Schnurr, M. E., Yin, Y., Scott, G. R. Temperature during embryonic development has persistent effects on metabolic enzymes in the muscle of zebrafish. Journal of Experimental Biology. 217 (8), 1370-1380 (2014).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Translational Oncology. 14 (1), 100899(2021).
- Hamilton, L., Astell, K. R., Velikova, G., Sieger, D. A zebrafish live imaging model reveals differential responses of microglia toward glioblastoma cells in vivo. Zebrafish. 13 (6), 523-534 (2016).
- Gillespie, S., Monje, M. An active role for neurons in glioma progression: making sense of Scherer's structures. NeuroOncology. 20 (10), 1292-1299 (2018).
- Wolf, K. J., et al. A mode of cell adhesion and migration facilitated by CD44-dependent microtentacles. Proceedings of the National Academy of Sciences. 117 (21), 11432-11443 (2020).
- Zhou, Y. X., et al. Transcriptional upregulation of microtubule-associated protein 2 is involved in the protein kinase A-induced decrease in the invasiveness of glioma cells. Neuro-Oncology. 17 (12), 1578-1588 (2015).
- Monzo, P., et al. Mechanical confinement triggers glioma linear migration dependent on formin FHOD3. Molecular Biology of the Cell. 27 (8), 1246-1261 (2016).
- Vollmann-Zwerenz, A., Leidgens, V., Feliciello, G., Klein, C. A., Hau, P. Tumor cell invasion in glioblastoma. International Journal of Molecular Science. 21 (6), 1932(2020).
- Feng, H., et al. EGFRvIII stimulates glioma growth and invasion through PKA-dependent serine phosphorylation of Dock180. Oncogene. 33 (19), 2504-2512 (2014).
- Liu, R., et al. Cdk5-mediated regulation of the PIKE-A-Akt pathway and glioblastoma cell invasion. Proceedings of the National Academy of Sciences. 105 (21), 7570-7575 (2008).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trends in Cancer. 6 (7), 569-579 (2020).
- Baxendale, S., van Eeden, F., Wilkinson, R. The power of zebrafish in personalised medicine. Personalised Medicine: Lessons from Neurodegeneration to Cancer. 1007, 179-197 (2017).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Stanchi, F., Matsumoto, K., Gerhardt, H. Imaging glioma progression by intravital microscopy. Methods in Molecular Biology. 1862, 227-243 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon