Method Article
ライブセルにおけるeIF4E-eIF4G相互作用を測定してeIF4Fアセンブリをモニタリング
要約
ここでは、スクリーニングフォーマットにおけるeIF4F複合ダイナミクスの薬物誘発摂動を評価することを可能にする生細胞におけるeIF4E-eIF4G相互作用を測定するプロトコルを提示する。
要約
eIF4F複合体の形成は、ヒトにおいてしばしば発癌活性化を受けるシグナル伝達経路の収束のための主要な下流節であることが示されている。eIF4Fは、翻訳開始のmRNA-リボソーム採用段階に関与するキャップ結合複合体である。多くの癌の細胞および前臨床モデルにおいて、eIF4Fの調節緩和は癌の増殖および生存に関与する特定のmRNAサブセットの翻訳の増加をもたらす。eIF4Fは、キャップ結合サブユニットeIF4E、ヘリケースeIF4Aおよび足場サブユニットeIF4Gから構築されたヘテロ三量体複合体である。活性eIF4F複合体の組み立てに重要なのは、eIF4EとeIF4Gタンパク質のタンパク質間相互作用です。この記事では、ライブセルにおけるeIF4E-eIF4G相互作用の状態を監視するeIF4Fアセンブリを測定するプロトコルについて説明します。eIF4e:4G細胞タンパク質-タンパク質相互作用アッセイは、eIF4F複合体完全性における薬物誘発変化を正確かつ確実に評価することを可能にします。この方法は、市販の化合物の活性を検証したり、eIF4F複合体の形成を効率的に妨害する新規化合物やモダリティのさらなるスクリーニングに応用できると考えています。
概要
遺伝子発現の制御は、増殖増殖や分化などの細胞プログラムの正しい実行において極めて重要な役割を果たす。調節制御機構は、遺伝子転写のレベルまたはmRNA翻訳のレベルで発揮することができます。過去10年間で、伸びと終了の後半のステップではなく、開始プロセスの変調による翻訳制御が、幅広い生物学的機能を果たすタンパク質の特定のサブセットの合成を細かく調節できることがますます明らかになりました。
生存に関与するmRNAの翻訳の増加は、抗オートファジーおよび抗アポトーシス応答がいくつかの癌に関与しており、また、異常活性化または翻訳開始因子1の発現を介して関連している。
eIF4F複合体は翻訳開始のマスターレギュレータです。5'mRNA末端にキャップ構造を結合することにより、eIF4Fは、初期mRNA-リボソームの採用を推進し、今度は弱く翻訳された真核生物mRNA2のmRNA翻訳効率を高めている。EIF4Fは、RAS/MAPKまたはAKT/TOR経路の異常活性化を有する多くの癌モデルに対して癌関連mRNAの媒介翻訳が報告されており、癌細胞が独自の腫瘍性腫瘍性活性を高めるためにeIF4Fをアップレコンドすることを示唆している。eIF4F複合体形成を阻害することによってこのフィードフォワードループの破壊は、これにより非常に有望な治療戦略3、4である。
eIF4F複合体は、(i)eIF4E、mRNAの5'UTRで見つかったキャップ構造と相互作用するeIF4Fのキャップ結合サブユニット、(ii)eIF4A、RNAヘリカーゼおよび(iii)eIF4G、eIF4AおよびeIF4Eの両方と相互作用し、最終的に40SSサブユニットを募集する足場タンパク質からなる。eIF4GとeIF4Eとの会合は、機能的eIF4F複合体の組み立てのためのレート制限ステップであり、eIF4E結合タンパク質(4EbPs、メンバー1、2および3)によって負の調節を行う)6。正規および非正規のeIF4E結合配列7、8、9(ヒトeIF4E上のaa 604-646にまたがる領域)から成るインターフェースを介してeIF4G結合eIF4Eと競合することにより、4EBPはeIF4Eの翻訳に積極的に関与し、eIF4Fの複雑な形成を防ぐeIF4Eのプールを減少させる。これらのタンパク質相互作用の相互作用は主に、4EBPのラパマイシン(mTOR)媒介リン酸化の哺乳動物標的によって調節される。ミトゲン刺激の際に、mTORは4E-BPタンパク質ファミリーのメンバーを直接リン酸化し、eIF4Eとの関連を減少させ、そしてそれにより、eIF4E-eIF4G相互作用および機能的eIF4F複合体の形成を促進する。
eIF4F複合体完全性を標的とする化合物の開発に多大な努力をしたにもかかわらず、生細胞におけるeIF4E-eIF4G相互作用の直接的な破壊を測定するアッセイの欠如は、細胞活性ヒット化合物の探索を制限している。eIF4E-eIF4G相互作用を通じてeIF4F完全性の状態をリアルタイムに監視するために、コエンテラジンアナログ(例えば、ナノルクベースの補完アッセイ)に基づくルシファーゼアッセイを適用しました。ルシベーター補完タンパク質系は、18kDaタンパク質フラグメント(SubA)と11個のアミノ酸ペプチド断片(SubB)からなるが、自己の最小の自己結合と安定性11に最適化されている。ヒトeiF4G1(aa 604-646)からのヒト全長eIF4EおよびeIF4E相互作用ドメインとの融合産物として表現されると、2つの相互作用タンパク質はSubAとSubB断片を近接して近接し、細胞透過性基質の存在下で、最終的に明るい図を生成する活性型発光体の形成を誘導する(我々は他の場所でeIF4E:eIF4G604-646 補完システム16の構築と検証を報告している。
ここでは、eIF4E:eIF4G604-646 補完システム(要求に応じて利用可能)を適用して、生細胞における4EBP1媒介eIF4E-eIF4G破壊を正確に測定する方法を説明する。さらに、我々は、潜在的な癌治療薬12として現在臨床試験中のいくつかのmTOR阻害剤の効果を測定することによって、その有用性を実証する。オフターゲット効果は薬物特異的活性をマスクすることが多いため、eIF4E:eIF4G604-646 システム測定の汎用性を、これらを考慮に入れて細胞生存率の直交測定で拡張する方法についても説明します。
プロトコル
HEK293細胞株はプロトコルに使用され、10%のウシ胎児血清、2 mM L-グルタミン、および100 U/mLペニシリン/ストレプトマイシンを添加したダルベックコの修飾イーグル培地で培養された。細胞を加湿環境下で5%CO2 で37°Cで培養した。
1. eIF4E:eIF4G604-646 相補分析によるeIF4F複合破壊の定量的評価
- eIF4Eの細胞培養と一過性トランスフェクション:eIF4G604-646 相補アッセイ
- すべての実験のために20の通過未満で解凍した細胞を使用してください。1 日目に、標準セル カウンタを使用してセル番号を決定し、Trypan blue 除外方法13を使用して生存可能なセルの総数をカウントします。
- 標準成長培地の2 mLで1ウェルあたり0.9 -1.2 x 106 のHEK 293細胞を含む6ウェルプレートをシード。
注:上記の細胞株内で最高のトランスフェクション効率を達成するために、播種の翌日にメッキされた細胞が70〜90%コンフルエントであることを確認してください。 - 2日目の朝、以下に説明する脂質系トランスフェクション試薬を用いたSubA-eIF4EおよびeIF4G604-646-SubBプラスミドを用いた細胞を共トランスフェクトする( 材料表を参照)。
- 125 μLの還元血清培地を含むチューブに9 μLのリポソームベース溶液をフェノールレッド( 材料表を参照)を入れたチューブで、トランスフェクションを行い、室温で5分間インキュベートします。
- 各トランスフェクションチューブに対して各プラスミドの3μgを125μLの減らされた血清培地に希釈して、DNAのマスターミックスを調製します。
- DNAマスターミックスチューブに12μLのエンハンサー試薬を加え、よく混ぜてすぐにDNAを加える:比1:1で希釈リポソームの各チューブにエンハンサーマスターミックス。室温で15分間インキュベートします。
- 各ウェルにDNA-脂質複合体を加え、24時間5%CO2の37°Cインキュベーターで細胞をインキュベートします。
- 3日目の朝、PBS 1 mLでそれぞれをよくすすいでください。
- PBSを取り出し、37°Cで5分間0.3mLのトリプシンを各ウェルにインキュベートします。
- 各ウェルに0%のFCSを含むフェノールレッドを含まない還元血清培地の2 mLを加えてトリプシンを中和し、トランスフェクションした細胞を15mLチューブに移す。
注:フェノールレッドは、ルシファーゼ活性を妨げる可能性があります。したがって、細胞はフェノールレッドのない培地において、このステップから上に処理されなければならない。 - 290 x g で 5 分間スピンダウンし、培地を吸引します。0%FCSを含むフェノールレッドなしで2mLの還元血清培地中の細胞を再懸濁する。ステップ 1.1 で説明したとおりにカウントします。
- 種子は、0%FCSを含むフェノールレッドなしで培地90 μLのウェルあたり30,000細胞の密度で96ウェル不透明プレートでHEK 293細胞をトランスフェクトしました。3つの異なる化合物に対する同じ実験内で3つの技術的複製を得るために、縁のウェルを除く細胞を持つプレートの60の井戸を種付けする。
- トランスフェクションした細胞を播種した直後に、10%DMSO化合物溶液を10μL添加します(ステップ1.2参照)。
- 化合物製剤
- 100% DMSO (v/v) に目的の化合物を溶解することにより、1 mM の化合物ストック溶液を調製します。各化合物滴定に対して3回の反復を行うために、1 mM化合物ストック溶液の8 μLを使用してください。
注:使用される1 mMストックコンパウンドのボリュームは、必要以上です。これは、ピペットエラーがあれば考慮するために行われます。 - 1 mMストックの4 μLを持つストックコンパウンド溶液の2倍シリアル希釈を、各滴定ポイントごとに4 μLの100%DMSOに実行します。
注:完全な複合滴定を行う場合は、開始在庫から9個のシリアル希釈を100%DMSOで実行します。複数の化合物をテストする必要がある場合は、このステップとその後の希釈を容易にするために96ウェルプレートとマルチチャンネルピペットを使用してください。 - 2倍シリアル希釈の各ポイントに36μLのHPLCグレードの無菌水を加え、10%DMSO(v/v)で40μLの10倍の作動溶液を調製します(すなわち100 μM〜0.39 μM 10%DMSOストックシリーズは、10μM〜0.039μMの最終溶液につながる。治療制御については、HPLCグレードの滅菌水に10%DMSOのみのストック溶液も用意してください。
- 10x作動溶液の10μLを96ウェル不透明プレートの細胞に加えて、残存DMSO濃度1%(v/v)を100μLの残量で目的の最終濃度で得、37°Cで3時間インキュベートし、5%v/v大気CO2でインキュベートします。
- 100% DMSO (v/v) に目的の化合物を溶解することにより、1 mM の化合物ストック溶液を調製します。各化合物滴定に対して3回の反復を行うために、1 mM化合物ストック溶液の8 μLを使用してください。
- ルシファーゼの相補性と生存率アッセイ
- 3時間の薬物化後、1体積の基質と19ボリュームの希釈試薬を組み合わせることによりルシファーゼ基質試薬の調製を開始する(メーカーの指示書を参照)。
注:ルシファーゼアッセイは市販のキットを使用して実行されます( 材料表を参照)。 - マルチチャンネルピペットを使用して、25 μLの基質試薬をすぐに添加します。
- 室温で軌道シェーカーで50分間350 rpmでプレートを振ります。
- プレートリーダーを使用して発光を評価します。そのためには、ミラーリーダーを発光に、発光フィルタを455に設定します。測定時間を1 sにして、6.5mmの測定高さを使用してください。
- 細胞の生存率を評価するために、33 μLの生存率アッセイ試薬を加え、プレートリーダーを使用して室温で15分後に再び発光を再測定します。
- 600 nmの発光と発光フィルターにミラーリーダーを設定して、プレートリーダーで発光を評価します。測定時間を1 sにして、6.5mmの測定高さを使用してください。
注:生存率は、メーカーの指示に従って細胞のリシス時のATPの細胞内レベルを測定することによって評価されます。この場合、生存率アッセイは異なる発光波長を有する別のルシファーゼを使用するため、多重化が可能である。 - データを使用して、データを 4 パラメータフィッティング曲線式に適合させるカーブによって、各化合物の IC50 値を決定します。
Y = ((A-D)/(1+((x/C)^B)) + D
数値 D と A は、カーブフィッティングプロセスで拘束する必要があります。
D = Y 軸上の発光値は、最小曲線漸近曲線または最小理論レベルの応答を eIF4E:4G 相補アッセイから期待される最小の理論レベルで行う。
A = Y 軸上の発光値は、eIF4E:4G 相補アッセイから予想される最大曲線アセンプトまたは最大理論レベル応答を求める。
注: 最小応答の値は 1% DMSO (v/v) コントロール処理から導き出され、最大応答の値は、細胞の生存率に影響を与えずに高原化した高親和性 mTOR 阻害剤の最大応答から導出されます。
- 3時間の薬物化後、1体積の基質と19ボリュームの希釈試薬を組み合わせることによりルシファーゼ基質試薬の調製を開始する(メーカーの指示書を参照)。
2. eIF4E:eIF4G604-646 細胞の eIF4F 複合破壊によるアッセイ阻害
- アッセイによって測定される信号が化合物によるeIF4E-eIF4G相互作用の物理的破壊に対応していることを確認するために、ステップ1.1に記載されるように細胞をシードする。
- 翌日、フェノールレッドを含まない減らされた血清培地の1mLで培地を交換し、目的の化合物で4時間インキュベートする。DMSO濃度が1mLの総体積で1%(v/v)の残留を確認します。
注: 結果との相関を容易にするため、測定された補完アッセイ滴定曲線の始まり、中点、終点の化合物濃度を使用します。 - 細胞をライゼし、m7GTPプルダウンを行い、eIF4FおよびeIF4E:4EBP1複合体を単離した。m7GTPプルダウン実験を行う方法の詳細な手順は、他の場所で見つけることができます 14.
- ウェスタンブロット分析によりm7GTP結合eIF4G、eIF4Eおよび4EBP1タンパク質レベルを検出し、相補アッセイシグナル阻害を伴うeIF4F複合破壊に相関させる。
結果
eIF4E:eIF4G604-646 相補系の感度を検証するために、4EBP1媒介性eIF4F複合体集合体の阻害をmTOR阻害剤を用いて評価した。4EBPタンパク質ファミリーのmTORC1キナーゼ依存性リン酸化を阻害することにより、mTOR阻害は、eIF4Eに対する4EBP1会合を増強し、したがって、eIF4F分解15を増強する。mTORC1のアロステリック阻害剤であるがmTORC2およびATP競合ベースの阻害剤(例えば、PP242)のmTORC1およびmTORC2キナーゼの両方を特異的に阻害するように設計されたラパログ(例えば、ラパマイシン)の2つのクラスが試験された。
HEK293細胞は、ステップ1に記載されているようにeIF4E:eIF4G604-646 相補系でトランスフェクトした。24時間のトランスフェクションの後、細胞を再播種し、mTOR阻害剤PP242およびラパマイシン(ステップ1.2に記載)で処理した。治療の4時間後、ルミネッセンスを評価し、先に説明したように、続いて細胞生存率を評価した。 図2に示すように、PP242は0.72±0.04 μMの計算されたIC50を用いて信号の用量依存的阻害を生じ、0.88±のIC50はラパマイシンに由来する(図2A)。その後、細胞生存アッセイのためにプレートを多重化した(図2D)。この分析は、PP242もラパマイシンも細胞生存率の有意な低下を生じないことを示しており、eIF4E:eIF4G604-646 相補システムにおける発光の低下は、非特異的細胞死によるものではなく、むしろeIF4E:4G相互作用の破壊によるものであることが証明された。
図2の測定された滴定曲線の始まり、中点、終点に対応する化合物濃度を有する未感染細胞をインキュベートすることによって行われたm7GTPプルダウン実験は、4EBP1媒介性内因性eIF4E-eIF4G相互作用の破壊が測定されたeIF4E:eIF4G604-646シグナルゼイとして相関することを示す(BC)これらの結果と一致して、PP242は、HEK 293細胞(図3A)で試験された実験条件下でのラパマイシンよりも総4EBP1リン酸化のより強力な阻害剤であることが示されているが、両方の阻害剤はmTORC1基質およびPP242の両方に対してより活性であるmTORC1基質およびPP242の両方を標的とするmTORC1基質および図(図)の両方に対してmTORC1基質およびPP242の両方を標的とするmTORシグナル伝達に影響を及ぼす。
これらの結果をまとめて、PP242がHEK293細胞のラパマイシンよりもeIF4F複合体形成を破壊するのにより効果的であることを示し、さらにeIF4E:eIF4G604-646 システムが生細胞中のeIF4F複合体集合体を正確に測定できることを実証した。
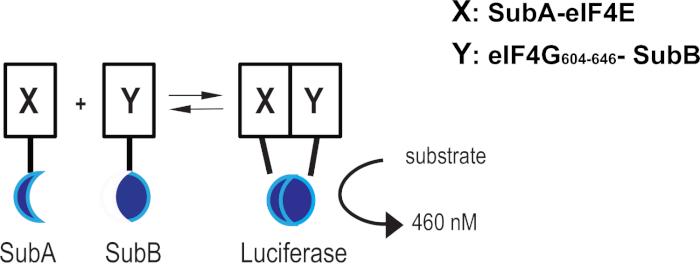
図1:eIF4E:eIF4G604-646 補完システム タンパク質X(eIF4E)とプロテインY(eIF4G604-646)の相互作用により、SubAとSubB融合が互いに近接し、活性ルシファーゼを再構成する方法を示す模式図表現。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:4EBP1媒介性eIF4F複合体の破壊。 (A)PP242およびラパマイシン eIF4E:eIF4G604-646 トランスフェクト HEK 293細胞における eIF4E と eIF4G の相互作用をモデル化した測定結果滴定(B,C)EIF4E、eIF4Gおよび4EBP1の内因性レベルをHEK 293抽出物およびm7GTPでそれぞれPP242またはラパマイシンの異なる濃度で培養した後にプルダウンした。(D) Aの処理細胞において、細胞生存率および発光性について多重化した細胞が評価される。すべての値は、SD±平均値(n=3)を表します。この図は16から変更されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
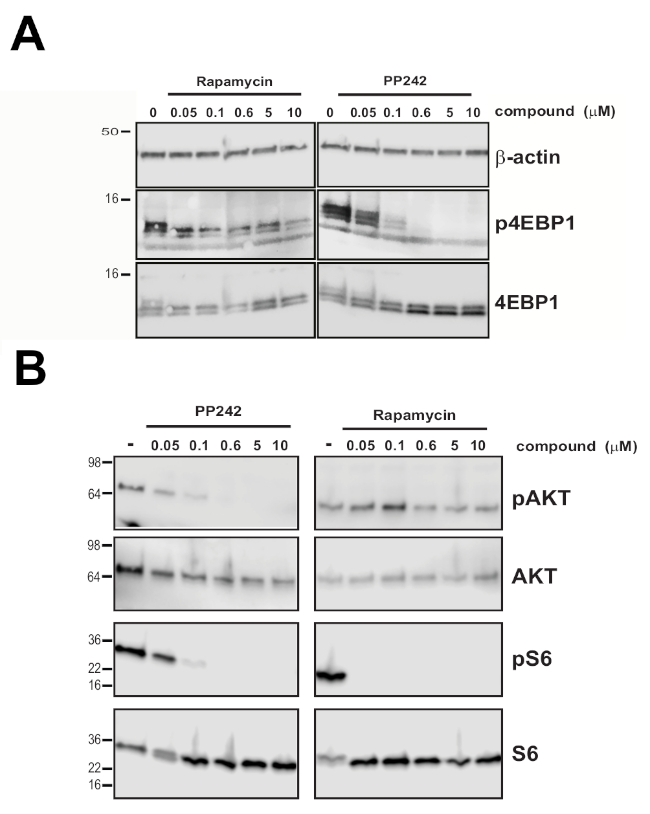
図3:4EBP1ホスホリル化に対するmTOR阻害の差動効果。(A)PP242およびラパマイシンの示された濃度で処理された非トランスフェクトHEK293細胞における4EBP1のリン酸化状態のウェスタンブロット分析。(B)非トランスフェクトHEK293細胞におけるAKTおよびS6リン酸化状態のウェスタンブロット分析は、二重MTORC1/2活性部位阻害剤PP242、またはmTORC1ラパマイシンのアロステリック阻害剤で処理した。ベータアクチンは、負荷制御だけでなく、合計4EBP1、AKTおよびS6のために視覚化された。この図は16から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本稿で説明する方法は、生細胞におけるeIF4G-eIF4E相互作用の直接測定を通じてeIF4F複合体集合体を定量的に監視するためのルシメラーゼベースの相補アッセイを利用する。我々は、eIF4E-eIF4G相補システムの使用に関する詳細を提供しており、また、このシステムが、eIF4E-eIF4G相互作用16の薬物誘発4EBP1媒介解離解を測定する際に極めて正確であることを示した。このアッセイのスループットを容易にするために、この記事で説明する実験用セットアップは、96ウェルマイクロプレート形式の使用のために設計されています。
最適な結果を得るには、アッセイを行う際に2つの重要なステップを考慮する必要があります。まず、実験間のトランスフェクション効率は同様であるべきである。これは、低い通過数細胞の使用を通じて、そして厳密に播種の日に細胞を数えることによって保証することができる。細胞の合流度が70-90%未満の場合、脂質ベースのトランスフェクション試薬で細胞をトランスフェクションすることは推奨されないので、DNAトランスフェクションが行われる前に細胞の合流性も評価する必要があります。第2に、細胞生存アッセイを用いて相補アッセイを多重化することが重要である。いくつかの化合物は、主に有害な効果を通じて生存細胞の数を減少させることによってルシファーゼのシグナルに影響を与える可能性があります。.したがって、オフターゲットおよび非特異的効果に対処するためにeIF4E:eIF4G604-646 相補アッセイの直後に細胞の生存率を測定することが重要である。
タンパク質とタンパク質のインターフェースは、eIF4EとeIF4Gの間の1つ、疎水性の裂け目を欠き、比較的大きく平面的である、一般的には従来の低分子治療薬(<500MW)17によって「薬物化不可能」であると考えられている。したがって、これらのタイプの表面(例えば、大環状およびペプチド模倣化合物)と効率的に相互作用する新しいモダリティの開発に対する関心が高まっている。しかし、これらの新しいモダリティの多くは、生まれつき細胞膜を横切って標的に係合することはできません。これらの問題を回避するために、多くの研究グループが新しい化学最適化と細胞送達戦略の研究を行っています。eIF4E:eIF4G604-646 ライブセルPPIアッセイおよび他の同様のPPI導出アッセイは、これらの戦略を推進し、それらを検証する上で極めて重要な役割を果たすと考えています。
開示事項
著者らは開示するものは何もない。
謝辞
この作業は、p53lab (BMSI、A*STAR) および JCO VIP 認可 (A*STAR) からのコア予算によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| Cell culture microplate 96 well, F-Bottom | greiner bio-one | 655083 | |
| Cell titer Glo 2.0 | PROMEGA | G9241 | |
| Envision Multilabel Reader | PerkinElmer | not applcable | |
| Finnpipette F2 Multichannel Pipettes 12-channels 30-300 ml | Thermo Fisher Scientific | 4662070 | |
| Finnpipette F2 Multichannel Pipettes 12-channels 5-50 ml | Thermo Fisher Scientific | 4662050 | |
| FUGENE6 | PROMEGA | E2692 | |
| Lipofectamine 3000 | Thermo Fisher Scientific | L3000015 | |
| NanoBiT PPI Starter Systems | PROMEGA | N2014 | |
| Optimem I Reduced Serum Mediun, no phenol red | Thermo Fisher Scientific | 11058021 | |
| Orbital shaker | Eppendorf | not appicable | |
| γ-Aminophenyl-m7GTP (C10-spacer)-Agarose | Jena Bioscience | AC-155S |
参考文献
- Silvera, D., Formenti, S. C., Schneider, R. J. Translational control in cancer. Nature Reviews Cancer. 10 (4), 254-266 (2010).
- Gebauer, F., Hentze, M. W. Molecular Mechanism of translational control. Nature Reviews Molecular Cell Biology. 10, 827-835 (2004).
- Bhat, M., et al. Targeting the translation machinery in cancer. Nature Reviews Drug Discovery. 14 (4), 261-278 (2015).
- Pelletier, J., Graff, J., Ruggero, D., Sonenberg, N. Targeting the eIF4F translation initiation complex: a critical nexus for cancer development. Cancer Research. 75 (2), 250-263 (2015).
- Montanaro, L., Pandolfi, P. P. Initiation of mRNA translation in oncogenesis: the role of eIF4E. Cell Cycle. 11, 1387-1389 (2004).
- Merrick, W. C. eIF4E: A retrospective. Journal of Biological Chemistry. 290 (40), 24091-24099 (2015).
- Marcotrigiano, J., Gingras, A. C., Sonenberg, N., Burley, S. K. Cap-dependent translation initiation in eukaryotes is regulated by a molecular mimic of eIF4G. Molecular Cell. 3 (6), 707-716 (1999).
- Umenaga, Y., Paku, K. S., In, Y., Ishida, T., Tomoo, K. Identification and function of the second eIF4E-binding region in N-terminal domain of eIF4G: comparison with eIF4E-binding protein. Biochemical and Biophysical Research Communication. 414 (3), 462-467 (2011).
- Grüner, S., et al. The Structures of eIF4E-eIF4G Complexes Reveal an Extended Interface to Regulate Translation Initiation. Molecular Cell. 64 (3), 467-479 (2016).
- Gingras, A. C., et al. Hierarchical phosphorylation of the translation inhibitor 4E-BP1. Genes and Development. 15 (21), 2852-2864 (2001).
- Dixon, A. S., et al. NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells. ACS Chemical Biology. 11 (2), 400-408 (2016).
- Sun, S. Y. mTOR kinase inhibitors as potential cancer therapeutic drugs. Cancer Letters. 340 (1), 1-8 (2013).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. , Appendix 3: Appendix 3B (2001).
- Sekiyama, N., et al. Molecular mechanism of the dual activity of 4EGI-1: Dissociating eIF4G from eIF4E but stabilizing the binding of unphosphorylated 4E-BP1. Proceedings of the National Academy of Science U. S. A. 112 (30), e4036-e4045 (2015).
- Muller, D., et al. 4E-BP restrains eIF4E phosphorylation. Translation. 1 (2), e25819(2013).
- Frosi, Y., Usher, R., Lian, D. T. G., Lane, D. P., Brown, C. J. Monitoring flux in signalling pathways through measurements of 4EBP1-mediated eIF4F complex assembly. BMC Biology. (1), 40(2019).
- Ran, X., Gestwicki, J. E. Inhibitors of protein-protein interactions (PPIs): An analysis of scaffold choices and buried surface area. Current Opinion in Chemical Biology. 44, 75-86 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved