Method Article
مراقبة تجميع eIF4F من خلال قياس تفاعل eIF4E-eIF4G في الخلايا الحية
In This Article
Summary
هنا ، نقدم بروتوكولا لقياس تفاعل eIF4E-eIF4G في الخلايا الحية من شأنه أن يمكن المستخدم من تقييم الاضطراب الناجم عن المخدرات للديناميكيات المعقدة eIF4F في أشكال الفحص.
Abstract
وقد تبين أن تشكيل مجمع eIF4F هو العقدة الرئيسية في المصب للتقارب بين مسارات الإشارات التي غالبا ما تخضع للتنشيط على نحو غير مركب في البشر. eIF4F هو مجمع ربط الحد الأقصى المشاركة في مرحلة التوظيف مرنا-ريبوسوم من بدء الترجمة. في العديد من النماذج الخلوية وما قبل السريرية للسرطانات ، يؤدي إلغاء تحرير eIF4F إلى زيادة ترجمة مجموعات فرعية محددة من الحمض النووي الريبي تشارك في انتشار السرطان والبقاء على قيد الحياة. eIF4F هو مجمع ثلاثي التريك مبني من وحدة ربط الغطاء الفرعية eIF4E ، وeIF4A helicase والوحدات الفرعية للسقالات eIF4G. حاسمة لتجميع مجمعات eIF4F النشطة هو التفاعل البروتين البروتين بين eIF4E والبروتينات eIF4G. في هذه المقالة، نقوم بوصف بروتوكول لقياس تجميع eIF4F الذي يراقب حالة تفاعل eIF4E-eIF4G في الخلايا الحية. كما يسمح اختبار التفاعل بين البروتين البروتيني القائم على الخلايا eIF4e:4G بتقييم التغيرات الناجمة عن المخدرات في سلامة eIF4F المعقدة بدقة وموثوقية. ونحن نتصور أن هذه الطريقة يمكن تطبيقها للتحقق من نشاط المركبات المتاحة تجاريا أو لمزيد من الفحص للمركبات أو الطرائق الجديدة التي تعطل بكفاءة تشكيل مجمع eIF4F.
Introduction
تلعب السيطرة على التعبير الجيني دورا محوريا في التنفيذ الصحيح للبرامج الخلوية مثل انتشار النمو والتمايز. يمكن أن تمارس آلية الرقابة التنظيمية إما على مستوى النسخ الجيني أو على مستوى ترجمة الحمض النووي الريبي. في العقد الماضي ، أصبح من الواضح بشكل متزايد أن التحكم التحويلي عن طريق تعديل عملية البدء بدلا من الخطوات اللاحقة للاستطالة والإنهاء يمكن أن ينظم بدقة تركيب مجموعات فرعية محددة من البروتينات التي تلعب مجموعة واسعة من الوظائف البيولوجية.
وقد تورطت زيادة ترجمة mRNAs المشاركة في البقاء على قيد الحياة، والاستجابات المضادة ل autophagic ومكافحة المبرمج في العديد من أنواع السرطان وارتبطت أيضا بشكل سببي إما تنشيط منحرفة أو أكثر من التعبير عن عوامل بدء الترجمة1.
مجمع eIF4F هو المنظم الرئيسي لبدء الترجمة. من خلال ربط هيكل الحد الأقصى على نهاية 5 'من mRNAs، eIF4F يقود التوظيف الأولي مرنا-ريبوسوم وبالتالي زيادة كفاءة الترجمة مرنا من mRNAs eukaryotic ترجمة ضعيفة2. تم الإبلاغ عن ترجمة eIF4F بوساطة من mRNAs المرتبطة بالسرطان للعديد من نماذج السرطان التي تؤوي التنشيط الشاذ لمسارات RAS /MAPK أو AKT / TOR ، مما يشير إلى أن الخلايا السرطانية ترفع eIF4F لتعزيز نشاطها المؤيد للأورام. تعطيل هذه الحلقة تغذية إلى الأمام عن طريق تثبيط تشكيل eIF4F المعقدة وبالتالي استراتيجية علاجية واعدة جدا3،4.
يتكون مجمع eIF4F من (i) eIF4E ، الوحدة الفرعية الملزمة للغطاء eIF4F التي تتفاعل مع هيكل الغطاء الموجود في UTR 5 من mRNA ، (ii) eIF4A ، وحقيبة طائرات RNA و (3) eIF4G ، بروتين السقالة الذي يتفاعل مع كل من eIF4A و eIF4E والذي يجند في نهاية المطاف 40S ribosomal subunit5. ارتباط eIF4G مع eIF4E هو خطوة الحد من معدل لتجميع المجمعات eIF4F وظيفية وينظم سلبا من قبل eIF4E ملزمة البروتينات (4EBPs، أعضاء 1 و 2 و 3))6. من خلال التنافس مع ربط eIF4G إلى eIF4E من خلال واجهة تتكون من تسلسلات ربط eIF4E الكنسية وغير الكنسية7و8و9 (منطقة تمتد aa 604-646 على eIF4E البشري) ، يقلل 4EBP من مجموعة eIF4E المشاركة بنشاط في الترجمة ومنع تشكيل eIF4F المعقد. يتم تنظيم التفاعل بين هذه التفاعلات البروتين البروتين أساسا من قبل هدف الثدييات من راباميسين (mTOR) بوساطة الفوسفور من 4EBP. على المحفزات mitogenic، mTOR الفوسفور مباشرة أعضاء الأسرة البروتين 4E-BP، وخفض ارتباطهم مع eIF4E، وبالتالي، وتعزيز التفاعل eIF4E-eIF4G وتشكيل مجمعات eIF4F وظيفية10.
على الرغم من الجهد الكبير في تطوير المركبات التي تستهدف سلامة eIF4F المعقدة ، فإن عدم وجود مقايسات تقيس التعطيل المباشر لتفاعل eIF4E-eIF4G في الخلايا الحية قد حد من البحث عن مركبات ضرب نشطة خلوية. لقد طبقنا فحص لوسيفيراز على أساس تناظري coelenterazine (على سبيل المثال، فحص التكامل القائم على Nanoluc) لمراقبة حالة سلامة eIF4F في الوقت الحقيقي من خلال تفاعل eIF4E-eIF4G. يتكون نظام بروتين مكمل لوسيفيراز من جزء بروتين 18 kDa (SubA) و 11 جزء ببتيد من الأحماض الأمينية (SubB) تم تحسينه لتحقيق الحد الأدنى من الارتباط الذاتي والاستقرار11. مرة واحدة أعرب عن منتج الانصهار مع eIF4E طول الإنسان الكامل والمجال التفاعل eIF4E من eiF4G1 الإنسان (aa 604-646)، واثنين من البروتينات التفاعل سوف تجلب SubA وS subB جزء في القرب من بعضها البعض، وسوف تحفز على تشكيل لوسيفيراز النشطة التي، في وجود خلية نفاذية الركيزة، وسوف تولد في نهاية المطاف إشارة مضيئة(الشكل 1). لقد أبلغنا في مكان آخر عن بناء وإقرار eIF4E:eIF4G604-646 نظام استكمال16.
هنا، نقوم بوصف كيف يمكن تطبيق نظام إكمال eIF4E:eIF4G604-646 (متوفر عند الطلب) لقياس اضطراب eIF4E-eIF4G بوساطة 4EBP1 بدقة في الخلايا الحية. بالإضافة إلى ذلك، فإننا نثبت فائدتها من خلال قياس آثار العديد من مثبطات mTOR التي تخضع حاليا للتجارب السريرية والأدوية العلاجية المحتملة للسرطان12. ولأن الآثار خارج الهدف غالبا ما تخفي نشاطا خاصا بالعقاقير، فإننا نصف أيضا كيف يمكن توسيع نطاق تعدد استخدامات قياس نظام eIF4E:eIF4G604-646 مع القياسات المتعامدة للقدرة على البقاء الخلوية لأخذ هذه القياسات في الاعتبار.
Protocol
HEK293 تم استخدام خط الخلية للبروتوكول وكان مثقفا في دولبيكو تعديل النسر المتوسطة تكملها 10٪ مصل البقر الجنيني، 2 MM L-الجلوتامين، و 100 U/mL البنسلين / العقديبتوميسين. تم استزراع الخلايا عند 37 درجة مئوية مع 5٪ من ثاني أكسيد الكربون فيبيئة رطبة.
1. التقييم الكمي للاضطراب المعقد eIF4F عن طريق eIF4E:eIF4G604-646 اختبار الاستكمال
- زراعة الخلايا والإصابة العابرة ل eIF4E:eIF4G604-646 اختبار الاستكمال
- استخدم خلايا مذابة حديثا مع أقل من 20 مقطعا لجميع التجارب. في اليوم الأول، حدد رقم الخلية باستخدام عداد خلية قياسي واحسب إجمالي الخلايا القابلة للحياة باستخدام طريقة استبعاد Trypan الزرقاء13.
- لوحات البذور 6-جيدا مع 0.9 - 1.2 × 106 من خلايا HEK 293 لكل بئر في 2 مل من متوسط النمو القياسي.
ملاحظة: من أجل تحقيق أفضل كفاءة في العدوى داخل خطوط الخلية المشار إليها أعلاه، تأكد من أن الخلايا المطلية هي التقاء 70-90٪ في اليوم التالي للبذر. - في صباح اليوم 2، خلايا العدوى المشتركة مع SubA-eIF4E و eIF4G604-646-SubB plasmid باستخدام كاشف العدوى القائم على الدهون (انظر جدول المواد)كما هو موضح أدناه.
- تمييع 9 ميكرولتر من محلول الليبوسوم القائم في أنبوب يحتوي على 125 ميكرولتر من متوسط المصل المنخفض بدون فينول أحمر (انظر جدول المواد)لكل عملية إصابة واحتضان في درجة حرارة الغرفة لمدة 5 دقائق.
- إعداد مزيج رئيسي من الحمض النووي عن طريق تخفيف 3 ميكروغرام من كلplasmid في 125 ميكروغرام من انخفاض متوسط المصل لكل أنبوب العدوى.
- إضافة 12 ميكرولتر من الكواشف محسن إلى أنبوب مزيج الحمض النووي الرئيسي، مزيج جيدا وإضافة الحمض النووي على الفور: محسن مزيج رئيسي إلى كل أنبوب من الليبوسومات المخففة في نسبة 1:1. حضانة لمدة 15 دقيقة في درجة حرارة الغرفة.
- إضافة مجمع الحمض النووي الدهون إلى كل بئر واحتضان الخلايا في حاضنة 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة.
- في صباح اليوم 3، شطف كل بئر مع 1 مل من برنامج تلفزيوني.
- إزالة برنامج تلفزيوني واحتضان الخلايا في كل بئر مع 0.3 مل من التريبسين لمدة 5 دقائق في 37 درجة مئوية.
- تحييد التربسين بإضافة 2 مل من متوسط المصل المنخفض دون فينول أحمر يحتوي على 0٪ FCS في كل بئر ونقل الخلايا المصابة إلى أنبوب 15 مل.
ملاحظة: فينول الأحمر يمكن أن تتداخل مع نشاط لوسيفيراز; لذلك، يجب معالجة الخلايا من هذه الخطوة فصاعدا في المتوسط دون فينول الأحمر. - قم بتدبير الخلايا لمدة 5 دقائق عند 290 × ز ونسخ الوسط. Resuspend الخلايا في 2 مل من المتوسط المصل انخفاض دون فينول الأحمر التي تحتوي على 0٪ FCS. عد كما هو موضح في الخطوة 1.1.
- البذور المصابة HEK 293 الخلايا في 96 لوحات مبهمة جيدا في كثافة 30،000 خلية لكل بئر في 90 ميكرولتر من المتوسط دون فينول الأحمر التي تحتوي على 0٪ FCS. من أجل الحصول على 3 تكرارات تقنية في نفس التجربة ل 3 مركبات مختلفة ، بذور 60 بئرا من اللوحات مع خلايا باستثناء الآبار على الحواف.
- مباشرة بعد البذر الخلايا المصابة، إضافة 10 ميكرولتر من محلول مركب DMSO 10٪ (انظر الخطوة 1.2).
- إعداد المركب
- إعداد 1 MM حلول المخزون المركب عن طريق حل مجمع الفائدة في 100٪ DMSO (v/v). من أجل الحصول على 3 نسخ متماثلة لكل معيرة مركبة ، استخدم 8 ميكرولتر من محلول المخزون المركب 1 mM.
ملاحظة: حجم مركب المخزون 1 mM المستخدمة هو أكثر من ما هو مطلوب. ويتم ذلك لتأخذ في الاعتبار أخطاء ماصة إن وجدت. - تنفيذ 2 أضعاف المخفف التسلسلي للمحلول مركب الأسهم مع 4 ميكرولتر من المخزون 1 mM إلى 4 ميكرولتر من DMSO 100٪ لكل نقطة المعايرة.
ملاحظة: للحصول على المعايرة المركبة كاملة، تنفيذ 9 المخففات التسلسلية من المخزون بدءا في DMSO 100٪. إذا كانت هناك حاجة إلى اختبار مركبات متعددة، استخدم لوحة بئر 96 وماصة متعددة القنوات لتسهيل هذه الخطوة والتخفيفات اللاحقة. - إضافة 36 ميكرولتر من HPLC الصف المياه العقيمة لكل نقطة من تخفيف المسلسل 2 أضعاف لإعداد 40 ميكرولتر من حلول العمل 10x في 10٪ DMSO (v/v) (أي. 100 μM إلى 0.39 ميكرومتر 10٪ سلسلة أسهم DMSO ستؤدي إلى حل نهائي من 10 ميكرومتر إلى 0.039 ميكرومتر، في 1٪ DMSO عند إضافتها إلى الخلايا). أما بالنسبة للسيطرة على العلاج، وإعداد أيضا 10٪ DMSO الأسهم الحل فقط في المياه العقيمة HPLC الصف.
- إضافة 10 ميكرولتر من حلول العمل 10x إلى الخلايا في لوحة 96 مبهمة جيدا من أجل تحقيق التركيز النهائي المقصود مع تركيز DMSO المتبقية من 1٪ (v/v) في حجم إجمالي قدره 100 ميكرولتر واحتضان لمدة 3 ساعة في 37 درجة مئوية مع 5٪ v/vCO2في الغلاف الجوي .
- إعداد 1 MM حلول المخزون المركب عن طريق حل مجمع الفائدة في 100٪ DMSO (v/v). من أجل الحصول على 3 نسخ متماثلة لكل معيرة مركبة ، استخدم 8 ميكرولتر من محلول المخزون المركب 1 mM.
- لوكيفيراز تكملة وثبات البقاء
- بعد 3 ساعة من المخدرات، والبدء في إعداد كاشف الركيزة لوسيفيراز عن طريق الجمع بين 1 حجم الركيزة مع 19 مجلدا من كاشف التخفيف (انظر تعليمات الشركة المصنعة).
ملاحظة: يتم إجراء المقايسة لوسيفيراز باستخدام عدة متوفرة تجاريا (انظر جدول المواد). - استخدم ماصة متعددة القنوات لإضافة 25 ميكرولتر من كاشف الركيزة على الفور.
- يهز لوحة في 350 دورة في الدقيقة لمدة 50 دقيقة على شاكر المدارية في درجة حرارة الغرفة.
- تقييم التلألؤ باستخدام قارئ لوحة. للقيام بذلك، تعيين قارئ المرآة على التلألؤ ومرشح الانبعاثات على 455. استخدم ارتفاع قياس 6.5 مم مع وقت قياس قدره 1 s.
- من أجل تقييم صلاحية الخلية ، أضف 33 ميكرولتر من كاشف فحص الجدوى ثم إعادة قياس التلألؤ مرة أخرى بعد 15 دقيقة في درجة حرارة الغرفة ، باستخدام قارئ اللوحة.
- تقييم التلألؤ مع قارئ لوحة عن طريق وضع قارئ المرآة على التلألؤ ومرشح الانبعاثات على 600 نانومتر. استخدم ارتفاع قياس 6.5 مم مع وقت قياس قدره 1 s.
ملاحظة: يتم تقييم الجدوى عن طريق قياس مستوى ATP داخل الخلايا عند تحلل الخلية وفقا لتعليمات الشركة المصنعة. تعدد ممكن في هذه الحالة منذ المقايسة صلاحية يستخدم لوسيفيراز مختلفة مع الطول الموجي انبعاث مختلفة. - استخدم البيانات لتحديد قيم IC50 لكل مركب بواسطة منحنى يتناسب مع البيانات إلى معادلة منحنى 4 معلمات مناسبة:
Y = ((A-D)/(1+((x/C)^B))) + D
يجب تقييد القيم الرقمية D و A في عملية تركيب المنحنى:
D = القيمة الإنارة على محور ص للحصول على الحد الأدنى من المنحنى غير المكتئب أو الحد الأدنى من المستوى النظري للاستجابة المتوقع من مقايسة الإكمال eIF4E:4G.
A = قيمة الإنارة على محور Y للحصول على أقصى قدر من المنحنى غير المكتئب أو استجابة المستوى النظري الأقصى المتوقعة من مقايسة التكامل eIF4E:4G.
ملاحظة: يتم اشتقاق قيمة الاستجابة الأدنى من علاج التحكم DMSO (v/v) 1٪ ويتم اشتقاق قيمة الاستجابة القصوى من الاستجابة القصوى لمثبط mTOR عالي التقارب الذي استقر دون أي تأثير على صلاحية الخلية.
- بعد 3 ساعة من المخدرات، والبدء في إعداد كاشف الركيزة لوسيفيراز عن طريق الجمع بين 1 حجم الركيزة مع 19 مجلدا من كاشف التخفيف (انظر تعليمات الشركة المصنعة).
2. ربط eIF4E: eIF4G604-646 تثبيط المقايسة مع اضطراب eIF4F المعقدة في الخلايا
- للتأكد من أن الإشارة التي يتم قياسها بالتقييس تتوافق مع التعطيل المادي لتفاعل eIF4E-eIF4G من قبل المركب ، خلايا البذور كما هو موضح في الخطوة 1.1.
- في اليوم التالي، استبدل الوسط ب 1 مل من متوسط المصل المخفض الذي لا يحتوي على الفينول الأحمر واحتضانه لمدة 4 ساعة مع مركب الفائدة. ضمان تركيز DMSO المتبقي بنسبة 1٪ (v/v) في حجم إجمالي قدره 1 مل.
ملاحظة: من أجل السماح بسهولة ارتباط مع النتيجة, استخدام تركيزات مركب في بداية, نقطة الوسط ونقطة النهاية من قياس الاستكمال المقايسة منحنى المعايرة. - خلايا الليس وأداء M7GTP سحب لأسفل لعزل eIF4F و eIF4E: 4EBP1 المجمعات. ويمكن الاطلاع على إجراءات مفصلة حول كيفية تنفيذ M7GTP سحب أسفل التجربة في مكان آخر14.
- الكشف عن M7GTP ملزمة eIF4G, eIF4E و 4EBP1 مستويات البروتين عن طريق تحليل لطخة الغربية, ومن ثم ترتبط تعطل eIF4F المعقدة مع تثبيط إشارة المقايسة التكميلية.
النتائج
من أجل التحقق من صحة حساسية eIF4E:eIF4G604-646 نظام الاستكمال، تم تقييم 4EBP1 تثبيط الجمعية المعقدة eIF4F باستخدام مثبطات mTOR. عن طريق تثبيط mTORC1 كيناز الفوسفور تعتمد على الأسرة البروتين 4EBP، تثبيط mTOR يعزز ارتباط 4EBP1 إلى eIF4E، وبالتالي، eIF4F تفكيك15. تم اختبار فئتين من مثبط مختلف ميكانيكيا من kinases mTOR: rapalogs (على سبيل المثال، Rapamycin) التي هي مثبطات allosteric من mTORC1 ولكن ليس mTORC2 ومثبطات ATP القائمة على المنافسة (على سبيل المثال، PP242) التي تم تصميمها لتثبيط على وجه التحديد كل من mTORC1 و mTORC2 كيناز النشاط الحفاز.
تم تحويل خلايا HEK293 مع eIF4E:eIF4G604-646 نظام استكمال كما هو موضح في الخطوة 1. بعد 24 ساعة من العدوى، تم إعادة زرع الخلايا وعلاجها بمثبطات mTOR PP242 و rapamycin (كما هو موضح في الخطوة 1.2). بعد أربع ساعات من العلاج، تم تقييم التلألؤ، كما هو موضح سابقا، تليها صلاحية الخلية. وكما هو مبين في الشكل 2، تنتج PP242 تثبيط تعتمد على الجرعة للإشارة مع IC50 محسوبة من 0.72 ± 0.04 ميكرومتر ، في حين يتم اشتقاق IC50 من 6.88 ± 0.88 ميكرومتر لراباميسين (الشكل 2A). لوحات ثم متعددة لقابلية البقاء الخلوية المقايسة (الشكل 2D). ويبين هذا التحليل أن لا PP242 ولا rapamycin تنتج انخفاضا كبيرا في صلاحية الخلية، مما يثبت أن الانخفاض في التلألؤ في eIF4E:eIF4G604-646 نظام استكمال ليس بسبب وفاة الخلية غير محددة ولكن بدلا من ذلك من خلال تعطيل التفاعل eIF4E:4G.
M7GTP سحب أسفل التجربة التي أجريت عن طريق احتضان الخلايا غير المصابة مع تركيزات مركبة التي تتوافق مع نقاط البداية والمتوسطة والنهاية من منحنى المعايرة المقاسة في الشكل 2A تظهر أن اضطراب 4EBP1 بوساطة من التفاعل eIF4E-eIF4G الذاتية يرتبط مع قياس eIF4E:eIF4G604-646 إشارة التماثل (الشكل 2B, 2C). بما يتفق مع هذه النتائج، يظهر PP242 أن يكون مثبط أكثر فعالية من مجموع الفوسفور 4EBP1 من راباميسين في ظل الظروف التجريبية التي تم اختبارها في خلايا HEK 293 (الشكل 3A)،في حين أظهرت كل من المثبطات تأثير على إشارات mTOR عادة، مع راباميسين يجري أكثر نشاطا ضد ركائز mTORC1 وPP242 تستهدف كل من mTORC1 و mTORC2 (الشكل 3B).
وأظهرت هذه النتائج مجتمعة أن PP242 هو أكثر فعالية في تعطيل تشكيل eIF4F المعقدة من راباميسين في خلايا HEK293 ومزيد من إثبات أن eIF4E:eIF4G604-646 نظام يمكن قياس بدقة eIF4F التجميع المعقد في الخلايا الحية.
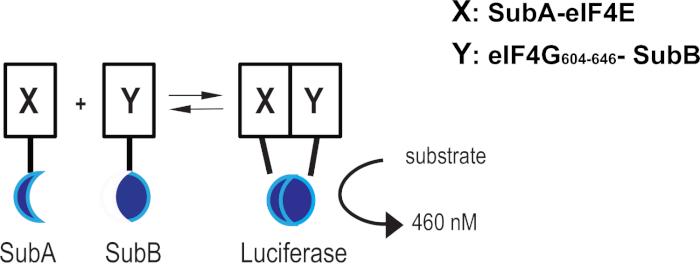
الشكل 1: eIF4E:eIF4G604-646 نظام الاستكمال. تمثيل تخطيطي يبين كيف أن تفاعل البروتين X (eIF4E) والبروتين Y (eIF4G604-646)يمكن اندماجات SubA و SubB من الاقتراب من بعضها البعض وإعادة تشكيل لوسيفيراز النشط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تعطيل مجمع eIF4F بوساطة 4EBP1. (أ)PP242 و rapamycin eIF4E:eIF4G604-646 المقايسة المعايرة نمذجة التفاعل بين eIF4E و eIF4G في خلايا HEK 293 المصابة. (B, C) تحليل لطخة الغربية التي تبين المستوى الداخلي من eIF4E، eIF4G و 4EBP1 في مقتطفات HEK 293 وفي M7GTP سحب أسفل بعد حضانة الخلايا المستزرعة مع تركيز مختلف من PP242 أو راباميسين على التوالي. (د)الخلايا المعالجة في A حيث تم تقييم تعدد مرات بقاء الخلية والتلألؤ. تمثل كافة القيم متوسط ± SD (n = 3). وقد تم تعديل هذا الرقم من16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
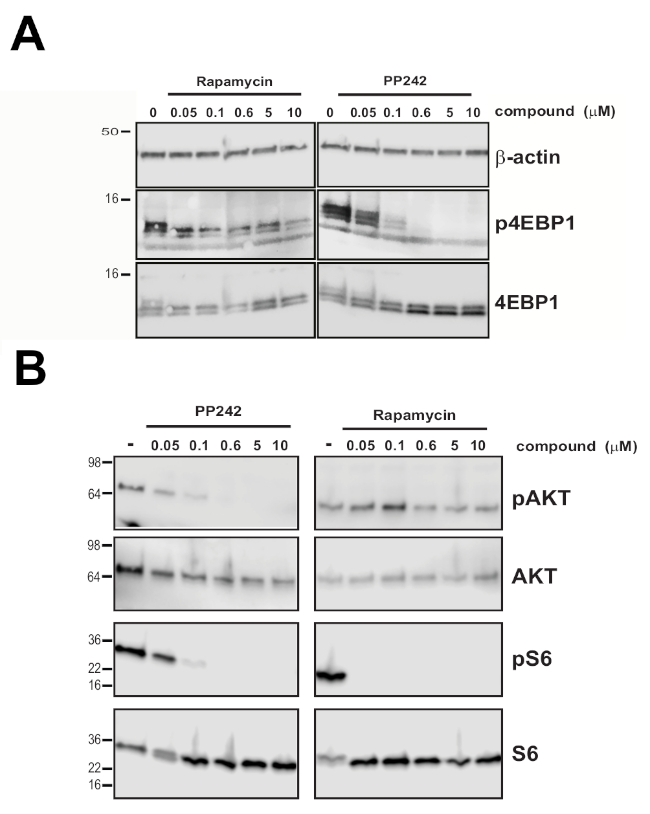
الشكل 3: التأثير التفاضلي لتثبيط mTOR على 4EBP1 phoshorylation. (أ)تحليل لطخة الغربية لحالة الفوسفور من 4EBP1 في خلايا HEK293 غير المصابة تعامل مع تركيز المشار إليها من PP242 وراباميسين. (ب)تحليل لطخة الغربية من حالة الفوسفور AKT و S6 في خلايا HEK293 غير المصابة تعامل إما مع مثبطات الموقع النشط MTORC1/2 المزدوج PP242، أو مثبط الألستيريك من mTORC1 Rapamycin. تم تصور بيتا أكتين للتحكم في التحميل وكذلك إجمالي 4EBP1 و AKT و S6. وقد تم تعديل هذا الرقم من16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تستخدم الطريقة الموضحة في هذه المقالة م المقايسة التكميلية المستندة إلى لوسيفيراز لرصد التجميع المعقد eIF4F كميا من خلال القياس المباشر لتفاعل eIF4G-eIF4E في الخلايا الحية. لقد قدمنا تفاصيل لاستخدام نظام إكمال eIF4E-eIF4G وأظهرنا أيضا أن النظام دقيق للغاية في قياس التفكك بوساطة 4EBP1 الناجم عن المخدرات للتفاعل eIF4E-eIF4G16. من أجل تسهيل الإنتاجية لهذا المقايسة، تم تصميم الإعداد التجريبي الموصوف في هذه المقالة لاستخدام تنسيق 96 microplate جيدا.
للحصول على أفضل النتائج، ينبغي النظر في خطوتين حاسمتين عند إجراء الفحص. أولا، ينبغي أن تظل كفاءة العدوى بين التجارب متشابهة. ويمكن ضمان ذلك من خلال استخدام خلايا عدد المرور المنخفض، ومن خلال عد الخلايا بدقة في يوم البذر. وينبغي أيضا تقييم التقاء الخلايا قبل إجراء نقل الحمض النووي، حيث لا ينصح بإصابة الخلايا مع كاشف العدوى القائم على الدهون إذا كان التقاء الخلايا أقل من 70-90٪. ثانيا، من المهم مضاعفة المقايسة التكميلية مع اختبار صلاحية الخلية. قد تؤثر بعض المركبات على إشارة لوسيفيراز في المقام الأول عن طريق تقليل عدد الخلايا القابلة للحياة من خلال الآثار الضارة. ولذلك، من المهم قياس صلاحية الخلية مباشرة بعد إجراء اختبار الاستكمال eIF4E:eIF4G604-646 لمعالجة الآثار غير المستهدفة وغير المحددة.
واجهات البروتين والبروتين، مثل واحد بين eIF4E و eIF4G، التي تخلو من الشقوق الكارهة للماء وكبيرة نسبيا وبلانار، تعتبر عموما أن تكون "غير مخدرة" من قبل العلاجية جزيء صغير التقليدية (< 500 ميغاواط)17. وبالتالي، هناك اهتمام متزايد في تطوير طرائق جديدة تتفاعل بكفاءة مع هذا النوع من السطوح (مثل المركبات الكلية الكيسية والبيبتيدوميميتيك). ومع ذلك ، فإن العديد من هذه الطرائق الجديدة ليست قادرة بشكل فطري على عبور غشاء الخلية وإشراك هدفها. وللالتفاف على هذه القضايا، تجري العديد من مجموعات البحث أبحاثا حول تحسين المواد الكيميائية الجديدة واستراتيجيات توصيل الخلايا. ونحن نتصور أن eIF4E:eIF4G604-646 فحص PPI الخلية الحية وغيرها من المقايسات المماثلة PPI المستمدة سوف تلعب دورا محوريا في تعزيز هذه الاستراتيجيات والتحقق من صحتها.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا العمل من الميزانية الأساسية من P53lab (BMSI ، A * STAR) ومنحة JCO VIP (A * STAR).
Materials
| Name | Company | Catalog Number | Comments |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| Cell culture microplate 96 well, F-Bottom | greiner bio-one | 655083 | |
| Cell titer Glo 2.0 | PROMEGA | G9241 | |
| Envision Multilabel Reader | PerkinElmer | not applcable | |
| Finnpipette F2 Multichannel Pipettes 12-channels 30-300 ml | Thermo Fisher Scientific | 4662070 | |
| Finnpipette F2 Multichannel Pipettes 12-channels 5-50 ml | Thermo Fisher Scientific | 4662050 | |
| FUGENE6 | PROMEGA | E2692 | |
| Lipofectamine 3000 | Thermo Fisher Scientific | L3000015 | |
| NanoBiT PPI Starter Systems | PROMEGA | N2014 | |
| Optimem I Reduced Serum Mediun, no phenol red | Thermo Fisher Scientific | 11058021 | |
| Orbital shaker | Eppendorf | not appicable | |
| γ-Aminophenyl-m7GTP (C10-spacer)-Agarose | Jena Bioscience | AC-155S |
References
- Silvera, D., Formenti, S. C., Schneider, R. J. Translational control in cancer. Nature Reviews Cancer. 10 (4), 254-266 (2010).
- Gebauer, F., Hentze, M. W. Molecular Mechanism of translational control. Nature Reviews Molecular Cell Biology. 10, 827-835 (2004).
- Bhat, M., et al. Targeting the translation machinery in cancer. Nature Reviews Drug Discovery. 14 (4), 261-278 (2015).
- Pelletier, J., Graff, J., Ruggero, D., Sonenberg, N. Targeting the eIF4F translation initiation complex: a critical nexus for cancer development. Cancer Research. 75 (2), 250-263 (2015).
- Montanaro, L., Pandolfi, P. P. Initiation of mRNA translation in oncogenesis: the role of eIF4E. Cell Cycle. 11, 1387-1389 (2004).
- Merrick, W. C. eIF4E: A retrospective. Journal of Biological Chemistry. 290 (40), 24091-24099 (2015).
- Marcotrigiano, J., Gingras, A. C., Sonenberg, N., Burley, S. K. Cap-dependent translation initiation in eukaryotes is regulated by a molecular mimic of eIF4G. Molecular Cell. 3 (6), 707-716 (1999).
- Umenaga, Y., Paku, K. S., In, Y., Ishida, T., Tomoo, K. Identification and function of the second eIF4E-binding region in N-terminal domain of eIF4G: comparison with eIF4E-binding protein. Biochemical and Biophysical Research Communication. 414 (3), 462-467 (2011).
- Grüner, S., et al. The Structures of eIF4E-eIF4G Complexes Reveal an Extended Interface to Regulate Translation Initiation. Molecular Cell. 64 (3), 467-479 (2016).
- Gingras, A. C., et al. Hierarchical phosphorylation of the translation inhibitor 4E-BP1. Genes and Development. 15 (21), 2852-2864 (2001).
- Dixon, A. S., et al. NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells. ACS Chemical Biology. 11 (2), 400-408 (2016).
- Sun, S. Y. mTOR kinase inhibitors as potential cancer therapeutic drugs. Cancer Letters. 340 (1), 1-8 (2013).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. , Appendix 3: Appendix 3B (2001).
- Sekiyama, N., et al. Molecular mechanism of the dual activity of 4EGI-1: Dissociating eIF4G from eIF4E but stabilizing the binding of unphosphorylated 4E-BP1. Proceedings of the National Academy of Science U. S. A. 112 (30), e4036-e4045 (2015).
- Muller, D., et al. 4E-BP restrains eIF4E phosphorylation. Translation. 1 (2), e25819(2013).
- Frosi, Y., Usher, R., Lian, D. T. G., Lane, D. P., Brown, C. J. Monitoring flux in signalling pathways through measurements of 4EBP1-mediated eIF4F complex assembly. BMC Biology. (1), 40(2019).
- Ran, X., Gestwicki, J. E. Inhibitors of protein-protein interactions (PPIs): An analysis of scaffold choices and buried surface area. Current Opinion in Chemical Biology. 44, 75-86 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved