Method Article
Surveillance de l’assemblage eIF4F en mesurant l’interaction eIF4E-eIF4G dans les cellules vivantes
Dans cet article
Résumé
Ici, nous présentons un protocole pour mesurer l’interaction eIF4E-eIF4G dans les cellules vivantes qui permettrait à l’utilisateur d’évaluer la perturbation induite par les médicaments de la dynamique complexe eIF4F dans les formats de dépistage.
Résumé
La formation du complexe eIF4F s’est montrée être le nœud clé en aval pour la convergence des voies de signalisation qui subissent souvent une activation oncogène chez l’homme. eIF4F est un complexe de fixation de bouchons impliqué dans la phase de recrutement de l’ARNm-ribosome de l’initiation à la traduction. Dans de nombreux modèles cellulaires et précliniques de cancers, la déréglementation de l’eIF4F conduit à une traduction accrue de sous-ensembles spécifiques d’ARNm impliqués dans la prolifération et la survie du cancer. eIF4F est un complexe hétéro-trimeric construit à partir du sous-unité de fixation de bouchon eIF4E, de l’héliase eIF4A et du sous-unité d’échafaudage eIF4G. L’interaction protéine-protéine entre les protéines eIF4E et les protéines eIF4G est essentielle pour l’assemblage de complexes eIF4F actifs. Dans cet article, nous décrivons un protocole pour mesurer l’assemblage eIF4F qui surveille l’état de l’interaction eIF4E-eIF4G dans les cellules vivantes. L’analyse d’interaction protéine-protéine à base de cellules eIF4e:4G permet également d’évaluer avec précision et fiabilité les changements induits par les médicaments dans l’intégrité du complexe eIF4F. Nous envisageons que cette méthode puisse être appliquée pour vérifier l’activité des composés disponibles dans le commerce ou pour le dépistage plus avant de nouveaux composés ou modalités qui perturbent efficacement la formation du complexe eIF4F.
Introduction
Le contrôle de l’expression des gènes joue un rôle central dans l’exécution correcte des programmes cellulaires tels que la prolifération de la croissance et la différenciation. Un mécanisme de contrôle réglementaire peut être exercé soit au niveau de la transcription des gènes, soit au niveau de la traduction de l’ARNm. Au cours de la dernière décennie, il est devenu de plus en plus évident que le contrôle translationnel par modulation du processus d’initiation plutôt que par les étapes ultérieures de l’allongement et de l’arrêt peut réguler finement la synthèse de sous-ensembles spécifiques de protéines qui jouent un large éventail de fonctions biologiques.
Une traduction accrue des ARNN impliqués dans la survie, les réponses anti-autophagiques et antipoptotiques ont été impliquées dans plusieurs cancers et ont également été causativement liées à l’activation aberrante ou à la sur-expression des facteurs d’initiation à latraduction 1.
Le complexe eIF4F est un régulateur principal de l’initiation à la traduction. En liant la structure du plafond à la fin de 5' des ARNM, eIF4F conduit le recrutement initial d’ARNm-ribosome et augmente à son tour l’efficacité de traduction de l’ARNm de mRNAs eucaryotesfaiblement traduits 2. La traduction médiatisée eIF4F des ARNM liés au cancer a été signalée pour de nombreux modèles de cancer abritant l’activation aberrante des voies RAS/MAPK ou AKT/TOR, ce qui suggère que les cellules cancéreuses upregulate eIF4F pour stimuler leur propre activité pro-néoplastique. La perturbation de cette boucle d’alimentation vers l’avant en inhibant la formation complexe eIF4F est donc une stratégie thérapeutiquetrès prometteuse 3,4.
Le complexe eIF4F se compose de (i) eIF4E, le sous-unité liant le bouchon de l’eIF4F qui interagit avec la structure du bouchon trouvée à l’UTR de 5' de l’ARNm, (ii) eIF4A, l’hélicase arn et (iii) eIF4G, la protéine échafaudage qui interagit à la fois avec eIF4A et eIF4E et qui recrute finalement le subunit ribosomal 40S5. l’association eIF4G avec eIF4E est l’étape limitant les taux pour l’assemblage de complexes fonctionnels eIF4F et elle est négativement réglementée par les protéines liantes eIF4E (4EBPs, membres 1, 2 et 3))6. En concurrence avec la liaison eIF4G à l’eIF4E par le biais d’une interface composée de séquences de liaison eIF4E canoniques et non canoniques7,8,9 (région couvrant aa 604-646 sur eIF4E humain), 4EBP réduit le pool d’eIF4E activement impliqué dans la traduction et la prévention de la formation complexe eIF4F. L’interaction de ces interactions protéine-protéine est principalement régulée par la cible mammifère de la phosphorylation 201ée de 4EBP par la rapamycine (mTOR). Sur les stimuli mitogéniques, mTOR phosphorylate directement les membres de la famille des protéines 4E-BP, diminuant leur association avec eIF4E et, par conséquent, favorisant l’interaction eIF4E-eIF4G et la formation de complexes fonctionnels eIF4F10.
Malgré le grand effort dans le développement de composés ciblant l’intégrité complexe eIF4F, l’absence d’analyses mesurant la perturbation directe de l’interaction eIF4E-eIF4G dans les cellules vivantes a limité la recherche de composés cellulaires actifs touchés. Nous avons appliqué un test de luciferase basé sur un analogue de coelenterazine (par exemple, analyse de complémentarité basée sur Nanoluc) pour surveiller en temps réel l’état de l’intégrité eIF4F grâce à l’interaction eIF4E-eIF4G. Le système de protéine de complémentarité de luciferase se compose d’un fragment de protéine de 18 kDa (SubA) et de 11 fragments de peptide d’acide aminé (SubB) optimisés pour l’auto-association minimale et lastabilité 11. Une fois exprimées comme un produit de fusion avec l’eIF4E pleine longueur humaine et le domaine d’interaction eIF4E de l’eiF4G1 humain (aa 604-646), les deux protéines en interaction amèneront le fragment suba et subb à proximité les unes des autres et induiront la formation de la luciferase active qui, en présence d’un substrat perméable à cellules, finira par générer un signal lumineux luminescent (Figure 1). Nous avons signalé ailleurs la construction et la validation du système de complémentarité eIF4E:eIF4G604-646 16.
Ici, nous décrivons comment le système de complémentarité eIF4E:eIF4G604-646 (disponible sur demande) peut être appliqué pour mesurer avec précision les perturbations eIF4E-eIF4G 4EBP1-201 dans les cellules vivantes. En outre, nous démontrons son utilité en mesurant les effets de plusieurs inhibiteurs de mTOR qui sont actuellement en cours d’essais cliniques en tant que médicaments thérapeutiques potentiels contre le cancer12. Étant donné que les effets hors cible masquent souvent l’activité spécifique aux médicaments, nous décrivons également comment la polyvalence de la mesure du système eIF4E:eIF4G604-646 peut être étendue avec des mesures orthogonales de la viabilité cellulaire pour en tenir compte.
Protocole
La lignée cellulaire HEK293 a été utilisée pour le protocole et a été cultivé dans le milieu modifié de l’aigle de Dulbecco complété par 10 % de sérum bovin fœtal, 2 mM de L-glutamine et 100 U/mL de pénicilline/streptocotomycine. Les cellules ont été cultivés à 37 °C avec 5% de CO2 dans un environnement humidifié.
1. Évaluation quantitative des perturbations complexes eIF4F via eIF4E:eIF4G604-646 test de complémentarité
- Culture cellulaire et passagère transitoire de l’eIF4E:eIF4G604-646 test de complémentarité
- Utilisez des cellules fraîchement décongelées avec moins de 20 passages pour toutes les expériences. Le jour 1, déterminez le numéro de cellule à l’aide d’un compteur cellulaire standard et comptez le nombre total de cellules viables à l’aide de la méthode d’exclusion bleue Trypan13.
- Graine plaques de 6 puits avec 0,9 - 1,2 x 106 de HEK 293 cellules par puits dans 2 mL de milieu de croissance standard.
REMARQUE : Afin d’atteindre la meilleure efficacité de transfection dans les lignées cellulaires indiquées ci-dessus, assurez-vous que les cellules plaquées sont confluentes à 70-90 % le lendemain de l’ensemencement. - Le matin du jour 2, cellules co-transfectibles avec SubA-eIF4E et eIF4G604-646-SubB plasmide à l’aide d’un réaccérable transfection à base de lipides (voir tableau des matériaux) tel que décrit ci-dessous.
- Diluer 9 μL de solution à base de liposome dans un tube contenant 125 μL de sérum moyen réduit sans rouge phénol (voir tableau des matériaux)pour chaque transfection et incuber à température ambiante pendant 5 min.
- Préparer le mélange principal d’ADN en diluant 3 μg de chaque plasmide dans 125 μL de sérum moyen réduit pour chaque tube de transfection.
- Ajouter 12 μL de reagents enhancer au tube de mixage maître ADN, bien mélanger et ajouter immédiatement l’ADN: enhancer master mix à chaque tube de liposomes dilués dans un rapport 1:1. Incuber pendant 15 min à température ambiante.
- Ajouter le complexe ADN-lipide à chaque puits et incuber les cellules dans un incubateur à 37 °C avec 5 % de CO2 pendant 24 h.
- Le matin du jour 3, rincer chaque puits avec 1 mL de PBS.
- Retirer le PBS et les cellules d’incubation dans chaque puits avec 0,3 mL de trypsine pendant 5 min à 37 °C.
- Neutraliser la trypsine en ajoutant 2 mL du milieu de sérum réduit sans rouge phénol contenant 0% de FCS dans chaque puits et transférer les cellules transfectées dans un tube de 15 mL.
REMARQUE : Le rouge phénol peut interférer avec l’activité de la luciferase; par conséquent, les cellules doivent être manipulées à partir de cette étape dans le milieu sans rouge phénol. - Faire tourner les cellules pendant 5 min à 290 x g et aspirer le milieu. Resuspendez les cellules dans 2 mL du milieu réduit de sérum sans rouge phénol contenant 0% FCS. Comptez tel que décrit à l’étape 1.1.
- Les graines ont transfecté les cellules HEK 293 dans 96 plaques bien opaques à une densité de 30 000 cellules par puits dans 90 μL de milieu sans rouge phénol contenant 0 % de SFC. Afin d’obtenir 3 répliques techniques dans le cadre d’une même expérience pour 3 composés différents, les semences 60 puits des plaques avec des cellules à l’exclusion des puits sur les bords.
- Immédiatement après l’ensemencement des cellules transfectées, ajouter 10 μL de solution composée 10 % de DMSO (voir l’étape 1.2).
- Préparation composée
- Préparez des solutions d’actions composées de 1 mM en dissolvant le composé d’intérêt dans 100% DMSO (v/v). Afin d’avoir 3 répétitions pour chaque titration composée, utilisez 8 μL de la solution de stock composé de 1 mM.
REMARQUE : Le volume du composé de stock de 1 mM utilisé est plus élevé que ce dont il a besoin. Ceci est fait pour prendre en compte les erreurs de pipetting le cas échéant. - Effectuer une dilution en série 2 fois de la solution composée de stock avec 4 μL du stock de 1 mM en 4 μL de 100% DMSO pour chaque point de titration.
REMARQUE : Pour une titration composée complète, effectuez 9 dilutions en série à partir du stock de départ dans 100% DMSO. Si plusieurs composés doivent être testés, utilisez une plaque de puits 96 et une pipette multicanal pour faciliter cette étape et les dilutions subséquentes. - Ajouter 36 μL d’eau stérile de qualité HPLC pour chaque point de la dilution sérielle 2 fois pour préparer un 40 μL de solutions de travail 10x dans 10% DMSO (v/v) (c.-à-d. 100 μM à 0,39 μM 10% Série d’actions DMSO conduira à une solution finale de 10 μM à 0,039 μM, en 1% DMSO lorsqu’il est ajouté aux cellules). En ce qui concerne le contrôle du traitement, également préparer une solution de stock de 10% DMSO seulement dans l’eau stérile de qualité HPLC.
- Ajouter 10 μL de solutions de travail 10x aux cellules de la plaque 96 bien opaque afin de produire la concentration finale prévue avec une concentration résiduelle de DMSO de 1% (v/v) dans un volume total de 100 μL et d’incuber pendant 3 h à 37 °C avec 5% v/v de COatmosphérique 2.
- Préparez des solutions d’actions composées de 1 mM en dissolvant le composé d’intérêt dans 100% DMSO (v/v). Afin d’avoir 3 répétitions pour chaque titration composée, utilisez 8 μL de la solution de stock composé de 1 mM.
- Complémentarité et viabilité de Luciferase
- Après 3 h de drogue, commencer à préparer le réaccente du substrat de luciferase en combinant 1 volume de substrat avec 19 volumes du reagent de dilution (voir les instructions du fabricant).
REMARQUE : L’essai de luciferase est effectué à l’aide d’un kit disponible dans le commerce (voir tableau des matériaux). - Utilisez une pipette multicanal pour ajouter immédiatement 25 μL de réageni de substrat.
- Secouez la plaque à 350 rpm pendant 50 min sur un shaker orbital à température ambiante.
- Évaluer la luminescence à l’aide d’un lecteur de plaques. Pour ce faire, réglez le lecteur miroir sur la luminescence et le filtre d’émission sur 455. Utilisez une hauteur de mesure de 6,5 mm avec un temps de mesure de 1 s.
- Afin d’évaluer la viabilité des cellules, ajouter 33 μL de réagencé de viabilité, puis re-mesurer la luminescence à nouveau après 15 min à température ambiante, en utilisant le lecteur de plaque.
- Évaluez la luminescence avec le lecteur de plaque en fixant le lecteur miroir sur Luminescence et le filtre d’émission sur 600 nm. Utilisez une hauteur de mesure de 6,5 mm avec un temps de mesure de 1 s.
REMARQUE : La viabilité est évaluée en mesurant le niveau intracellulaire d’ATP sur la lyse cellulaire selon les instructions du fabricant. Le multiplexage est possible dans ce cas puisque l’analyse de viabilité utilise une luciferase différente avec une longueur d’onde d’émission différente. - Utilisez les données pour déterminer les valeurs IC50 de chaque composé en adaptant les données à une équation de courbe d’ajustement de 4 paramètres :
Y = ((A-D)/(1+(x/C)^B)) + D
Les valeurs numériques D et A doivent être limitées dans le processus d’ajustement de la courbe :
D = valeur luminescente sur l’axe Y pour l’asymptote de courbe minimale ou le niveau théorique minimal de réponse attendu de l’essai de complémentarité eIF4E:4G.
A = valeur luminescente sur l’axe Y pour l’asymptote de courbe maximale ou la réponse théorique maximale attendue de l’essai de complémentarité eIF4E:4G.
REMARQUE : La valeur de la réponse minimale est dérivée du traitement de contrôle de 1 % du DMSO (v/v) et la valeur de la réponse maximale est dérivée de la réponse maximale d’un inhibiteur mTOR à haute affinité qui a plafonné sans effet sur la viabilité cellulaire.
- Après 3 h de drogue, commencer à préparer le réaccente du substrat de luciferase en combinant 1 volume de substrat avec 19 volumes du reagent de dilution (voir les instructions du fabricant).
2. Corrélation eIF4E:eIF4G604-646 inhibition d’essai avec perturbation complexe eIF4F dans les cellules
- Pour confirmer que le signal mesuré par l’analyse correspond à la perturbation physique de l’interaction eIF4E-eIF4G par le composé, les cellules de graines décrites à l’étape 1.1.
- Le lendemain, remplacer le milieu par 1 mL de sérum réduit moyen ne contenant pas de phénol rouge et incuber pendant 4 h avec le composé d’intérêt. Assurer une concentration résiduelle de DMSO de 1 % (v/v) dans un volume total de 1 mL.
REMARQUE : Afin de permettre facilement une corrélation avec le résultat, utilisez des concentrations composées au début, au point médian et au point final de la courbe de titration d’analyse de complémentarité mesurée. - Les cellules de Lyse et les cellules m7GTP exécutées tirent vers le bas pour isoler les complexes eIF4F et eIF4E:4EBP1. Des procédures détaillées sur la façon d’effectuerl’expériencede traction m 7 GTP peuvent être trouvées ailleurs14.
- Détecter m7GTP lié eIF4G, eIF4E et 4EBP1 niveaux de protéines par l’analyse des taches occidentales, puis corréler à la perturbation complexe eIF4F avec inhibition du signal d’essai de complémentation.
Résultats
Afin de valider la sensibilité du système de complémentarité eIF4E:eIF4G604-646, l’inhibition 4EBP1 de l’assemblage complexe eIF4F a été évaluée à l’aide d’inhibiteurs mTOR. En inhibant la phosphorylation dépendante de la kinase mTORC1 de la famille des protéines 4EBP, l’inhibition du mTOR améliore l’association 4EBP1 à l’eIF4E et, par conséquent, le démontage eIF4F15. Deux classes d’inhibiteurs mécanistes différents des kinases mTOR ont été testées : les rapalogs (p. ex., rapamycine) qui sont des inhibiteurs allosteriques du mTORC1 mais pas du mTORC2 et des inhibiteurs à base de compétition ATP (p. ex., PP242) qui sont conçus pour inhiber spécifiquement l’activité catalytique du mTORC1 et du mTORC2 kinase.
Les cellules HEK293 ont été transfectées avec le système de complémentarité eIF4E:eIF4G604-646 tel que décrit à l’étape 1. Après 24 h de transfection, les cellules ont été resemencées et traitées avec les inhibiteurs du mTOR PP242 et la rapamycine (tel que décrit à l’étape 1.2). Quatre heures après le traitement, la luminescence a été évaluée, comme décrit précédemment, suivie de la viabilité cellulaire. Comme le montre la figure 2, PP242 produit une inhibition dépendante de la dose du signal avec un IC50 calculé de 0,72 ± 0,04 μM, tandis qu’un IC50 de 6,88 ± 0,88 μM est dérivé de la rapamycine (figure 2A). Les plaques ont ensuite été multiplexées pour l’analyse de viabilité cellulaire (Figure 2D). Cette analyse montre que ni PP242 ni rapamycine ne produit une diminution significative de la viabilité cellulaire, prouvant que la diminution de la luminescence dans le système de complémentarité eIF4E:eIF4G604-646 n’est pas due à la mort cellulaire non spécifique, mais plutôt par la perturbation de l’interaction eIF4E:4G.
Une expérience de traction m7GTP effectuée en incubant des cellules non infectées avec des concentrations composées qui correspondent aux points de début, de milieu et d’extrémité de la courbe de titration mesurée à la figure 2A montre que la perturbation 4EBP1-246 de l’interaction eIF4E-eIF4G est corrélée avec l’eIF4E mesurée : eIF4G604-646 signal d’essai(figure 2B, 2C). Conformément à ces résultats, pp242 s’est révélé être un inhibiteur plus puissant de la phosphorylation totale 4EBP1 que la rapamycine dans les conditions expérimentales testées dans les cellules HEK 293 (Figure 3A), tandis que les deux inhibiteurs ont montré un impact à la signalisation mTOR normalement, avec la rapamycine étant plus active contre les substrats mTORC1 et PP242 ciblant à la fois mTORC1 et mTORC2 (Figure 3B).
Pris ensemble, ces résultats ont montré que PP242 est plus efficace pour perturber la formation complexe eIF4F que la rapamycine dans les cellules HEK293 et démontrent en outre que le système eIF4E:eIF4G604-646 peut mesurer avec précision l’assemblage complexe eIF4F dans les cellules vivantes.
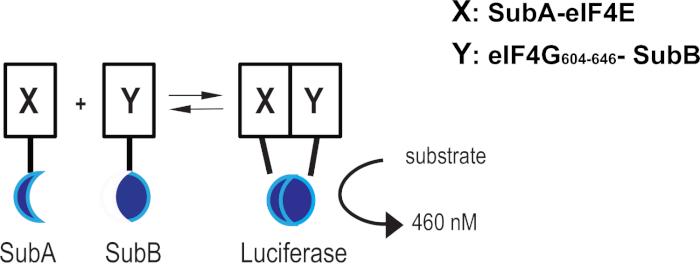
Figure 1 : système de complémentarité eIF4E:eIF4G604-646. Représentation schématique montrant comment l’interaction des fusions protéine X (eIF4E) et protéine Y (eIF4G604-646)permet aux fusions SubA et SubB de se proximité les unes avec les autres et de reconstituer la luciferase active. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Perturbation 4EBP1 du complexe eIF4F. (A) PP242 et rapamycine eIF4E:eIF4G604-646 analyse de titration modélisant l’interaction entre eIF4E et eIF4G dans les cellules TRANSfected HEK 293. (B,C) Analyse des taches occidentales montrant le niveau endogène d’eIF4E, eIF4G et 4EBP1 dans les extraits hek 293 et dans m7GTP tirer vers le bas après incubation de cellules de culture avec une concentration différente de PP242 ou Rapamycin respectivement. (D) Cellules traitées en A où multiplexed pour la viabilité cellulaire et la luminescence évaluée. Toutes les valeurs représentent ± SD (n=3). Ce chiffre a été modifié à partirde 16. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
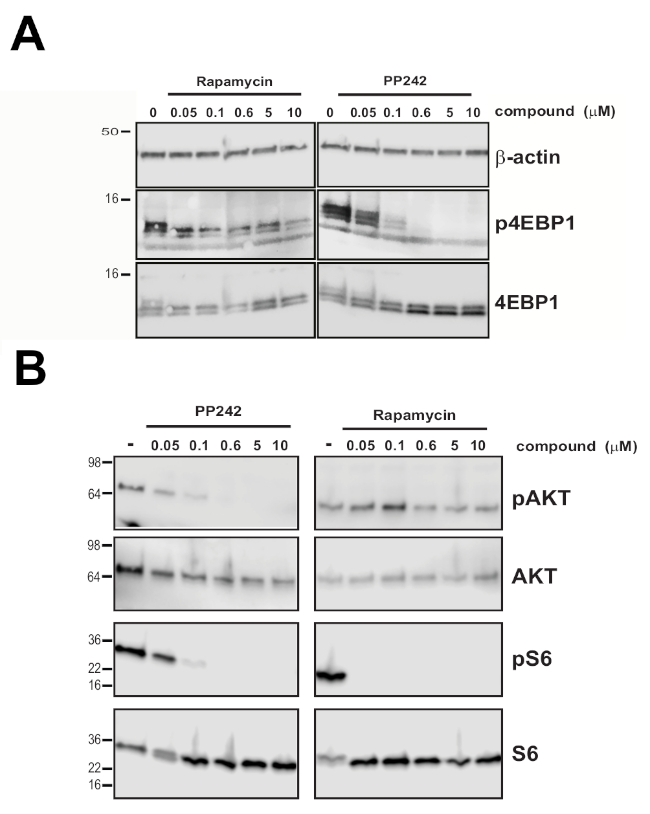
Figure 3 : Effet différentiel de l’inhibition du mTOR sur la phoshorylation 4EBP1. (A) Analyse occidentale de tache de l’état de phosphorylation de 4EBP1 dans les cellules HEK293 non transfected traitées avec la concentration indiquée de PP242 et de rapamycine. (B) Analyse de tache occidentale de l’état de phosphorylation d’AKT et de S6 dans les cellules non transfected de HEK293 traitées avec les inhibiteurs actifs dual MTORC1/2 de site PP242, ou l’inhibiteur allosteric de la rapamycine mTORC1. Beta actin a été visualisé pour le contrôle de chargement ainsi que le total 4EBP1, AKT et S6. Ce chiffre a été modifié à partirde 16. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
La méthode décrite dans cet article utilise un test de complémentarité basé sur la luciferase pour surveiller quantitativement l’assemblage complexe eIF4F par mesure directe de l’interaction eIF4G-eIF4E dans les cellules vivantes. Nous avons fourni des détails pour l’utilisation du système de complémentarité eIF4E-eIF4G et nous avons également montré que le système est extrêmement précis dans la mesure de la dissociation médicamenteuse induite par 4EBP1 de l’interaction eIF4E-eIF4G16. Afin de faciliter le débit de cet essai, la configuration expérimentale décrite dans cet article a été conçue pour une utilisation de format 96 microplaqués bien.
Pour obtenir des résultats optimaux, deux étapes critiques doivent être envisagées lors de l’analyse. Premièrement, l’efficacité de la transfection entre les expériences devrait rester similaire. Ceci peut être assuré par l’utilisation de cellules à faible nombre de passage, et en comptant rigoureusement les cellules le jour de l’ensemencement. La confluence cellulaire devrait également être évaluée avant la transfection de l’ADN, car il n’est pas recommandé de transfecter les cellules avec réaccfection transfection à base de lipides si la confluence cellulaire est inférieure à 70-90%. Deuxièmement, il est important de multiplexer l’analyse de complémentarité avec un essai de viabilité cellulaire. Certains composés peuvent avoir un impact sur le signal de luciferase principalement en diminuant le nombre de cellules viables par des effets délétères. Il est donc important de mesurer la viabilité de la cellule immédiatement après l’analyse de complémentarité eIF4E:eIF4G604-646 pour traiter les effets non cibles et non spécifiques.
Les interfaces protéines-protéines, comme celle entre eIF4E et eIF4G, dépourvues de fissures hydrophobes et relativement grandes et planaires, sont généralement considérées comme « non médicamentables » par les petites molécules thérapeutiques conventionnelles (<500 MW)17. Ainsi, on s’intéresse de plus en plus au développement de nouvelles modalités qui interagissent efficacement avec ce type de surfaces (p. ex., composés macrocycliques et peptidomimétiques). Cependant, bon nombre de ces nouvelles modalités ne sont pas innées capables de traverser la membrane cellulaire et d’engager leur cible. Pour contourner ces problèmes, de nombreux groupes de recherche mènent des recherches sur de nouvelles stratégies d’optimisation chimique et d’administration cellulaire. Nous envisageons que le test eIF4E:eIF4G604-646 live cell PPI et d’autres essais similaires dérivés de l’IPP joueront un rôle central dans la promotion de ces stratégies et leur validation.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux ont été appuyés par le budget de base du p53lab (BMSI, A*STAR) et de la subvention VIP de l’ACO (A*STAR).
matériels
| Name | Company | Catalog Number | Comments |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| Cell culture microplate 96 well, F-Bottom | greiner bio-one | 655083 | |
| Cell titer Glo 2.0 | PROMEGA | G9241 | |
| Envision Multilabel Reader | PerkinElmer | not applcable | |
| Finnpipette F2 Multichannel Pipettes 12-channels 30-300 ml | Thermo Fisher Scientific | 4662070 | |
| Finnpipette F2 Multichannel Pipettes 12-channels 5-50 ml | Thermo Fisher Scientific | 4662050 | |
| FUGENE6 | PROMEGA | E2692 | |
| Lipofectamine 3000 | Thermo Fisher Scientific | L3000015 | |
| NanoBiT PPI Starter Systems | PROMEGA | N2014 | |
| Optimem I Reduced Serum Mediun, no phenol red | Thermo Fisher Scientific | 11058021 | |
| Orbital shaker | Eppendorf | not appicable | |
| γ-Aminophenyl-m7GTP (C10-spacer)-Agarose | Jena Bioscience | AC-155S |
Références
- Silvera, D., Formenti, S. C., Schneider, R. J. Translational control in cancer. Nature Reviews Cancer. 10 (4), 254-266 (2010).
- Gebauer, F., Hentze, M. W. Molecular Mechanism of translational control. Nature Reviews Molecular Cell Biology. 10, 827-835 (2004).
- Bhat, M., et al. Targeting the translation machinery in cancer. Nature Reviews Drug Discovery. 14 (4), 261-278 (2015).
- Pelletier, J., Graff, J., Ruggero, D., Sonenberg, N. Targeting the eIF4F translation initiation complex: a critical nexus for cancer development. Cancer Research. 75 (2), 250-263 (2015).
- Montanaro, L., Pandolfi, P. P. Initiation of mRNA translation in oncogenesis: the role of eIF4E. Cell Cycle. 11, 1387-1389 (2004).
- Merrick, W. C. eIF4E: A retrospective. Journal of Biological Chemistry. 290 (40), 24091-24099 (2015).
- Marcotrigiano, J., Gingras, A. C., Sonenberg, N., Burley, S. K. Cap-dependent translation initiation in eukaryotes is regulated by a molecular mimic of eIF4G. Molecular Cell. 3 (6), 707-716 (1999).
- Umenaga, Y., Paku, K. S., In, Y., Ishida, T., Tomoo, K. Identification and function of the second eIF4E-binding region in N-terminal domain of eIF4G: comparison with eIF4E-binding protein. Biochemical and Biophysical Research Communication. 414 (3), 462-467 (2011).
- Grüner, S., et al. The Structures of eIF4E-eIF4G Complexes Reveal an Extended Interface to Regulate Translation Initiation. Molecular Cell. 64 (3), 467-479 (2016).
- Gingras, A. C., et al. Hierarchical phosphorylation of the translation inhibitor 4E-BP1. Genes and Development. 15 (21), 2852-2864 (2001).
- Dixon, A. S., et al. NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells. ACS Chemical Biology. 11 (2), 400-408 (2016).
- Sun, S. Y. mTOR kinase inhibitors as potential cancer therapeutic drugs. Cancer Letters. 340 (1), 1-8 (2013).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. , Appendix 3: Appendix 3B (2001).
- Sekiyama, N., et al. Molecular mechanism of the dual activity of 4EGI-1: Dissociating eIF4G from eIF4E but stabilizing the binding of unphosphorylated 4E-BP1. Proceedings of the National Academy of Science U. S. A. 112 (30), e4036-e4045 (2015).
- Muller, D., et al. 4E-BP restrains eIF4E phosphorylation. Translation. 1 (2), e25819(2013).
- Frosi, Y., Usher, R., Lian, D. T. G., Lane, D. P., Brown, C. J. Monitoring flux in signalling pathways through measurements of 4EBP1-mediated eIF4F complex assembly. BMC Biology. (1), 40(2019).
- Ran, X., Gestwicki, J. E. Inhibitors of protein-protein interactions (PPIs): An analysis of scaffold choices and buried surface area. Current Opinion in Chemical Biology. 44, 75-86 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon