Method Article
操作された腫瘍関連好中球を腫瘍性マウスに移植し、生体内の血管新生電位を研究する
要約
ここで、腫瘍担持マウスへの移植後の抗血管新腫腫瘍関連好中球の治療可能性を示す。このプロトコルは、好中球活性ex vivoを操作し、その後、腫瘍の発達における生体内でその機能性を評価するために使用することができる。これは、潜在的な好中球ベースの免疫療法を研究するための適切なモデルです。
要約
腫瘍形成の調節に対する好中球の寄与が注目を集めている。これらの細胞は不均一であり、腫瘍に応じて、プロまたは抗腫瘍能力を有することができる。腫瘍コンテキストにおける好中球機能を調節する重要なサイトカインの1つは、I型インターフェロンである。インターフェロンの存在下では、好中球は、細胞毒性または免疫系の刺激を含む抗腫瘍特性を得る。逆に、インターフェロンシグナル伝達の欠如は顕著なプロ腫瘍活性をもたらす、腫瘍血管新生の強い刺激を特徴とする。最近、好中球の血管新生作用は、これらの細胞におけるニコチンアミドリンオリボシルトランスフェラーゼ(NAMPT)シグナル伝達経路の活性化に依存することを実証することができた。腫瘍関連好中球におけるこの経路の阻害は、それらの強力な抗血管新生表現型をもたらす。ここでは、新たに確立されたモデルを実証し、腫瘍関連好中球(TAN)の腫瘍性電位の生体内評価を可能にする。まもなく、腫瘍に関連する腫瘍関連好中球は、腫瘍担持性インターフェロン欠損マウスから単離し、NAMPTシグナル伝達の遮断によって抗血管新生表現型に再分極することができる。これらの細胞の血管新生活性は、その後、大動脈環アッセイを用いて評価することができる。抗血管新生TANは、腫瘍を有する野生型レシピエントに転移することができ、腫瘍の増殖を14日間監視する必要があります。14日目にマウスを屠殺し、腫瘍を除去し、血管を評価して切断する。全体として、我々のプロトコルは、人工好中球細胞株モデルを使用する必要なしに、腫瘍関連好中球などの一次細胞の血管新生容量を生体内で評価するための新しいツールを提供する。Vc
概要
タイプIインターフェロン(IFN)は、新生物に対する宿主応答の刺激において重要な役割を果たし、タイプI IFNシグナル伝達の欠如は腫瘍増殖を有意に上昇させる1.このプロセスに関与するメカニズムの1つは、腫瘍関連好中球の腫瘍活性の調節であり、これはコロニー刺激因子3受容体(CSF3R)下流シグナル伝達2によって制御される。コロニー刺激因子3(CSF3)、または顆粒球コロニー刺激因子は、ニコチンアミドホスオリボシルトランスフェラーゼ(NAMPT)3、4を含むシグナル伝達を活性化することが示された。NAMPTは、ニコチンアミドアデニンジヌクレオチド合成のためのレート制限酵素であり、これは糖分解を増強し、DNA修復、遺伝子発現、および癌細胞の生存および増殖を促進するストレス応答を調節する5。NAMPTは、大腸、卵巣、乳房、胃、前立腺癌および神経膠腫6を含む複数の癌タイプで過剰発現される。NAMPTは、腫瘍細胞だけでなく、骨髄細胞などの腫瘍に存在する他の多種多様な細胞型に不可欠であり、その分化を促進し、アポトーシスを阻害し、複数のサイトカインの発現を刺激するか、マクロファージ7におけるマトリックス分解酵素。
腫瘍関連好中球は、腫瘍増殖の重要な調節因子を表す。TAN機能は、これらのサイトカインが好中球の主要な抗腫瘍活性として、I型IFNの利用可能性に強く依存する。反対に、IFNの不在は、これらの細胞、特に血管新生作用の腫瘍性活性化を支持する。これに合致して、IFNに欠損したマウスは、腫瘍/陽間異性好中球1、2、8、および強く浸潤している有意に大きく、より良い血管腫瘍を発症する。9,10.重要なことに、このような血管新生TANはNAMPTの活性の上昇を示し、好中球の腫瘍偏光にその重要な役割を示唆している。
Ly6G抗体を用いた好中球の枯渇またはそれらの移行の阻害(CXCR2抗体)は、腫瘍血管新生、増殖、および転移1、8の減少をもたらす。それにもかかわらず、生成されたモノクローナル抗体は免疫原性であり、その投与は生命を脅かす副作用の範囲と関連している11。好中球腫瘍原性を調節するNAMPT阻害剤FK866などの低分子による治療は、そのような合併症を回避するのに役立つ可能性がある。残念ながら、NAMPTの薬理学的全身阻害は、腫瘍増殖に対するその治療効果の隣に、胃腸毒性および血小板減少症を含む重篤な副作用をもたらす。したがって、NAMPT阻害剤の全身的な適用は、12、13、14では実現可能ではない。
このため、ここでは、NAMPT アクティビティが分離された TAN で直接ブロックされるプロトコルを提案します。このような抗腫瘍好中球は、次に、腫瘍担持宿主に採用的に伝達される。このプロトコルは、化合物の全身毒性副作用を回避するのに役立ちます, 標的細胞への影響が持続しながら、.
プロトコル
動物の被験者を含むすべての手順は、規制当局によって承認されています:LANUV(ランデサムト・フュール・ナチュラル、ウムウェルト・ウンド・ヴェルブラウシュツNRW)とレジエルンスプラシジウム・テュービンゲン。すべての操作は、滅菌試薬と器具(注射器、はさみ、鉗子、使い捨てメス、ペトリ皿)を使用して、滅菌条件(層状流フードの下で)で行われるべきです。
注: プロトコルの全体的なスキームを図 1に示します。
1. B16F10黒色腫細胞株の調製
- イスコベの修飾ダルベッコ培地(IMDMc:IMDMc:IMDM+10%胎児ウシ血清(FBS)+1%ペニシリン-ストレプトマイシン)で90%コンフルエント単層(約10 x 106細胞/T75フラスコ)に増殖したマイコプラズマ陰性細胞を調製する。
- 培地を取り出し、リン酸緩衝生理食生(PBS)で細胞をすすいで下す。プロテオ分解酵素とコラージュ分解酵素を含む細胞剥離液を6mL塗布し(材料表参照)、37°Cで2分間インキュベートします。
- フラスコをそっとノックし、残りの付着細胞を下から動員します。15 mLチューブと遠心分離機でセル懸濁液を300 x gで7分と20°Cで回収します。
- 上清を取り出し、PBSの1mLでペレットをよく再中断する。PBSと遠心分離機の14 mLを追加します(300 x gと20 °C 7分間)。
- 上清を取り出し、PBSの1mLでペレットを再中断します。
- 細胞を数え、3 x 106/mL PBSの濃度(ステップ2の場合)または6 x 106/mL PBS(ステップ6の場合)に再中断します。最大30分間氷の上にセルを保持します。
2. マウスの同原性腫瘍モデル
- 特定病原体不自由(SPF)条件下で保持されている10匹の雌Ifnar1-/-マウス8-12週齢を使用する。
注:雌マウスは、男性がより積極的であり、したがって腫瘍の成長に影響を与える腫瘍部位の侵害を起こしやすいので、腫瘍増殖の皮下モデルで好ましい。 - 電気的な剃り器で側面にマウスの皮膚を剃り、70%のエタノールで濡した組織で皮膚を消毒する。
- 1 mL注射器と0.4 x 19 mm針で3 x 106/mL PBS(ステップ1を参照)の濃度で調製したB16F10黒色腫細胞を採取する。懸濁液の100 mLを皮下に注入する。
- すべての注射の前によく細胞を混合します。腫瘍細胞を妨げないように直径0.4mm以上の針を使用してください。
- 1つのケージに最大5匹のマウスを置き、14日間キャリパーで腫瘍サイズ(長さ、幅、深さ)を制御します。
注:動物の規則に従って、腫瘍のサイズは直径15ミリメートルを超えてはならない、より大きいまたは壊死性/開いた腫瘍を有するマウスは、事前に犠牲にする必要があります。 - 14日目に、CO2チャンバ内でマウスを犠牲にする。
- 70%のエタノールで皮膚を消毒し、生殖不能のペトリ皿ではさみと鉗子で腫瘍を取り除きます。完全なダルベッコの修飾イーグル媒体(DMEMc:DMEM:DMEM+10%FBS+1%ペニシリン連鎖マイシン)の50 mLチューブに腫瘍を保ちます。
3. TAN 分離
- 滅菌6ウェルプレートに腫瘍を配置し、ウェルあたり5腫瘍。生殖不能のはさみで腫瘍を2〜3mmの部分に切ります。
- ジスパーゼ/コラゲナーゼD/DNase I溶液の1 mLでダイジェスト(DMEMcの1mLで0.2mg/0.2mg/100mg)。湿度の高いインキュベーターで37°C、5%CO2でインキュベートし、15分3回ごとに針なしで10mLシリンジと混合します。
- 未消化繊維を除去するには、100 μm フィルターを通してメッシュセルを 15 mL チューブ (チューブごとにフィルターごとに 1 つ) にします。PBSを15mLに、遠心管を460xg、4°Cを5分間加え、上清を取り除きます。
- ライシスバッファーを有するリゼ赤血球(NH4 Cl150 mM、KHCO3 10 mM、EDTA 0.1 mM、pH 7.3、20°C)を各チューブに1mLを添加して明後部を添加する。よく混ぜ、すべてのチューブからの溶液を1つに組み合わせます。11 mLの氷冷(4°C)DMEMcで2分後に反応を停止します。
- 460 x g、4 °Cで5分間遠心分離機を、上清を取り除きます。15 mLの冷たいPBSでペレットを再中断します。460 x g、4 °Cで5分間遠心分離機を、上清を取り除きます。
- PBSの1 mLでペレットを再中断します。3 mLのFcブロック抗体(CD16/CD32、ストック0.5mg/mL)を加え、氷上で15分間インキュベートします。
- 抗体を添加する: Ly6G-PE の 10 mL (ストック 0.2 mg/mL) および CD11b-APC の 10 mL (ストック 0.2 mg/mL)6-ダイアミジン-2-フェニリンドール生存率色素(DAPI、ストック5mg/mL)の20 mLを追加し、30分間暗闇の中で氷の上にインキュベートします。
注:抗体の生存性染料と蛍光コンジュゲートの別の組み合わせを使用することができます。 - 最大15mLのPBSを加え、遠心分離機を460xg、4°Cを5分間加え、上清を取り除きます。
- DMEMcのペレットを約10 x 106/mLの濃度に再ステースし、氷の上に保ちます。
- CD11b+ Ly6Ghi alive (DAPI 陰性) 蛍光活性化細胞選別器を使用した好中球を並べ替える (ゲーティング戦略は図 2を参照)。
注:4°Cでソートされた細胞のためのDMEMcとセルサスペンションとチューブとチューブを保管してください。70 mm ノズル、最大 22,000 イベント/秒のしきい値レート、および流量 1~ 3 の最適なソート設定を使用します。 - 細胞メーターを使用してソートされた好中球の純度を確認し、推奨純度を>95%にします。
- 遠心分離機は、好中球を460xg、4°Cで5分間選別し、上清を除去した。 DMEMcでソートされた細胞を1 x 106/mLの濃度に再中断する。
注:14日間のB16F10腫瘍(直径10mm)における好中球の予想数は、約3 x 104細胞である。
4. インビトロでのTANにおけるNAMPT阻害
- ジメチルスルホキシド(DMSO)中のFK866(NAMPT阻害剤)ストックを100mMの最終濃度で調出す。
- 種子は96ウェルUボトムプレート(1.5 x 105好中球/ウェル)の2ウェルに好中球(ステップ3.11)を選別した。FK866を介入ウェル(最終濃度100nM)に加え、DMSOを搭載したDMEMcを同量にコントロールウェルに追加します。湿度の高いインキュベーターで37°Cで2時間、CO2を5%インキュベーターでインキュベートします。
- 460 x g、4 °Cで5分間遠心分離機を、上清を取り除きます。各井戸のPBSの200 mLで再中断する。2回繰り返します。
- 460 x g、4 °Cで5分間遠心分離機を、上清を取り除きます。市販の内皮細胞増殖培地(4 μL/mL内皮細胞増殖サプリメント、0.1 ng/mL組換えヒト表皮増殖因子、1 ng/mL組換えヒト基本線維芽細胞増殖因子、90 μg/mLヘパリンおよび1μg/mLを補充)ヒドロコルチゾン)を0.2 x 106細胞/mLの最終濃度(0.75mL)(ステップ5の場合)、またはPBS内で0.6 x 106細胞/mL(0.25 mL)の最終濃度にする(ステップ6の場合)。
5. 大動脈環アッセイを用いてのTANの血管新生特性の推定
- 雄のC57BL/6J(WT)マウスから胸部大胸を解剖する。クリーニングし、0.5ミリメートル幅のリングにカットします。すべてのリングを24ウェルプレートのウェルに入れ、1 mLの補助内皮細胞増殖培地を使用します。湿度の高いインキュベーターで37°C、CO2を5%で一晩インキュベートします。
注:大動脈解離のための若い(8週間未満)雄マウスの使用は、より強い血管新生応答15を与えるので好ましい。 - 96ウェル平底板のウェルを50μLの可溶化地下膜マトリックスで充填し、37°C、5%CO2湿度のインキュベーターで30分間ゲルをセットし、マトリックスを重合させる。条件ごとに少なくとも3ウェルを準備します。
- 固体マトリックス層の上部に大動脈リングを配置することにより、可溶化基板膜マトリックスにリングを埋め込み、各ウェルの中心に1リング。各リングをカバーするために、可溶化地下膜マトリックスの別の50 μLを追加します。
- プレートを37°C、5%CO2湿気の多いインキュベーターに別の30分間置き、第2のマトリックス層の重合を可能にする。
- 補充された内皮細胞増殖培地および2x104Ifnar1-/-TAN(対照およびFK866処理)の150 mL/ウェルを加える(ステップ4.4)。
- 湿度の高いインキュベーターで37°C、CO2を5%で14日間インキュベートします。
- 標準的な位相コントラスト顕微鏡を用いて画像を用いて、内皮分岐を推定する。分岐指数を含む血管形態および空間パラメータの定量的評価は、科学的画像用に設計された画像処理プログラムを使用して自動的に行うことができる。
注: 代表的な結果は図 3に示されています。
6. 同種腫瘍モデルにおける治療好中球の導入移植
- 6 x 106細胞/mLの濃度でPBSでB16F10黒色腫細胞(ステップ1.6)を調出します。
- 2種類の好中球を調製する:FK866処理好中球とPBSの未処理好中球(ステップ4.4)を濃度6 x 105細胞/mLで制御する。好中球をB16F10黒色腫細胞(腫瘍細胞比1:10に対する最終好中球)と混合し、2種類の細胞混合物を有する。
- 生齢8~12週齢の雌WTマウス10匹、各群で5匹を採取する。電気的な剃り器で側面の皮膚を剃り、70%のエタノールで消毒する。
- インスリン注射器と直径0.4mmの針で細胞懸濁液(ステップ6.2)を皮下に100μLをマウスの両群に注入する。同じ群から1~5匹のマウスを1つのケージに入れなさい。
- 2日目に、FK866処理された好中球の2種類を調製し、PBSの未処理好中球(ステップ4.4)を濃度6 x 105細胞/mLで制御する。インスリン注射器と直径0.4mmの針で尾静脈に100 μLの細胞懸濁液(ステップ6.4)i.v.を注入し、マウスの両方の群に注入する。マウスをケージに戻します。
7. 腫瘍増殖測定、組織学的検査
- 腫瘍の成長を1日おきに監視する。キャリパーで腫瘍サイズを評価し、式V=4/3*π*(h*w 2)/8(h=高さ、w=幅、深さ=幅)で腫瘍体積を計算します。
- CO2室で14日目にマウスを犠牲にする。腫瘍を除去し、腫瘍の重量を測定します。
- 液体窒素中の最適な切断温度化合物で腫瘍を凍結し、-80°Cで保存します。
- サンプルを-20 °Cに解凍し、クライオトームを使用して5mmの切片を準備します。クライオカットを20°Cで30分間乾燥させます。-20 °C冷たいアセトンの切片を2分間固定し、20°Cで30分間乾燥させます。
- FCブロック抗体(CD16/CD32、ストック0.5mg/mL 1:500)をPBSで20°Cで1時間ブロックしたブロック。
- ウサギの抗マウスラミニンガンマ抗体(PBSでは1:1500、200μL)で20°Cで1時間染色する。PBSで3回洗います。
- 二次ヤギ抗ウサギ抗体(ストック0.5mg/mL、PBSで1:400)、抗マウスαSMA(PBSでは1:500)、DAPIの2μL(ストック5mg/mL、PBSでは1:100)で、抗体溶液の最終容積200μLで染色する。暗闇の中で20°Cで1時間インキュベートする。PBSで3回洗います。
- 暗闇の中で20°Cで20分間スライドを乾燥させます。顕微鏡検査用の無水取り付け媒体付きマウント、カバースリップ付きカバー付き。37°Cで1時間乾燥させてください。
- 顕微鏡検査を行う。ラミニン+容器の総数(オプション面積)とSMA+開発船舶の数(面積)を数えることによって血管を定量化する。
注: 画像解析を実行するには、すべての画像を同じ条件(光、コントラスト、倍率)で撮影します。この場合、処理パラメータが固定され、画像処理が完全に自動になります。代表的な結果を図4および図 5に示します。
結果
ここで説明する手順を用いて、Ifnar1-/-好中球を腫瘍から単離し、2時間のNAMPT阻害剤FK866で処理した未処理のIfnar1-/-好中球を対照として用いた。治療の効果は、血管新生に関与する主要なステップ(マトリックス分解、移行、増殖、再編成)を反映する大動脈環状アッセイを用いて評価した。FK866処理された好中球は、未処理細胞と比較して大動脈枝形成を刺激する能力が有意に低下していることを示すことができる(図3A,3B)。FK866処理された抗血管新生好中球は、腫瘍を有するマウスに皮下注射した(0日目および2日目i.v.)。未治療のIfnar1-/-好中球を注射したマウスと比較して、腫瘍増殖を有意に損なうことができた(図4A,4B)。抽出された腫瘍の組織学的検査は、未処置のIfnar1-/--好中球を注射したものと比較して、FK866処置TANで処置されたマウスから単離された腫瘍における血管新生の有意な抑制を証明した(図 5A,B)
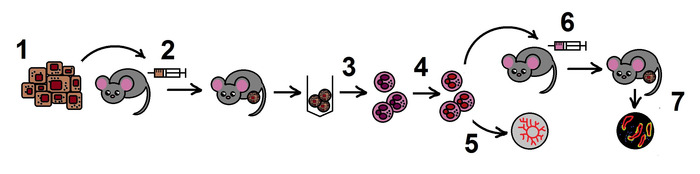
図 1.プロトコルのスキーム.手順 1.B16F10黒色腫細胞株の調製;2. マウスの同数腫瘍モデル;3. 腫瘍からのTANの分離;4. インビトロでのTANにおけるNAMPTの阻害;5. 大動脈環アッセイにおけるTANの血管新生特性の推定;6. 同種腫瘍モデルにおける治療された好中球の導入移植;7.腫瘍成長モニタリング、組織学的検査。この図のより大きなバージョンを表示するには、ここをクリックしてください。
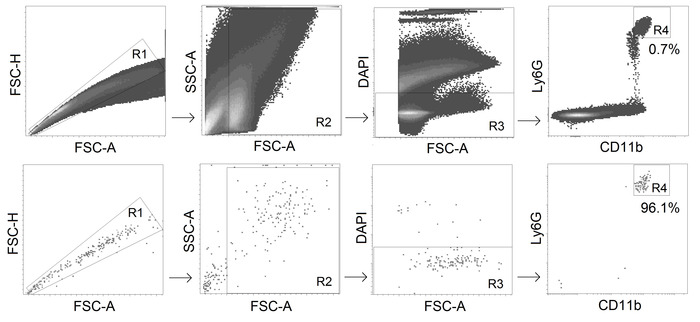
図 2.TAN 並べ替えのゲーティング戦略:CD11b+Ly6Gハイ生中気球は、純度≥95%の腫瘍からソートされる。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 3.FK866処理後のTANの血管新生特性の抑制選別されたIfnar1-/-TANをFK866または培地で処理した血管新生特性は、大器環アッセイを用いて推定した。分岐形成を14日間モニタリングし、14日目の代表的な結果を発表する(A)。FK866による治療は、内皮枝の数を有意に減少させた(B)。データは中央値、四分位範囲、最小値、*p<0.05として表示されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4.FK866処置好中球の養子転移後の腫瘍増殖の遅滞.TANが腫瘍増殖に及ぼす影響を評価した。TANを単離し、FK866で処理し、上述したように腫瘍担持マウスに注射した。14匹のマウスを屠殺し、腫瘍を除去して分析した。Ifnar1-/- FK866対コントロールで処理されたTANを比較した。(A)腫瘍増殖を測定し、(B)腫瘍塊および(C)サイズを推定した。データは中央値、四分位範囲、最小値、*p<0.05として表示されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
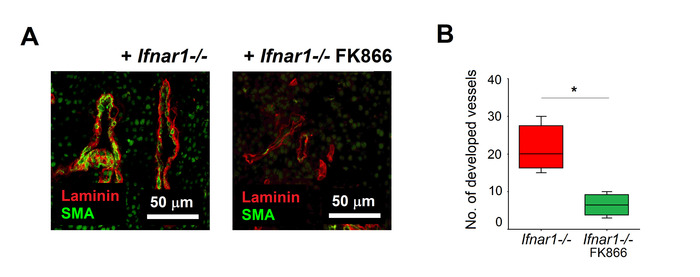
図 5.FK866処理好中球の養子転移後の腫瘍血管化を抑制した。腫瘍を上述したように単離した(図4)。血管成熟は、抗SMA抗体(成熟血管)および抗ガンマラミニン(内皮細胞)を用いて評価した。(A)腫瘍の代表的な染色が示されている:SMA(緑)、ラミニン(赤)。スケールバー:50 μm。(B) FK866(緑)または中(赤)で培養されたTANの採用転移後の腫瘍血管化の定量化データは、中央値、四分位範囲及び最小値、*p<0.05として示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
外科的および薬理学的癌治療の進歩にもかかわらず、成功した治療は挑戦のままである。免疫細胞は腫瘍増殖の調節に重要な役割を果たすることが知られているので、このような細胞の腫瘍原性を阻害する新しい方法を確立する必要があります。ここでは、抗血管新生腫瘍関連好中球の養子転移を介して腫瘍増殖を抑制する新しいアプローチを示す。TANにおける血管新生性NAMPTシグナル伝達の選択的ターゲティングは、FK866阻害剤を用いて、全身性FK866治療時に観察される副作用を防止する。
プロトコルの最も重要な部分は、新たに単離された一次好中球を使用する必要性です。好中球は短生細胞であり、アポトーシスを受けるか、単離の手順中に活性化される。マウス好中球は、細胞選別を含む分離のすべてのステップの間に4°C培中に保たれるべきである。好中球の単離はできるだけ早く行われるべきであり、実験は一時停止すべきではない。Fcブロックの使用は、NK細胞のような高いFc受容体発現を有する細胞の非特異的染色を減らすことができます。また、ゲーティング戦略を簡素化し、抗体結合による好中球の活性化を避けるために、蛍光共役抗体の数を最小限に抑えることをお勧めします。
プロトコルの制限ステップは、腫瘍中のこれらの細胞の比較的低い量(黒色腫における単一生細胞の1%以下)に起因する腫瘍からの生きている好中球の単離である。これは、フローサイトメトリーベースのソートを使用する場合にのみ可能です。同時に、このプロトコルの血液好中球の使用は、腫瘍組織到着時に変化するNAMPT発現およびその低機能性のわずかな調節のため避けるべきである16。おそらく、血液好中球を使用するためには、腫瘍由来の成長因子を用いて以前に活性化されるべきである。
好中球アポトーシスを避けるために、FK866(2-4 h)による短い治療は、TANの生存率に影響を与えないため、長期治療は好中球アポトーシス16を誘発する。要するに、このプロトコルは、マウス黒色腫腫瘍モデルにおける腫瘍増殖を機能的に抑制する外体外的操作抗血管新生好中球の可能性を示す。
開示事項
著者は何も開示していない。
謝辞
私たちの仕事は、ドイツのクレブシルフ、助成金番号:111647、ドイツ研究評議会(DFG)、助成番号:JA 2461/2-1からの助成金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 15 ml tubes | Sarstedt AG & Co., Nümbrecht, Germany | 62,554,502 | |
| 50 ml tubes | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 227261 | |
| 5ml / 10ml / 25ml sterile tipps for the automatic pipette | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 6006180 / 607180 / 760180 | |
| 6 well flat-bottom cell culture plates | Sarstedt AG & Co., Nümbrecht, Germany | 833,920 | |
| 96 well flat-bottom cell culture plates | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 655180 | |
| 96 well U-bottom cell culture plates | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 65018 | |
| AMG EVOS fl digital inverted microscope | AMG, Bothel, U.S. | ||
| anti-mouse CD11b | BD Pharmigen, Becton Dickinson, Franklin Lakes, U.S. | 553312 | clone M1/70, APC-conjugated, 0.2mg/mL |
| anti-mouse Ly6G | BioLegend, California, U.S. | 127608 | clone 1A8, PE-conjugated, 0.2mg/mL |
| BD FACS AriaII | BD Biosciences, Becton Dickinson, Franklin Lakes, U.S. | cell sorter | |
| Caliper | Vogel Germany, Kevelaer, Germany | ||
| Casy cell counter | Innovatis, Roche Innovatis AG, Bielefeld, Germany | ||
| Cell Trics 50µm / 100 µm sterile filters | Sysmex Partec GmbH, Goerlitz, Germany | 04-004-2327 / 04-004-2328 | |
| Centrifuge Rotina 420 R | Andreas Hettich, Tuttlingen, Germany | 4706 | |
| Collagenase D | Sigma-Aldrich/Merck, Darmstadt, Germany | 11088858001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dilactate) | BioLegend, California, U.S. | 422801 | Stock: 5mg/ml |
| Dispase I | Sigma-Aldrich/Merck, Darmstadt, Germany | D4818-2MG | |
| DMEM | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 41966-029 | DMEM complete: DMEM + 10% FBS + 1% penicillin-streptomycin |
| DMSO (Dimethylsufoxide) | WAK-Chemie Medical GmbH, Steinbach, Germany | WAK-DMSO-10 | CryoSure-DMSO |
| DNase I | Sigma-Aldrich/Merck, Darmstadt, Germany | DN25-100MG | |
| DPBS | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 14190-094 | |
| Endothelial cell growth medium | PromoCell, Heidelberg, Germany | c-22010 | |
| FBS (Fetal Bovine Serum) | Biochrom, Berlin, Germany | S0115 | |
| Fc-block (Anti-mouse CD16/32) | BD Pharmingen, Becton Dickinson,Becton Dickinson, Franklin Lakes, U.S. | 553142 | clone 2.4G2, Stock: 0.5mg/mL |
| FK 866 hydrochloride | Axon Medchem, Groningen, Netherlands | Axon 1546 | Stock: 100 mM |
| Goat Anti-Rabbit IgG H&L | Abcam, Cambridge, U.K. | ab97075 | Cy3-conjugated, Stock: 0.5 mg/mL |
| Heracell 240i CO2 Incubator | Thermo Fisher Scientific, Waltham, U.S. | 51026334 | |
| IMDM | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 12440-053 | IMDM complete: IMDM + 10% FBS + 1% penicillin-streptomycin |
| Isis GT420 shaver | B. Braun Asculap, Suhl, Germany | 90200714 | |
| Matrigel Matrix basement membrane | Corning Life Sciences, Amsterdam, Netherlands | 7205011 | |
| Microtome Cryostat Microm HM 505 N | Microm International GmbH, Walldorf, Germany | ||
| Monoclonal Anti-Actin, α-Smooth Muscle | Sigma-Aldrich/Merck, Darmstadt, Germany | F3777 | FITC-conjugated, no information about stock concentration |
| Needles 0.4 mm x 16 mm | BD Microlance, Becton Dicson, Becton Dickinson, Franklin Lakes, U.S. | 302200 | |
| Neomount | Merck, Darmstadt, Germany | HX67590916 | |
| Normal goat serum | Jackson ImmunoResearch Laboratories, West Grove, U.S. | 005-000-121 | |
| Penicillin Streptomycin | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 15140-122 | |
| Pipetus automatic pipette | Hirschmann Laborgeräte, Eberstadt, Germany | 9907200 | |
| ProLong Gold Antifade Mountant with DAPI | Invitrogen, Thermo Fisher Scientific, Massachusetts, U.S. | P36935 | |
| rabbit anti mouse Laminin gamma 1 chain | Immundiagnostik, Bensheim, Germany | AP1001.1 | No information about stock concentration |
| StemPro Accutase | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | A1105-01 | |
| Sterile disposal scalpel (no. 15) | MedWare, Naples, U.S. | 120920 | |
| Syringes 1 ml | BD Plastipak, Becton Dickinson, Franklin Lakes, U.S. | 303172 | |
| Syringes 10 ml | BD Discardit II, Becton Dickinson, Franklin Lakes, U.S. | 309110 | |
| T75 sterile cell culture flasks | Sarstedt AG & Co., Nümbrecht, Germany | 833,911,302 | |
| Tissue-Tek O.C.T. Compound | Sakura Finetek, Torrance, U.S. | 4583 | |
| Zeiss AxioObserver.Z1 Inverted Microscope with ApoTome Optical Sectioning | Carl Zeiss, Oberkochen, Germany |
参考文献
- Jablonska, J., Leschner, S., Westphal, K., Lienenklaus, S., Weiss, S. Neutrophils responsive to endogenous IFN-beta regulate tumor angiogenesis and growth in a mouse tumor model. Journal of Clinical Investigation. 120 (4), 1151-1164 (2010).
- Andzinski, L., Wu, C. F., Lienenklaus, S., Kröger, A., Weiss, S., Jablonska, J. Delayed apoptosis of tumor associated neutrophils in the absence of endogenous IFN-β. International Journal of Cancer. 136, 572-583 (2015).
- Rongvaux, A., et al. Pre-B-cell colony-enhancing factor, whose expression is upregulated in activated lymphocytes, is a nicotinamide phosphoribosyltransferase, a cytosolic enzyme involved in NAD biosynthesis. European Journal of Immunology. 32, 3225-3234 (2002).
- Skokowa, J., et al. NAMPT is essential for the G-CSF-induced myeloid differentiation via a NAD(+)-sirtuin-1-dependent pathway. Nature Medicine. 15, 151-158 (2009).
- Yaku, K., Okabe, K., Hikosaka, K., Nakagawa, T. NAD Metabolism in Cancer Therapeutics. Frontiers in Oncology. 8, 622 (2018).
- Audrito, V., et al. Extracellular nicotinamide phosphoribosyltransferase (NAMPT) promotes M2 macrophage polarization in chronic lymphocytic leukemia. Blood. 125, 111-123 (2015).
- Brentano, F., et al. Pre-B cell colony-enhancing factor/visfatin, a new marker of inflammation in rheumatoid arthritis with proinflammatory and matrix degrading activities. Arthritis & Rheumatology. 56, 2829-2839 (2007).
- Jablonska, J., Wu, C. -. F., Andzinski, L., Leschner, S., Weiss, S. CXCR2-mediated tumor associated neutrophilrecruitment is regulated by IFN-beta. International Journal of Cancer. 134, 1346-1358 (2014).
- Andzinski, L., et al. Type I IFNs induce anti-tumor polarization of tumor associated neutrophils in mice and human. International Journal of Cancer. 138, 1982-1993 (2016).
- Wu, C. -. F., et al. The lack of type I interferon induces neutrophil-mediated pre-metastatic niche formation in the mouse lung. International Journal of Cancer. 137, 837-847 (2015).
- Hansel, T. T., Kropshofer, H., Singer, T., Mitchell, J. A., George, A. J. The safety and side effects of monoclonal antibodies. Nature Reviews Drug Discovery. 9 (4), 325-338 (2010).
- Hasmann, M., Schemainda, I. FK866, a highly specific noncompetitive inhibitor of nicotinamide phosphoribosyltransferase, represents a novel mechanism for induction of tumor cell apoptosis. Cancer Research. 63, 7436-7442 (2003).
- Holen, K., Saltz, L. B., Hollywood, E., Burk, K., Hanauske, A. R. The pharmacokinetics, toxicities, and biologic effects of FK866, a nicotinamide adenine dinucleotide biosynthesis inhibitor. Investigational New Drugs. 26, 45-51 (2008).
- von Heideman, A., Berglund, A., Larsson, R., Nygren, P. Safety and efficacy of NAD depleting cancer drugs: results of a phase I clinical trial of CHS 828 and overview of published data. Cancer Cancer Chemotherapy and Pharmacology. 65, 1165-1172 (2010).
- De Rossi, G., Scotland, R., Whiteford, J. Critical Factors in Measuring Angiogenesis Using the Aortic Ring Model. Journal of Genetic Syndromes and Gene Therapy. 4 (5), (2013).
- Pylaeva, E., et al. NAMPT signaling is critical for the proangiogenic activity of tumor-associated neutrophils. International Journal of Cancer. 144 (1), 136-149 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved