Method Article
Transfer von manipulierten Tumor-assoziierten Neutrophilen in tumortragende Mäuse zur Untersuchung ihres angiogenen Potenzials in Vivo
In diesem Artikel
Zusammenfassung
Hier zeigen wir das therapeutische Potenzial antiangiogener Tumor-assoziierter Neutrophilen nach ihrer Übertragung in tumortragende Mäuse. Dieses Protokoll kann verwendet werden, um neutrophile Aktivität ex vivo zu manipulieren und anschließend ihre Funktionalität in vivo bei der Entwicklungvon Tumoren zu bewerten. Es ist ein geeignetes Modell für die Untersuchung potenzieller neutrophiler Immuntherapien.
Zusammenfassung
Der Beitrag von Neutrophilen zur Regulierung der Tumorgenese wird immer mehr beachtet. Diese Zellen sind heterogen und können je nach Tumormilieu pro- oder antitumor-Kapazität besitzen. Eines der wichtigen Zytokine, die neutrophile Funktionen in einem Tumorkontext regulieren, sind Typ-I-Interferone. In Gegenwart von Interferonen, Neutrophile gewinnen Anti-Tumor-Eigenschaften, einschließlich Zytotoxizität oder Stimulation des Immunsystems. Umgekehrt führt das Fehlen einer Interferon-Signalisierung zu einer ausgeprägten Pro-Tumor-Aktivität, die durch eine starke Stimulation der Tumorangiogenese gekennzeichnet ist. Kürzlich konnten wir zeigen, dass pro-angiogene Eigenschaften von Neutrophilen von der Aktivierung von Nicotinamidphosphoribosyltransferase (NAMPT) Signalweg in diesen Zellen abhängen. Die Hemmung dieses Weges bei tumorassoziierten Neutrophilen führt zu ihrem potenten antiangiogenen Phänotyp. Hier zeigen wir unser neu etabliertes Modell, das die In-vivo-Bewertung des tumorgenen Potenzials manipulierter tumorassoziierter Neutrophilen (TANs) ermöglicht. Kurz darauf können pro-angiogene tumorassoziierte Neutrophile von tumortragenden Interferon-Mäusen isoliert und durch Blockierung der NAMPT-Signalisierung zu antiangiogenem Phänotyp repolarisiert werden. Die angiogene Aktivität dieser Zellen kann anschließend mit einem Aortenring-Assay bewertet werden. Antiangiogene TANs können in tumortragende Wildtyp-Empfänger übertragen werden und das Tumorwachstum sollte 14 Tage lang überwacht werden. Am Tag werden 14 Mäuse geopfert, Tumore entfernt und mit ihrer Vaskularisation geschnitten. Insgesamt bietet unser Protokoll ein neuartiges Werkzeug zur In-vivo-Bewertung der angiogenen Kapazität von Primärzellen, wie tumorassoziierten Neutrophilen, ohne künstliche neutrophile Zelllinienmodelle verwenden zu müssen. Vc
Einleitung
Typ-I-Interferone (IFNs) spielen eine wichtige Rolle bei der Stimulierung von Wirtsreaktionen auf Neoplasie, da der Mangel an Typ-I-IFN-Signalisierung zu einem signifikant erhöhten Tumorwachstum führt1. Einer der Mechanismen, die an diesem Prozess beteiligt sind, ist die Regulierung der tumorigenen Aktivität von tumorassoziierten Neutrophilen, die durch koloniestimulierenden Faktor 3-Rezeptor (CSF3R) nachgeschaltete Signalisierung2gesteuert wird. Der koloniestimulierende Faktor 3 (CSF3) oder granulozyten koloniestimulierender Faktor wurde gezeigt, dass die Signalisierung mit Nicotinamidphosphoribosyltransferase (NAMPT) aktiviert wird3,4. NAMPT ist ein ratenbegrenzendes Enzym für die Nicotinamid-Adenin-Dinukleotid-Synthese, das die Glykolyse verbessert und DNA-Reparatur, Genexpression und Stressreaktion reguliert, die das Überleben und die Proliferation von Krebszellen fördern5. NAMPT ist bei mehreren Krebsarten überexprimiert, einschließlich Dickdarm-, Eierstock-, Brust-, Magen-, Prostatakrebs- und Gliome6. NAMPT ist nicht nur für Tumorzellen wichtig, sondern auch für eine Vielzahl anderer Zelltypen, die in Tumoren vorhanden sind, wie z. B. myeloische Zellen - es treibt ihre Differenzierungan 4, hemmt die Apoptose und stimuliert die Expression mehrerer Zytokine oder Matrixabbauende Enzyme in Makrophagen7.
Tumorassoziierte Neutrophile stellen wichtige Modulatoren des Tumorwachstums dar. TAN-Funktionen sind stark abhängig von der Verfügbarkeit des Typs I IFN, da diese Zytokine die Antitumoraktivität von Neutrophilen prime. Im Gegenteil, das Fehlen von IFNs unterstützt die tumorgene Aktivierung dieser Zellen, insbesondere ihre pro-angiogenen Eigenschaften. In Übereinstimmung damit entwickeln Mäuse mit einem Mangel an IFNs signifikant größere und besser vaskularisierte Tumoren, die stark mit protumoralen/pro-angiogenen Neutrophilen infiltriert werden1,2,8, 9,10. Wichtig ist, dass solche pro-angiogenen TANs eine erhöhte Aktivität von NAMPT aufweisen, was auf seine wesentliche Rolle bei der Pro-Tumor-Polarisation von Neutrophilen hindeutet.
Die Erschöpfung von Neutrophilen mit Ly6G-Antikörpern oder Hemmung ihrer Migration (CXCR2-Antikörper) führt zu verminderter Tumorangiogenese, Wachstum und Metastasierung1,8. Dennoch sind erzeugte monoklonale Antikörper immunogen, und ihre Verabreichung ist mit einer Reihe von lebensbedrohlichen Nebenwirkungen verbunden11. Die Behandlung mit kleinen Molekülen, wie dem NAMPT-Hemmer FK866, der die neutrophile Tumoriogenität modulieren, könnte helfen, solche Komplikationen zu vermeiden. Leider, pharmakologische systemische Hemmung von NAMPT, neben seiner therapeutischen Wirkung auf das Tumorwachstum, führt zu schweren Nebenwirkungen einschließlich gastrointestinaler Toxizität und Thrombozytopenie. Daher ist die systemische Anwendung von NAMPT-Inhibitoren nicht möglich12,13,14.
Aus diesem Grund schlagen wir hier ein Protokoll vor, bei dem NAMPT-Aktivitäten direkt in isolierten TANs blockiert werden. Solche Anti-Tumor-Neutrophile werden dann adoptiv in einen tumortragenden Wirt übertragen. Dieses Protokoll wird dazu beitragen, systemische toxische Nebenwirkungen der Verbindungen zu vermeiden, während seine Wirkung auf die Zielzellen erhalten bleibt.
Protokoll
Alle Verfahren einschließlich Tiergegenständen wurden von den Aufsichtsbehörden GENEHMIGT: LANUV (Landesamt für Natur, Umwelt und Verbraucherschutz NRW) und Regierungspräsidium Tübingen, Deutschland. Alle Manipulationen sollten unter sterilen Bedingungen (unter laminarer Durchflusshaube) mit sterilen Reagenzien und Instrumenten (Spritzen, Scheren, Zangen, Einwegsskalpelle, Petrischalen) durchgeführt werden.
ANMERKUNG: Das Gesamtschema des Protokolls ist in Abbildung 1dargestellt.
1. Herstellung der B16F10 Melanom-Zelllinie
- Bereiten Sie mykoplasma-negative Zellen, die zu einer 90% konfluenten Monoschicht (ca. 10 x 106 Zellen/T75-Kolben) angebaut werden, in vollständigem Iscove es Modified Dulbecco es Medium (IMDMc: IMDM + 10% Fetal Bovine Serum (FBS) + 1% Penicillin-Streptomycin) vor.
- Entfernen Sie das Medium, und spülen Sie die Zellen mit Phosphatgepufferter Saline (PBS). Tragen Sie 6 ml einer Zellablösung auf, die proteolytische und kollagenlytische Enzyme enthält (siehe Materialtabelle),und brüten Sie 2 min bei 37 °C.
- Klopfen Sie den Kolben sanft, um die verbleibenden haftenden Zellen von unten zu mobilisieren. Sammeln Sie die Zellsuspension in 15 ml-Röhrchen und Zentrifuge bei 300 x g für 7 min und 20 °C.
- Entfernen Sie den Überstand, und setzen Sie das Pellet gut in 1 ml PBS wieder aus. 14 ml PBS und Zentrifuge hinzufügen (300 x g und 20 °C für 7 min).
- Entfernen Sie den Überstand und setzen Sie das Pellet in 1 ml PBS wieder auf.
- Zählen Sie die Zellen und setzen Sie sie auf die Konzentration von 3 x 106/ml PBS (für den Schritt 2) oder 6 x 106/ml PBS (für den Schritt 6) für die Injektion wieder aus. Halten Sie Zellen maximal 30 min auf Eis.
2. Allogenes Tumormodell bei Mäusen
- Verwenden Sie 10 weibliche Ifnar1-/- Mäuse, die 8-12 Wochen alt sind und unter spezifisch pathogenfreien (SPF) Bedingungen gehalten werden.
HINWEIS: Weibliche Mäuse sind in einem subkutanen Modell des Tumorwachstums vorzuziehen, da Männchen aggressiver und daher anfällig für Verstöße an der Tumorstelle sind, was das Tumorwachstum beeinflusst. - Rasieren Sie die Haut der Maus auf der Flanke mit einem elektrischen Rasierer, und desinfizieren Sie die Haut mit Gewebe nass mit 70% Ethanol.
- Sammeln Sie die vorbereiteten B16F10 Melanomzellen in einer Konzentration von 3 x 106/ml PBS (siehe Schritt 1) in einer 1 ml Spritze und 0,4 x 19 mm Nadel. 100 ml der Suspension subkutan injizieren.
- Mischen Sie die Zellen vor jeder Injektion gut. Verwenden Sie Nadeln mit einem Durchmesser von nicht weniger als 0,4 mm, um Tumorzellen nicht zu stören.
- Legen Sie bis zu 5 Mäuse in einen Käfig und kontrollieren Sie die Tumorgröße (Länge, Breite und Tiefe) mit einem Bremssattel für 14 Tage.
HINWEIS: Gemäß den Tiervorschriften sollte die Tumorgröße 15 mm im Durchmesser nicht überschreiten, Mäuse mit größeren oder nekrotischen/offenen Tumoren sollten vorher geopfert werden. - Am 14. Tag opfern Sie die Mäuse in der CO2-Kammer.
- Desinfizieren Sie die Haut mit 70% Ethanol und entfernen Sie Tumore mit Schere und Zange in einer sterilen Petrischale. Halten Sie Tumore in einem 50 ml Rohr in vollständig Dulbecco modified Eagle Medium (DMEMc: DMEM + 10% FBS + 1% Penicillin-Streptomycin) auf Eis.
3. TAN-Isolierung
- Legen Sie Tumore in sterile 6-Well-Platten, 5 Tumoren pro Brunnen. Tumoren mit einer sterilen Schere in 2-3 mm Stücke schneiden.
- Digest mit 1 ml Dispase/Kollagenase D/DNase I Lösung (0,2 mg/0,2 mg/100 mg in 1 ml DMEMc) pro Tumor. Bei 37 °C, 5%CO2 in einem feuchten Inkubator inkubieren und mit einer 10 ml Spritze ohne Nadel alle 15 min 3 mal mischen.
- Um unverdaute Fasern zu entfernen, filtern Netzzellen durch 100 m filtert in 15 ml-Rohre (ein Brunnen pro Filter pro Röhre). PBS zu 15 ml, Zentrifugenrohre bei 460 x g, 4 °C für 5 min hinzufügen und den Überstand entfernen.
- Lyse erythrozyten mit einem Lysepuffer (NH4Cl 150 mM, KHCO3 10 mM, EDTA 0,1 mM, pH 7,3, 20 °C) durch Zugabe von 1 ml in jedes Rohr. Gut mischen und die Lösung aus allen Rohren zu einem kombinieren. Stoppen Sie die Reaktion nach 2 Minuten mit 11 ml eiskaltem (4 °C) DMEMc.
- Zentrifuge bei 460 x g,4 °C für 5 min, und entfernen Sie den Überstand. Das Pellet mit 15 ml kaltem PBS aussetzen. Zentrifuge bei 460 x g,4 °C für 5 min, und entfernen Sie den Überstand.
- Das Pellet in 1 ml PBS wieder aufhängen. Fügen Sie 3 ml Fc-Block-Antikörper (CD16/CD32, Vorrat 0,5 mg/ml) hinzu und tauchen Sie 15 min auf Eis ein.
- Antikörper hinzufügen: 10 ml Ly6G-PE (Lager 0,2 mg/ml) und 10 ml CD11b-APC (Lager 0,2 mg/ml). 20 ml 6-Diamidin-2-Phenylindol-Lebensfähigkeitsfarbstoff (DAPI, Lager 5 mg/ml) hinzufügen und 30 min in der Dunkelheit auf Eis brüten.
HINWEIS: Es kann eine weitere Kombination aus Lebensfähigkeitsfarbstoffen und fluoreszierenden Konjugaten von Antikörpern verwendet werden. - PBS bis 15 ml, Zentrifuge bei 460 x g,4 °C für 5 min hinzufügen und den Überstand entfernen.
- Setzen Sie das Pellet in DMEMc auf die Konzentration ca. 10 x 106/ml aus und halten Sie auf Eis.
- Sortieren Sie CD11b+ Ly6Ghi alive (DAPI-negative) Neutrophile mit einem fluoreszenzaktivierten Zellsortierer (Gating-Strategie siehe Abbildung 2).
HINWEIS: Bewahren Sie das Rohr mit Zellaufhängung und das Rohr mit DMEMc für sortierte Zellen bei 4 °C auf. Verwenden Sie die folgenden optimalen Sortiereinstellungen: eine 70-mm-Düse, eine Schwellenrate von maximal 22.000 Ereignissen/Sekunde und eine Durchflussrate von 1-3. - Überprüfen Sie die Reinheit der sortierten Neutrophilen mit einem Zytometer auf eine empfohlene Reinheit von >95%.
- Zentrifuge sortierte Neutrophile bei 460 x g, 4 °C für 5 min, und entfernen Sie den Überstand. Setzen Sie die sortierten Zellen in DMEMc auf die Konzentration von 1 x 106/ml aus.
HINWEIS: Die erwartete Anzahl von Neutrophilen in einem 14-Tägigen B16F10-Tumor (10 mm Durchmesser) beträgt etwa 3 x 104 Zellen.
4. NAMPT-Hemmung in TANs in vitro
- Fk866 (NAMPT-Hemmer) in Dimethylsulfoxid (DMSO) in einer Endkonzentration von 100 mM vorbereiten.
- Samen sortierte Neutrophile (Schritt 3.11) in 2 Brunnen einer 96-Well U-Bodenplatte (1,5 x 105 Neutrophile/Well). Fügen Sie FK866 in den Interventionsbrunnen (Endkonzentration von 100 nM) und eine gleiche Menge DMEMc mit DMSO in den Kontrollbrunnen ein. 2 h bei 37 °C, 5% CO2 in einem feuchten Inkubator inkubieren.
- Zentrifuge bei 460 x g,4 °C für 5 min, und entfernen Sie den Überstand. Resuspend in 200 ml PBS in jedem Brunnen. Wiederholen Sie dies 2 Mal.
- Zentrifuge bei 460 x g,4 °C für 5 min, und entfernen Sie den Überstand. Resuspend in kommerziellen endothelialen Zellwachstumsmedium (ergänzt mit 4 l/mL Endothelzellwachstumsergänzung, 0,1 ng/mL rekombinanter humaner epidermaler Wachstumsfaktor, 1 ng/mL rekombinanter menschlicher Basis-Fibroblasten-Wachstumsfaktor, 90 g/ml Heparin und 1 g/ml Hydrocortison) auf eine Endkonzentration von 0,2 x 106 Zellen/ml (in 0,75 ml) (für Schritt 5) oder in PBS auf die Endkonzentration von 0,6 x 106 Zellen/ml (in 0,25 ml) (für Schritt 6).
5. Abschätzung der angiogenen Eigenschaften von TANs mit dem Aortenring-Assay
- Sezieren Sie die thorakale Aorta von einer männlichen C57BL/6J (WT) Maus. Reinigen und in 0,5 mm Breite Ringe schneiden. Legen Sie alle Ringe in einen Brunnen einer 24-Well-Platte mit 1 ml ergänztem Endothelzellwachstumsmedium. Über Nacht bei 37 °C, 5% CO2 in einem feuchten Inkubator inkubieren.
HINWEIS: Die Verwendung von jungen (jünger als 8 Wochen) männlichen Mäusen zur Aortasektion ist vorzuziehen, da sie eine robustere angiogene Reaktion geben15. - Füllen Sie die Brunnen der 96-Well-Flachbodenplatte mit 50 l löslicher Kellermembranmatrix, lassen Sie das Gel 30 min in einem 37 °C, 5% CO2 feuchten Inkubator setzen, damit die Matrix polymerisieren kann. Bereiten Sie mindestens 3 Brunnen pro Zustand vor.
- Betten Sie die Ringe in eine lösliche Kellermembranmatrix ein, indem Sie einen Aortenring auf der Oberseite der festen Matrixschicht platzieren, 1 Ring in der Mitte jedes Brunnens. Fügen Sie weitere 50 l lösliche Kellermembranmatrix hinzu, um jeden Ring abzudecken.
- Legen Sie die Platte in einen 37 °C, 5%CO2 feuchten Inkubator für weitere 30 min, um die Polymerisation der zweiten Matrixschicht zu ermöglichen.
- Fügen Sie 150 ml/Well des ergänzten Endothelzellwachstumsmediums und 2x104Ifnar1-/- TANs (Kontroll- und FK866-behandelt) hinzu (Schritt 4.4).
- Inkubieren Sie die Platte 14 Tage lang bei 37 °C, 5% CO2 in einem feuchten Inkubator.
- Bild mit einem Standard-Phasenkontrastmikroskop und schätzen Sie die endotheliale Verzweigung. Die quantitative Bewertung von gefäßmorphometrischen und räumlichen Parametern einschließlich Verzweigungsindex kann automatisch mit dem bildverarbeitenden Programm für wissenschaftliche Bilder durchgeführt werden.
ANMERKUNG: Repräsentative Ergebnisse sind in Abbildung 3dargestellt.
6. Adoptivtransfer von behandelten Neutrophilen im allogenen Tumormodell
- Bereiten Sie B16F10 Melanomzellen (Schritt 1.6) in PBS in einer Konzentration von 6 x 106 Zellen/ml vor.
- Bereiten Sie 2 Arten von Neutrophilen vor: FK866-behandelte Neutrophile und kontrollieren Sie unbehandelte Neutrophile (Schritt 4.4) in PBS in einer Konzentration von 6 x 105 Zellen/ml. Mischen Sie Neutrophile mit B16F10 Melanomzellen (das endgültige Neutrophil-Zu-Tumor-Zellen-Verhältnis 1:10), um 2 Arten von Zellmischungen zu haben.
- Nehmen Sie 10 weibliche WT-Mäuse 8-12 Wochen alt, 5 in jeder Gruppe. Rasieren Sie die Haut an der Flanke mit einem elektrischen Rasierer und desinfizieren Sie mit 70% Ethanol.
- In beiden Gruppen von Mäusen 100 l der Zellsuspension (Schritt 6.2) subkutan mit einer Insulinspritze und einer Nadel mit 0,4 mm Durchmesser injizieren. Legen Sie 1-5 Mäuse aus der gleichen Gruppe in einen Käfig.
- Am 2. Tag bereiten Sie 2 Arten von Neutrophilen vor: FK866-behandelte Neutrophile und kontrollieren unbehandelte Neutrophile (Schritt 4.4) in PBS in einer Konzentration von 6 x 105 Zellen/ml. Mit einer Insulinspritze und einer Nadel mit einem Durchmesser von 0,4 mm in beide Gruppen von Mäusen in die Schwanzvene injizieren (Schritt 6.4) i.v. Legen Sie Mäuse zurück in den Käfig.
7. Tumorwachstumsmessung, histologische Untersuchung
- Überwachen Sie das Tumorwachstum jeden zweiten Tag. Bewerten Sie die Tumorgröße mit Sätteln und berechnen Sie das Tumorvolumen mit der Formel V=4/3**(h*w2)/8 (h=Höhe, b=Breite, Tiefe= Breite).
- Opfern Sie Mäuse am Tag 14 in der CO2-Kammer. Entfernen Sie Tumore und messen Sie die Tumorgewichte.
- Tumoren in optimaler Schnitttemperaturverbindung in flüssigem Stickstoff einfrieren und bei -80 °C lagern.
- Die Proben auf -20 °C auftauen und 5 mm Abschnitte mit einem Kryotom vorbereiten. Die Kryocuts 30 min bei 20 °C trocknen lassen. Befestigen Sie die Abschnitte in -20 °C kaltem Aceton für 2 min und lassen Sie sie 30 min bei 20 °C trocknen.
- Block mit Fc-Block Antikörpern (CD16/CD32, Lager 0,5 mg/ml 1:500) in PBS für 1 h bei 20 °C.
- Mit Kaninchen Antimaus Laminin Gamma-Antikörper (1:1500 in PBS, 200 l) für 1 h bei 20 °C. Dreimal mit PBS waschen.
- Fleck mit sekundärem Ziegen-Anti-Kaninchen-Antikörper (Bestand 0,5 mg/ml, 1:400 in PBS), Anti-Maus-SMA (1:500 in PBS) und 2 l DAPI (Bestand 5 mg/ml, 1:100 in PBS) in einem Endvolumen von 200 l Antikörperlösung. 1 h bei 20 °C bei Dunkelheit inkubieren. Dreimal mit PBS waschen.
- Trockene Rutschen für 20 Minuten bei 20 °C bei Dunkelheit. Montage mit wasserfreiem Montagemedium für die Mikroskopie und Abdeckung mit Einem Deckelschlupf. 1 h in 37 °C trocknen lassen.
- Führen Sie eine mikroskopische Untersuchung durch. Quantifizieren Sie die Vaskularisation durch Zählen der Gesamtzahl (optional Fläche) von Laminin+ Gefäßen und der Anzahl (Fläche) von SMA+ entwickelten Gefäßen.
HINWEIS: Um eine Bildanalyse durchzuführen, nehmen Sie alle Bilder unter den gleichen Bedingungen (Licht, Kontrast, Vergrößerung) auf. In diesem Fall werden Verarbeitungsparameter festgelegt, und die Bildverarbeitung wird vollautomatisch. Repräsentative Ergebnisse sind in Abbildung 4 und Abbildung 5dargestellt.
Ergebnisse
Mit dem hier beschriebenen Verfahren wurden Ifnar1-/- Neutrophile von Tumoren isoliert und mit DemAmpT-Hemmer FK866 für 2 h behandelt. Unbehandelte Ifnar1-/- Neutrophile wurden als Kontrolle verwendet. Die Wirksamkeit der Behandlung wurde mit dem Aortenring-Assay bewertet, der die wichtigsten Schritte der Angiogenese (Matrixdegradation, Migration, Proliferation, Reorganisation) widerspiegelt. Wir konnten nachweisen, dass FK866-behandelte Neutrophile eine signifikant verminderte Fähigkeit haben, die Aortenzweigbildung im Vergleich zu unbehandelten Zellen zu stimulieren (Abbildung 3A, 3B). FK866-behandelte antiangiogene Neutrophile wurden subkutan in tumortragende Mäuse injiziert (an Tag 0 Flanke und Tag 2 i.v.). Wir konnten ein signifikant beeinträchtigtes Tumorwachstum beobachten, im Vergleich zu Mäusen, die mit unbehandelten Ifnar1-/- Neutrophilen injiziert wurden (Abbildung 4A, 4B). Die histologische Untersuchung der extrahierten Tumoren zeigte die signifikante Unterdrückung der Angiogenese bei Tumoren, die von Mäusen isoliert wurden, die mit FK866-behandelten TANs behandelt wurden, im Vergleich zu jenen, die mit unbehandelten Ifnar1-/- Neutrophilen injiziert wurden ( Abbildung 5A ,B).
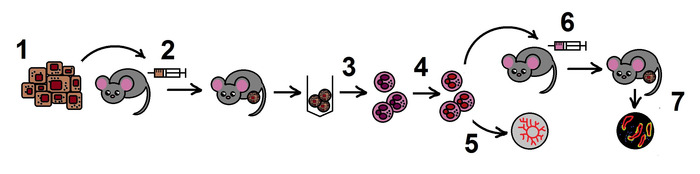
Abbildung 1. Das Schema des Protokolls. Schritt 1. Herstellung der B16F10 Melanom-Zelllinie; 2. Allogenes Tumormodell bei Mäusen; 3. Isolierung von TANs von den Tumoren; 4. Hemmung von NAMPT in TANs in vitro; 5. Abschätzung der angiogenen Eigenschaften von TANs im Aortenring-Assay; 6. Adoptivtransfer von behandelten Neutrophilen im allogenen Tumormodell; 7. Tumorwachstumsüberwachung, histologische Untersuchung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
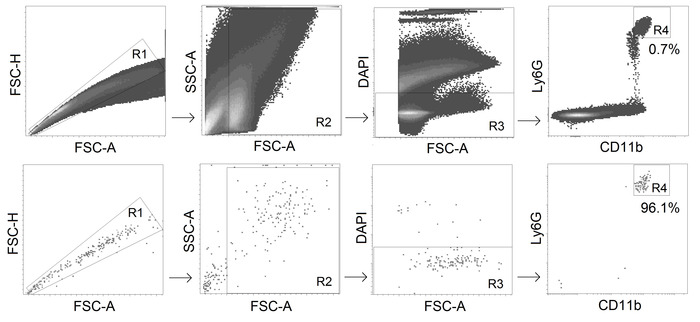
Abbildung 2. Gating-Strategie für TANs-Sortierung. CD11b+ Ly6Ghi lebende Neutrophile werden aus Tumoren mit der Reinheit von 95% sortiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3. Unterdrückung angiogener Eigenschaften von TANs nach DER BEHANDLUNG von FK866. Angiogene Eigenschaften von sortierten Ifnar1-/-TANs, die mit FK866 oder mit Medium behandelt wurden, wurden mit Aorta-Ring-Assay geschätzt. Die Zweigbildung wurde 14 Tage lang überwacht, repräsentative Ergebnisse werden am Tag 14 vorgestellt (A). Die Behandlung mit FK866 verringerte die Anzahl der Endothelzweige (B). Die Daten werden als Median, Interquartilbereich und min-max, *p<0.05 angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4. Verzögerung des Tumorwachstums nach Adoptivtransfer von FK866-behandelten Neutrophilen. Der Einfluss von TANs auf das Tumorwachstum wurde bewertet. TANs wurden isoliert, mit FK866 behandelt und wie oben beschrieben in tumortragende Mäuse injiziert. Am Tag wurden 14 Mäuse geopfert, Tumore entfernt und analysiert. Ifnar1-/- TANs, die mit FK866 im Vergleich zu Kontrollen behandelt wurden, wurden verglichen. (A) Das Tumorwachstum wurde gemessen, (B) Tumormasse und (C) Größe wurden geschätzt. Die Daten werden als Median, Interquartilbereich und min-max, *p<0.05 angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
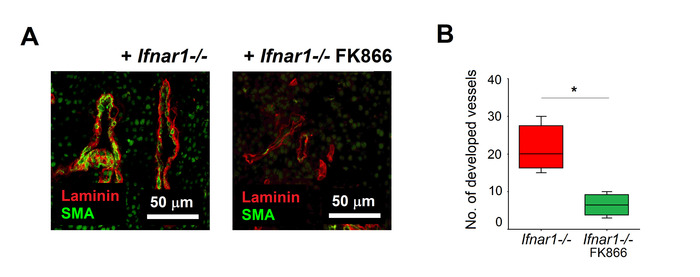
Abbildung 5. Unterdrückte Tumorvaskularisation nach Adoptivtransfer von FK866-behandelten Neutrophilen. Tumore wurden wie oben beschrieben isoliert (Abb. 4). Die Gefäßreifung wurde mit Anti-SMA-Antikörpern (reifen Gefäßen) und Anti-Gamma-Laminin (Endothelzellen) bewertet. (A) Repräsentative Färbung von Tumoren werden gezeigt: SMA (grün), Laminin (rot). Skalenbalken: 50 m. (B) Quantifizierung der Tumorvaskularisation nach Adoptivübertragung von TANs, die mit FK866 (grün) oder mittel (rot) kultiviert wurden Daten werden als Median, Interquartilbereich und min-max, *p<0.05 angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Trotz der Fortschritte in der chirurgischen und pharmakologischen Krebsbehandlung bleibt eine erfolgreiche Therapie eine Herausforderung. Da Immunzellen bekanntermaßen eine wichtige Rolle bei der Regulierung des Tumorwachstums spielen, sollten neuartige Methoden etabliert werden, die die Tumorigenizität solcher Zellen hemmen. Hier zeigen wir einen neuartigen Ansatz zur Unterdrückung des Tumorwachstums durch Adoptivtransfer antiangiogenicer Tumor-assoziierter Neutrophile. Selektives Targeting der pro-angiogenen NAMPT-Signalisierung in TANs, mit FK866-Hemmer, verhindert Nebenwirkungen, die bei der systemischen FK866-Behandlung beobachtet werden.
Der kritischste Teil des Protokolls ist die Notwendigkeit, frisch isolierte primäre Neutrophile zu verwenden. Neutrophile sind kurzlebige Zellen, die einer Apoptose unterzogen oder während des Isolationsverfahrens aktiviert werden. Murine Neutrophile sollten während aller Isolationsschritte, einschließlich der Zellsortierung, in 4 °C-Medien aufbewahrt werden. Die Isolierung von Neutrophilen sollte so schnell wie möglich durchgeführt werden und das Experiment sollte nicht angehalten werden. Die Verwendung von Fc-Block ermöglicht die Reduzierung der unspezifischen Färbung der Zellen mit hoher Fc-Rezeptor-Expression, wie NK-Zellen. Wir empfehlen auch, die Anzahl der fluoreszierend konjugierten Antikörper zu minimieren, um die Gating-Strategie zu vereinfachen und die Aktivierung von Neutrophilen durch Antikörperbindung zu vermeiden.
Der einschränkende Schritt des Protokolls ist die Isolierung lebender Neutrophile von Tumoren aufgrund einer relativ geringen Anzahl dieser Zellen in Tumoren (nicht mehr als 1% der einzelnen lebenden Zellen bei Melanomen). Dies war nur mit Flow-Zytometrie-basierter Sortierung möglich. Zur gleichen Zeit, die Verwendung von Blut Neutrophile für dieses Protokoll sollte aufgrund nur geringfügige Regulierung der NAMPT-Expression und ihre geringe Funktionalität, die bei Tumorgewebe Ankunft verändert16vermieden werden. Möglicherweise, um Blut neutrophile zu verwenden, Sie sollten zuvor mit Tumor-abgeleiteten Wachstumsfaktoren aktiviert werden.
Um neutrophile Apoptose zu vermeiden, wird eine kurze Behandlung mit FK866 (2-4 h) vorgeschlagen, da sie keinen Einfluss auf die Lebensfähigkeit von TANs hat, während eine längere Behandlung eine neutrophile Apoptose16induziert. Zusammenfassend zeigt das Protokoll das Potenzial von ex-vitro-manipulierten antiangiogenen Neutrophilen, das Tumorwachstum im Tumormodell des Mausmelanoms funktionell zu unterdrücken.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Unterstützt wurde unsere Arbeit durch Stipendien der Deutschen Krebshilfe, Fördernummer: 111647, und des Deutschen Forschungsrates (DFG), Fördernummer: JA 2461/2-1.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 ml tubes | Sarstedt AG & Co., Nümbrecht, Germany | 62,554,502 | |
| 50 ml tubes | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 227261 | |
| 5ml / 10ml / 25ml sterile tipps for the automatic pipette | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 6006180 / 607180 / 760180 | |
| 6 well flat-bottom cell culture plates | Sarstedt AG & Co., Nümbrecht, Germany | 833,920 | |
| 96 well flat-bottom cell culture plates | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 655180 | |
| 96 well U-bottom cell culture plates | Cellstar, Greiner Bio One International GmbH, Frickenhausen, Germany | 65018 | |
| AMG EVOS fl digital inverted microscope | AMG, Bothel, U.S. | ||
| anti-mouse CD11b | BD Pharmigen, Becton Dickinson, Franklin Lakes, U.S. | 553312 | clone M1/70, APC-conjugated, 0.2mg/mL |
| anti-mouse Ly6G | BioLegend, California, U.S. | 127608 | clone 1A8, PE-conjugated, 0.2mg/mL |
| BD FACS AriaII | BD Biosciences, Becton Dickinson, Franklin Lakes, U.S. | cell sorter | |
| Caliper | Vogel Germany, Kevelaer, Germany | ||
| Casy cell counter | Innovatis, Roche Innovatis AG, Bielefeld, Germany | ||
| Cell Trics 50µm / 100 µm sterile filters | Sysmex Partec GmbH, Goerlitz, Germany | 04-004-2327 / 04-004-2328 | |
| Centrifuge Rotina 420 R | Andreas Hettich, Tuttlingen, Germany | 4706 | |
| Collagenase D | Sigma-Aldrich/Merck, Darmstadt, Germany | 11088858001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dilactate) | BioLegend, California, U.S. | 422801 | Stock: 5mg/ml |
| Dispase I | Sigma-Aldrich/Merck, Darmstadt, Germany | D4818-2MG | |
| DMEM | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 41966-029 | DMEM complete: DMEM + 10% FBS + 1% penicillin-streptomycin |
| DMSO (Dimethylsufoxide) | WAK-Chemie Medical GmbH, Steinbach, Germany | WAK-DMSO-10 | CryoSure-DMSO |
| DNase I | Sigma-Aldrich/Merck, Darmstadt, Germany | DN25-100MG | |
| DPBS | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 14190-094 | |
| Endothelial cell growth medium | PromoCell, Heidelberg, Germany | c-22010 | |
| FBS (Fetal Bovine Serum) | Biochrom, Berlin, Germany | S0115 | |
| Fc-block (Anti-mouse CD16/32) | BD Pharmingen, Becton Dickinson,Becton Dickinson, Franklin Lakes, U.S. | 553142 | clone 2.4G2, Stock: 0.5mg/mL |
| FK 866 hydrochloride | Axon Medchem, Groningen, Netherlands | Axon 1546 | Stock: 100 mM |
| Goat Anti-Rabbit IgG H&L | Abcam, Cambridge, U.K. | ab97075 | Cy3-conjugated, Stock: 0.5 mg/mL |
| Heracell 240i CO2 Incubator | Thermo Fisher Scientific, Waltham, U.S. | 51026334 | |
| IMDM | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 12440-053 | IMDM complete: IMDM + 10% FBS + 1% penicillin-streptomycin |
| Isis GT420 shaver | B. Braun Asculap, Suhl, Germany | 90200714 | |
| Matrigel Matrix basement membrane | Corning Life Sciences, Amsterdam, Netherlands | 7205011 | |
| Microtome Cryostat Microm HM 505 N | Microm International GmbH, Walldorf, Germany | ||
| Monoclonal Anti-Actin, α-Smooth Muscle | Sigma-Aldrich/Merck, Darmstadt, Germany | F3777 | FITC-conjugated, no information about stock concentration |
| Needles 0.4 mm x 16 mm | BD Microlance, Becton Dicson, Becton Dickinson, Franklin Lakes, U.S. | 302200 | |
| Neomount | Merck, Darmstadt, Germany | HX67590916 | |
| Normal goat serum | Jackson ImmunoResearch Laboratories, West Grove, U.S. | 005-000-121 | |
| Penicillin Streptomycin | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | 15140-122 | |
| Pipetus automatic pipette | Hirschmann Laborgeräte, Eberstadt, Germany | 9907200 | |
| ProLong Gold Antifade Mountant with DAPI | Invitrogen, Thermo Fisher Scientific, Massachusetts, U.S. | P36935 | |
| rabbit anti mouse Laminin gamma 1 chain | Immundiagnostik, Bensheim, Germany | AP1001.1 | No information about stock concentration |
| StemPro Accutase | Gibco, Life Technologies/Thermo Fisher Scientific, Massachusetts, U.S. | A1105-01 | |
| Sterile disposal scalpel (no. 15) | MedWare, Naples, U.S. | 120920 | |
| Syringes 1 ml | BD Plastipak, Becton Dickinson, Franklin Lakes, U.S. | 303172 | |
| Syringes 10 ml | BD Discardit II, Becton Dickinson, Franklin Lakes, U.S. | 309110 | |
| T75 sterile cell culture flasks | Sarstedt AG & Co., Nümbrecht, Germany | 833,911,302 | |
| Tissue-Tek O.C.T. Compound | Sakura Finetek, Torrance, U.S. | 4583 | |
| Zeiss AxioObserver.Z1 Inverted Microscope with ApoTome Optical Sectioning | Carl Zeiss, Oberkochen, Germany |
Referenzen
- Jablonska, J., Leschner, S., Westphal, K., Lienenklaus, S., Weiss, S. Neutrophils responsive to endogenous IFN-beta regulate tumor angiogenesis and growth in a mouse tumor model. Journal of Clinical Investigation. 120 (4), 1151-1164 (2010).
- Andzinski, L., Wu, C. F., Lienenklaus, S., Kröger, A., Weiss, S., Jablonska, J. Delayed apoptosis of tumor associated neutrophils in the absence of endogenous IFN-β. International Journal of Cancer. 136, 572-583 (2015).
- Rongvaux, A., et al. Pre-B-cell colony-enhancing factor, whose expression is upregulated in activated lymphocytes, is a nicotinamide phosphoribosyltransferase, a cytosolic enzyme involved in NAD biosynthesis. European Journal of Immunology. 32, 3225-3234 (2002).
- Skokowa, J., et al. NAMPT is essential for the G-CSF-induced myeloid differentiation via a NAD(+)-sirtuin-1-dependent pathway. Nature Medicine. 15, 151-158 (2009).
- Yaku, K., Okabe, K., Hikosaka, K., Nakagawa, T. NAD Metabolism in Cancer Therapeutics. Frontiers in Oncology. 8, 622(2018).
- Audrito, V., et al. Extracellular nicotinamide phosphoribosyltransferase (NAMPT) promotes M2 macrophage polarization in chronic lymphocytic leukemia. Blood. 125, 111-123 (2015).
- Brentano, F., et al. Pre-B cell colony-enhancing factor/visfatin, a new marker of inflammation in rheumatoid arthritis with proinflammatory and matrix degrading activities. Arthritis & Rheumatology. 56, 2829-2839 (2007).
- Jablonska, J., Wu, C. -F., Andzinski, L., Leschner, S., Weiss, S. CXCR2-mediated tumor associated neutrophilrecruitment is regulated by IFN-beta. International Journal of Cancer. 134, 1346-1358 (2014).
- Andzinski, L., et al. Type I IFNs induce anti-tumor polarization of tumor associated neutrophils in mice and human. International Journal of Cancer. 138, 1982-1993 (2016).
- Wu, C. -F., et al. The lack of type I interferon induces neutrophil-mediated pre-metastatic niche formation in the mouse lung. International Journal of Cancer. 137, 837-847 (2015).
- Hansel, T. T., Kropshofer, H., Singer, T., Mitchell, J. A., George, A. J. The safety and side effects of monoclonal antibodies. Nature Reviews Drug Discovery. 9 (4), 325-338 (2010).
- Hasmann, M., Schemainda, I. FK866, a highly specific noncompetitive inhibitor of nicotinamide phosphoribosyltransferase, represents a novel mechanism for induction of tumor cell apoptosis. Cancer Research. 63, 7436-7442 (2003).
- Holen, K., Saltz, L. B., Hollywood, E., Burk, K., Hanauske, A. R. The pharmacokinetics, toxicities, and biologic effects of FK866, a nicotinamide adenine dinucleotide biosynthesis inhibitor. Investigational New Drugs. 26, 45-51 (2008).
- von Heideman, A., Berglund, A., Larsson, R., Nygren, P. Safety and efficacy of NAD depleting cancer drugs: results of a phase I clinical trial of CHS 828 and overview of published data. Cancer Cancer Chemotherapy and Pharmacology. 65, 1165-1172 (2010).
- De Rossi, G., Scotland, R., Whiteford, J. Critical Factors in Measuring Angiogenesis Using the Aortic Ring Model. Journal of Genetic Syndromes and Gene Therapy. 4 (5), (2013).
- Pylaeva, E., et al. NAMPT signaling is critical for the proangiogenic activity of tumor-associated neutrophils. International Journal of Cancer. 144 (1), 136-149 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten