Method Article
アファチニブ耐性肺腺癌PC-9細胞株の確立と特徴付けは、アファチニブの用量の増加とともに開発された
要約
肺腺癌PC-9細胞からアファチニブ耐性細胞株を確立する方法が開発され、耐性細胞が特徴付けられた。耐性細胞は、非小細胞肺癌患者に適用可能な表皮成長因子受容体チロシンキナーゼ阻害剤耐性機構を調製するために使用することができる。
要約
分子標的阻害剤に対する後天性耐性は、がん治療において深刻な問題である。肺癌は、ほとんどの国で癌関連死の主要な原因のままです。表皮成長因子受容体(EGFR)-活性化変異などの「発死因子変異」の発見、およびEGFRチロシンキナーゼ阻害剤(TKI)の分子標的剤のその後の開発(ゲフィチニブ、エルロチニブ、アファチニブ、ダコミチニブ、オシメルチニブ)は、ここ数十年で肺癌治療を劇的に変化させた。しかしながら、これらの薬剤は、EGFR-活性化変異を有する非小細胞肺癌(NSCLC)患者には依然として有効ではない。 後天性抵抗に続いて、NSCLCの全身進行は、EGFR変異陽性NSCLC患者の治療において重要な障害のままである。ここで、EGFRエキソン19における15塩基対欠損のEGFR活性化変異を有するNSCLC PC-9細胞から3つの独立したアファチニブ耐性細胞株を確立するための段階的な用量エスカレーション法を提示する。3つの独立したアファチニブ耐性細胞株を特徴付けるための方法を簡単に説明する。EGFR TKIに対する後天性抵抗機構は不均一である。したがって、EGFR-TKIに対する後天性耐性を持つ複数の細胞株を調べる必要があります。この段階的な用量エスカレーションアプローチを使用して、後天性抵抗を持つ細胞株を得るために10〜12ヶ月が必要です。新しい取得抵抗機構の発見は、より効果的で安全な治療戦略の開発に貢献します。
概要
5つのチロシンキナーゼ阻害剤、表皮成長因子受容体(EGFR)を標的とし、ゲフィチニブ、エルロチニブ、アファチニブ、ダコミチニブ、およびオシメルチニブを含む、EGFR変異陽性非小細胞肺の患者を治療するために現在利用可能であるがん (NSCLC)。過去10年間にわたり、このような患者のための治療法は、新しい潜在的なEGFR-TKIの発見と劇的な発展を遂げました。肺腺癌の患者の中で、EGFRの体細胞変異は、アジアの約50%および白人患者の15%で同定される。EGFRにおける最も一般的な変異は、EGFRエキソン21および15塩基対(bp)欠損におけるL858R点変異である。NSCLCを有するEGFR変異陽性患者において、EGFR-TKIは、以前の標準のプラチナ・ダブルト化学療法3と比較して、応答率および臨床転帰を改善する。
ゲフィチニブおよびエルロチニブは、最初に承認された低分子阻害剤であり、一般に第1世代EGFR TKIと呼ばれています。これらのEGFR TKIは、ATPと競合し、ATP結合部位4に可逆的に結合することにより、チロシンキナーゼ活性をブロックする。アファチニブは、EGFRのチロシンキナーゼドメインに不可逆的かつ共有的に結合する第2世代EGFR TKIであり、汎ヒトEGFRファミリー阻害剤5として特徴付ける。
NSCLC患者におけるこれらの治療法の劇的な利益にもかかわらず、獲得された抵抗は避けられない。第1および第2世代のEGFR TKIに対する最も一般的な耐性機構は、腫瘍試料6、7、8の50〜70%に存在するEGFRエキソン20におけるT790M変異の出現である。その他の抵抗機構には、バイパスシグナル(MET、IGF1R、およびHER2)、小細胞肺癌への変換、および前臨床および臨床的に9に起こる上皮間葉間膜遷移の誘導が含まれる。EGFR TKIに対する抵抗機構は不均一である。前臨床試験における新規耐性機構を同定することにより、耐性を克服する新規治療薬の開発が可能となる可能性がある。患者に対する臨床的利益を最大化する最適な配列療法は、抵抗機構および治療目標を考慮しなければならない。
それはすべての後続の実験の基礎であるので、右の親の細胞株を選択することが不可欠です。選択戦略は臨床的な関連性から始まります。化学療法と放射線ナイーブ細胞株を選択する必要があります。以前の化学療法および/または放射治療は、抵抗経路の変化および薬剤耐性マーカーの発現の変化を誘発し得る。本研究では、EGFRエキソン19で15bp欠損を担うPC-9細胞が、アファチニブに対する後天性耐性の確立に用いられる。この細胞株は、化学療法と放射線治療を受けていない日本のNSCLC患者に由来した。
アファチニブは日常的に経口投与されるので、連続的なインビトロ治療は、細胞がアファチニブの存在下で絶えず培養される場合には臨床的に関連するであろう。実験の様々なステップで使用される薬物の用量は、選択された親細胞株のために最適化されなければならない。細胞毒性アッセイは、薬物の薬物動態情報に匹敵するはずの適切な薬物範囲を決定するために使用することができる。
選択プロセス全体を通じて、細胞の母集団全体が単一のグループとして維持されます。クローン作成またはその他の分離方法は使用されません。細胞は、最初に薬物の低レベルに連続的に露出されます。続いて、細胞が薬物の存在下で増殖するように適応した後、薬物の用量は、薬物10、11の最終最適用量にゆっくりと増加する。あるいは、パルス薬物投与または変異発生は、薬剤治療12、13の前に行われる抵抗細胞の選択に使用することができる。残念ながら、薬剤耐性が発症しない症例は一般的に報告されていない。選択戦略は、臨床的に関連する抵抗を再構築するための癌患者の状態を模倣することを目的として開発されています。時には、薬剤耐性のメカニズムに関連する分子変化を同定するために、高い薬物濃度が使用される。このモデルは臨床的に関連性が低くなる。
ここでは、EGFRエキソン19における15bp欠損を持つPC-9細胞から3つの独立したアファチニブ耐性細胞株を確立する方法と、アファチニブ耐性細胞株の初期特性を確立する方法について説明する。
プロトコル
1. 3つの独立したアファチニブ耐性PC-9細胞株の確立
- 3-(4,5-ジメチルチアゾル-2-yl)-2,5-ジフェニルテトラゾリウム臭化物(MTT)アッセイを用いたPC-9細胞に対する初期アファチニブ暴露濃度の決定
- 胎児ウシ血清(10%)、ペニシリン(100U/mL)、およびストレプトマイシン(100μg/mL)を含有する増殖培地におけるPC-9細胞を、37°Cで5%CO2インキュベーターで10cm皿で処理した細胞培養中の血清中に培養した。
- 成長培地で4 x 104セル/mLでPC-9細胞を再中断し、96ウェルマイクロプレートで50 μL/ウェルにシードします。細胞の最終的な濃度は2.0 x 103細胞/50 μL/ウェルである。37°Cで5%CO2インキュベーターで一晩インキュベートします。
- 異なる濃度でアファチニブ溶液の50 μLを追加します: 0, 0.002, 0.006, 0.02, 0.06, 0.2, 0.6, 2, 6, 20 μM 成長培地を含むウェルに(50 μL)アファチニブの最終容積および濃度は、それぞれ100 μLおよび0、0.001、0.003、0.01、0.03、0.1、0.3、1、3、および10 μMである。
- 96ウェルプレートを37°Cで5%CO2インキュベーターで96時間インキュベートします。
- 各井戸に15μLの色素溶液(材料表を参照)を追加し、37°Cで5%CO2インキュベーターで4時間インキュベートし、100 μLの可溶化/ストップ溶液(材料の表を参照)を各ウェルに加え、5%COで一晩インキュベートします。c10>2インキュベーター(37°C)。
- マイクロプレートリーダーを使用して570nm(OD570)で光学密度を測定します(材料の表を参照)。6-12反復を準備し、少なくとも3回実験を繰り返します。
- 統計ソフトウェア (材料の表を参照) を使用して、これらのデータを半ロググラフとしてグラフィカルにプロットし、最大値の50% に対する応答を減少させる薬物濃度である IC 50 値を計算します (材料の表を参照)).
- 不可逆的なEGFR-TKI、アファチニブへのPC-9細胞の連続的な暴露は、3つの独立した10cm皿における段階的な用量エスカレーションによって
- 増殖培地の10mLを含むp100皿中のPC-9細胞を培養する。PC-9細胞がサブコンフルエント段階に達すると、1mLの細胞懸濁液を3つの新しいp100皿に移し、9mLの成長培地を使用する。1:10希釈されたPC-9細胞は3〜4日でサブコンフルエントになり、細胞数は約4-5 x 105細胞/mLである。
- 翌日、3つのp100料理のそれぞれにアファチニブのIC50値の1/10を追加します。
注:アファチニブは、1 μM、10 μM、100 μM、1 mM、および 5 mM のストック濃度で DMSO で再構成されます。アファチニブ溶液の1〜10 μLは、必要な最終濃度に応じて、培養中の成長培地の10mLに添加される。 - アファチニブ含有p100皿の細胞がサブコンフルエントになると、1 mLピペットで吸引によってよく混合し、新しいp100皿に新鮮な成長培地の9mLに細胞懸濁液の1 mLを追加します。次に、新しい培養物にアファチニブの濃度を10〜20%高く加える。
- アファチニブ濃度を用いた段階的な用量エスカレーションにより培地中の0.1nMから1μMのアファチニブ濃度を10〜12ヶ月の期間にわたって各工程で10〜20%増加させた。
注:アファチニブ濃度がIC50値に近づくと、細胞増殖が非常に遅くなる。細胞が1:9に分割された場合、これらの細胞はアファチニブのより高い濃度によって殺されるにつれて、成長しないことがあります。したがって、より高いアファニチブ濃度では、細胞を1:2の比率で分割することができる。最も耐性のある細胞は、アファチニブ含有培地で3〜14日間増殖させ、耐性細胞を通過させる必要があるまで培地は変化しなかった。 - アファチニブ耐性細胞を1μMアファチニブ含有増殖培地で2〜3ヶ月間培養する。1 μMのアファチニブ濃度では、このモデルでアファチニブに対する耐性を開発するために10〜12ヶ月が必要です。MTTアッセイを実行して、細胞がアファチニブに耐性であることを確認します。独立して確立された3つのアファチニブ耐性細胞株は、AFR1、AFR2、およびAFR3と命名された。
2. 3つの独立性アファチニブ耐性細胞の特性化
- 親のPC-9細胞の増殖曲線の決定とアファチニブ耐性細胞の確立
- PC-9、AFR1、AFR2、およびAFR3細胞を37°Cで5%CO2インキュベーターで培養する。
- 増殖培地で5 x 103細胞/mLで細胞を再定重し、100 μL/ウェルを96ウェルマイクロプレートにシードし、細胞の最終濃度が500細胞/100μL/ウェルであることを明します。
注:MTTアッセイは、0日、1日、2日、3日、5日、7日でOD570値を測定するために実行されます。1日に6つの96ウェルマイクロプレートが必要です。 - MTT アッセイを 24 時間ごとに実行し、次に 0、1、2、3、5、および 7 日目に実行します。OD570値を測定し、6~ 12 レプリケートを準備します。実験を少なくとも3回繰り返し、統計ソフトウェアを使用して結果をグラフィカルにプロットします(「材料の表」を参照)。
- リアルタイムPCRによるEGFRにおけるゲノムDNA改変の同定
注:アファチニブは、EGFRチロシンキナーゼを標的とする低分子阻害剤です。EGFR発現状態は、DNAおよびタンパク質レベルで決定される。- ゲノムDNAは、製造元の指示に従ってDNA精製キット(材料の表を参照)を使用して単離されます。分光光度計(材料の表を参照)で単離されたゲノムDNAの濃度を測定し、すべてのゲノムDNAサンプルを25 ng/μLに調整します。
- SYBRグリーンマスターミックス(材料表参照)を用いて、25ng/μL株の2μLに相当するゲノムDNAの50ngを増幅し、蛍光ベースのRT-PCR検出システムを用いて結果を分析する(材料の表参照)。
注:PCRサイクリング条件は、20sの95°Cで初期脱生ステップから始まり、続いて3s、60°Cアニーリングの95°Cの40サイクルを30s用に焼成した。具体的なプライマーセットは以下の通りです: EGFR F: 5 '-CAAGGCCATGAATGTCA-3', R: 5'-CTGAATGAGGGGGAGGAACA-3'.正規化遺伝子 LINE-1 F: 5'-AAAGCCGCTCAACTACATGG-3', R: 5'-TGCTTTTGAATGCGCCCCAGAG-3'
- ウェスタンブロット分析によるEGFRレベルに対するタンパク質変化の効果の評価
- 24時間の実験の前にアファチニブで細胞を連続的に処理し、PC-9、AFR1、AFR2、およびAFR3細胞をPBSで2回洗浄し、アファチニブなしで成長培養培養物に播種する。PC-9、AFR1、AFR2、およびAFR3細胞を5 mLの氷冷PBSで2回洗浄します。
- 1%プロテアーゼ阻害剤カクテルを含むRIPAバッファー内の細胞を溶解し(材料の表を参照)、ホスファターゼ阻害剤カクテルIIおよびIII(材料の表を参照)、この溶液を4°Cで30分間インキュベートします。100 x gおよび4 °Cで、クリアされたライサットを収集します。
- ビシンコニン酸アッセイ(材料の表を参照)を使用してタンパク質濃度を決定し、4xサンプルバッファー(500 mMトリス(PH 6.8)、40%グリセロール、8%SDS、20%H2O、0.02%ブロモフェノールブルー)を使用して、すべてのタンパク質サンプルを0.5または1 μg/μLに調整し、96 °Cで5分間沸騰し、これらのタンパク質サンプルを-80°Cで保存し、ウェスタンブロット分析が行われるまで保存します。
- 同量のタンパク質試料を分離し、好ましくは20〜30μL、8%SDSページでタンパク質をポリビニルフッ化物(PVDF)膜に移す。
注:ドデシル硫酸ポリアクリルアミドゲル電気泳動ナトリウム(SDS-PAGE)は、その分子量に基づいてタンパク質を分離するための実験室で一般的に使用されています。- エタノールでガラス板をきれいにし、ガラス板とスペーサーを組み立てます。1.5Mトリス-HCl、pH 8.8、40%ビスアクリルアミド、10%SDS、10%APS、およびTEMEDを含む8%のポリアクリルアミドゲルを調製します。室温で30分間重合します。
- 続いて、0.5Mトリス-HCl、pH 6.8、40%ビスアクリルアミド、10%SDS、10%APS、およびTEMEDを含む積み重ねゲルを調製する。スタッキングゲル溶液を追加し、櫛を挿入し、室温で20〜30分間ゲルを重合します。
- 電気泳動装置にゲルを入れ、タンクにランニングバッファー(0.25 Mトリス、1.92 Mグリシン、および1%SDS)を充填します。同量のタンパク質サンプル(20~30μL)をロードし、約60分後に色素前面がゲルから流出したら、180V.電気泳動を停止します。
- TBSTで1-2分間ゲルを洗浄し、300 mAの一定電流で1.5時間のセミドライブロッティング(材料の表を参照)によってPVDF膜にタンパク質を移します。
- 室温で1時間TBST溶液(材料の表を参照)で希釈した非脂肪ドライミルクの5%で膜をブロックし、その後、抗EGFR、抗ホスホ-EGFR(Y1068)、抗HER2、抗HER2で膜をプローブし、抗HER3、抗MET、および抗アクチン抗体(TBSTで1:3,000希釈)(材料の表を参照)を一晩4°Cで。
- TBSTで膜を10分間3回洗浄し、その後、室温で1〜1.5時間の二次抗体(TBSTで希釈された1:200)に膜を露出させます。室温で10分間TBSTで膜を5回洗い、ECL溶液(材料の表を参照)にさらし、フィルムを使用して信号を視覚化します。
- シーケンシングによるEGFR変異の解析
- EGFRエキソン19-21の特異的プライマーを用いてゲノムDNAを増幅する。PCRサイクリング条件は、最初の脱退ステップを94°Cで1分間開始し、続いて98°Cで10s、30sで55°Cでアニーリング、72°Cで1分間延長する30サイクルで始まります。
注:EGFRエクソン19の特定のプライマー:F:5'-GCAATCAGCGTGTGTGGCTC-3'R:5'-カタガアガアガッタッタガットグ-3'、 エクソン 20: F: 5'-CCATGAGTACGTTTTAACTC-3', R: 5'-CATATCCCCGGCAACTCTCTTGC-3', およびエキソン 21: F: 5'-ATGAACATGGATATATATTCGG-3', R: 5'-GCTCACCCAGAGTGTG-3'。 - PCR精製キット(材料の表を参照)を使用して増幅されたPCR製品を浄化し、アンプリコンを配列します。
- EGFRエキソン19-21の特異的プライマーを用いてゲノムDNAを増幅する。PCRサイクリング条件は、最初の脱退ステップを94°Cで1分間開始し、続いて98°Cで10s、30sで55°Cでアニーリング、72°Cで1分間延長する30サイクルで始まります。
結果
段階的な用量エスカレーション手順を用いてPC-9細胞から3つのアファチニブ耐性細胞株を確立するためのスキーマを図1に示す。図2は、アファチニブの濃度が増加するにつれて親のPC-9細胞の細胞増殖の減少を示し、PC-9細胞がアファチニブ曝露に敏感であることを示す。図3は、3つの細胞株のアファチニブ耐性を示す。3つのアファチニブ耐性細胞株、AFR1、AFR2、およびAFR3のいずれも、アファチニブ暴露下での細胞増殖の抑制を示さなかった。図4は、PC-9、AFR1、AFR2、およびAFR3細胞の細胞増殖曲線を示す。3つのアファチニブ耐性細胞株は、親のPC-9細胞よりも有意に遅い成長を示した。図5は、PC-9および3つのアファチニブ耐性細胞におけるEGFR gDNAの発現レベルを示し、これは、親のPC-9細胞よりも有意に高いレベルのEGFR gDNAを発現したことを示す。図6は、PC-9およびアファチニブ耐性細胞におけるEGFRのタンパク質発現を示す。同等のgDNA発現レベルでは、EGFRタンパク質発現は親のPC-9細胞よりも耐性細胞において高かった。図7は、PC-9、AFR1、AFR2、およびAFR3細胞におけるEGFRエクソン19および20の配列決定結果を示す。PC-9細胞は、EGFRエキソン19および野生型EGFRにおいて15bp欠損を示した。しかしながら、AFR1およびAFR2細胞は、野生型EGFRエキソン19の増幅を示した。AFR3細胞は、PC-9細胞と同様にEGFRエキソン19に15bp欠損を含んでいたが、EGFRエキソン20では点変異T790Mが認められた。

図 1:PC-9から3つのアファチニブ耐性細胞株を確立するために使用されるプロセスのスキーマ。まず、PC-9細胞を3つのp100皿に分離し、IC50値の1/10でアファチニブに曝露した。次に、増殖培地中のアファチニブ濃度を段階的に用量エスカレーションして1μMに増加させた。10-12ヶ月後、3つの独立したアファチニブ耐性細胞株が確立され、AFR1、AFR2、およびAFR3と命名された。この図のより大きなバージョンを表示するには、ここをクリックしてください。
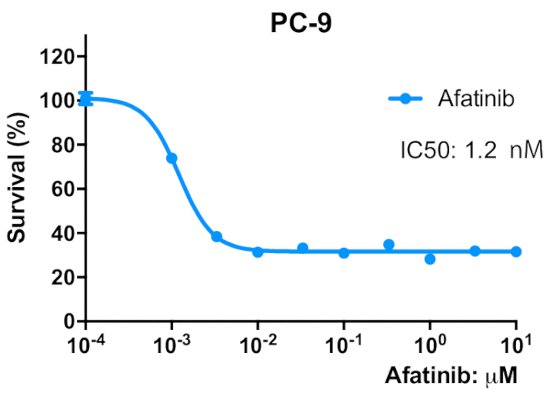
図 2: 親PC-9細胞は、不可逆的なEGFR TKI、アファチニブに敏感である。細胞を2 x 103細胞/ウェル/50μLの増殖培地で96ウェルマイクロプレートに播種し、一晩前培養した。細胞を96時間アファチニブの示された濃度で処理した。MTTアッセイを行い、OD570値をマイクロプレートリーダー(材料表参照)を用いて測定し、対照細胞に対して得られた値のパーセンテージとして表した。データは、6-12レプリケートウェルからの値の平均±SEMとして提示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
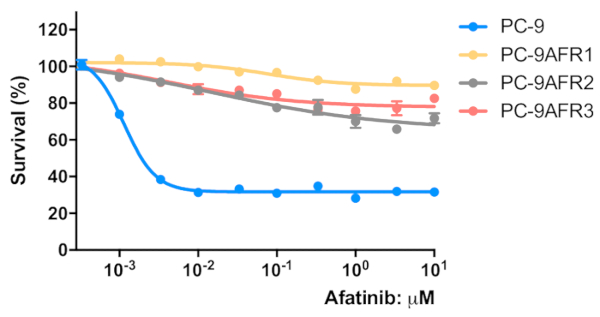
図 3:確立された細胞は、不可逆的なEGFR TKI、アファチニブに対する耐性を示した。細胞を2 x 103細胞/ウェル/50 μLの成長培地で96ウェルマイクロプレートに播種し、一晩前培地した。細胞を96時間アファチニブの示された濃度で処理した。MTTアッセイを行い、OD570値をマイクロプレートリーダー(材料表参照)を用いて測定し、対照細胞に対して得られた値のパーセンテージとして表した。データは、6-12レプリケートウェルからの値の平均±SEMとして提示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
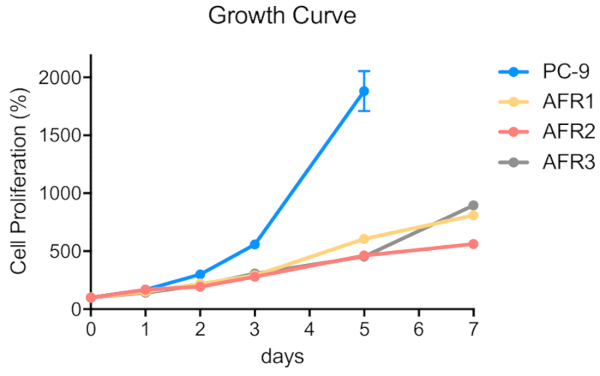
図 4: アファチニブ耐性細胞株は、親のPC-9細胞よりも低い増殖を示した。細胞を5 x 102細胞/100 μL/ウェルで96ウェルマイクロプレートに播種した。MTTアッセイを行い、OD570値をマイクロプレートリーダー(材料表参照)を用いて0日目、1日目、2日目、3月5日、7日目に測定し、対照細胞に対して得られた値のパーセンテージで表した。データは、6-12レプリケートウェルからの値の平均±SEMとして提示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
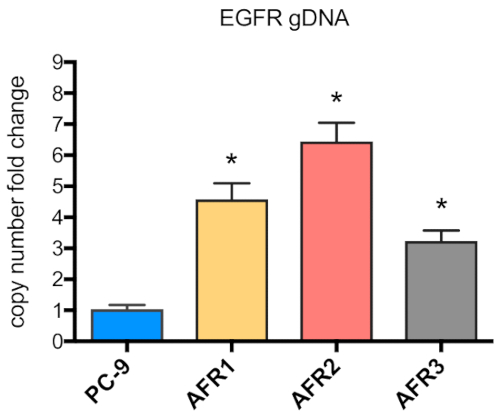
図 5: EGFRの遺伝子コピー数は、アファチニブ耐性細胞において上昇した。EGFR遺伝子コピー数の標高は、PC-9、AFR1、AFR2、およびAFR3細胞から単離されたゲノムDNAの定量PCRによって測定した。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 6: EGFRタンパク質の基底レベルは、アファチニブ耐性細胞において増加した。PC-9、AFR1、AFR2、およびAFR3細胞におけるホスホEGFR、EGFR、HER2、HER3、MET発現のウェスタンブロット解析。β-アクチンをローディング制御として用いた。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 7: DNA配列はEGFRエキソン19および20で読み取る。PC-9、AFR1、AFR2、およびAFR3のゲノムDNAをEGFRエキソン19および21に対する特異的プライマーで増幅し、シーケンシング用に精製した。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、3つの独立したアファチニブ耐性細胞株を確立する方法を説明し、親のPC-9細胞と比較してこれらの細胞を特徴付けた。段階的な用量エスカレーション暴露により、親のPC-9細胞は10〜12ヶ月の期間にわたってアファチニブに対する耐性を獲得した。臨床的には、EGFR TKIに対する耐性機構は不均一であり、したがって、アファチニブによる初期処理後、PC-9細胞を3つの独立したp100皿に分割し、さらにアファチニブに曝露した。当初、細胞増殖は有意に遅くはなかったが、薬物濃度がIC50値に近づくにつれて、細胞増殖は遅くなった。これは、阻害剤に対する後天性耐性を持つ細胞を得るための重要なステップである。増殖細胞は分割され、1:10または1:5の比率で新しいp100皿に移されるべきである。PC-9細胞をp100皿で培養したところ、いくらかの付着が認められたが、ほとんどの細胞は懸濁液中で成長した。アファチニブの濃度が増加するにつれて、細胞は、食器を処理した組織培養の底部に付着した。ほとんどの細胞が付着している場合は、細胞スクレーパーで剥離することができます。アファチニブの最終濃度は1μMであり、これは最大血清濃度(Cmax)14の約5倍である。親クローンと抵抗クローンの間に明確な差異を得るために、最終濃度はCmaxよりも高くなるに設定した。
RPMI-1640にはペニシリンとストレプトマイシンが含まれていますが、手順中の1つの深刻な懸念は細菌汚染です。これを避けるために、細胞が分割されたときに新鮮な成長培地を含む2つのp100皿を調製することができる。細胞がサブコンフルエント段階に達すると、1つのp100皿の細胞をさらに分割することができ、他のp100皿の細胞は凍結保存媒体(材料の表を参照)で-80°Cで保存することができ、1本のラインが汚染された場合にバックアップとして保存することができます。を使用して、格納された行を使用できます。
細胞培養を用いてヒトにおけるアファチニブ耐性の獲得を完全に再現することは困難であろう。EGFRエキソン20におけるT790M変異の出現は、アファチニブに対する耐性の主な原因として報告された。我々の報告書では、1つの耐性クローンはT790M突然変異11を含んでいた。さらに、AFR1およびAFR2細胞における野生型EGFRの増加は、我々および他の群15、16によって報告されている。EGFR変異の喪失および野生型EGFRの増加は、EGFR-TKIs 17,18に対する後天性耐性を有する患者からの臨床サンプルにおいても報告される。 したがって、我々の現在のモデルのインビトロ研究は、後天性耐性を有する臨床試料の分子プロファイルを反映し得る。
この段階的な用量エスカレーション法は、後天性耐性細胞ラインを得るための最も信頼性が高いと考えられる。しかし、培養細胞における最初の高用量アファチニブ曝露は、がん患者におけるアファチニブ治療の効果をよりよく反映する可能性が高いが、耐性細胞の確立はより困難である。この方法には、PC-9などの浮動細胞株だけでなく、HCC827、11-18、HCC4006などの付着細胞株も採用できます。この段階的な用量エスカレーション法は、他のタイプの癌を表す他の細胞株を使用して、他の阻害剤に耐性のあるクローンを確立するのにも有用である。
N-エチル-N-n-nitrosoureaなどの変異型薬剤への親細胞の曝露、続いてアファチニブまたはオシメルチニブ治療に耐性のある細胞の選択が報告されている19 、20.しかし、この人工的な方法は、GCからATへの遷移、ATからTA転移への特定の塩基置換を引き起こす傾向がある。また、EGFR TKIはNSCLC患者における変異型化剤ではない。したがって、段階的な用量エスカレーションの方法は、変異型薬剤を使用するよりも代表的である。
EGFR TKIは最初は有効ですが、細胞は最終的にこのような単一標的薬に対する耐性を発症し、癌の治癒を困難にします。したがって、複数の分子を標的とする阻害剤は、開発に不可欠です。そのためには、多標的阻害剤に対する後天性耐性を持つ細胞を得て、薬剤耐性の根底にあるメカニズムを評価する必要がある。
開示事項
著者は何も開示していない。
謝辞
先進がん翻訳研究所のメンバーの皆さんの思いやりのあるコメントと編集に感謝します。この作品は、JSPS KAKENHI(助成番号:16K09590 to T.Y.)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| afatinib | Selleck | S1011 | |
| anti-EGFR monoclonal antibody | cell signaling technology | 4267S | |
| bicinchoninc acid assay | sigma | B9643 | |
| cell-culture treated 10 cm dish | Violamo | 2-8590-03 | |
| CELL BANKER1 | TakaRa | CB011 | cryopreservation media |
| CellTiter 96 | Promega | G4100 | Non-Radioactive Cell Proliferation Assay; Dye solution and Solubilization/Stop solution |
| DMSO | Wako | 043-07216 | |
| ECL solution | Perkin Elmer | NEL105001EA | |
| FBS | gibco | 26140-079 | |
| GeneAmp 5700 | Applied Biosystems | fluorescence-based RT-PCR-detection system | |
| GraphPad Prism v.7 software | GraphPad, Inc. | a statistical software | |
| NanoDrop Lite spectrophotometer | Thermo | spectrophotometer | |
| Nonfat dry milk | cell signaling technology | 9999S | |
| Pen Strep | gibco | 15140-163 | |
| phosphatase inhibitor cocktail 2 | sigma | P5726 | |
| phosphatase inhibitor cocktail 3 | sigma | P0044 | |
| Powerscan HT microplate reader | BioTek | ||
| Power SYBR Green master mix | Applied Biosystems | SYBR Green master mix | |
| protease inhibitor cocktail | sigma | P8340 | |
| QIAamp DNA Mini kit | Qiagen | 51306 | DNA purification kit |
| QIAquick PCR Purification Kit | QIAGEN | PCR purification kit | |
| RPMI-1640 | Wako | 189-02025 | with L-Glutamine and Phenol Red |
| TBST powder | sigma | T9039 | |
| Trans-Blot SD Semi-Dry Electrophoretic Transfer cell | Bio-Rad | semi-dry t4ransfer apparatus | |
| 96 well microplate | Thermo | 130188 |
参考文献
- Chan, B. A., Hughes, B. G. Targeted therapy for non-small cell lung cancer: current standards and the promise of the future. Translational Lung Cancer Research. 4 (1), 36-54 (2015).
- Mitsudomi, T., Yatabe, Y. Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidermal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer. Cancer Science. 98 (12), 1817-1824 (2007).
- Yamaoka, T., Kusumoto, S., Ando, K., Ohba, M., Ohmori, T. Receptor tyrosine kinase-targeted cancer therapy. International Journal of Molecular Science. 19 (11), (2018).
- Marshall, J. Clinical implications of the mechanism of epidermal growth factor receptor inhibitors. Cancer. 107 (6), 1207-1218 (2006).
- Hirsh, V. Managing treatment-related adverse events associated with egfr tyrosine kinase inhibitors in advanced non-small-cell lung cancer. Current Oncology. 18 (3), 126-138 (2011).
- Arcila, M. E., et al. Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay. Clinical Cancer Research. 17 (5), 1169-1180 (2011).
- Sequist, L. V., et al. Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Science Translational Medicine. 3 (75), 75ra26 (2011).
- Yang, J. C., et al. Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. Journal of Clinical Oncology. 35 (12), 1288-1296 (2017).
- Chong, C. R., Janne, P. A. The quest to overcome resistance to EGFR-targeted therapies in cancer. Nature Medicine. 19 (11), 1389-1400 (2013).
- Clynes, M., Redmond, A., Moran, E., Gilvarry, U. Multiple drug-resistance in variant of a human non-small cell lung carcinoma cell line, DLKP-A. Cytotechnology. 10 (1), 75-89 (1992).
- Yamaoka, T., et al. Distinct afatinib resistance mechanisms identified in lung adenocarcinoma harboring an EGFR mutation. Molecular Cancer Research. 15 (7), 915-928 (2017).
- Liang, X. J., Shen, D. W., Garfield, S., Gottesman, M. M. Mislocalization of membrane proteins associated with multidrug resistance in cisplatin-resistant cancer cell lines. Cancer Research. 63 (18), 5909-5916 (2003).
- Shen, D. W., Akiyama, S., Schoenlein, P., Pastan, I., Gottesman, M. M. Characterisation of high-level cisplatin-resistant cell lines established from a human hepatoma cell line and human KB adenocarcinoma cells: cross-resistance and protein changes. British Journal of Cancer. 71 (4), 676-683 (1995).
- Murakami, H., et al. Phase I study of continuous afatinib (BIBW 2992) in patients with advanced non-small cell lung cancer after prior chemotherapy/erlotinib/gefitinib (LUX-Lung 4). Cancer Chemotherapy and Pharmacology. 69 (4), 891-899 (2012).
- Nukaga, S., et al. Amplification of EGFR wild-type alleles in non-small cell lung cancer cells confers acquired resistance to mutation-selective EGFR tyrosine kinase inhibitors. Cancer Research. 77 (8), 2078-2089 (2017).
- Nakatani, K., et al. EGFR amplifications mediate resistance to rociletinib and osimertinib in acquired afatinib-resistant NSCLC harboring exon 19 deletion/T790M in EGFR. Molecualr Cancer Therapy. 18 (1), 112-126 (2019).
- Piotrowska, Z., et al. Heterogeneity underlies the emergence of EGFRT790 wild-type clones following treatment of T790M-positive cancers with a third-generation EGFR inhibitor. Cancer Discovery. 5 (7), 713-722 (2015).
- Ortiz-Cuaran, S., et al. Heterogeneous mechanisms of primary and acquired resistance to third-generation EGFR inhibitors. Clinical Cancer Research. 22 (19), 4837-4847 (2016).
- Kobayashi, Y., et al. Characterization of EGFR T790M, L792F, and C797S mutations as mechanisms of acquired resistance to afatinib in lung cancer. Molecular Cancer Therapy. 16 (2), 357-364 (2017).
- Uchibori, K., Inase, N., Nishio, M., Fujita, N., Katayama, R. Identification of mutation accumulation as resistance mechanism emerging in first-line osimertinib treatment. Journal of Thoracic Oncology. 13 (7), 915-925 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved