Method Article
Istituzione e caratterizzazione di tre linee cellulari adenocarcinoma polmonare resistente agli Agrassiinib sviluppate con l'aumento delle dosi di Afatinib
In questo articolo
Riepilogo
È stato sviluppato un metodo per stabilire linee cellulari aresistenza ai grassiinib da cellule adenocarcinoma polmonari PC-9, e sono state caratterizzate cellule resistenti. Le cellule resistenti possono essere utilizzate per studiare i meccanismi di resistenza dell'inibitore della cinesi del fattore di crescita epidermico, applicabili per i pazienti con carcinoma polmonare non a piccole cellule.
Abstract
La resistenza acquisita agli inibitori molecolari è un grave problema nella terapia del cancro. Il cancro del polmone rimane la principale causa di morte per cancro nella maggior parte dei paesi. La scoperta di "mutazioni del driver oncogeniche", come il recettore del fattore di crescita epidermico(EGFR) e il successivo sviluppo di agenti molecolari mirati della licinesi (TCI) (gefitinib, erlotinib, afatinib, dacomitinib, e osimertinib) hanno drammaticamente alterato il trattamento del cancro ai polmoni negli ultimi decenni. Tuttavia, questi farmaci non sono ancora efficaci nei pazienti con cancro polmonare a cellule non piccole (NSCLC) che trasportano mutazioni attivanti EGFR. A seguito della resistenza acquisita, la progressione sistemica della NSCLC rimane un ostacolo significativo nel trattamento dei pazienti con NSCLC positivo alla mutazione EGFR. Qui, presentiamo un metodo di escalation delle dosi graduale per stabilire tre linee cellulari agrassinib agrassiinib acquisite in modo indipendente da cellule NSCLC PC-9 che ospitano mutazioni di commutazione di coppie di 15 basi in EGFR esoni 19. Vengono brevemente presentati metodi per caratterizzare le tre linee cellulari indipendenti aresistenza agrassiinib. I meccanismi di resistenza acquisiti alle EGFR TCI sono eterogenei. Pertanto, devono essere esaminate più linee cellulari con resistenza acquisita agli EGFR-TCI. Da dieci a dodici mesi sono necessari per ottenere linee cellulari con resistenza acquisita utilizzando questo approccio di escalation della dose stepwise. La scoperta di nuovi meccanismi di resistenza acquisiti contribuirà allo sviluppo di strategie terapeutiche più efficaci e sicure.
Introduzione
Cinque inibitori della kinasi tirosina, mirati al recettore del fattore di crescita epidermico (EGFR), tra cui gefitinib, erlotinib, afatinib, dacomitinib e osimertinib sono attualmente disponibili per il trattamento di pazienti con cancro (NSCLC). Negli ultimi dieci anni, le terapie per tali pazienti hanno subito uno sviluppo drammatico con la scoperta di nuovi potenziali EGFR-TMI. Tra i pazienti con adenocarcinoma polmonare, le mutazioni somatiche nell'EGFR sono identificate in circa il 50% dei pazienti asiatici e il 15% dei pazienti caucasici1. Le mutazioni più comuni in EGFR sono una mutazione punto L858R in EGFR exon 21 e 15 coppie di base (bp) delezioni in EGFR exon 192. Nei pazienti eGFR con NSCLC, gli EGFR-TMI migliorano i tassi di risposta e gli esiti clinici rispetto al precedente standard di chemioterapia del doppietto di platino3.
Gefitinib e erlotinib sono stati i primi inibitori di piccole molecole approvati e sono generalmente indicati come TCI EGFR di prima generazione. Questi EGFR TKIs bloccano l'attività della chinasi della tirosina competendo con ATP e legandosi reversibilmente ai siti di legame ATP4. Afatinib è un EGFR TKI di seconda generazione che si lega in modo irreversibile e covalente al dominio della chinasi tirosina di EGFR ed è caratterizzato come un inibitore della famiglia EGFR pan-umano5.
Nonostante il vantaggio drammatico di queste terapie nei pazienti con NSCLC, la resistenza acquisita è inevitabile. Il meccanismo di resistenza più comune contro i TCI EGFR di prima e seconda generazione è l'emergere della mutazione T790M in EGFR exon 20, che è presente nel 50-70% dei campioni di tumore6,7,8. Altri meccanismi di resistenza includono segnali di bypass (a MET, IGF1R, e HER2), trasformazione in carcinoma polmonare a piccole cellule, e l'induzione di transizione epiteliale-mesenchymal, che si verificano pre-clinicamente e clinicamente9. I meccanismi di resistenza alle EGFR TCI sono eterogenei. Identificando nuovi meccanismi di resistenza negli studi preclinici, potrebbe essere possibile sviluppare nuove terapie per superare la resistenza. Le terapie di sequenza ottimali che massimizzano il beneficio clinico per i pazienti devono considerare i meccanismi di resistenza e l'obiettivo terapeutico.
È imperativo scegliere la giusta linea cellulare dei genitori, in quanto è la base di tutti gli esperimenti successivi. Le strategie di selezione iniziano con rilevanza clinica; è necessario scegliere una linea cellulare chemioterapia e radioattiva. Il precedente trattamento chemioterapico e/o radiativo può indurre l'alterazione delle vie di resistenza e cambiamenti dell'espressione dei marcatori di resistenza ai farmaci. In questo studio, le cellule PC-9, che trasportano 15 bp delezioni in EGFR exon 19, sono impiegate per l'istituzione di resistenza acquisita all'afatinib. Questa linea cellulare è stata derivata da un paziente NSCLC giapponese, che non ha ricevuto chemioterapia e radiazioni precedenti.
Poiché afatinib viene somministrato per via orale su base giornaliera, il trattamento continuo in vitro, in cui le cellule vengono coltivate costantemente in presenza di afatinib sarebbe clinicamente rilevante. La dose di droghe utilizzate nelle varie fasi dell'esperimento deve essere ottimizzata per la linea cellulare dei genitori selezionata. Un saggio di citotossicità può essere utilizzato per determinare una gamma di farmaci adatti, che dovrebbe essere paragonabile alle informazioni farmacocinetiche del farmaco.
Durante tutto il processo di selezione, l'intera popolazione di cellule viene mantenuta come un unico gruppo; la clonazione o altri metodi di separazione non vengono utilizzati. Le cellule sono prima continuamente esposte a un basso livello del farmaco. Successivamente, dopo che le cellule si adattano a crescere in presenza del farmaco, la dose del farmaco viene lentamente aumentata alla dose ottimale finale del farmaco10,11. In alternativa, un impulso farmaco-somministrazione o mutagenesi può essere utilizzato per la selezione di cellule di resistenza, che vengono eseguite anche prima del trattamento farmacologico 12,13. Purtroppo, i casi in cui la resistenza ai farmaci non si sviluppa sono generalmente segnalati. Le strategie di selezione sono sviluppate con l'obiettivo di cercare di imitare le condizioni dei pazienti oncologici per ricostruire la resistenza clinicamente rilevante. A volte, per identificare i cambiamenti molecolari associati ai meccanismi di resistenza ai farmaci, viene utilizzata un'alta concentrazione di farmaci. Questo modello diventa meno clinicamente rilevante.
Qui, descriviamo un metodo per stabilire tre linee cellulari indipendenti resistenti agli agrassinib da cellule PC-9 che ospitano 15 bp delezioni in EGFR exon 19, nonché la caratterizzazione iniziale delle linee cellulari resistenti agli agrassiinib.
Protocollo
1. Creazione di tre linee cellulari indipendente resistente agli agrassiinib PC-9
- Determinazione della concentrazione iniziale di esposizione agrassinib per le cellule PC-9 utilizzando il saggio 3-(4,5-dithlthiazol-2-yl)-2,5- diphenyltetrazolium bromuro (MTT)
- Coltura PC-9 cellule nel mezzo di crescita contenente siero bovino fetale (10%), penicillina (100 U/mL), e streptomicina (100 g/mL) in una coltura cellulare trattata 10 cm piatto in un 5% DI CO2 incubatore a 37 .
- Risospendere le cellule PC-9 a 4 x 104 celle/mL nel mezzo di crescita e poi seme a 50 .l/well in una micropiastra da 96 pozze. La concentrazione finale delle cellule è 2,0 x 103 cellule/50 - L/po. Incubare pernottamento in un incubatore di CO2 del 5% a 37gradi centigradi.
- Aggiungere 50 l di soluzione agrassinib a diverse concentrazioni: 0, 0,002, 0,006, 0,02, 0,06, 0,2, 0,6, 2, 6 e 20M ai pozze contenenti il mezzo di crescita (50 . Il volume finale e le concentrazioni di afatinib sono rispettivamente di 100 , L e 0, 0,001, 0,01, 0,01, 0,1, 0,3, 1, 3 e 10M.
- Incubare la piastra 96 per 96 h in un'incubatrice di CO2 del 5% a 37 gradi centigradi.
- Aggiungete 15 l della soluzione di colorante (vedi Tabella deimateriali) ad ogni pozzo e incubate per 4 h in un'incubatrice di CO2 del 5% a 37 gradi centigradi, quindi aggiungete 100 l di solubilizzazione/stop-solution (vedere Tabella deimateriali) a ciascun pozzo e incubate durante la notte in un CO del 5%). incubatore c10>2 a 37 gradi centigradi.
- Misurare la densità ottica a 570 nm (OD570) utilizzando un lettore di microplacino (vedere Tabella dei materiali). Preparare 6-12 repliche e ripetere gli esperimenti almeno tre volte.
- Utilizzare un software statistico (vedi Tabella dei materiali) per tracciare graficamente questi dati come un grafico semi-log e calcolare il valore IC50, che è la concentrazione di droga che riduce la risposta al 50% del suo massimo (vedi Tabella dei materiali ).
- Esposizione continua delle cellule PC-9 all'irreversibile EGFR-TKI, afatinib, mediante escalation graduale della dose in tre piatti indipendenti da 10 cm
- Coltura PC-9 cellule in piatti p100 contenenti 10 mL di mezzo di crescita. Quando le cellule PC-9 raggiungono la fase sub-confluente, trasferire 1 mL di sospensione cellulare in tre nuovi piatti p100, con 9 mL di mezzo di crescita. Le cellule 1:10 PC-9 diluite diventano sub-confluenti in 3-4 giorni, con un numero di cellule di circa 4-5 x 105 celle / mL.
- Il giorno successivo, aggiungere 1/10 del valore IC50 di afatinib in ciascuno dei tre piatti p100.
NOT: Afatinib è ricostituito in DMSO a concentrazioni di scorte di 1 m, 10 M, 100 M, 1 mM e 5 mM. Da 1 a 10 l di afatinib-solution viene aggiunto in 10 mL di mezzo di crescita nella coltura, come dalle concentrazioni finali richieste. - Quando le cellule dei piatti afatinib p100 diventano sub-confluenti, mescolare bene per aspirazione con una pipetta da 1 mL e aggiungere 1 mL della sospensione cellulare a 9 mL di mezzo di crescita fresco in un nuovo piatto p100. Successivamente, aggiungere 10-20% più alte concentrazioni di agrassiinib alla nuova cultura.
- Aumentare la concentrazione di agrassiinibi di 0,1 nM a 1 M nel mezzo con l'escalation della dose stepwise con la concentrazione di agrassiinib aumentata del 10-20% ad ogni passo nel periodo di 10-12 mesi.
NOT: Quando la concentrazione agrassinib si avvicina al valore IC50, la crescita cellulare diventa piuttosto lenta. Se le cellule sono divise 1:9, non possono crescere, in quanto queste cellule vengono uccise da concentrazioni più elevate di asinneb. Pertanto, a concentrazioni afanitib più elevate, le cellule possono essere divise con un rapporto di 1:2. Le cellule più resistenti sono state coltivate in un mezzo agrassinib-contenuto per 3-14 giorni, e il mezzo non è stato cambiato fino a quando le cellule resistenti dovevano essere passaggio. - Coltura le cellule resistenti agli agrassiinib per 2-3 mesi in 1 mezzo di crescita agrassiinib contenente. Ad una concentrazione agrassinib di 1 M, sono necessari 10-12 mesi per sviluppare resistenza all'afatinib in questo modello. Eseguire il saggio MTT per confermare che le cellule sono resistenti all'agrasso. Le tre linee cellulari agrassinib stabilite indipendentemente erano denominate AFR1, AFR2 e AFR3.
2. Caratterizzazione di tre celle indipendenti resistenti agli Agrassiinib
- Determinazione della curva di crescita delle cellule parentali PC-9 e creazione di cellule resistenti agli agrassinibi
- Cultura delle cellule PC-9, AFR1, AFR2 e AFR3 in media di crescita in un incubatore di CO2 del 5% a 37 gradi centigradi.
- Risospendere le cellule a 5 x 103 cellule/mL con mezzo di crescita, e seme 100 l/well in una micropiastra da 96 pozze, in modo che la concentrazione finale delle cellule sia 500 cellule/100 l/l/well.
NOT: L'analisi MTT viene eseguita per misurare i valori OD570 a 0, 1, 2, 3, 5 e 7 giorni. Per ogni giorno sono necessarie sei microplacche da 96 pozze. - Eseguire il saggio MTT ogni 24 h e quindi nei giorni 0, 1, 2, 3, 5 e 7. Misurare i valori OD570 e preparare 6-12 repliche; ripetere gli esperimenti almeno tre volte e tracciare graficamente i risultati utilizzando un software statistico (vedere Tabella dei materiali).
- Identificazione delle alterazioni genomiche del DNA nell'EGFR tramite PCR in tempo reale
NOT: Afatinib è un piccolo inibitore molecolare che si rivolge alla tirosina EGFR kinase. Lo stato di espressione EGFR è determinato a livello di DNA e proteine.- Il DNA genomico è isolato utilizzando un kit di purificazione del DNA (vedi Tabella deimateriali) seguendo le istruzioni del produttore. Misurare la concentrazione del DNA genomico isolato con uno spettrofotometro (vedi Tabella deimateriali) e regolare tutti i campioni di DNA genomico a 25 ng/ L.
- Amplifica 50 ng di DNA genomico, che equivale a 2 litri dei 25 stock ng/L, utilizzando un mix master verde SYBR (vedi Tabella dei materiali) e analizza i risultati utilizzando un sistema di rilevamento RT-PCR basato sulla fluorescenza (vedi Tabella dei materiali).
NOT: Le condizioni di ciclo PCR sono iniziate con un primo passo di denaturazione a 95 gradi centigradi per i 20 s, seguito da 40 cicli di denaturazione di 95 gradi centigradi per 3 s, 60 gradi annealing per 30 s. I set di primer specifici sono i seguenti: EGFR F: 5'-CAAGGCCATGGACTA-3'R: 5'-CTGGAATGTGGAGGAGGACA-3'. Gene di normalizzazione LINE-1 F: 5'-AAAGGCTCAACTACATGG-3', R: 5-TGCTTTTGAATGCGTCCCAGAG-3'.
- Valutazione dell'effetto delle alterazioni proteiche sul livello dell'EGFR mediante l'analisi delle macchie occidentali
- Trattare le cellule con agrassiinib in modo continuo prima di esperimenti per 24 h. Lavare le cellule PC-9, AFR1, AFR2 e AFR3 due volte con PBS e poi semerli in mezzi di crescita senza afatinib. Lavare due volte le celle PC-9, AFR1, AFR2 e AFR3 con 5 mL di PBS ghiacciato.
- Lyse le cellule nel buffer RIPA contenente 1% protease inhibitor cocktail (vedi Tabella dei materiali) e fosforo cocktail inibitore II e III (vedi Tabella dei materiali) e incubare questa soluzione a 4 gradi centigradi per 30 min. Centrifugare le lismi per 10 min a 100 x g e 4 gradi centigradi e raccogliere i lismi cancellati.
- Determinare le concentrazioni di proteine utilizzando l'acido bicinchoninico (vedi Tabella dei Materiali), regolare tutti i campioni di proteine a 0,5 o 1 g/L utilizzando un buffer di campioni 4x (500 mM) (PH 6,8), il 40% di glicerolo, l'8% di SDS, il 20% H2O, lo 0,02% blu bronolifeolo) e bollire a 96 gradi centigradi per 5 min. Conservare questi campioni di proteine a -80 gradi centigradi fino a quando non viene eseguita l'analisi delle macchie occidentali.
- Separare le stesse quantità di campioni di proteine, preferibilmente 20-30 l, per l'8% di pagine SDS e trasferire le proteine in una membrana di fluoruro polivichine (PVDF).
NOT: L'elettroforesi del gel di sodio dodecyl-polyacrilio (SDS-PAGE) è comunemente usato in laboratorio per la separazione delle proteine in base al loro peso molecolare.- Pulire le lastre di vetro con etanolo e assemblare la lastra di vetro e distanziali. Preparare gel poliacrilamide dell'8% contenenti 1,5 M Tris-HCl, pH 8,8, 40% Bis-acrilamide, 10% SDS, 10% APS e TEMED. Polimerizzare per 30 min a temperatura ambiente.
- Successivamente, preparare un gel di impilamento contenente 0,5 M Tris-HCl, pH 6,8, 40% bis-acrylamide, 10% SDS, 10% APS e TEMED. Aggiungere la soluzione di gel di impilamento, inserire il pettine e polimerizzare il gel per 20-30 min a temperatura ambiente.
- Posizionare i gel nell'apparato di elettroforesi e riempire il serbatoio con tampone di funzionamento (0,25 M Tris, 1,92 M glicina e 1% SDS). Caricare la stessa quantità di campioni di proteine (20-30 l) ed eseguire il gel a 180 V. Fermare l'elettroforesi una volta che la parte anteriore colorante fuoriesce dal gel, dopo circa 60 min.
- Lavare il gel per 1-2 min con TBST e poi trasferire le proteine su una membrana PVDF da gonfiore semi-secco (vedi Tabella dei Materiali) per 1,5 h ad una corrente costante di 300 mA.
- Bloccare le membrane con il 5% di latte secco non grasso (vedi Tabella deimateriali) diluito con soluzione TBST (vedi Tabella dei materiali) per 1 h a temperatura ambiente, quindi sondare le membrane con anti-EGFR, anti-phospho-EGFR (Y1068), anti-HER2, anticorpi anti-HER3, anti-MET e anti-actin (diluiti 1:3.000 in TBST) (vedi Tabella deimateriali) a 4 gradi durante la notte.
- Lavare le membrane con TBST tre volte per 10 min, quindi esporre le membrane all'anticorpo secondario (diluito 1:200 in TBST) per 1-1,5 h a temperatura ambiente. Lavare le membrane cinque volte con TBST per 10 minuti a temperatura ambiente, esporli alla soluzione ECL (vedere Tabella dei materiali) e visualizzare i segnali utilizzando le pellicole.
- Analisi delle mutazioni EGFR mediante sequenziamento
- Amplifica il DNA genomico usando primer specifici per gli esoni EGFR 19-21. Le condizioni di denaturazione della PCR iniziano con un primo passo di denaturazione a 94 gradi centigradi per 1 min, seguito da 30 cicli di denaturazione a 98 gradi centigradi per 10 s, annealando a 55 s per 30 s, ed estraendo si protrae a 72 gradi centigradi per 1 min.
NOT: I primer specifici per EGFR exon 19: F: 5'-GCAATATCGCCTTAGTagTGCCTCTCTC-3' R: 5'-CATAGAAAGTGAACATTTAGGATGTG-3', Esone 20: F: 5'-CCATGAGACTATTTTGAAACTC-3', R: 5-CATATCCCTCCATCCAACTCTCTCTGC-3', e exon 21' e eson 21: F: 5'-ATGAACATGACCCTCTCTGAATTCGG-3', R: 5'- GCTCcACCCAGAATGTCTGGAGA-3. - Depurai i prodotti PCR amplificati utilizzando un kit di purificazione PCR (vedi Tabella deimateriali) e sequenzia gli ampi.
- Amplifica il DNA genomico usando primer specifici per gli esoni EGFR 19-21. Le condizioni di denaturazione della PCR iniziano con un primo passo di denaturazione a 94 gradi centigradi per 1 min, seguito da 30 cicli di denaturazione a 98 gradi centigradi per 10 s, annealando a 55 s per 30 s, ed estraendo si protrae a 72 gradi centigradi per 1 min.
Risultati
Lo schema per stabilire tre linee cellulari aresistenza agrassiinib da cellule PC-9 utilizzando una procedura di dose-escalation passo a passo è illustrato nella Figura 1. La figura 2 mostra una diminuzione della proliferazione cellulare delle cellule parentali del PC-9 con l'aumento della concentrazione di agrassinib, indicando che le cellule PC-9 sono sensibili all'esposizione agrassinib. La figura 3 mostra la resistenza agrassinib delle tre linee cellulari. Nessuna delle tre linee cellulari resistenti agli agrassiinib, AFR1, AFR2 e AFR3, ha mostrato la soppressione della proliferazione cellulare sotto l'esposizione agrassinib. Nella figura 4 sono illustrate le curve di proliferazione delle cellule per le celle PC-9, AFR1, AFR2 e AFR3. Le tre linee cellulari resistenti agli agrassi hanno mostrato una crescita significativamente più lenta rispetto alle cellule parentali del PC-9. La figura 5 mostra i livelli di espressione di EGFR gDNA nel PC-9 e le tre cellule resistenti agli agrassi, che indicano che le cellule resistenti agli agrassinib hanno espresso livelli significativamente più elevati di EGFR gDNA rispetto alle cellule parentali del PC-9. La figura 6 mostra l'espressione proteica di EGFR nelle cellule PC-9 e resistenti agli agrassiini. A livelli comparabili di espressione gDNA, l'espressione della proteina EGFR era più alta nelle cellule resistenti che nelle cellule parentali del PC-9. La figura 7 mostra che i risultati della sequenza degli esoni EGFR 19 e 20 nelle celle PC-9, AFR1, AFR2 e AFR3. Le celle PC-9 hanno mostrato destrazioni di 15 bp in EGFR exon 19 e EGFR wild-type in exon 20. Tuttavia, le cellule AFR1 e AFR2 hanno mostrato amplificazione di EGFR exon 19 di tipo selvaggio. Le cellule AFR3 contenevano espulsioni di 15 bp in EGFR exon 19 come nelle cellule PC-9, ma la mutazione puntiforme T790M è stata osservata nell'EGFR exon 20.

Figura 1 : Schema del processo utilizzato per stabilire tre linee cellulari resistenti agli agrassiini da PC-9. In primo luogo, le cellule PC-9 sono state separate in tre piatti p100 ed esposte ad afatinib a 1/10 del valore IC50. Successivamente, le concentrazioni di asonibi nel mezzo di crescita sono state aumentate di una dose graduale che si è aumento a 1 M. Dopo 10-12 mesi, sono state stabilite tre linee cellulari indipendenti resistenti agli agrassiinib denominate AFR1, AFR2 e AFR3. Fare clic qui per visualizzare una versione più grande di questa figura.
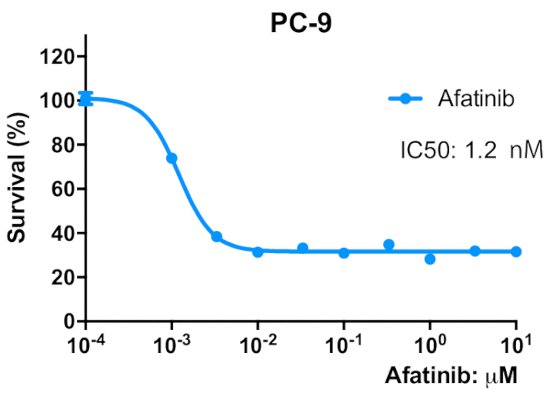
Figura 2 : Le cellule parentali PC-9 sono sensibili all'irreversibile EGFR TKI, afatinib. Le cellule sono state seminate in una micropiastra di 96 pozze a 2 x 103 cellule/pozzo/50 - L di mezzo di crescita, e preincubate durante la notte. Le cellule sono state trattate con le concentrazioni indicate di agrassiinib per 96 h. È stato eseguito un saggio MTT, i valori OD570 sono stati misurati utilizzando un lettore di microplacche (vedi Tabella deimateriali) ed espressi come percentuale del valore ottenuto per le celle di controllo. I dati sono presentati come media: SEM di valori da 6 a 12 replicare pozzi. Fare clic qui per visualizzare una versione più grande di questa figura.
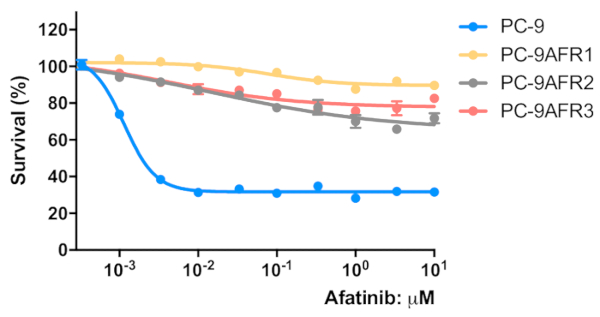
Figura 3 : Le cellule stabilite mostravano resistenza all'eGFR TKI irreversibile, afatinib. Le cellule sono state seminate in una micropiastra da 96 pozze a 2 x 103 cellule/pozzo/50 - L di mezzo di crescita e preincubate durante la notte. Le cellule sono state trattate con le concentrazioni indicate di agrassiinib per 96 h. È stato eseguito un saggio MTT, i valori OD570 sono stati misurati utilizzando un lettore di microplacche (vedi Tabella deimateriali) ed espressi come percentuale del valore ottenuto per le celle di controllo. I dati sono presentati come media: SEM di valori da 6 a 12 replicare pozzi. Fare clic qui per visualizzare una versione più grande di questa figura.
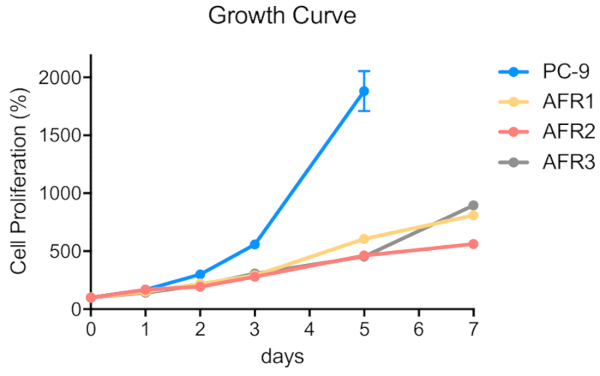
Figura 4 : Le linee cellulari resistenti agli ai grassi mostravano una proliferazione più lenta rispetto alle cellule parentali del PC-9. Le cellule sono state semiatse in microplacche 96-well a 5 x 102 cellule / 100 l/pozzo. È stato eseguito un saggio MTT e i valori OD570 sono stati misurati nei giorni 0, 1, 2, 3, 5 e 7 utilizzando un lettore di microplacche (vedi Tabella deimateriali) ed espressi come percentuale del valore ottenuto per le celle di controllo. I dati sono presentati come media: SEM di valori da 6 a 12 replicare pozzi. Fare clic qui per visualizzare una versione più grande di questa figura.
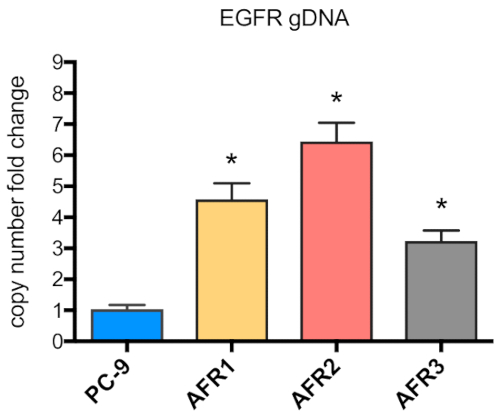
Figura 5 : Il numero di copia genica di EGFR è stato elevato in cellule resistenti agli agrassi. L'elevazione del numero di copie del gene EGFR è stata misurata dalla PCR quantitativa del DNA genomico isolato dalle cellule PC-9, AFR1, AFR2 e AFR3. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6 : Il livello basale della proteina EGFR è stato aumentato nelle cellule resistenti agli agrassi. Analisi commerciale delle espressioni fosforo-EGFR, EGFR, HER2, HER3 e MET nelle cellule PC-9, AFR1, AFR2 e AFR3. L'Actin è stato utilizzato come controllo del carico. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7 : Sequenza di DNA in EGFR esoni 19 e 20. Il DNA genomico di PC-9, AFR1, AFR2 e AFR3 è stato amplificato con primer specifici per EGFR exon 19 e 21 e purificato per il sequenziamento. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui, abbiamo descritto un metodo per stabilire tre linee cellulari indipendenti resistenti agli agrassinib e abbiamo caratterizzato queste cellule rispetto alle cellule parentali del PC-9. Con l'esposizione all'escalation della dose graduale, le cellule parentali di PC-9 hanno acquisito resistenza all'afatinib per un periodo di 10-12 mesi. Clinicamente, i meccanismi di resistenza ai TCI EGFR sono eterogenei, e quindi, dopo il trattamento iniziale con afatinib, le cellule PC-9 sono state suddivise in tre piatti p100 indipendenti ed esposte ulteriormente ad afatinib. Inizialmente, la crescita cellulare non è stata significativamente rallentata, ma quando la concentrazione di farmaci si è avvicinata al valore di IC50, la proliferazione cellulare è stata rallentata. Questo è un passo critico per ottenere cellule con resistenza acquisita agli inibitori. Le cellule proliferative devono essere divise e trasferite a nuovi piatti p100 con un rapporto di 1:10 o 1:5. Quando le cellule PC-9 sono state coltivate in un piatto p100, è stata osservata una certa aderenza, ma la maggior parte delle cellule è cresciuta in sospensione. Con l'aumentare della concentrazione di agrassiinib, le cellule aderito al fondo della coltura tissutale trattati piatti. Se la maggior parte delle cellule sono aderenti, possono essere staccate con un frammentario. La concentrazione finale di afatinib è stata di 1 M, che è di circa 5 volte la concentrazione massima di siero (Cmax)14. Per ottenere chiare differenze tra cloni genitori e resistenza, la concentrazione finale è stata impostata per essere superiore a Cmax.
Una seria preoccupazione durante la procedura è la contaminazione batterica, anche se RPMI-1640 contiene penicillina e streptomicina. Per evitare questo, due piatti p100 contenenti mezzo di crescita fresco possono essere preparati quando le cellule sono divise. Quando le cellule raggiungono lo stadio sub-confluente, le cellule in un piatto p100 possono essere ulteriormente divise, mentre le cellule nell'altra p100 possono essere conservate a -80 gradi centigradi nel mezzo di crioconservazione (vedi Tabella dei materiali) come backup, in modo tale che se una linea è contaminata , è possibile utilizzare la linea memorizzata.
Sarebbe difficile riprodurre completamente l'acquisizione di resistenza agrassinib negli esseri umani utilizzando la coltura cellulare. L'emergere della mutazione T790M in EGFR exon 20 è stato segnalato come la causa dominante della resistenza all'asinib. Nel nostro rapporto, un clone resistente conteneva la mutazione T790M11. Inoltre, l'aumento di tipo selvaggio EGFR, come nelle cellule AFR1 e AFR2, è stato segnalato da noi e da altri gruppi15,16. La perdita della mutazione EGFR e l'aumento del tipo selvaggio EGFR è riportato anche in campioni clinici da pazienti con resistenza acquisita agli EGFR-TCi 17,18. Pertanto, gli studi in vitro del nostro modello attuale possono riflettere i profili molecolari dei campioni clinici con resistenza acquisita.
Questo metodo di escalation della dose graduale è considerato il più affidabile per ottenere linee di cellule resistenti acquisite. Tuttavia, l'esposizione iniziale di agrassiinib ad alta dose nelle cellule coltivate probabilmente rifletterebbe meglio gli effetti del trattamento agrassinib nei pazienti affetti da cancro, anche se è più difficile stabilire cellule resistenti. Per questo metodo possono essere utilizzate non solo linee cellulari mobili, come PC-9, ma anche linee cellulari aderenti, come HCC827, 11-18 o HCC4006. Questo metodo di escalation delle dosi graduali è utile anche per stabilire cloni resistenti ad altri inibitori, utilizzando altre linee cellulari, che rappresentano altri tipi di cancro.
L'esposizione delle cellule parentali ad agenti mutageni, come N-ethyl-N-nitrosourea, seguita dalla selezione di cellule resistenti al trattamento agrassinib o osimertinico, è stata segnalata per consentire una rapida acquisizione di cloni resistenti 19 ,20. Tuttavia, questo metodo artificiale tende a causare sostituzioni di base specifiche, come le transizioni da GC ad AT e le traversioni da AT a TA. Inoltre, EGFR TKI non è un agente mutageno nei pazienti con NSCLC. Pertanto, il metodo di escalation della dose passo per passo è più rappresentativo rispetto all'utilizzo di agenti mutageni.
Anche se i TCI EGFR sono inizialmente efficaci, le cellule alla fine sviluppano resistenza a tali farmaci a bersaglio singolo, rendendo difficile curare il cancro. Gli inibitori che prendono di mira più molecole sono quindi essenziali per lo sviluppo. A tal fine, è necessario ottenere cellule con resistenza acquisita agli inibitori multi-bersaglio e valutare i meccanismi alla base della resistenza ai farmaci.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il membro dell'Advanced Cancer Translational Research Institute per i loro commenti premurosi e Editage per la loro assistenza con l'editing in lingua inglese. Questo lavoro è stato supportato da JSPS KAKENHI (numero di sovvenzione: 16K09590 a T.Y.).
Materiali
| Name | Company | Catalog Number | Comments |
| afatinib | Selleck | S1011 | |
| anti-EGFR monoclonal antibody | cell signaling technology | 4267S | |
| bicinchoninc acid assay | sigma | B9643 | |
| cell-culture treated 10 cm dish | Violamo | 2-8590-03 | |
| CELL BANKER1 | TakaRa | CB011 | cryopreservation media |
| CellTiter 96 | Promega | G4100 | Non-Radioactive Cell Proliferation Assay; Dye solution and Solubilization/Stop solution |
| DMSO | Wako | 043-07216 | |
| ECL solution | Perkin Elmer | NEL105001EA | |
| FBS | gibco | 26140-079 | |
| GeneAmp 5700 | Applied Biosystems | fluorescence-based RT-PCR-detection system | |
| GraphPad Prism v.7 software | GraphPad, Inc. | a statistical software | |
| NanoDrop Lite spectrophotometer | Thermo | spectrophotometer | |
| Nonfat dry milk | cell signaling technology | 9999S | |
| Pen Strep | gibco | 15140-163 | |
| phosphatase inhibitor cocktail 2 | sigma | P5726 | |
| phosphatase inhibitor cocktail 3 | sigma | P0044 | |
| Powerscan HT microplate reader | BioTek | ||
| Power SYBR Green master mix | Applied Biosystems | SYBR Green master mix | |
| protease inhibitor cocktail | sigma | P8340 | |
| QIAamp DNA Mini kit | Qiagen | 51306 | DNA purification kit |
| QIAquick PCR Purification Kit | QIAGEN | PCR purification kit | |
| RPMI-1640 | Wako | 189-02025 | with L-Glutamine and Phenol Red |
| TBST powder | sigma | T9039 | |
| Trans-Blot SD Semi-Dry Electrophoretic Transfer cell | Bio-Rad | semi-dry t4ransfer apparatus | |
| 96 well microplate | Thermo | 130188 |
Riferimenti
- Chan, B. A., Hughes, B. G. Targeted therapy for non-small cell lung cancer: current standards and the promise of the future. Translational Lung Cancer Research. 4 (1), 36-54 (2015).
- Mitsudomi, T., Yatabe, Y. Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidermal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer. Cancer Science. 98 (12), 1817-1824 (2007).
- Yamaoka, T., Kusumoto, S., Ando, K., Ohba, M., Ohmori, T. Receptor tyrosine kinase-targeted cancer therapy. International Journal of Molecular Science. 19 (11), (2018).
- Marshall, J. Clinical implications of the mechanism of epidermal growth factor receptor inhibitors. Cancer. 107 (6), 1207-1218 (2006).
- Hirsh, V. Managing treatment-related adverse events associated with egfr tyrosine kinase inhibitors in advanced non-small-cell lung cancer. Current Oncology. 18 (3), 126-138 (2011).
- Arcila, M. E., et al. Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay. Clinical Cancer Research. 17 (5), 1169-1180 (2011).
- Sequist, L. V., et al. Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Science Translational Medicine. 3 (75), 75ra26 (2011).
- Yang, J. C., et al. Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. Journal of Clinical Oncology. 35 (12), 1288-1296 (2017).
- Chong, C. R., Janne, P. A. The quest to overcome resistance to EGFR-targeted therapies in cancer. Nature Medicine. 19 (11), 1389-1400 (2013).
- Clynes, M., Redmond, A., Moran, E., Gilvarry, U. Multiple drug-resistance in variant of a human non-small cell lung carcinoma cell line, DLKP-A. Cytotechnology. 10 (1), 75-89 (1992).
- Yamaoka, T., et al. Distinct afatinib resistance mechanisms identified in lung adenocarcinoma harboring an EGFR mutation. Molecular Cancer Research. 15 (7), 915-928 (2017).
- Liang, X. J., Shen, D. W., Garfield, S., Gottesman, M. M. Mislocalization of membrane proteins associated with multidrug resistance in cisplatin-resistant cancer cell lines. Cancer Research. 63 (18), 5909-5916 (2003).
- Shen, D. W., Akiyama, S., Schoenlein, P., Pastan, I., Gottesman, M. M. Characterisation of high-level cisplatin-resistant cell lines established from a human hepatoma cell line and human KB adenocarcinoma cells: cross-resistance and protein changes. British Journal of Cancer. 71 (4), 676-683 (1995).
- Murakami, H., et al. Phase I study of continuous afatinib (BIBW 2992) in patients with advanced non-small cell lung cancer after prior chemotherapy/erlotinib/gefitinib (LUX-Lung 4). Cancer Chemotherapy and Pharmacology. 69 (4), 891-899 (2012).
- Nukaga, S., et al. Amplification of EGFR wild-type alleles in non-small cell lung cancer cells confers acquired resistance to mutation-selective EGFR tyrosine kinase inhibitors. Cancer Research. 77 (8), 2078-2089 (2017).
- Nakatani, K., et al. EGFR amplifications mediate resistance to rociletinib and osimertinib in acquired afatinib-resistant NSCLC harboring exon 19 deletion/T790M in EGFR. Molecualr Cancer Therapy. 18 (1), 112-126 (2019).
- Piotrowska, Z., et al. Heterogeneity underlies the emergence of EGFRT790 wild-type clones following treatment of T790M-positive cancers with a third-generation EGFR inhibitor. Cancer Discovery. 5 (7), 713-722 (2015).
- Ortiz-Cuaran, S., et al. Heterogeneous mechanisms of primary and acquired resistance to third-generation EGFR inhibitors. Clinical Cancer Research. 22 (19), 4837-4847 (2016).
- Kobayashi, Y., et al. Characterization of EGFR T790M, L792F, and C797S mutations as mechanisms of acquired resistance to afatinib in lung cancer. Molecular Cancer Therapy. 16 (2), 357-364 (2017).
- Uchibori, K., Inase, N., Nishio, M., Fujita, N., Katayama, R. Identification of mutation accumulation as resistance mechanism emerging in first-line osimertinib treatment. Journal of Thoracic Oncology. 13 (7), 915-925 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon