Method Article
Etablierung und Charakterisierung von drei Afatinib-resistenten Lungenadenokarzinom PC-9 Zelllinien entwickelt mit zunehmenden Dosen von Afatinib
In diesem Artikel
Zusammenfassung
Es wurde ein Verfahren zur Etablierung von Afatinib-Resistenz-Zelllinien aus Lungenadenokarzinom-PC-9-Zellen entwickelt und resistente Zellen charakterisiert. Die resistenten Zellen können verwendet werden, um epidermale Wachstumsfaktor-Rezeptor-Tyrosin-Kinase-Inhibitor-Resistenz-Mechanismen zu untersuchen, anwendbar für Patienten mit nicht-kleinzelligem Lungenkrebs.
Zusammenfassung
Erworbene Resistenz gegen molekulare Zielhemmer ist ein ernstes Problem in der Krebstherapie. Lungenkrebs ist in den meisten Ländern nach wie vor die häufigste Ursache für krebsbedingte Todesfälle. Die Entdeckung von "onkogenen Treibermutationen", wie epidermale Wachstumsfaktorrezeptor (EGFR)-aktivierende Mutationen, und die anschließende Entwicklung molekularer gezielter Wirkstoffe von EGFR-Tyrosinkinase-Inhibitoren (TKIs) (Gefitinib, Erlotinib, Afatinib, Dacomitinib und Osimertinib) haben die Lungenkrebsbehandlung in den letzten Jahrzehnten dramatisch verändert. Diese Medikamente sind jedoch immer noch nicht wirksam bei Patienten mit nicht-kleinzelligem Lungenkrebs (NSCLC), die EGFR-aktivierende Mutationen tragen. Nach erworbener Resistenz bleibt das systemische Fortschreiten von NSCLC ein erhebliches Hindernis bei der Behandlung von Patienten mit EGFR-Mutation-positivem NSCLC. Hier stellen wir eine stufenweise Dosiseskalationsmethode zur Etablierung von drei unabhängigen erworbenen Afatinib-resistenten Zelllinien aus NSCLC PC-9-Zellen vor, die EGFR-aktivierende Mutationen von 15-Basen-Paar-Deletionen in EGFR exon 19 enthalten. Methoden zur Charakterisierung der drei unabhängigen afatinib-widerstandsgebundenen Zelllinien werden kurz vorgestellt. Die erworbenen Resistenzmechanismen gegen EGFR-TKIs sind heterogen. Daher müssen mehrere Zelllinien mit erworbener Resistenz gegen EGFR-TKIs untersucht werden. Zehn bis zwölf Monate sind erforderlich, um Zelllinien mit erworbenem Widerstand mit diesem schrittweisen Dosiseskalationsansatz zu erhalten. Die Entdeckung neuartiger resistenzmechanismen wird zur Entwicklung wirksamerer und sicherer therapeutischer Strategien beitragen.
Einleitung
Fünf Tyrosinkinase-Inhibitoren, die auf epidermale Wachstumsfaktorrezeptor (EGFR) abzielen, einschließlich Gefitinib, Erlotinib, Afatinib, Dacomitinib und Osimertinib, sind derzeit für die Behandlung von Patienten mit EGFR-Mutation-positiver nicht-kleinzelliger Lunge verfügbar. Krebs (NSCLC). In den letzten zehn Jahren haben sich Therapien für solche Patienten mit der Entdeckung neuer potenzieller EGFR-TKIs dramatisch entwickelt. Bei Patienten mit Lungenadenokarzinom wurden somatische Mutationen in EGFR bei etwa 50%der asiatischen und 15% der kaukasischen Patienten 1 identifiziert. Die häufigsten Mutationen in EGFR sind eine L858R-Punktmutation bei EGFR exon 21 und 15 Base pair (bp) Deletionen in EGFR exon 192. Bei EGFR-Mutations-positiven Patienten mit NSCLC verbessern EGFR-TKIs die Ansprechraten und klinischen Ergebnisse im Vergleich zum vorherigen Standard der Platin-Doppelchemotherapie3.
Gefitinib und Erlotinib waren die ersten zugelassenen kleinen Molekülinhibitoren und werden im Allgemeinen als EGFR-TKIs der ersten Generation bezeichnet. Diese EGFR TKIs blockieren die Tyrosinkinase-Aktivität, indem sie mit ATP konkurrieren und reversibel an ATP-Bindungsstellen binden4. Afatinib ist ein EGFR-TKI der zweiten Generation, das irreversibel und kovalent an die Tyrosinkinase-Domäne von EGFR bindet und als panhumaner EGFR-Familieninhibitor5charakterisiert ist.
Trotz des dramatischen Nutzens dieser Therapien bei Patienten mit NSCLC ist eine erworbene Resistenz unvermeidlich. Der häufigste Resistenzmechanismus gegen EGFR-TKIs der ersten und zweiten Generation ist die Entstehung der T790M-Mutation in EGFR exon20, die in 50-70% der Tumorproben 6,7,8vorhanden ist. Andere Resistenzmechanismen sind Bypass-Signale (zu MET, IGF1R und HER2), Transformation zu kleinzelligem Lungenkrebs und Induktion epitheliaal-mesenchymaler Übergang, die vorklinisch und klinisch9auftreten. Die Resistenzmechanismen gegen EGFR-TKIs sind heterogen. Durch die Identifizierung neuartiger Resistenzmechanismen in präklinischen Studien kann es möglich sein, neuartige Therapeutika zu entwickeln, um Resistenzen zu überwinden. Optimale Sequenztherapien, die den klinischen Nutzen für die Patienten maximieren, müssen die Resistenzmechanismen und das therapeutische Ziel berücksichtigen.
Es ist zwingend notwendig, die richtige elterliche Zelllinie zu wählen, da sie die Grundlage aller nachfolgenden Experimente ist. Die Auswahlstrategien beginnen mit klinischer Relevanz; es ist notwendig, eine Chemotherapie und Bestrahlung naive Zelllinie zu wählen. Vorherige chemotherapeutische und/oder strahlungstechnische Behandlung kann die Veränderung der Resistenzwege und Veränderungen der Expression von Arzneimittelresistenzmarkern induzieren. In dieser Studie werden PC-9-Zellen, die 15 bp Deletionen in EGFR exon 19 tragen, für die Etablierung der erworbenen Resistenz gegen Afatinib eingesetzt. Diese Zelllinie wurde von einem japanischen NSCLC-Patienten abgeleitet, der keine vorherige Chemotherapie und Bestrahlung erhielt.
Da Afatinib täglich oral verabreicht wird, wäre eine kontinuierliche In-vitro-Behandlung, bei der die Zellen ständig in Gegenwart von Afatinib kultiviert werden, klinisch relevant. Die Dosis der Medikamente, die in den verschiedenen Schritten des Experiments verwendet werden, muss für die ausgewählte Elternzelllinie optimiert werden. Zur Bestimmung eines geeigneten Arzneimittelbereichs kann ein Zytotoxizitätstest verwendet werden, der mit den pharmakokinetischen Informationen des Arzneimittels vergleichbar sein sollte.
Während des gesamten Auswahlprozesses wird die gesamte Zellgesamtheit als eine einzige Gruppe beibehalten. Klonen oder andere Trennmethoden werden nicht verwendet. Die Zellen werden zunächst kontinuierlich einem niedrigen Niveau des Medikaments ausgesetzt. Anschließend, nachdem sich die Zellen anpassen, um in Gegenwart des Medikaments zu wachsen, wird die Dosis des Medikaments langsam auf die endgültige optimale Dosis des Medikaments10,11erhöht. Alternativ kann eine Pulsmedikamenten-Verabreichung oder Mutagenese zur Auswahl von Resistenzzellen verwendet werden, die auch vor der medikamentösen Behandlung durchgeführt werden 12,13. Leider werden Fälle, in denen sich die Arzneimittelresistenz nicht entwickelt, in der Regel nicht gemeldet. Die Selektionsstrategien werden mit dem Ziel entwickelt, die Bedingungen von Krebspatienten für den Wiederaufbau klinisch relevanter Resistenzen nachzuahmen. Manchmal wird eine hohe Arzneimittelkonzentration verwendet, um molekulare Veränderungen im Zusammenhang mit Mechanismen der Arzneimittelresistenz zu identifizieren. Dieses Modell wird weniger klinisch relevant.
Hier beschreiben wir ein Verfahren zur Etablierung von drei unabhängigen afatinibresistenten Zelllinien aus PC-9-Zellen, die 15 bp Deletionen in EGFR exon 19 enthalten, sowie die anfängliche Charakterisierung der afatinibresistenten Zelllinien.
Protokoll
1. Aufbau von drei unabhängigen Afatinib-resistenten PC-9-Zelllinien
- Bestimmung der anfänglichen Afatinib-Expositionskonzentration für PC-9-Zellen mit dem 3-(4,5-Dimethylthiazol-2-yl)-2,5- Diphenyltetrazoliumbromid (MTT)-Test
- Kultur-PC-9-Zellen im Wachstumsmedium, die fetales Rinderserum (10%), Penicillin (100 U/ml) und Streptomycin (100 g/ml) in einer 10 cm großen Zellkultur in einem 5% CO2-Inkubator bei 37 °C behandelten Zellkultur-Schale enthalten.
- PC-9-Zellen bei 4 x 104 Zellen/ml im Wachstumsmedium aussetzen und dann in einer 96-Well-Mikroplatte bei 50 l/well aussaat. Die Endkonzentration der Zellen beträgt 2,0 x 103 Zellen/50 l/well. Über Nacht in einem 5% CO2-Inkubator bei 37°C inkubieren.
- Fügen Sie den Brunnen, die das Wachstumsmedium (50 ,L) enthalten, 50 L Afatinib-Lösung in unterschiedlichen Konzentrationen: 0, 0,002, 0,06, 0,06, 0,6, 2, 6 und 20 ,M bei. Das Endvolumen und die Konzentrationen von Afatinib betragen 100 l und 0, 0,001, 0,003, 0,01, 0,03, 0,1, 0,3, 1, 3 und 10 M.
- Inkubieren Sie die 96-Well-Platte für 96 h in einem 5% CO2-Inkubator bei 37 °C.
- Fügen Sie jedem Brunnen 15 l der Farbstofflösung (siehe Materialtabelle) hinzu und in einem 5% CO2-Inkubator bei 37 °C 4 h brüten, und fügen Sie dann 100 l Löslichkeit/Stop-Lösung (siehe Materialtabelle)zu jedem Brunnen hinzu und in kubieren Sie über Nacht in einem 5% CO. c10>2 Inkubator bei 37 °C.
- Messen Sie die optische Dichte bei 570 nm (OD570) mit einem Mikroplattenleser (siehe Materialtabelle). Bereiten Sie 6-12 Replikationen vor und wiederholen Sie die Experimente mindestens dreimal.
- Verwenden Sie statistische Software (siehe Materialtabelle), um diese Daten grafisch als Halbprotokolldiagramm darzustellen und den IC50-Wert zu berechnen, d. h. die Arzneimittelkonzentration, die die Reaktion auf 50 % ihres Maximums reduziert (siehe Tabelle der Materialien). ).
- Kontinuierliche Exposition von PC-9-Zellen gegenüber dem irreversiblen EGFR-TKI, Afatinib, durch schrittweise Dosiseskalation in drei unabhängigen 10 cm-Schalen
- Kultur PC-9 Zellen in p100 Geschirr mit 10 ml Wachstumsmedium. Wenn die PC-9-Zellen das subkonfluente Stadium erreichen, übertragen Sie 1 ml Zellsuspension in drei neue p100-Schalen mit 9 ml Wachstumsmedium. Die 1:10 verdünnten PC-9-Zellen werden in 3-4 Tagen subkonfluent, mit einer Zellzahl von etwa 4-5 x 105 Zellen/ml.
- Am nächsten Tag 1/10 des IC50 Wertes von Afatinib in jedes der drei p100 Gerichte hinzufügen.
HINWEIS: Afatinib wird in DMSO bei Bestandskonzentrationen von 1 m, 10 m, 100 m, 1 mM und 5 mM rekonstituiert. 1 bis 10 l Afatinib-Lösung wird gemäß den erforderlichen Endkonzentrationen in 10 ml Wachstumsmedium der Kultur zugegeben. - Wenn die Zellen in den afatinibhaltigen p100-Schalen sub-konfluent werden, gut durch Aspiration mit einer 1 ml Pipette mischen und 1 ml der Zellsuspension zu 9 ml frischem Wachstumsmedium in einer neuen p100 Schale hinzufügen. Als nächstes fügen Sie der neuen Kultur 10-20% höhere Konzentrationen von Afatinib hinzu.
- Erhöhen Sie die Afatinib-Konzentration von 0,1 nM bis 1 m im Medium durch die schrittweise Dosiseskalation mit der Afatinib-Konzentration, die bei jedem Schritt über einen Zeitraum von 10-12 Monaten um 10-20 % erhöht wird.
HINWEIS: Wenn sich die Afatinib-Konzentration demIC-50-Wert nähert, wird das Zellwachstum recht langsam. Wenn die Zellen 1:9 geteilt sind, können sie nicht wachsen, da diese Zellen durch höhere Konzentrationen von Afatinib getötet werden. Daher können die Zellen bei höheren Afanitib-Konzentrationen im Verhältnis 1:2 geteilt werden. Die widerstandsfähigsten Zellen wurden 3-14 Tage lang in Afatinib-enthaltenem Medium angebaut, und das Medium wurde erst verändert, wenn die resistenten Zellen durchgedrungen werden mussten. - Die afatinibresistenten Zellen für 2-3 Monate in 1 'M Afatinib-haltigem Wachstumsmedium kulturieren. Bei einer Afatinib-Konzentration von 1 M sind 10-12 Monate erforderlich, um in diesem Modell eine Resistenz gegen Afatinib zu entwickeln. Führen Sie den MTT-Test durch, um zu bestätigen, dass die Zellen gegen Afatinib resistent sind. Die drei unabhängig etablierten Afatinib-Resistenzzelllinien wurden AFR1, AFR2 und AFR3 genannt.
2. Charakterisierung von drei unabhängigen Afatinib-resistenten Zellen
- Bestimmung der Wachstumskurve von elternden PC-9-Zellen und Etablierung von Afatinib-resistenten Zellen
- Kultur die PC-9, AFR1, AFR2 und AFR3 Zellen in Wachstumsmedium in einem 5% CO2-Inkubator bei 37 °C.
- Setzen Sie die Zellen bei 5 x 103 Zellen/ml mit Wachstumsmedium und Samen 100 l/well in eine 96-Well-Mikroplatte aus, so dass die Endkonzentration der Zellen 500 Zellen/100 l/well beträgt.
HINWEIS: Der MTT-Assay wird durchgeführt, um die OD570-Werte bei 0, 1, 2, 3, 5 und 7 Tagen zu messen. Für jeden Tag werden sechs 96-Well-Mikroplatten benötigt. - Führen Sie den MTT-Test alle 24 h und dann an den Tagen 0, 1, 2, 3, 5 und 7 durch. Messen Sie die OD570-Werte und bereiten Sie 6-12-Replikationen vor. Wiederholen Sie die Experimente mindestens dreimal, und zeichnen Sie die Ergebnisse mit einer statistischen Software grafisch auf (siehe Tabelle der Materialien).
- Identifizierung der genomischen DNA-Veränderungen in EGFR durch Echtzeit-PCR
HINWEIS: Afatinib ist ein kleiner Molekülinhibitor, der auf EGFR-Tyrosinkinase abzielt. Der EGFR-Expressionsstatus wird auf DNA- und Proteinebene bestimmt.- Die genomische DNA wird mit einem DNA-Reinigungskit (siehe Materialtabelle)nach den Anweisungen des Herstellers isoliert. Messen Sie die Konzentration der isolierten genomischen DNA mit einem Spektralphotometer (siehe Materialtabelle) und passen Sie alle genomischen DNA-Proben auf 25 ng/L an.
- Amplify 50 ng of genomic DNA, which is equivalent to 2 'L of the 25 ng/'L stocks, using a SYBR Green master mix (siehe Table of Materials) and analyze the results by a fluorescence-based RT-PCR-detection system (siehe Tabelle of Materials).
HINWEIS: Die PCR-Zyklusbedingungen begannen mit einem ersten Denaturierungsschritt bei 95 °C für 20 s, gefolgt von 40 Zyklen 95 °C Denaturierung für 3 s, 60 °C Glühen für 30 s. Die spezifischen Primer-Sets sind wie folgt: EGFR F: 5'-CAAGGCCATGGAATCTCTCA-3', R: 5'-CTGGAATGAGGTGGAGAGaACA-3'. Normalisationsgen LINE-1 F: 5'-AAAGCCGCTCAACTACATGG-3', R: 5'-TGCTTTGAATGCGTCCCAGAG-3'.
- Bewertung der Auswirkungen von Proteinveränderungen auf EGFR-Ebene durch Western-Blot-Analyse
- Behandeln Sie die Zellen mit Afatinib kontinuierlich vor Denexperimenten für 24 h. Waschen Sie PC-9-, AFR1-, AFR2- und AFR3-Zellen zweimal mit PBS und säen Sie sie dann ohne Afatinib in Wachstumsmedien aus. Waschen Sie PC-9-, AFR1-, AFR2- und AFR3-Zellen zweimal mit 5 ml eiskaltem PBS.
- Lyse die Zellen in RIPA-Puffer mit 1% Protease-Hemmer-Cocktail (siehe Tabelle der Materialien) und Phosphatase-Hemmer-Cocktail II und III (siehe Tabelle der Materialien) und inkubieren Sie diese Lösung bei 4 °C für 30 min. Zentrifugieren Sie die Lysate für 10 min bei 100 x g und 4 °C und die gereinigten Lysate einsammeln.
- Bestimmen Sie die Proteinkonzentrationen mit dem Bicinchoninsäure-Assay (siehe Materialtabelle),passen Sie alle Proteinproben auf 0,5 oder 1 g/l mit 4x Probenpuffer (500 mM Tris (PH 6.8), 40% Glycerin, 8% SDS, 20% H2O, 0,02% Bromphenolblau) und bei 96 °C für 5 min. Lagern Sie diese Proteinproben bei -80 °C, bis eine Western-Blot-Analyse durchgeführt wird.
- Separate gleiche Mengen an Proteinproben, vorzugsweise 20-30 l, um 8% SDS-Seite und übertragen die Proteine auf eine Polyvinylidenfluorid-Membran (PVDF).
HINWEIS: Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese (SDS-PAGE) wird häufig im Labor zur Trennung von Proteinen auf basis ihres Molekulargewichts eingesetzt.- Glasplatten mit Ethanol reinigen und die Glasplatte und Abstandshalter montieren. 8% Polyacrylamid-Gele mit 1,5 M Tris-HCl, pH 8,8, 40% Bis-Acrylamid, 10% SDS, 10% APS und TEMED zubereiten. 30 min bei Raumtemperatur polymerisieren.
- Anschließend ein Stapelgel mit 0,5 M Tris-HCl, pH 6,8, 40% Bis-Acrylamid, 10% SDS, 10% APS und TEMED zubereiten. Fügen Sie die Stapelgellösung hinzu, legen Sie den Kamm ein und polymerisieren Sie das Gel für 20-30 min bei Raumtemperatur.
- Legen Sie die Gele in das Elektrophoresegerät und füllen Sie den Tank mit Laufpuffer (0,25 M Tris, 1,92 m Glycin und 1% SDS). Laden Sie die gleiche Menge an Proteinproben (20-30 l) und führen Sie das Gel bei 180 V. Stoppen Sie die Elektrophorese, sobald die Farbstofffront aus dem Gel fließt, nach ca. 60 min.
- Waschen Sie das Gel 1-2 min mit TBST und übertragen Sie die Proteine dann auf eine PVDF-Membran durch halbtrockenes Blotting (siehe Tabelle der Materialien) für 1,5 h bei einem konstanten Strom von 300 mA.
- Blockieren Sie die Membranen mit 5% fettfreier Trockenmilch (siehe Materialtabelle), die mit TBST-Lösung (siehe Materialtabelle)für 1 h bei Raumtemperatur verdünnt wird, und sonden Sie dann die Membranen mit Anti-EGFR, Anti-Phospho-EGFR (Y1068), Anti-HER2, Anti-HER3-, Anti-MET- und Anti-Actin-Antikörper (in TBST 1:3.000 verdünnt) (siehe Materialtabelle) bei 4 °C über Nacht.
- Waschen Sie die Membranen mit TBST dreimal für 10 min, und setzen Sie die Membranen dann dem sekundären Antikörper (verdünnt 1:200 in TBST) für 1-1,5 h bei Raumtemperatur aus. Waschen Sie die Membranen fünfmal mit TBST 10 min bei Raumtemperatur, setzen Sie sie der ECL-Lösung aus (siehe Tabelle derMaterialien), und visualisieren Sie die Signale mithilfe von Folien.
- Analyse von EGFR-Mutationen durch Sequenzierung
- Amplify genomic DNA using specific primer for EGFR exons 19-21. Die PCR-Zyklusbedingungen beginnen mit einem ersten Denaturierungsschritt bei 94 °C für 1 min, gefolgt von 30 Denaturierungszyklen bei 98 °C für 10 s, Glühen bei 55 °C für 30 s und Verlängerung bei 72 °C für 1 min.
HINWEIS: Die spezifischen Primer für EGFR exon 19: F: 5'-GCAATATCAGCCTTAGGTGCGGCTC-3' R: 5'-CATAGAAAGTGAACATTTAGGATGTG-3', exon 20: F: 5'-CCATGAGTACGTATTTTGAAACTC-3', R: 5'-CATATCCCCATGGCAAACTCTTGC-3', und exon 21: F: 5'-ATGAACATGACCCTGAATTCGG-3', R: 5'- GCTCACCCAGAATGTCTGGAGA-3.. - Reinigen Sie die verstärkten PCR-Produkte mit einem PCR-Reinigungskit (siehe Materialtabelle) und sequenzieren Sie die Amplicons.
- Amplify genomic DNA using specific primer for EGFR exons 19-21. Die PCR-Zyklusbedingungen beginnen mit einem ersten Denaturierungsschritt bei 94 °C für 1 min, gefolgt von 30 Denaturierungszyklen bei 98 °C für 10 s, Glühen bei 55 °C für 30 s und Verlängerung bei 72 °C für 1 min.
Ergebnisse
Das Schema zur Einrichtung von drei Afatinib-Resistenz-Zelllinien aus PC-9-Zellen mit einem schrittweisen Dosis-Eskalationsverfahren ist in Abbildung 1dargestellt. Abbildung 2 zeigt eine Abnahme der Zellproliferation von elterlichen PC-9-Zellen, da die Konzentration von Afatinib erhöht ist, was darauf hindeutet, dass PC-9-Zellen empfindlich auf Afatinib-Exposition reagieren. Abbildung 3 zeigt die Afatinib-Resistenz der drei Zelllinien. Keine der drei afatinibresistenten Zelllinien, AFR1, AFR2 und AFR3, zeigte eine Unterdrückung der Zellproliferation unter Afatinib-Exposition. Abbildung 4 zeigt die Zellproliferationskurven für PC-9-, AFR1-, AFR2- und AFR3-Zellen. Die drei afatinibresistenten Zelllinien zeigten ein deutlich langsameres Wachstum als die elterlichen PC-9-Zellen. Abbildung 5 zeigt die Expressionskonzentrationen von EGFR gDNA in PC-9 und den drei afatinibresistenten Zellen, die darauf hindeuten, dass Afatinib-resistente Zellen signifikant höhere EGFR-gDNA-Spiegel exprimieren als die elterlichen PC-9-Zellen. Abbildung 6 zeigt die Proteinexpression von EGFR in PC-9- und Afatinib-resistenten Zellen. Bei vergleichbaren gDNA-Expressionswerten war die EGFR-Proteinexpression in resistenten Zellen höher als in elterlichen PC-9-Zellen. Abbildung 7 zeigt, dass die Sequenzierungsergebnisse der EGFR-Exons 19 und 20 in PC-9-, AFR1-, AFR2- und AFR3-Zellen. PC-9-Zellen zeigten 15 bp Deletionen in EGFR exon 19 und Wildtyp EGFR in exon 20. AFR1- und AFR2-Zellen zeigten jedoch eine Amplifikation des Wildtyps EGFR exon 19. AFR3-Zellen enthielten 15 bp Deletionen in EGFR exon 19 wie in PC-9-Zellen, aber die Punktmutation T790M wurde in EGFR exon 20 beobachtet.

Abbildung 1 : Schema des Verfahrens zur Herstellung von drei afatinibresistenten Zelllinien von PC-9. Zunächst wurden PC-9-Zellen in drei p100-Schalen aufgeteilt und Afatinib bei 1/10 des IC 50-Wertes ausgesetzt. Als nächstes wurden die Afatinib-Konzentrationen im Wachstumsmedium durch schrittweise Dosiseskalation auf 1 M erhöht. Nach 10-12 Monaten wurden drei unabhängige afatinibresistente Zelllinien mit den Namen AFR1, AFR2 und AFR3 eingerichtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
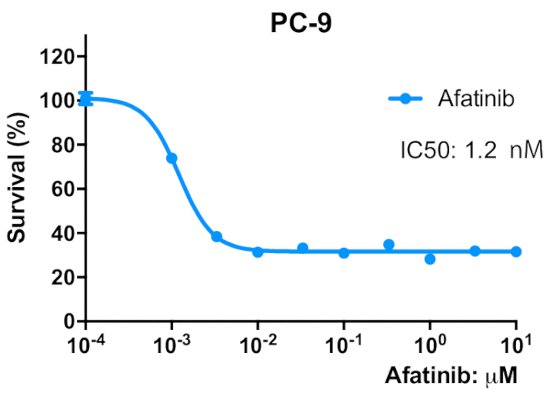
Abbildung 2 : Eltern-PC-9-Zellen sind empfindlich gegenüber dem irreversiblen EGFR TKI, Afatinib. Die Zellen wurden in eine 96-Well-Mikroplatte mit 2 x 103 Zellen/well/50 L Wachstumsmedium gesät und über Nacht vorinkubiert. Die Zellen wurden mit den angegebenen Konzentrationen von Afatinib für 96 h behandelt. Ein MTT-Test wurde durchgeführt, OD570-Werte wurden mit einem Mikroplattenleser gemessen (siehe Materialtabelle) und als Prozentsatz des für die Kontrollzellen erhaltenen Wertes ausgedrückt. Die Daten werden als mittelwert-SEM von Werten aus 6-12 Replizienbrunnen dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
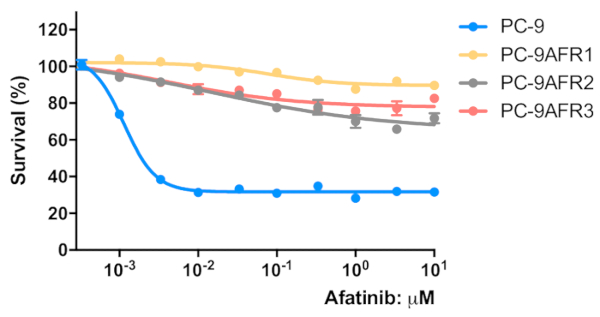
Abbildung 3 : Etablierte Zellen zeigten Resistenz gegen irreversible siren EGFR TKI, Afatinib. Die Zellen wurden in eine 96-Well-Mikroplatte mit 2 x 103 Zellen/well/50 L Wachstumsmedium gesät und über Nacht vorinkubiert. Die Zellen wurden mit den angegebenen Konzentrationen von Afatinib für 96 h behandelt. Ein MTT-Test wurde durchgeführt, OD570-Werte wurden mit einem Mikroplattenleser gemessen (siehe Materialtabelle) und als Prozentsatz des für die Kontrollzellen erhaltenen Wertes ausgedrückt. Die Daten werden als mittelwert-SEM von Werten aus 6-12 Replizienbrunnen dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
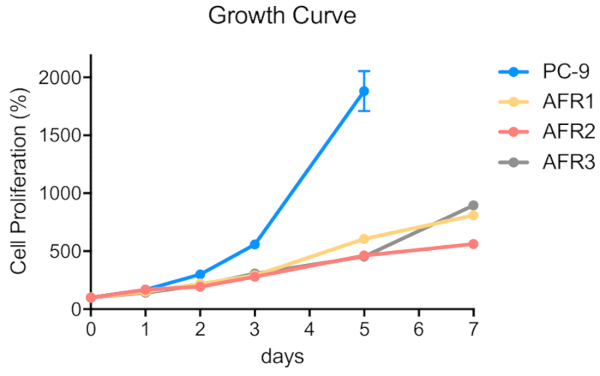
Abbildung 4 : Afatinib-resistente Zelllinien zeigten eine langsamere Proliferation als elterliche PC-9-Zellen. Die Zellen wurden in 96-Well-Mikroplatten bei 5 x 102 Zellen/100 l/well gesät. MTT-Assay wurde durchgeführt, und OD570-Werte wurden an den Tagen 0, 1, 2, 3, 5 und 7 mit einem Mikroplattenleser (siehe Materialtabelle)gemessen und als Prozentsatz des für die Kontrollzellen ermittelten Wertes ausgedrückt. Die Daten werden als mittelwert-SEM von Werten aus 6-12 Replizienbrunnen dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
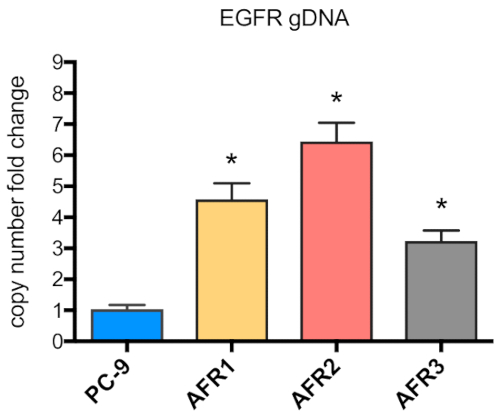
Abbildung 5 : Die Anzahl der EgFR-Kopien wurde in afatinibresistenten Zellen erhöht. Die Höhe der EGFR-Genkopienummer wurde durch quantitative PCR genomischer DNA gemessen, die aus PC-9-, AFR1-, AFR2- und AFR3-Zellen isoliert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6 : Der Basalgehalt des EGFR-Proteins wurde in afatinibresistenten Zellen erhöht. Western Blot-Analyse von Phospho-EGFR-, EGFR-, HER2-, HER3- und MET-Expression in PC-9-, AFR1-, AFR2- und AFR3-Zellen. Als Ladekontrolle wurde das Gerät verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7 : DNA-Sequenz liest sich in EGFR Exons 19 und 20. Die Genom-DNA von PC-9, AFR1, AFR2 und AFR3 wurde mit spezifischen Primern für EGFR exon 19 und 21 verstärkt und zur Sequenzierung gereinigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier beschrieben wir ein Verfahren zur Etablierung von drei unabhängigen afatinibresistenten Zelllinien und charakterisierten diese Zellen im Vergleich zu elterlichen PC-9-Zellen. Durch schrittweise Dosiseskalationsexposition erhielten die elterlichen PC-9-Zellen über einen Zeitraum von 10-12 Monaten eine Resistenz gegen Afatinib. Klinisch sind die Resistenzmechanismen gegen EGFR-TKIs heterogen, so dass PC-9-Zellen nach der Erstbehandlung mit Afatinib in drei unabhängige p100-Gerichte unterteilt und afatinib weiter ausgesetzt wurden. Anfangs wurde das Zellwachstum nicht signifikant verlangsamt, aber als sich die Wirkstoffkonzentration dem IC-50-Wert näherte, wurde die Zellproliferation verlangsamt. Dies ist ein kritischer Schritt für die Gewinnung von Zellen mit erworbener Resistenz gegen Inhibitoren. Die sich ausbreitenden Zellen sollten geteilt und in neue p100-Gerichte im Verhältnis 1:10 oder 1:5 übertragen werden. Wenn PC-9-Zellen in einer p100 Schale kultiviert wurden, wurde eine gewisse Adhärenz beobachtet, aber die meisten Zellen wuchsen in Suspension. Als die Konzentration von Afatinib erhöht wurde, hafteten die Zellen an der Unterseite der Gewebekultur behandeltEn Gerichte. Wenn die meisten Zellen haften, können sie mit einem Zellkratzer getrennt werden. Die Endkonzentration von Afatinib betrug 1 m, was etwa dem 5-fachen der maximalen Serumkonzentration (Cmax)14entspricht. Um klare Unterschiede zwischen Eltern- und Widerstandsklonen zu erhalten, wurde die endgültige Konzentration auf höher als Cmax.festgelegt.
Eine ernste Sorge während des Verfahrens ist die bakterielle Kontamination, obwohl RPMI-1640 Penicillin und Streptomycin enthält. Um dies zu vermeiden, können zwei p100 Gerichte mit frischem Wachstumsmedium zubereitet werden, wenn die Zellen geteilt werden. Wenn die Zellen das subkonfluente Stadium erreichen, können die Zellen in einer p100 Schale weiter geteilt werden, während die Zellen in der anderen p100 Schale bei -80 °C im Kryokonservierungsmedium (siehe Tabelle derMaterialien) als Backup gelagert werden können, so dass, wenn eine Linie kontaminiert ist kann die gespeicherte Zeile verwendet werden.
Es wäre schwierig, den Erwerb von Afatinib-Resistenz beim Menschen mit Hilfe der Zellkultur vollständig zu reproduzieren. Die Entstehung der T790M-Mutation in EGFR exon 20 wurde als dominante Ursache für die Resistenz gegen Afatinib berichtet. In unserem Bericht enthielt ein resistenter Klon die T790M-Mutation11. Darüber hinaus wurde der Anstieg der Wildtyp-EGFR, wie in AFR1- und AFR2-Zellen, von uns und anderen Gruppen15,16berichtet. Der Verlust der EGFR-Mutation und die Zunahme des Wildtyps EGFR wird auch in klinischen Proben von Patienten mit erworbener Resistenz gegen EGFR-TKIs 17,18berichtet. Daher können In-vitro-Studien unseres aktuellen Modells die molekularen Profile klinischer Proben mit erworbener Resistenz widerspiegeln.
Diese schrittweise Dosiseskalationsmethode gilt als die zuverlässigste für die Gewinnung erworbener resistenter Zelllinien. Die anfängliche hochdosierte Afatinib-Exposition in kultivierten Zellen würde jedoch wahrscheinlich die Auswirkungen der Afatinib-Behandlung bei Krebspatienten besser widerspiegeln, obwohl die Etablierung resistenter Zellen schwieriger ist. Für diese Methode können nicht nur schwebende Zelllinien wie PC-9 verwendet werden, sondern auch anhaftende Zelllinien wie HCC827, 11-18 oder HCC4006. Diese schrittweise Dosiseskalationsmethode ist auch nützlich für die Etablierung von Klonen, die gegen andere Inhibitoren resistent sind, mit anderen Zelllinien, die andere Krebsarten darstellen.
Die Exposition von Elternzellen gegenüber mutagenen Wirkstoffen wie N-Ethyl-N-Nitrosourea, gefolgt von der Auswahl von Zellen, die gegen Afatinib- oder Osimertinib-Behandlung resistent sind, wurde berichtet, um eine schnelle Erfassung resistenter Klone zu ermöglichen 19 ,20. Diese künstliche Methode führt jedoch tendenziell zu spezifischen Basissubstitutionen, wie Z. B. GC-zu-AT-Übergängen und AT-TA-Transversionen. Darüber hinaus ist EGFR TKI kein mutagenes Mittel bei Patienten mit NSCLC. Daher ist die Methode der schrittweisen Dosiseskalation repräsentativer als die Verwendung von mutagenen Mitteln.
Obwohl EGFR TKIs zunächst wirksam sind, entwickeln Zellen schließlich Resistenzen gegen solche Einzelzielmedikamente, was es schwierig macht, Krebs zu heilen. Inhibitoren, die auf mehrere Moleküle abzielen, sind daher unerlässlich, um sich zu entwickeln. Zu diesem Zweck ist es notwendig, Zellen mit erworbener Resistenz gegen Multi-Target-Inhibitoren zu erhalten und die Mechanismen zu bewerten, die der Arzneimittelresistenz zugrunde liegen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken dem Mitglied des Advanced Cancer Translational Research Institute für ihre nachdenklichen Kommentare und Editage für ihre Unterstützung bei der englischsprachigen Bearbeitung. Diese Arbeit wurde von JSPS KAKENHI (Zuschussnummer: 16K09590 an T.Y.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| afatinib | Selleck | S1011 | |
| anti-EGFR monoclonal antibody | cell signaling technology | 4267S | |
| bicinchoninc acid assay | sigma | B9643 | |
| cell-culture treated 10 cm dish | Violamo | 2-8590-03 | |
| CELL BANKER1 | TakaRa | CB011 | cryopreservation media |
| CellTiter 96 | Promega | G4100 | Non-Radioactive Cell Proliferation Assay; Dye solution and Solubilization/Stop solution |
| DMSO | Wako | 043-07216 | |
| ECL solution | Perkin Elmer | NEL105001EA | |
| FBS | gibco | 26140-079 | |
| GeneAmp 5700 | Applied Biosystems | fluorescence-based RT-PCR-detection system | |
| GraphPad Prism v.7 software | GraphPad, Inc. | a statistical software | |
| NanoDrop Lite spectrophotometer | Thermo | spectrophotometer | |
| Nonfat dry milk | cell signaling technology | 9999S | |
| Pen Strep | gibco | 15140-163 | |
| phosphatase inhibitor cocktail 2 | sigma | P5726 | |
| phosphatase inhibitor cocktail 3 | sigma | P0044 | |
| Powerscan HT microplate reader | BioTek | ||
| Power SYBR Green master mix | Applied Biosystems | SYBR Green master mix | |
| protease inhibitor cocktail | sigma | P8340 | |
| QIAamp DNA Mini kit | Qiagen | 51306 | DNA purification kit |
| QIAquick PCR Purification Kit | QIAGEN | PCR purification kit | |
| RPMI-1640 | Wako | 189-02025 | with L-Glutamine and Phenol Red |
| TBST powder | sigma | T9039 | |
| Trans-Blot SD Semi-Dry Electrophoretic Transfer cell | Bio-Rad | semi-dry t4ransfer apparatus | |
| 96 well microplate | Thermo | 130188 |
Referenzen
- Chan, B. A., Hughes, B. G. Targeted therapy for non-small cell lung cancer: current standards and the promise of the future. Translational Lung Cancer Research. 4 (1), 36-54 (2015).
- Mitsudomi, T., Yatabe, Y. Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidermal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer. Cancer Science. 98 (12), 1817-1824 (2007).
- Yamaoka, T., Kusumoto, S., Ando, K., Ohba, M., Ohmori, T. Receptor tyrosine kinase-targeted cancer therapy. International Journal of Molecular Science. 19 (11), (2018).
- Marshall, J. Clinical implications of the mechanism of epidermal growth factor receptor inhibitors. Cancer. 107 (6), 1207-1218 (2006).
- Hirsh, V. Managing treatment-related adverse events associated with egfr tyrosine kinase inhibitors in advanced non-small-cell lung cancer. Current Oncology. 18 (3), 126-138 (2011).
- Arcila, M. E., et al. Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay. Clinical Cancer Research. 17 (5), 1169-1180 (2011).
- Sequist, L. V., et al. Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Science Translational Medicine. 3 (75), 75ra26 (2011).
- Yang, J. C., et al. Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. Journal of Clinical Oncology. 35 (12), 1288-1296 (2017).
- Chong, C. R., Janne, P. A. The quest to overcome resistance to EGFR-targeted therapies in cancer. Nature Medicine. 19 (11), 1389-1400 (2013).
- Clynes, M., Redmond, A., Moran, E., Gilvarry, U. Multiple drug-resistance in variant of a human non-small cell lung carcinoma cell line, DLKP-A. Cytotechnology. 10 (1), 75-89 (1992).
- Yamaoka, T., et al. Distinct afatinib resistance mechanisms identified in lung adenocarcinoma harboring an EGFR mutation. Molecular Cancer Research. 15 (7), 915-928 (2017).
- Liang, X. J., Shen, D. W., Garfield, S., Gottesman, M. M. Mislocalization of membrane proteins associated with multidrug resistance in cisplatin-resistant cancer cell lines. Cancer Research. 63 (18), 5909-5916 (2003).
- Shen, D. W., Akiyama, S., Schoenlein, P., Pastan, I., Gottesman, M. M. Characterisation of high-level cisplatin-resistant cell lines established from a human hepatoma cell line and human KB adenocarcinoma cells: cross-resistance and protein changes. British Journal of Cancer. 71 (4), 676-683 (1995).
- Murakami, H., et al. Phase I study of continuous afatinib (BIBW 2992) in patients with advanced non-small cell lung cancer after prior chemotherapy/erlotinib/gefitinib (LUX-Lung 4). Cancer Chemotherapy and Pharmacology. 69 (4), 891-899 (2012).
- Nukaga, S., et al. Amplification of EGFR wild-type alleles in non-small cell lung cancer cells confers acquired resistance to mutation-selective EGFR tyrosine kinase inhibitors. Cancer Research. 77 (8), 2078-2089 (2017).
- Nakatani, K., et al. EGFR amplifications mediate resistance to rociletinib and osimertinib in acquired afatinib-resistant NSCLC harboring exon 19 deletion/T790M in EGFR. Molecualr Cancer Therapy. 18 (1), 112-126 (2019).
- Piotrowska, Z., et al. Heterogeneity underlies the emergence of EGFRT790 wild-type clones following treatment of T790M-positive cancers with a third-generation EGFR inhibitor. Cancer Discovery. 5 (7), 713-722 (2015).
- Ortiz-Cuaran, S., et al. Heterogeneous mechanisms of primary and acquired resistance to third-generation EGFR inhibitors. Clinical Cancer Research. 22 (19), 4837-4847 (2016).
- Kobayashi, Y., et al. Characterization of EGFR T790M, L792F, and C797S mutations as mechanisms of acquired resistance to afatinib in lung cancer. Molecular Cancer Therapy. 16 (2), 357-364 (2017).
- Uchibori, K., Inase, N., Nishio, M., Fujita, N., Katayama, R. Identification of mutation accumulation as resistance mechanism emerging in first-line osimertinib treatment. Journal of Thoracic Oncology. 13 (7), 915-925 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten