Method Article
胚性パターンスケーリングの研究のためのゼブラフィッシュの外科的サイズ縮小
要約
ここでは、通常の発達過程を妨げずにゼブラフィッシュの胚のサイズを小さくする方法について述べる。この手法により、サイズ変更に対するパターンのスケーリングと開発の堅牢性の検討が可能になります。
要約
発達過程において、胚は体のサイズに自分の体のパターンを一致させる顕著な能力を示す。それらの体の割合は、特定の限界内で、より大きいか、またはより小さい胚においてさえ維持される。このスケーリングの現象は1世紀以上にわたって注目されてきたが、様々なサイズの胚における発達力学の量的記述不足のために、根底にあるメカニズムを理解することは限定的であった。このような制約を克服するため、ゼブラフィッシュの胚のサイズを外科的に減少させる新しい手法を開発し、生体内ライブイメージングに大きな利点を持っています。我々は、別のステップで胞胚段階で細胞および卵黄を平衡除去した後、胚が適切な条件下で迅速に回復し、より小さいがそれ以外の場合は正常な胚に成長することを実証する。この技術は特別な装置を必要としないので、それは容易に適応可能であり、morphogen によって媒介されるパターン化の強さを含むスケールの問題の広い範囲を研究するのに使用することができる。
概要
科学者たちは、胚の大きさは、自然と実験的な条件1,2,3の下で大きく異なるが、一定の体の割合を形成する顕著な能力を持っていることを長い間知られています。数十年にわたる理論的および実験的研究にもかかわらず、このようなサイズ変動に対する頑健性は、スケーリングと呼ばれ、多くの組織や器官においてその根底にあるメカニズムは未知のままである。現像システムのダイナミクスを直接捕捉するために、ゼブラフィッシュ4において再現性がありかつ単純なサイズ低減技術を確立し、これは生体内ライブ撮像5において大きな利点を有する。
ゼブラフィッシュは、発生生物学を含む生物学の複数の学問分野を研究するためのモデル脊椎動物として役立ってきた。特に、ゼブラフィッシュは生体内ライブ撮像6にとって理想的であるので 1) 開発は母と卵殻の外で正常に進行でき、そして 2) 胚は透明である。さらに、胚は、それらが実験室条件で研究されることを可能にするいくつかの温度および環境変動に耐えることができる。また、モルホリノや mRNA 注入7,8による従来の遺伝子発現摂動に加え、近年の CRISPR/Cas9 技術の進歩により、ゼブラフィッシュにおける逆遺伝学が極めて効率的な9となっている。さらに、細胞移植または組織手術などの発生学における多くの古典的技術を、4、10、11に適用することができる。
サイズ低減技術は、両生類および他の非脊椎動物12で元々開発された。例えば、アフリカツメガエルガエルにおいて、他の一般的な脊椎動物モデルでは、胞胚段階で動物植物軸に沿って公知は、サイズ減少した胚12,13を作り出すことができる。しかし、私たちの手の中でこのワンステップのアプローチは、dorsalized または ventralized の胚が不均一に分布しており、胚の形態からの局在を知ることができないためであると考えられます。ここでは、通常発達しているがより小さな胚を生成するゼブラフィッシュのための代替の2段階のチョッピング技術を示す。この技術によって、細胞は最初に動物の極から、オーガナイザーの活動に欠けているナイーブな細胞の領域から取り除かれます。Epiboly とその後の形態形成に重要な卵黄と細胞の量のバランスをとるために、卵黄を除去する。ここでは、このプロトコルについて詳しく説明し、パターン形成におけるサイズ不変性の2つの例を示します。somite 形成と腹部神経管のパターニング。定量的イメージングと組み合わせることで、サイズ低減技術を利用して、体節と神経管のサイズが減少した胚のサイズにどのように影響するかを調べました。
プロトコル
すべての魚関連の手続きは、ハーバード大学医学部の制度的動物ケアと使用委員会 (IACUC) の承認を得て行われました。
1. ツールと試薬の準備
-
胚を切り刻むためにワイヤーループを作る
- 40μ m の直径の堅く、非腐食性であるステンレス鋼ワイヤーの 20 cm を取りなさい。ワイヤーをガラス毛細管 (1.0 mm 外径、0.5 mm 内径、フィラメントなし) にループさせ、上部に小さなループを作ります (ループ長は 1.0 mm)。
- ワイヤーループの間にガラス毛細管の先端に明確なマニキュアの小さな液滴を入れて所定の位置に保持する。乾かしてそれは胚を損傷する可能性がありますように、ループ部分の上に任意のマニキュアを取得しないようにしてください。
- 実験用テープを使用したガラス毛細管を、木製の箸 (9 "半分に割れた竹の割り箸) の上に取り付けます。箸の先に伸びるガラス毛細管は約 2.5 cm ありますので、箸部分が水の中に入ることはありません。この長さを [優先] に調整します。
-
あるいは、胚をチョップするためにガラスの針を作る
- ガラスパスツールピペットの一方の端を鉗子で挟み、反対側を手で押さえます。ピペットの薄い部分をスピリットランプまたはブンゼンバーナーの上に加熱します。
- ガラスピペットを手で引っ張ります。約30μ m の直径と緩やかな曲線 (曲率半径 = 約 5mm) として理想的なピペット。適切な直径および湾曲は練習およびあるチャンスと得られる。
-
メチルセルロースを準備する
- メチルセルロースは、チョッピングしながら胚を保持するために使用される。1/3x リンガー溶液 (116 mM NaCl、2.9 mM KCl、1.8 mM CaCl2、5 mm 4-(2-ヒドロキシエチル)-1-piperazineethanesulfonic 酸 (HEPES; pH 7.2) の 2% メチルセルロース溶液を作る。1/3x リンガー溶液中のメチルセルロース粉末を一晩4° c で振ります。
- 必要に応じて、〜 1.5 mL フェノールレッド (DPBS 原液で 0.5%) を 10 mL 2% メチルセルロース溶液に、赤まで、溶液を可視にする。色が均一になるまで振ってください。
2. ゼブラフィッシュ胚の外科的サイズ低減のための準備
-
胚の収集
- 多くの水で満たされた嵌合室に、男性 1 ~ 2 人の女性ゼブラフィッシュを配置します。プラスチック製の仕切りを使用して男性と女性を分離します。Somite イメージングのための AB ライン (セクション 4) と神経管パターン形成のトランスジェニックレポーターライン (nkx 2.2: mem − gfp、dbx1b: gfp、またはOlig2: dsred) を使用して神経管イメージングを行います。一晩室に放置してください。
注:大人の選択は、よく手術を生き残る卵を得るために重要です。典型的には、若い健康な女性は健康卵を生産します。 - 翌朝には、チャンバを浅い水に移し、わずかな傾きでチャンバを配置します。魚が交尾できるように仕切りを取り外します。
- お茶のストレーナーに注ぐことによって卵を収集します。卵をペトリ皿に移し、卵水 (20 倍の卵水、6 g のインスタント海塩、1.5 g CaSO4と 1 L H2O; 1x で使用)。より良いステージングのために、産卵後すぐに卵を収集します。28.5 ° c のインキュベーター内に胚を配置します。
- 必要に応じて、一般的なプロトコル7、8に続く1〜4細胞段階でモルホリノ、mRNA などを注入する。神経管画像化のための蛍光膜標識 (mem − mCherry、mem − mBFP1、またはmem − MCitrine) の mRNA を注入する (第5項)。
- 多くの水で満たされた嵌合室に、男性 1 ~ 2 人の女性ゼブラフィッシュを配置します。プラスチック製の仕切りを使用して男性と女性を分離します。Somite イメージングのための AB ライン (セクション 4) と神経管パターン形成のトランスジェニックレポーターライン (nkx 2.2: mem − gfp、dbx1b: gfp、またはOlig2: dsred) を使用して神経管イメージングを行います。一晩室に放置してください。
-
プロナーゼを使用し Dechorionate
- 128-セル ~ 256 細胞ステージの周囲で、正常な胚を卵水で満たされた 35 mm のガラス皿に移します。お皿からできるだけ多くの卵水を取り除いてください。
- 20mg/mL のプロナーゼを1ml 加えます。プレートを移動させることによって、周囲の胚を静かに渦巻きし、ガラスピペットを使用して dechorionation を助けるために溶液を上下にやさしくピペットで移します。
- Chorions が弾力性を失い始めたとき (通常、プロナーゼの添加後に1-4 分、卵と水の量に応じて)、プロナーゼを希釈するためにできるだけ多くの卵の水を追加します。慎重に鉗子で絨毛膜に触れることによって弾力性の損失を評価します。絨毛膜はすぐにバウンスすることなくへこみを保持する必要があります。ガラスピペットを使用して卵水で別の皿に卵を移します (この時点では、chorions のほとんどは壊れていません)。
- 別の方法として、卵水で満たされた大きな 400 mL のガラスビーカーに、胚を空気にさらすことなく穏やかに、ディッシュから胚を注ぎます。その後、胚を完全に沈降させます。ビーカーを傾けて、胚が片側に落ちるようにする。ガラスピペットを使用してこれらの胚を収集し、1/3x リンガー溶液で満たされた新しい 35 mm ガラス皿に移します。
- Chorions のほとんどが弾力性を完全に失うまで、数分間待機します。卵をそっとピペッティングすることによって、胚から残りの chorions を取り除きます。損傷した胚を除去し、28.5 ° c のインキュベーター内で胚をインキュベートします。
3. 外科サイズの減少および回復
- 1つのきれいな 35 mm のガラス皿を準備しなさい。約 0.5 mL の 2% のメチルセルロース (1/3x リンガー溶液で、フェノールレッドを使用して、プラスチック製のスパチュラを用いて、より大きな皿の底の中央付近を視覚化するのに役立つ) を広げます。メチルセルロースを薄く均一に約 0.5 mm の厚さに広げます。
- 1/3x リンガー溶液の約 30 mL を皿の側面に注ぎ、メチルセルロースを覆う残りの皿の上に広げることを可能にする。
- 256細胞-1k 細胞の段階で dechorionated 胚を 2% メチルセルロースに置きます。細胞と卵黄の両方を視覚化するために、側に胚の向きを調整します。(図 1)
- ワイヤーループ (またはガラス針) を使用して植物軸に垂直に切断することにより、動物の極近くの blastoderm から約 30%-40% の細胞を切ります (図 1、トップパネル)。細胞を取り除いた後、端を静かにタップして残りの細胞がくっつくようにします。胚が治癒し始めると、数分以内に死んだ細胞が脱落するはずです。
- 卵黄を「チョッピング」する代わりに、植物の近くの卵黄に小さな傷をつけます (図 1中央パネル)。卵膜を取り付けられたワイヤーで施与ことによって卵黄を巻き付けた。創傷の後、数分間卵黄がにじみ出て、傷口が治る (図 1下部パネル)。
- 卵黄がにじみ出て止まるとき、同じ皿にあるメチルセルロースの外にある pipet を使って胚を動かし、より良く回復できるようにします。
- すべての胚について、手順 3.4-3.6 を繰り返します。胚が回復する間、皿を30分間安定させておきなさい。
-
新鮮な 1/3x リンガー溶液で新しい皿に胚を転送し、それらが完全に回復することができるように28.5 ° c のインキュベーター内に入れます。
- オプション対象となる段階が初期の somite 段階である場合、胚は、遮蔽段階まで28.5 ° c でインキュベートされた後に20° c でインキュベートすることができ、実験および画像化のためのタイミングを調整する。
4. ゼブラフィッシュ Somitogenesis のライブイメージング
- 1 g のアガロースを 100 mL の卵水に添加し、アガロースが完全に溶けるまで加熱して、100 mL を調製します。5-10 分を62-72 ° c の温度に冷ましてください。
-
イメージング用のマウントを準備します。
注:このガイドは、反転した広視野顕微鏡での使用のために開発されました。- 〜 15 mL の 1% アガロースを 100 mm x 15 mm のプラスチックペトリ皿に注ぎます。
- 背面マウント V1 鋳型テンプレート5をペトリ皿の底にそっと置きます。水で 15 mL チューブなどの重量を使用して、底部に金型を保管してください。
注:これは、逆に顕微鏡を使用する場合、胚が可能な限りペトリ皿の底に近いようにするためである。胚は somite イメージングのために横方向に取り付けられているが、ここでは somite の初期段階でより良好に胚を保持しているために背側マウント V15が使用される。 - アガロースが完全に固化するまで冷ましてください。〜 30 mL の卵水を 0.01% の tricaine で注ぎ、慎重に鉗子で外を詮索してカビを取り除いてください。
-
Somite イメージングのための胚のマウント
- 1/3x リンガー溶液 (または卵水) に 1% の低融点アガロースを調製し、42° c で保管してください。温度が42° c に下がるまで待ちます。
- 解剖顕微鏡下では、1つの胚をウェルごとに配置します。約1μ l の低融点アガロースをピペットで使用し、サイズが異なる個々の胚のサイズ、特にサイズの減少の有無にかかわらず、十分なサイズを微調整します。
- 低融点アガロースが固化する前に速やかに胚を配向させることで、胚が皿に完全に横に向くようにする。胚を取り付けた後、アガロースマウントにカバースリップをそっと置き、胚を所定の位置に保持する。胚は完全に横方向に取り付けられ、すべての somite 境界が後の段階で鮮明に撮像される必要があるため、配向は長期 somite イメージングにとって特に重要です。
- 取り付けエリアから離れて水没し、25 mm x 25 mm のカバーガラスを操作して、金型によって作成された正方形のインデントの方向から45度オフセットします。この方向の金型の上にカバースリップをスライドさせて、それぞれの角が金型の別の側を休ませるようにします。
注:このプロトコルは倒立顕微鏡用ですが、金型の上にカバーガラスを配置することは、胚が顕微鏡に移動しながら動かないようにするためには依然として重要です。
-
イメージング somite 形成過程
- 外は、foamcore ボードとキャビネットヒーターで構築されたインキュベーター内で、顕微鏡を28° c にします。
- 取り付けられた胚を顕微鏡ステージ上に入れてペトリ皿を配置する。低倍率レンズでアガロースマウントの左上に取り付けた胚を見つけ、目標を10x に切り替えます。
- 画像取得を設定します。
注:この命令は明るいフィールド用です。 - Somite 境界を明確に見ることができるように、光パワー、露光時間、およびコンデンサーの条件を検索します。Z スタック設定を使用して、必要なイメージングプレーンを最小および最高に設定します。合計時間と時間間隔を設定します。複数の胚が一度にタイムラプス撮影できるように取り付けられたすべての胚の xy 位置を見つけて登録します。
- フィジー16を使用して PSM と体節の長さを測定します。
5. 神経管パターニングのイメージング
- 1 g のアガロースを 100 mL の卵水に添加し、アガロースが完全に溶けるまで加熱して、100 mL を調製します。5-10 分 ~ 62-72 ° c まで冷ましてください。Tricaine を 0.01% に調整します。
-
イメージング用の背面マウントを準備します。
注:このガイドは直立した蛍光顕微鏡との使用のために開発される。倒立顕微鏡ではカバースリップボトムディッシュが必要であり、ステップ3での取り付け方向が反転されます。- 〜 15 mL の 1% アガロースを 100 mm x 15 mm のプラスチックペトリ皿に注ぎます。アガロースの表面にある背面取り付け V1 モールドをそっと浮かべて、気泡の混入を防ぎます。アガロースが完全に固化するまで冷ましてください。
- 注意深く鉗子またはかみそりの刃が付いている型を取除きなさい。0.01% の tricaine と卵の水で料理を記入し、使用するまでカバーしています。
-
神経管イメージングのための胚をマウントします。
- 遺伝子組み換えまたは注入された蛍光サイズの減少および制御胚が 20-25 somite 段階 (受精後約 18-22 h) まで発達することを可能にする。蛍光膜標識を発現する胚 (mem − mCherry、 mem − mBFP1、又はmem − mCitrine) と神経管パターン形成のトランスジェニックレポーター (nkx 2.2: mem − gfp、 dbx1b: gfp、又はOlig2: dsred) を用いたイメージング用。
- 0.01% tricaine の働く解決と準備された背部台紙の卵水媒体を取り替えなさい。徐々に背面のマウントのウェルに画像化されるように胚にピペット。
- 頭がマウントで前方に向いているように正しい方向に胚を操作し、尾は水面に向かって直面している背側の部分と後部の方を指しています。
- 尾が平らに横たわって、皿の底に向かって下方に向いていないように胚の向きを合わせる。尾が沈み込むのを防ぎ、不注意に後脳を撮像するのを防ぐために、取り付け井戸の側面の棚に尾の後部を休ませると便利なことがあります。各胚について繰り返します。画像化するために井戸に深く落ちないようにサイズを減少させた胚で特定してください。
- 取り付けエリアから離れて水没し、25 mm x 25 mm のカバーガラスを操作して、金型によって作成された正方形のインデントの方向から45°のオフセットを行います。この方向の金型の上にカバースリップをスライドさせて、それぞれの角が金型の別の側を休ませるようにします。
- チェンバーを徐々に回転させて、取り付け領域にゆっくりと落下します。胚がまだ正しい位置と向きに取り付けられていることを確認してください。あまりにも多くの動きがチェンバーの落下によって引き起こされた場合、穏やかに除去し、ステップ C からの取り付けを繰り返します。
-
現像脊髄の3d における画像。
- 取り付けた胚を含むディッシュを共焦点顕微鏡に優しく輸送する。長期のライブイメージングのためには、インキュベートされた顕微鏡を使用するようにしてください。それ以外の場合、低温は許容されます。
- 明視野の照明の下で、望ましい前方後方の位置の視野をイメージし、中心に胚にナビゲートしなさい。胚間の詳細な比較を可能にするために、各胚におけるこの位置は一貫していなければならない。
- 画像化されている蛍光タンパク質からのシグナルを励起して捕捉するように撮像パラメータを設定する。パラメータは、最初のサンプルに所望の画像を作成するために、目で調整することができます。測定の一貫性を有効にするには、データセット内のすべての胚にこれらの設定を適用します。多くの z スタックが必要な場合は、速度の設定を最適化します。
- Z スタック設定を使用して、最小および最高の目的のイメージングプレーンを設定します。Z スタックで最適な画質を設定するには、[z 解像度] を [開口部] の設定に最適な最大値にします。1μ m の z 間隔で良好な画像を生成できます。
- 任意の方法でイメージングデータを分析します。
注:この場合、画像の神経部分の単純なセグメンテーションと撮像信号の定量化を可能にする、カスタムの MATLAB スクリプトを使用して分析を行いました。
結果
卵黄体積減少は、通常の形態にとって重要である
最近述べたように Almuedo-カスティージョ et al.17において、胚のサイズ減少は卵黄体積を減少させることなく達成することができる。卵黄体積減少と比較するために、我々は2段階のチョッピング (胞胚と卵黄の両方) と胞胚のみのチョッピング (図 2と補足ムービー 1) の両方を行いました。2段階の細断された胚は、発達段階全体にわたって、サイズ差以外のコントロール (dechorionation のみ) 胚に比べて一見正常な全体的形態を示した (図 2の上部および中央パネルを参照)。一方、胞胚のみの細断胚は、特に初期の段階で特異な形態を示した。Epiboly の間、胚は狭窄し、インデントされた外観を有していた (図2の epiboly% 70 の下側パネルを参照)。次の somite 段階では、中線構造が平坦であることが見出された (すなわち DV 長は ML 長よりも比較的短い) 多くの軸レベルで (図 2の下部パネルを参照してください8と 20 somite).後期段階において、卵黄に隣接する身体構造、例えばミッドおよび後脳、および最初〜10体節は、依然として比較的平坦な形状を示し、おそらく比較的大きな卵黄からの張力の増加に起因する。
Somite サイズ縮小胚のサイズ減少
体節は、胚発生中に一過性に現れ、椎骨および骨格筋を生じさせる部分的な構造である。Presomitic 中胚葉 (PSM) から、体節は、定期的に前方から後方向に1つずつ形成される (例えばゼブラフィッシュの場合は25分、マウスの場合は 2 h) (図 3a)。我々は、コントロールと細断された胚の両方の somite 形成のタイムラプス撮影を行い、最も新しく形成した体節のサイズを測定した (図 3B)。胚の制御とみじん切りの両方において、後の段階で形成された体節のサイズは、初期の段階からのものと比較してより小さいことが見出された。また、somite 形成段階を通して、細断された胚は、対照胚におけるものよりも体節が小さかった (図 3C)。
神経管の高さは次のサイズの減少減少する
胚のサイズ減少が神経管サイズに及ぼす影響を確認するために、 mCherry注入胚に対して2段階のチョッピング技術を実施し、共焦点イメージングシステム (図 4A、B) を用いて20台の hpf で脊髄を画像化しました。このデータセットでは、ニューラルチューブの高さを 12.4% ± 3.2% 減少させた後、カスタム画像解析コード (図 4C) を用いて手動で測定した。まとめると、これらのデータは、サイズの減少が神経管の高さを減少させることを示している。この技術は、ニューラルパターニングにおけるサイズ減少の効果を測定するために使用することができる。
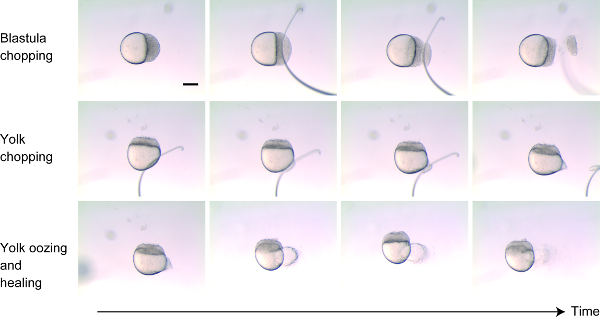
図 1: サイズ縮小技術。細胞の約 30%-40% が動物の棒 (上のパネル) から切られた。卵黄を取り囲んでいる膜は、卵黄がみなぎっ (中央のパネル) になるように注意深く傷つけられました。次の数分の間、卵黄がみなぎっし、次に blastoderm と卵黄の両方の傷が治った (下のパネル)。スケールバー = 200 μ mこの図の大規模なバージョンを表示するには、ここをクリックしてください。
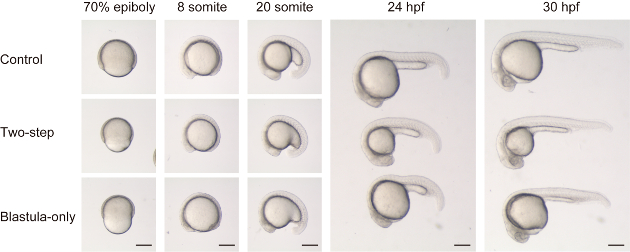
図 2: サイズ削減の2つの方法の比較。コントロールの胚 (トップパネル, 24 hpf のトップ胚と 30 hpf), サイズは、2段階のチョッピング (胞胚と卵黄, ミドルパネル, 24 hpf のための中間胚と 30 hpf) とサイズが減少した胚胞胚のみのチョッピング (下のパネル, 下の胚24 hpf と 30 hpf) 開発段階に沿って比較されます。なお、胞胚のみの細断された胚では、blastoderm 体積は卵黄に比べてはるかに小さい (70% epiboly)。結果として、胚は、somite 段階で不釣合いに平坦化した形状を有する (すなわち、DV 軸は、胞胚のみの細断された胚における AP 軸と比較して比較的短く、コントロールまたは2段階のチョップド 1) に比較した。スケール ba = 200 μ mこの図の大規模なバージョンを表示するには、ここをクリックしてください。
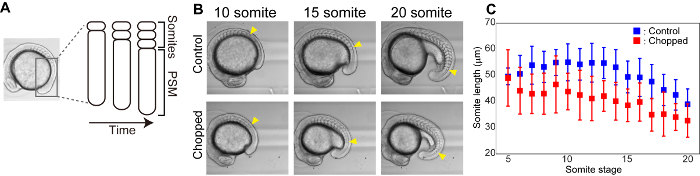
図 3: サイズ削減体節の長さ。(A) somite 形成の概略図。(B) 時間の経過とともに制御および細断した胚の明視野画像。黄色の矢印は、各 somite 段階で最も新しく形成された somite を示す。(C) コントロールと刻んだ胚の両方のための時間をかけての Somite の長さ (前後方軸) の測定値。誤差バーは標準偏差を表します。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 4: サイズの減少は神経管の高さを減らす。(A-B)正常サイズの画像例 (A) およびサイズ減少 (B) tg (ptch2: かえで)の胚を、mem − mCherry mRNA を用いて単一細胞段階で注入した。スケールバー = 20 μ m(C) 各 z スタック内の神経管の手動セグメンテーションから抽出された神経管高さ。非対 t 検定 (p = 0.0397) を使用して値を比較すると、統計的に有意な差が平均神経の高さで観察されます。この図の大規模なバージョンを表示するには、ここをクリックしてください。

補足動画 1: 2 段階のチョッピングと胞胚のみのチョッピングの比較。上段 = 制御胚、中央行 = 2 つのステップチョップでサイズを減少させた胚は、最下行 = サイズが胞胚でのみ減少した胚をチョッピングする。映画は12時間ごとに3分ごとに撮影しました。スケールバー = 1 mm。こちらをクリックして、この動画をご覧ください。(右クリックしてダウンロードします。
ディスカッション
歴史的に、脊椎動物のうち、サイズの減少は、主に両生類の胚を使用して行われており、植物軸に沿って胚を胞胚段階12で bisecting することによっている。しかし、カエルとゼブラフィッシュの胚の間には、胚を二分すると2つの違いがある。まず、ゼブラフィッシュの胚が bisecting (胞胚ステージ) に寛容になった段階で、オーガナイザーは胞胚マージン18、19、20、21の制限区域に位置しています。オーガナイザーの位置を胚の形態から伝えることができないので、動物-植物軸に沿って胚をランダムに切断すると、dorsalized または ventralized 胚が生成される。第2は、カエルの胚とは異なり、ゼブラフィッシュの胚は epiboly と呼ばれるプロセスを通過し、細胞は細胞に完全に囲まれるまで、分離された卵黄の周りに植物に向かって移動します。Blastoderm の一部のみが除去された場合、比較的大きな体積の卵黄を巻き込むために残っている細胞が少なくなり、その結果、形態は epiboly 後に影響を受けるように見える。したがって、私たちは、blastulae の近くで、オーガナイザーを切断し、卵黄膜を傷つけ、胞胚に比例した卵黄サイズを作る2段階のチョッピングを採用しています。
2段階のチョッピングに加えて、手術後の胚の回復にはサイズ縮小手術が行われる培地が重要であることがわかった。私たちが試したいくつかのメディアの中で (卵水、卵水 + アルブミン、Danieau バッファー、L15、L15 + FBS、1/3x リンガー、1x リンガー)、わずか 1/3x リンガーと1x リンガーは、高い生存率を得ました。他の培地では、胚は創傷から回復することができなかった。
低生存率のための重要なトラブルシューティングのヒントは、健康で若い親の魚から健康的な胚を使用することです。我々は、対照の非サイズ減少胚がほぼ 100% の生存率を示す場合でさえ、サイズが減少したとき、古い魚からの胚は、より低い生存率を示す傾向があることに留意した。また、サイズ減少がモルホリノ注入などの追加の摂動と組み合わされると、生存率が低下する傾向があることに注意してください。
ここに記載されているサイズ削減技術のシンプルさは、研究者が特殊な機器や集中的なトレーニングなしでこの技術を適用することができます。さらに、サイズ減少した胚は、開発の後の段階まで小さいままであるので (彼らが食べ始めると、そのサイズはコントロール魚に追いつくと思われる)、この技術は、多くの組織および器官のスケーリングを研究するために適用することができる。したがって、この技術は、生体イメージングにおけるサイズ縮小と定量を組み合わせて、様々なシステムのスケーリングおよびサイズ制御を研究することを可能にする。
開示事項
著者は、競合または金銭的利益を宣言しません。
謝辞
この研究は、日本科学技術振興機構 (JPMJPR11AA) と国立衛生研究所 (R01GM107733) の PRESTO 事業によって支援された。
資料
| Name | Company | Catalog Number | Comments |
| 60 mm PYREX Petri dish | CORNING | 3160-60 | |
| Agarose | affymetrix | 75817 | For making a mount for live imaging |
| Agarose, low gelling temperature Type VII-A | SIGMA-ALDRICH | A0701-25G | |
| CaCl2 | EMD | CX0130-1 | For 1/3 Ringer's solution |
| CaSO4 | For egg water | ||
| Cover slip (25 mm x 25 mm, Thickness 1) | CORNING | 2845-25 | |
| Disposable Spatula | VWR | 80081-188 | |
| Foam board | ELMER'S | 951300 | For microscope incubator |
| Forcept (No 55) | FST | 11255-20 | |
| Glass pipette | VWR | 14673-043 | |
| HEPES | SIGMA Life Science | H4034 | For 1/3 Ringer's solution |
| INCUKIT XL for Cabinet Incubators | INCUBATOR Warehouse.com | For microscope incubator | |
| Instant sea salt | Instant Ocean | 138510 | For egg water |
| KCl | SIGMA-ALDRICH | P4504 | For 1/3 Ringer's solution |
| Methyl cellulose | SIGMA-ALDRICH | M0387-100G | |
| NaCl | SIGMA-ALDRICH | S7653 | For 1/3 Ringer's solution |
| Petri dish | Falcon | 351029 | For making a mount for live imaging |
| Phenol red | SIGMA Life Science | P0290 | |
| Pipette pump | BEL-ART PRODUCTS | F37898 | |
| Pronase | EMD Millipore Corp | 53702-250KU | |
| Tricaine-S (MS222) | WESTERN CHEMICAL INC | NC0135573 | |
| Ultra thin bright annealed 316L dia. 0.035 mm Stainless Steel Weaving Wires | Sandra | The wire we used was obtained ~20 years ago and we could not find exactly the same one. This product has the same material and diameter as the one we use. |
参考文献
- Cooke, J. Scale of body pattern adjusts to available cell number in amphibian embryos. Nature. 290, 775-778 (1981).
- Driesch, H. Entwicklungsmechanische Studien: I. Der Werthe der beiden ersten Furchungszellen in der Echinogdermenentwicklung. Experimentelle Erzeugung von Theil- und Doppelbildungen. Zeitschrift fur wissenschaftliche Zoologie. , (1892).
- Morgan, T. H. Half embryos and whole embryos from one of the first two blastomeres. Anatomischer Anzeiger. 10, 623-638 (1895).
- Ishimatsu, K., et al. Size-reduced embryos reveal a gradient scaling-based mechanism for zebrafish somite formation. Development. 145, (2018).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods in Molecular Biology. 546, 317-332 (2009).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. Journal of Visualized Experiments. (26), e1217(2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115(2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113(2009).
- Sorlien, E. L., Witucki, M. A., Ogas, J. Efficient Production and Identification of CRISPR/Cas9-generated Gene Knockouts in the Model System Danio rerio. Journal of Visualized Experiments. (138), e56969(2018).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments. (29), e1394(2009).
- Mizuno, T., Shinya, M., Takeda, H. Cell and tissue transplantation in zebrafish embryos. Methods in Molecular Biology. 127, 15-28 (1999).
- Cooke, J. Control of somite number during morphogenesis of a vertebrate, Xenopus laevis. Nature. 254, 196-199 (1975).
- Inomata, H., Shibata, T., Haraguchi, T., Sasai, Y. Scaling of dorsal-ventral patterning by embryo size-dependent degradation of Spemann's organizer signals. Cell. 153, 1296-1311 (2013).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454, 335-339 (2008).
- Lauschke, V. M., Tsiairis, C. D., Francois, P., Aulehla, A. Scaling of embryonic patterning based on phase-gradient encoding. Nature. 493, 101-105 (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signalling. Nature Cell Biology. 20, 1032-1042 (2018).
- Koos, D. S., Ho, R. K. The nieuwkoid gene characterizes and mediates a Nieuwkoop-center-like activity in the zebrafish. Current Biology. 8, 1199-1206 (1998).
- Yamanaka, Y., et al. A novel homeobox gene, dharma, can induce the organizer in a non-cell-autonomous manner. Genes and Development. 12, 2345-2353 (1998).
- Jesuthasan, S., Stahle, U. Dynamic microtubules and specification of the zebrafish embryonic axis. Current Biology. 7, 31-42 (1997).
- Schier, A. F., Talbot, W. S. The zebrafish organizer. Current Opinion in Genetics and Development. 8, 464-471 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved