Method Article
Chirurgische Größenreduktion von Zebrafischen für die Erforschung der embryonalen Muster Skalierung
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode, um die Größe von Zebrafisch-Embryonen zu reduzieren, ohne die normalen Entwicklungsprozesse zu stören. Diese Technik ermöglicht das Studium der Musterskalierung und der Entwicklungsrobuste gegen Größenwechsel.
Zusammenfassung
Im Entwicklungsprozess weisen Embryonen eine bemerkenswerte Fähigkeit auf, ihr Körpermuster an ihre Körpergröße anzupassen; Ihr Körperanteil wird auch bei Embryonen, die größer oder kleiner sind, innerhalb bestimmter Grenzen erhalten. Obwohl dieses Phänomen der Skalierung seit mehr als einem Jahrhundert Aufmerksamkeit erregt hat, ist das Verständnis der zugrunde liegenden Mechanismen begrenzt, was teilweise auf die fehlende quantitative Beschreibung der Entwicklungsdynamik bei Embryonen unterschiedlicher Größe zurückzuführen ist. Um diese Einschränkung zu überwinden, haben wir eine neue Technik entwickelt, um die Größe von Zebrafisch-Embryonen, die große Vorteile für die in vivo lebende Bildgebung haben, chirurgisch zu reduzieren. Wir zeigen, dass sich Embryonen nach einer ausgewogenen Entfernung von Zellen und Eigelb im Blastula-Stadium in getrennten Schritten schnell unter den richtigen Bedingungen erholen und sich zu kleineren, aber ansonsten normalen Embryonen entwickeln können. Da diese Technik keine spezielle Ausrüstung benötigt, ist sie leicht anpassbar und kann verwendet werden, um eine breite Palette von Skalierungsproblemen zu untersuchen, einschließlich der Robustheit des morphogen vermittelten Musterning.
Einleitung
Wissenschaftler wissen seit langem, dass Embryonen eine bemerkenswerte Fähigkeit haben, konstante Körperproportionen zu bilden, obwohl die Embryonengröße sowohl unternatürlichen als auch unter experimentellen Bedingungen 1,2,3stark variieren kann. Trotz jahrzehntelanger theoretischer und experimenteller Studien bleibt diese Robustheit zu Größe Variation, genannt Skalierung, und ihre zugrunde liegenden Mechanismen in vielen Geweben und Organen unbekannt. Um die Dynamik des sich entwickelnden Systems direkt zu erfassen, haben wir eine reproduzierbare und einfache Größenreduktionstechnik in Zebrafischen 4 entwickelt, die den großen Vorteil in vivo live Bildgebunghat.
Zebrafisch hat als Mustertier für Wirbeltiere gedient, um verschiedene Disziplinen der Biologie zu untersuchen, darunter auch die Entwicklungsbiologie. Vor allem ist Zebrafisch ideal für in vivo leben Bildgebung 6, weil 1) Entwicklungkann normal außerhalb der Mutter und der Eierschale, und 2) die Embryonen sind transparent. Darüber hinaus können die Embryonen einigen Temperatur-und Umgebungsschwankungen standhalten, so dass sie unter Laborbedingungen untersucht werden können. Neben der konventionellen Genexpression Störung durch Morpholino und mRNA-Injektion 7,8 haben diejüngsten Fortschritte in der CRISPR/Cas9-Technologiedie umgekehrte Genetik im Zebrafisch hocheffizientgemacht. Darüber hinaus können viele klassische Techniken in der Embryologie, wie Zelltransplantation oder Gewebechirurgie,4, 10, 11angewendetwerden.
Die Größenreduktionstechniken wurden ursprünglich bei Amphibien-und anderen nicht-wirbelhaltigen Tieren 12 entwickelt. In Xenopus laevis, einem weiteren beliebten Wirbeltiermodell, kann zum Beispiel die Bisektion entlang der tierisch-vegetalen Achse im Blastula-Stadium mit größenreduzierten Embryonen 12,13 erzeugen. In unseren Händen führt dieser einstufige Ansatz jedoch zu dorsalisierten oder ventralisierten Embryonen in Zebrafischen, vermutlich weil dorsale Determinanten ungleichmäßig verteilt sind und man ihre Lokalisierung aus der Morphologie der Embryonen nicht kennen kann. Hier zeigen wir eine alternative zweistufige Hacktechnik für Zebrafische, die normalerweise sich entwickelnde, aber kleinere Embryonen produziert. Mit dieser Technik werden Zellen zunächst aus dem Tierpol entfernt, einer Region naiver Zellen, die an Organisatorenaktivität fehlen. Um die Menge an Eigelb und Zellen auszugleichen, die für die Epibolie und die anschließende Morphogenese wichtig ist, wird dann Eigelb entfernt. Hier werden wir dieses Protokoll detailliert darstellen und zwei Beispiele für die Größenunauswellen in der Musterbildung liefern; Somitbildung und ventrale Neuralröhren-Muster. In Kombination mit der quantitativen Bildgebung haben wir die Größen-Reduktionstechnik genutzt, um zu untersuchen, wie die Größe von Somiten und Neuralrohr in der Größe reduzierte Embryonen beeinflusst.
Protokoll
Alle fischbezogenen Verfahren wurden mit Zustimmung des Institutional Animal Care and Use Committee (IACUC) der Harvard Medical School durchgeführt.
1. Werkzeug-und Reagenzubereitung
-
Machen Sie eine Drahtschleife, um Embryonen zu hacken
- Nehmen Sie 20 cm Edelstahldraht, der steif und nicht korrosiv ist, mit einem Durchmesser von 40 μm. Schlaufe den Draht in Glaskapillaren (1,0 mm Außendurchmesser, 0,5 mm Innendurchmesser, kein Filament), so dass eine kleine Schleife an der Spitze (Schleifenlänge 1,0 mm)
- Legen Sie ein wenig Tropfen klaren Nagellack auf die Spitze der Glaskapillare zwischen die Drahtschleife, um sie an Ort und Stelle zu halten. Trocknen lassen. Achten Sie darauf, keinen Nagellack auf die Schleifenpartie zu bekommen, da er die Embryonen schädigen kann.
- Die Glaskapillare mit der Schlaufe auf einen hölzernen Chopstick (9 "Bambus-Einweg-Stäbchen, die in der Hälfte zerbrochen sind) mit Laborband befestigen. Lassen Sie etwa 2,5 cm der Glaskapillare über den Chopstick hinaus, so dass der Chopstick-Teil des Werkzeugs nicht ins Wasser eintaucht. Passen Sie diese Länge an.
-
Alternativ können Sie eine Glasnadel zum Hacken von Embryonen herstellen
- Das eine Ende der Glaspasteur-Pipette mit den Zangen anstechen, während man die andere Seite mit der Hand hält. Den dünnen Teil der Pipette über eine Geisterlampe oder Bunsenbrenner erhitzen.
- Handziehen Sie die Glaspipette. Die ideale Pipette als Durchmesser von ca. 30 μm und eine sanfte Kurve (Krümmungsradius = ca. 5 mm). Der richtige Durchmesser und die Krümmung werden mit Übung und etwas Zufall erreicht.
-
Methylzellulose vorbereiten
- Methylzellulose wird verwendet, um die Embryonen beim Hacken zu halten. Machen Sie 2% Methylzellulose-Lösung in der Lösung von einhalb-3x Ringer (116 mM NaCl, 2,9 mM KCl,1,8 mM CaCl 2, und 5 mM 4-(2-Hydroxyethyl) -1-Piperazineethanesulfonsäure (HEPES; pH 7.2)). Schütteln Sie Methylzellulosepulver in der Lösung von 3x Ringer über Nacht bei 4 ° C.
- Optional können Sie bis rot ~ 1,5 mL Phenolrot (0,5% in der DPBS-Lagenlösung) zu 10 mL 2% Methylzellulose-Lösung hinzufügen, bis rot, um die Lösung sichtbar zu machen. Schütteln Sie es so lange, bis die Farbe gleichmäßig wird.
2. Zubereitung von Zebrafischen Embryonen zur chirurgischen Größenreduktion
-
Embryonen sammeln
- Legen Sie ein oder zwei männliche und ein oder zwei weibliche Zebrafische in eine mit viel Wasser gefüllte Paarungskammer. Trennen Sie Männchen und Weibchen mit einem Plastikteiler. Verwenden Sie die AB-Linie für die Somite-Bildgebung (Abschnitt 4) und eine transgene Reporter-Linie der Neuralröhrenmusterung(nkx2.2:mem-gfp, dbx1b:gfp, oder Olig2:dsred) für die Neuralrohr-Bildgebung. Lassen Sie sie über Nacht in der Kammer.
NOTE: Die Auswahl der Erwachsenen ist wichtig, um Eier zu erhalten, die Chirurgie gut überleben. Typischerweise produzieren junge gesunde Weibchen gesunde Eier. - Am nächsten Morgen die Kammer in flaches Wasser geben und die Kammer mit leichter Neigung anlegen. Entfernen Sie den Teiler, damit sich die Fische paaren können.
- Sammeln Sie die Eier, indem Sie in einen Tee-Sieb. Die Eier in eine Petrischale mit Eierwasser (für 20x Eierwasser, 6 g Meersalz, 1,5 g CaSO 4 und 1 L H2 O;bei 1x). Für eine bessere Inszenierung sammeln Sie die Eier direkt nach dem Laichen. Legen Sie die Embryonen in einen 28,5 ° C Inkubator.
- Wenn nötig, injizieren Sie Morpholino, mRNA, etc., in 1 – 4 Zellstufen nach einemgemeinsamen Protokoll 7,8. Inject mRNA für fluoreszierende Membranetiketten (mem-mCherry, mem-mBFP1, oder mem-mCitrine) für die Neuralrohrabbildung (Abschnitt 5).
- Legen Sie ein oder zwei männliche und ein oder zwei weibliche Zebrafische in eine mit viel Wasser gefüllte Paarungskammer. Trennen Sie Männchen und Weibchen mit einem Plastikteiler. Verwenden Sie die AB-Linie für die Somite-Bildgebung (Abschnitt 4) und eine transgene Reporter-Linie der Neuralröhrenmusterung(nkx2.2:mem-gfp, dbx1b:gfp, oder Olig2:dsred) für die Neuralrohr-Bildgebung. Lassen Sie sie über Nacht in der Kammer.
-
Dechorionate mit pronase
- Um das 128-Zellen-Stadium auf das 256-Zellen-Stadium übertragen Sie gesunde Embryonen auf eine 35 mm große Glasschale, die mit Eierwasser gefüllt ist. So viel Eierwasser wie möglich aus der Schüssel nehmen.
- Fügen Sie 1 mL von 20 mg/mL pronase hinzu. Sanft wirbeln Embryonen herum, indem sie die Platte bewegen und die Lösung sanft nach oben und unten pipette, um die Dekorionation mit einer Glaspipette zu unterstützen.
- Wenn die Chorions beginnen, die Elastizität zu verlieren (in der Regel 1-4 min nach dem Zusatz der Pronase, je nach Menge der Eier und Wasser), fügen Sie so viel Eierwasser wie möglich, um Pronase zu verdünnen. Elastizitätsverlust bewerten, indem man das Chorion mit Zangen sanft berührt; Das Chorion sollte die Delle halten, ohne sofort wieder zu hüpfen. Die Eier mit einer Glaspipette auf eine andere Schüssel mit Eierwasser übertragen (an dieser Stelle sind die meisten Chorions nicht gebrochen).
- Alternativ können Sie die Embryonen aus der Schüssel sanft in einen großen 400 ml Glasbecher gießen, der mit Eierwasser gefüllt ist, ohne die Embryonen der Luft auszusetzen. Dann lassen Sie die Embryonen vollständig absetzen. Kippen Sie den Becher, um Embryonen zur Seite fallen zu lassen. Sammeln Sie diese Embryonen mit einer Glaspipette und übertragen Sie auf eine neue 35-mm-Glasschale, die mit der Lösung von "cm 3x Ringer" gefüllt ist.
- Warten Sie einige Minuten, bis die meisten Chorions die Elastizität vollständig verlieren. Entfernen Sie die restlichen Chorione von Embryonen, indem Sie die Eier vorsichtig pipettieren. Entfernen Sie beschädigte Embryonen und inkubieren Sie die Embryonen in einem 28,5 ° C Inkubator.
3. chirurgische Größenreduktion und-wiedergewinnung
- Bereiten Sie eine saubere 35-mm-Glasschale vor. In der Mitte der Unterseite der größeren Schüssel mit einem Plastikspachtel etwa 0,5 ml Methylzellulose (in der Ein-3x Ringer-Lösung, mit Phenol-Rot zur Visualisierung) aufbreiten. Dünn und gleichmäßig verteilen Sie die Methylzellulose auf eine Dicke von etwa 0,5 mm.
- Etwa 30 ml der Lösung von einhalb-3x Ringer auf die Seite der Schale gießen und auf den Rest der Schale verteilen, die Methylzellulose bedecken.
- Platzieren Sie dechlorierte Embryonen im 256-Zell-1k-Zell-Stadium auf 2% Methylzellulose. Stellen Sie die Ausrichtung der Embryonen auf die Seite, um sowohl die Zellen als auch das Eigelb zu visualisieren. (Bild 1)
- Etwa 30%-40% der Zellen aus dem Blastoderm in der Nähe des Tierpols hacken, indem man mit der Drahtschleife (oder der Glasnadel) senkrecht zur tierisch-vegetalen Achse schneidet (Abbildung1, obere Platten). Nach dem Entfernen der Zellen, sanft tippen Sie die Enden zusammen, um die restlichen Zellen wieder zu halten. Innerhalb von Minuten sollten die abgestorbenen Zellen abschlacken, wenn der Embryo zu heilen beginnt.
- Machen Sie eine kleine Wunde an dem Eigelb in der Nähe des pflanzlichen Pfostens, anstatt das Eigelb zu "hacken" (Abbildung 1 Mittelplatten). Das Eigelb aufwischen, indem man die Eiermembran mit dem montierten Draht nickt. Yolk wird nach der Verwundung für ein paar Minuten ausströmen, und dann wird die Wunde heilen (Abbildung 1 untere Tafeln).
- Wenn das Eigelb aufhört auszulaufen, bewegen Sie den Embryo mit einem Piptier außerhalb der Methylzellulose in der gleichen Schüssel, damit sie sich besser erholen können.
- Wiederholen Sie die Schritte 3.4-3.6 für alle Embryonen. Lassen Sie die Schale 30 Minuten stabil, während sich die Embryonen erholen.
-
Übertragen Sie die Embryonen auf ein neues Teller mit frischem Inhalt 3x Ringer-Lösung und legen Sie sie in 28,5 ° C Inkubator, damit sie sich vollständig erholen können.
- (Optional) Wenn das Stadium des Interesses das frühe Somitstadium ist, können Embryonen bei 20 ° C inkubiert werden, nachdem sie bei 28,5 ° C bis zum Schildstadium inkubiert wurden, um die Zeit für Experimente und Bildgebung anzupassen.
4. Live Imaging of Zebrafish Somitogenesis
- Bereiten Sie 100 ml von 1% Acharose Lösung, indem Sie 1 g Acharose zu 100 ml Eierwasser, Heizen, bis die Acharose vollständig aufgelöst ist. 5-10 min auf eine Temperatur von 62-72 ° C abkühlen lassen.
-
Bereiten Sie ein Reittier für die Bildgebung vor.
NOTE: Dieser Leitfaden wurde für den Einsatz mit einem umgekehrten Weitwefelmikroskop entwickelt.- ~ 15 ml von 1% Ature in eine 100 mm x 15 mm Plastik-Petrischale gießen.
- Setzen Sie eine Dorsal-Mount V1 Schimmelvorlage5 auf den Boden der Petrischale. Halten Sie die Form auf dem Boden mit einem Gewicht, wie 15 ml Rohr mit Wasser.
NOTE: Das ist so, dass die Embryonen so nah wie möglich am Boden der Petrischale sind, wenn sie ein umgekehrtes Mikroskop verwenden. Obwohl die Embryonen seitlich für die Somitabbildung montiert werden, wird hier der Dorsal-Berg V15 verwendet , da er die Embryonen in frühen Somitstadien besser hält. - Abkühlen lassen, bis die Acharose vollständig verfestigt ist. Ca. 30 ml Eierwasser mit 0,01% Trikaine eingießen und die Form vorsichtig entfernen, indem sie mit Zangen vorsichtig ablaufen.
-
Embryonen für die Somitabbildung
- Bereiten Sie 1% Niedrige Schmelzanlage in der Lösung von 3x Ringer (oder Eierwasser) vor und halten Sie sie bei 42 ° C. Warten Sie, bis die Temperatur auf 42 ° C sinkt.
- Unter einem Sektionsmikroskop einen Embryo pro Brunnen platzieren. Pipette etwa 1 μL Low Melting Agarose in der Brunnen, um die Brunnengröße fein an die Größe der einzelnen Embryonen, die in der Größe variieren, vor allem zwischen denen mit und ohne Größe Reduzierung anzupassen.
- Orient sich die Embryonen schnell, bevor die Low Melting Agarose verfestigt wird, so dass die Embryonen ganz seitlich auf die Schale blicken. Nach dem Einbau von Embryonen, vorsichtig legen Sie den Deckungsrutsch in der Acharo-Halterung, um die Embryonen an Ort und Stelle zu halten. Die Orientierung ist für die langfristige Somitabbildung besonders wichtig, da die Embryonen genau seitlich montiert werden müssen, damit alle Somitgrenzen später deutlich abgebildet werden.
- Tauchen Sie vom Montagebereich ab und manipulieren Sie ein 25 mm x 25 mm Deckglas so, dass es 45 Grad von der Ausrichtung des quadratischen Einrückens durch die Form ausgeglichen wird. Schieben Sie den Beisgelaufel über die Form in dieser Richtung, bis jede Ecke von einer anderen Seite der Form ruht.
NOTE: Obwohl dieses Protokoll für ein umgekehrtes Mikroskop ist, ist es immer noch wichtig, ein Deckglas auf die Form zu legen, damit sich die Embryonen nicht bewegen, während sie auf das Mikroskop übertragen werden.
-
Bildgebende Somitbildung
- Das Mikroskop auf 28 ° C in einem Inkubator mit Schaumkernplatten und einem Schrankheizer vorwärmen.
- Legen Sie die Petrischale mit den montierten Embryonen auf das Mikroskop-Stadium. Finden Sie den Embryo in der oberen linken Mitte des agarose Halters mit der unteren Vergrößerung Linse montiert, dann schalten Sie das Ziel auf 10x.
- Einstellung der Bildaufnahme.
NOTE: Diese Anweisung ist für helles Feld. - Finden Sie Bedingungen für die Lichtleistung, Belichtungszeit und Kondensator, so dass die Somitgrenze deutlich sichtbar ist. Mit Hilfe der z-stack-Einstellungen wird die niedrigste und am höchsten gewünschte Bildfläche gesetzt. Stellen Sie das gesamte Zeit-und Zeitintervall ein. Finden Sie und registrieren Sie die xy-Positionen aller Embryonen, die montiert sind, so dass mehrere Embryonen auf einmal abgebildet werden können.
- Messen Sie die Längen von PSM und Somites mit Fidschi16.
5. Bildgebung des Neuralröhrenmustermusterens
- Bereiten Sie 100 ml von 1% Acharose Lösung, indem Sie 1 g Acharose zu 100 ml Eierwasser, Heizen, bis die Acharose vollständig aufgelöst ist. 5-10 min bis 62-72 ° C abkühlen lassen. Dreikain auf 0,01% anbringen.
-
Bereiten Sie eine Rückenlehne für die Bildgebung vor.
Hinweis: Dieser Leitfaden ist für den Einsatz mit einem aufrechten Fluoreszenzmikroskop entwickelt. Für umgekehrte Mikroskope sind Coverslip-Bodengerichte notwendig und die Montageorientierung in Schritt 3 wird gedreht.- In ~ 15 mL von 1% Ature in eine 100 mm x 15 mm Plastik-Petrischale gießen. Schwimmen Sie sanft auf einer Dorsal-Berg-V1-Form auf der Oberfläche des Agros, um Luftblasen zu vermeiden. Abkühlen lassen, bis die Acharose vollständig verfestigt ist.
- Entfernen Sie die Form vorsichtig mit Zangen oder einer Rasierklinge. Die Schüssel mit Eierwasser mit 0,01% Trikaine füllen und bis zum Gebrauch abdecken.
-
Embryonen für die Neuralrohr-Bildgebung.
- Lassen Sie transgene oder injizierte fluoreszierende, fluoreszierende Größentätermischungen und kontrollieren Sie Embryonen bis zum 20-25-Somite-Stadium (ca. 18-22 h nach der Befruchtung). Embryonen, die ein fluoreszierendes Membranezeichen (mem-mCherry, Mem-mBFP1, oder mem-mCitrine)und ein transgener Reporter von Neuralrohrmusternen (nkx2.2:mem-gfp, dbx1b:gfp, oder Olig2:dsred) werden verwendet Für die Bildgebung.
- Ersetzen Sie das Eierwassermedium in der vorbereiteten Rückenhalterung durch eine Lösung für die Arbeit von 0,01%. Sanft Pipette in Embryonen, die in Brunnen der Rückenhalterung eingebildet werden.
- Manipulieren Sie Embryonen in die richtige Ausrichtung, so dass der Kopf in der Halterung nach vorne gerichtet ist und der Schwanz nach hinten zeigt, wobei der Rückenbereich zur Wasseroberfläche hin ausgerichtet ist.
- Orient den Embryo so, dass der Schwanz flach liegt und nicht nach unten nach unten der Schale zeigt. Manchmal ist es hilfreich, den hinteren Teil des Schwanzes auf der Seitenspitze der Halterung gut auszuruhen, um zu verhindern, dass der Schwanz sinkt und versehentlich das Hinterhirn abbildet. Wiederholen Sie für jeden Embryo. Achten Sie bei der Größe reduzierte Embryonen darauf, dass sie nicht tief in die zu abgebildet befindlichen Brunnen fallen.
- Tauchen Sie vom Montagebereich ab und manipulieren Sie ein 25 mm x 25 mm Deckglas so, dass es 45 ° von der Ausrichtung des quadratischen Einrückens der Form ausgeglichen wird. Schieben Sie den Beisgelaufel über die Form in dieser Richtung, bis jede Ecke von einer anderen Seite der Form ruht.
- Das Deckglas langsam drehen, bis es sanft auf den Montagebereich fällt. Überprüfen Sie, ob die Embryonen noch in den richtigen Positionen und Orientierungen montiert sind. Wenn zu viel Bewegung durch das Herunterfallen des Deckglases verursacht wird, entfernen Sie sanft und wiederholen Sie die Montage von Schritt C.
-
Bild in 3-D das sich entwickelnde Rückenmark.
- Transportieren Sie die Schale, die montierte Embryonen enthält, sanft in das konfokale Mikroskop. Für eine langfristige Live-Bildgebung sollten Sie unbedingt ein Inkubationsmikroskop verwenden. Ansonsten sind niedrige Temperaturen erträglich.
- Navigieren Sie unter Lichtfeldbeleuchtung zum Embryo, um das Sichtfeld auf die bevorzugte Anterior-nachträgerische Position zu zentrieren. Um einen detaillierten Vergleich zwischen Embryonen zu ermöglichen, muss diese Position auf jedem Embryo einheitlich sein.
- Stellen Sie die Bildparameter so ein, dass sie das Signal aus den fluoreszierenden Proteinen, die abgebildet werden, anregen und erfassen. Die Parameter können per Auge abgestimmt werden, um ein gewünschtes Bild auf der ersten Probe zu erstellen. Um die Messkonsistenz zu ermöglichen, wenden Sie diese Einstellungen auf alle Embryonen im Datensatz an. Wenn viele z-Stapel benötigt werden, optimieren Sie die Einstellungen für die Geschwindigkeit.
- Mit z-Stack-Einstellungen die niedrigste und am höchsten gewünschte Bildfläche einstellen. Für eine optimale Bildqualität im z-Stapel stellen Sie die z-Auflösung auf die höchste, die für die Blendeneinstellung optimal ist. Gute Bilder können mit 1 μm z-Abstand erzeugt werden.
- Analysieren Sie die Bilddaten mit jeder bevorzugten Methode.
NOTE: In diesem Fall wurde die Analyse mit benutzerdefinierten MATLAB-Skripten durchgeführt, die eine einfache Segmentierung der neuronalen Teile eines Bildes und eine Quantifizierung des Bildsignals ermöglichen.
Ergebnisse
Yolk-Volumenreduktion ist wichtig für normale Morphologie
Wie kürzlich in Almuedo-Castillo et al.17beschrieben, kann die Größenreduzierung von Embryonen erreicht werden, ohne dass das Yolk-Volumen reduziert wird. Zum Vergleich mit und ohne Yolk-Brästeinreduzierung haben wir sowohl zweistufiges Hacken (sowohl Blastula als auch Eigelb) und Blastula-only-Hackerlackieren (Abbildung 2 und SupplementalMovie 1) durchgeführt. Zweistufige gehackte Embryonen zeigten scheinbar normale Gesamtmorphologie im Vergleich zu den Kontrollen (nur Dekorionation) Embryonen, abgesehen von der Größendifferenz, während der Entwicklungsstadien (siehe Ober-und Mitteltafeln in Abbildung 2). Auf der anderen Seite zeigten nur blastula-gehackte Embryonen eine eigentümliche Morphologie, vor allem in früheren Stadien. Während der Epibolie hatten die Embryonen ein verengtes und eingezäuntes Aussehen (siehe untere Platte für 70% Epibolie in Abbildung 2). In der darauffolgenden Somite-Phase wurde festgestellt, dass die Mittelzeilen-Strukturen auf vielen Axialebenen abgeflacht (d.h. die DV-Länge ist relativ kürzer als die ML-Länge) auf vielen Axialebenen (siehe untere Paneele für 8 und 20 Somite in Abbildung 2). In späteren Stadien zeigten die an das Eigelb angrenzenden Körperstrukturen, wie das Mittel-und Hinterhirn, und die ersten ~ 10 Somiten noch eine relativ abgeflachte Form, möglicherweise aufgrund erhöhter Spannung durch das relativ größere Eigelb.
Somite Größe Verringerung der Größe reduziert Embryonen
Somiten sind segmentale Strukturen, die bei der Embryogenese vergänglich erscheinen und Wirbel und Skelettmuskulatur hervorrufen. Aus dem präomitischen Mesoderm (PSM) werden die Somiten von der vorderen bis zur hinteren Richtung periodisch voneinander gebildet (z.B. 25 Minuten für Zebrafische, 2 h für Mäuse) (Abbildung 3 A). Wir haben eine Zeitraffer-Abbildung der Somitbildung sowohl für die Kontrolle als auch für die gehackten Embryonen durchgeführt und die Größe der meisten neu gebildeten Somiten gemessen (Abbildung3B). Sowohl bei den Kontroll-als auch bei den gehackten Embryonen wurden die Größen der Somiten, die sich später gebildet hatten, im Vergleich zu denen früherer Stadien als kleiner. Außerdem hatten gehackte Embryonen während der gesamten Somitbildung kleinere Somiten als die in Kontrollembryonen (Abbildung 3C).
Neuronale Röhrenhöhen werden nach der Größenreduzierung reduziert
Um die Auswirkungen der Embryonengrößenreduzierung auf die Größe des Neuralrohrs zu sehen, haben wir unsere zweistufige Hacktechnik bei Mem-mCherry-injizierten Embryonen durchgeführt und ihre Wirbelsäulenkabel mit 20 hpf mit unserem konfokalen Bildgebungssystem abgebildet (Abbildung 4A, B). In diesem Datensatz wurden die neuronalen Röhrenhöhen nach der Größenreduzierung um 12,4% ± 3,2% reduziert, wie manuell mit dem eigenen Bildanalyse-Code gemessen wurde (Abbildung4C). Zusammengenommen zeigen diese Daten, dass die Größenreduzierung die Höhe der Neuralrohre reduziert. Mit dieser Technik lassen sich die Auswirkungen der Größenreduzierung auf das neuronale Muster messen.
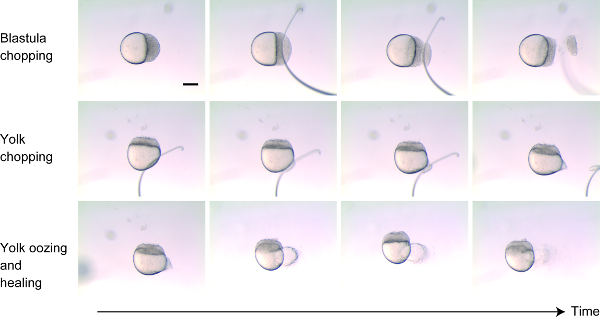
Bild 1 : Größe-Reduktionstechnik. Etwa 30%-40% der Zellen wurden aus dem Tierpol geschnitten (obere Platten). Die Membran, die das Eigelb umgab, wurde sorgfältig verwundet, so dass das Eigelb ausströmt (mittlere Tafeln). In den folgenden Minuten verströmte das Eigelb und dann heilten sich die Wunden an Blastoderm und Eigelb auf (Bodenplatten). Skalierbalken = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
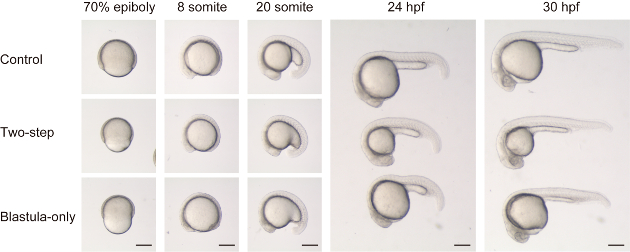
Bild 2 : Vergleich zwischen zwei Methoden der Größenreduzierung. Steuerembryonen (obere Paneele, obere Embryonen für 24 hpf und 30 hpf), Größe reduzierte Embryonen mit zweistufigem Hacken (Blastula und Eigelb, mittlere Paneele, mittlere Embryonen für 24 hpf und 30 hpf) und Größe reduzierte Embryonen mit Blastula-nur Hacken (untere Paneele, untere Embryonen Für 24 hpf und 30 hpf) werden entlang der Entwicklungsstufen verglichen. Beachten Sie, dass bei nur gehackten Embryonen, Blastoderm Volumen ist viel kleiner im Vergleich zu dem Eigelb (bei 70% Epiboly). Dadurch hat der Embryo in Somitstadien eine unverhältnismäßig abgeflacht Form (d.h. die DV-Achse ist im Vergleich zur AP-Achse in Blastula-nur gehackten Embryonen relativ kürzer, im Vergleich zur Kontrolle oder einem zweistufigen gehackten Embryonen). Maßstab ba = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
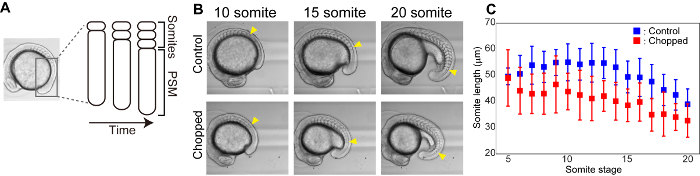
Bild 3 : Größenreduzierung reduziert Die Länge der Somiten. A) Schematische Darstellung der somatischen Bildung. B) Bright Field Bilder von Kontrolle und gehackte Embryonen im Laufe der Zeit. Gelbe Pfeilspitzen zeigen den am meisten geformten Somit in jeder Somitstufe an. (C) Somite length (in anterior-posterior achteriell) Messungen im Laufe der Zeit sowohl für die Kontrolle als auch für die gehackten Embryonen. Fehlerbalken stellen eine Standardabweichung dar. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Bild 4 : Die Größenreduktion reduziert die Höhe des Neuralrohrs. (A-B) Beispielbilder von normal dimensionaler(A) und Größe reduzierter (B) tg- ptch2:kaede) Embryonen, die im Einzelzellstadium mit mem-mCherry mRNA injiziert wurden. Skalierbalken = 20 μm. (C) Neuralrohrhöhen, die aus der manuellen Segmentierung des Neuralrohrs in jedem z-Stapel gewonnen werden. Statistisch signifikante Unterschiede werden in der durchschnittlichen neuronalen Höhe beobachtet, wenn Werte mit einem ungepaarten t-test verglichen werden (p = 0,0397). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Ergänzende Film 1: Vergleich zwischen zweistufigem Hacken und Blastula-Nur-Hacken. Obere Reihe = Kontrollembryonen, mittlere Reihe = Größe reduzierte Embryonen mit zwei Stufen hacken, untere Reihe = Größe reduzierte Embryonen mit Blastula nur hacken. Filme wurden alle 3 Minuten für 12 Stunden genommen. Skalierbalken = 1 mm. (Rechtsklick zum Download.)
Diskussion
In der Vergangenheit wurde bei Wirbeltieren die Größenreduzierung hauptsächlich mit Amphibien-Embryonen durchgeführt, indem die Embryonen in einem Blastula-Stadium 12 entlang der tierisch-vegetalen Achse gekleben. Es gibt jedoch vor allem zwei Unterschiede zwischen Frosch-und Zebrafisch-Embryonen, wenn wir Embryonen beißen. Zunächst befindet sich der Veranstalter in der Phase, in der Zebrafisch-Embryonen tolerant gegen Biskutionspüler werden (Blastula-Bühne), in einem eingeschränkten Bereich des Blastula-Mardes 18,19, 20,21. Da man die Position des Veranstalters nicht von der Morphologie der Embryonen unterscheiden kann, produziert das zufällige Schneiden des Embryos entlang der tierisch-vegetalen Achse dorsalisierte oder ventralisierte Embryonen. Zweitens durchlaufen Zebrafisch-Embryonen im Gegensatz zu Froschembryonen einen Prozess namens Epiboly, bei dem sich Zellen um einen abgetrennten Eigelb in Richtung des pflanzlichen Pols bewegen, bis er vollständig von Zellen umgeben ist. Wenn nur ein Teil des Blastoderms entfernt wird, bleiben weniger Zellen übrig, um ein Eigelb von relativ größerem Volumen zu verschlingen, und als Ergebnis scheint die Morphologie nach der Epibolie beeinflusst zu werden. Deshalb verwenden wir zweistufiges Hacken, bei dem wir Blastulae in der Nähe des Tierpols hacken, um den Veranstalter nicht abzuschneiden, und die Yolk-Membran verwunden, um die Yolk-Größe proportional zur Blastula zu machen.
Neben dem zweistufigen Hacken, fanden wir, dass das Medium, in dem die Größenreduzierung Chirurgie durchgeführt wird, entscheidend für die Wiederherstellung von Embryonen nach der Operation ist. Unter mehreren Medien haben wir versucht (Eierwasser, Eierwasser + Albumin, Danieau-Puffer, L15, L15 + FBS, 1/3x Ringer, 1x Ringer), nur 1/3x Ringer und 1x Ringer ergab hohe Überlebensraten; In anderen Medien gelang es Embryonen nicht, sich von den Wunden zu erholen.
Ein wichtiger Störenfried für eine niedrige Überlebensrate ist der Einsatz gesunder Embryonen aus gesunden und jungen elterlichen Fischen. Wir stellten fest, dass Embryonen von älteren Fischen selbst dann, wenn die Kontrolle nicht verkleinerte, reduzierte Embryonen eine Überlebensrate von fast 100% aufweisen, wenn die Größe reduziert wird, tendenziell eine geringere Überlebensrate aufweisen. Beachten Sie auch, dass die Überlebensrate tendenziell sinkt, wenn die Größenreduktion mit zusätzlichen Störungen kombiniert wird, wie Morpholino-Injektion.
Die hier beschriebene Einfachheit der Größenreduzierungstechnik ermöglicht es den Forschern, diese Technik ohne spezielle Ausrüstung oder intensives Training anzuwenden. Da die Größe reduzierter Embryonen bis zu späteren Entwicklungsstadien kleiner bleiben (sobald sie mit dem Essen beginnen, scheint ihre Größe mit den Kontrollfischen aufzuholen), kann diese Technik angewendet werden, um die Skalierung vieler Gewebe und Organe zu untersuchen. Daher ermöglicht diese Technik es, die Größenreduzierung und die quantitative in vivo live bildgebend zu kombinieren, um Skalierung und Größenkontrolle verschiedener Systeme zu untersuchen.
Offenlegungen
Die Autoren erklären keine konkurrierenden oder finanziellen Interessen.
Danksagungen
Unterstützt wurde die Arbeit durch das PRESTO-Programm der Japan Science and Technology Agency (JPMJPR11AA) und ein National Institutes of Health Granutes (R01GM107733).
Materialien
| Name | Company | Catalog Number | Comments |
| 60 mm PYREX Petri dish | CORNING | 3160-60 | |
| Agarose | affymetrix | 75817 | For making a mount for live imaging |
| Agarose, low gelling temperature Type VII-A | SIGMA-ALDRICH | A0701-25G | |
| CaCl2 | EMD | CX0130-1 | For 1/3 Ringer's solution |
| CaSO4 | For egg water | ||
| Cover slip (25 mm x 25 mm, Thickness 1) | CORNING | 2845-25 | |
| Disposable Spatula | VWR | 80081-188 | |
| Foam board | ELMER'S | 951300 | For microscope incubator |
| Forcept (No 55) | FST | 11255-20 | |
| Glass pipette | VWR | 14673-043 | |
| HEPES | SIGMA Life Science | H4034 | For 1/3 Ringer's solution |
| INCUKIT XL for Cabinet Incubators | INCUBATOR Warehouse.com | For microscope incubator | |
| Instant sea salt | Instant Ocean | 138510 | For egg water |
| KCl | SIGMA-ALDRICH | P4504 | For 1/3 Ringer's solution |
| Methyl cellulose | SIGMA-ALDRICH | M0387-100G | |
| NaCl | SIGMA-ALDRICH | S7653 | For 1/3 Ringer's solution |
| Petri dish | Falcon | 351029 | For making a mount for live imaging |
| Phenol red | SIGMA Life Science | P0290 | |
| Pipette pump | BEL-ART PRODUCTS | F37898 | |
| Pronase | EMD Millipore Corp | 53702-250KU | |
| Tricaine-S (MS222) | WESTERN CHEMICAL INC | NC0135573 | |
| Ultra thin bright annealed 316L dia. 0.035 mm Stainless Steel Weaving Wires | Sandra | The wire we used was obtained ~20 years ago and we could not find exactly the same one. This product has the same material and diameter as the one we use. |
Referenzen
- Cooke, J. Scale of body pattern adjusts to available cell number in amphibian embryos. Nature. 290, 775-778 (1981).
- Driesch, H. Entwicklungsmechanische Studien: I. Der Werthe der beiden ersten Furchungszellen in der Echinogdermenentwicklung. Experimentelle Erzeugung von Theil- und Doppelbildungen. Zeitschrift fur wissenschaftliche Zoologie. , (1892).
- Morgan, T. H. Half embryos and whole embryos from one of the first two blastomeres. Anatomischer Anzeiger. 10, 623-638 (1895).
- Ishimatsu, K., et al. Size-reduced embryos reveal a gradient scaling-based mechanism for zebrafish somite formation. Development. 145, (2018).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods in Molecular Biology. 546, 317-332 (2009).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. Journal of Visualized Experiments. (26), e1217(2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115(2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113(2009).
- Sorlien, E. L., Witucki, M. A., Ogas, J. Efficient Production and Identification of CRISPR/Cas9-generated Gene Knockouts in the Model System Danio rerio. Journal of Visualized Experiments. (138), e56969(2018).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments. (29), e1394(2009).
- Mizuno, T., Shinya, M., Takeda, H. Cell and tissue transplantation in zebrafish embryos. Methods in Molecular Biology. 127, 15-28 (1999).
- Cooke, J. Control of somite number during morphogenesis of a vertebrate, Xenopus laevis. Nature. 254, 196-199 (1975).
- Inomata, H., Shibata, T., Haraguchi, T., Sasai, Y. Scaling of dorsal-ventral patterning by embryo size-dependent degradation of Spemann's organizer signals. Cell. 153, 1296-1311 (2013).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454, 335-339 (2008).
- Lauschke, V. M., Tsiairis, C. D., Francois, P., Aulehla, A. Scaling of embryonic patterning based on phase-gradient encoding. Nature. 493, 101-105 (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signalling. Nature Cell Biology. 20, 1032-1042 (2018).
- Koos, D. S., Ho, R. K. The nieuwkoid gene characterizes and mediates a Nieuwkoop-center-like activity in the zebrafish. Current Biology. 8, 1199-1206 (1998).
- Yamanaka, Y., et al. A novel homeobox gene, dharma, can induce the organizer in a non-cell-autonomous manner. Genes and Development. 12, 2345-2353 (1998).
- Jesuthasan, S., Stahle, U. Dynamic microtubules and specification of the zebrafish embryonic axis. Current Biology. 7, 31-42 (1997).
- Schier, A. F., Talbot, W. S. The zebrafish organizer. Current Opinion in Genetics and Development. 8, 464-471 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten