Method Article
Riduzione delle dimensioni chirurgiche di zebrafish per lo studio della scala del modello embrionale
In questo articolo
Riepilogo
Qui descriviamo un metodo per ridurre le dimensioni degli embrioni di pesce zebra senza interrompere i normali processi di sviluppo. Questa tecnica consente lo studio del ridimensionamento del modello e della robustezza dello sviluppo contro il cambiamento delle dimensioni.
Abstract
Nel processo di sviluppo, gli embrioni mostrano una notevole capacità di abbinare il loro modello corporeo alle loro dimensioni corporee; la loro proporzione corporea è mantenuta anche in embrioni che sono più grandi o più piccoli, entro certi limiti. Anche se questo fenomeno di scalatura ha attirato l'attenzione di oltre un secolo, la comprensione dei meccanismi di base è stata limitata, a causa in parte di una mancanza di descrizione quantitativa delle dinamiche evolutive in embrioni di varie dimensioni. Per superare questa limitazione, abbiamo sviluppato una nuova tecnica per ridurre chirurgicamente le dimensioni degli embrioni di pesce zebra, che hanno grandi vantaggi per l'imaging Live in vivo. Abbiamo dimostrato che dopo una rimozione equilibrata delle cellule e del tuorlo alla fase Blastula in fasi distinte, gli embrioni possono recuperare rapidamente nelle giuste condizioni e svilupparsi in embrioni più piccoli ma altrimenti normali. Poiché questa tecnica non richiede attrezzature speciali, è facilmente adattabile e può essere utilizzata per studiare una vasta gamma di problemi di ridimensionamento, inclusa la robustezza del patterning mediogeno.
Introduzione
Gli scienziati hanno da tempo saputo che gli embrioni hanno una notevole capacità di formare proporzioni corporee costanti, anche se le dimensioni dell'embrione possono variare notevolmente sia in condizioni naturali che sperimentali1,2,3. Nonostante decenni di studi teorici e sperimentali, questa robustezza alla variazione dimensionale, il ridimensionamento definito, e i suoi meccanismi sottostanti rimangono sconosciuti in molti tessuti e organi. Al fine di catturare direttamente le dinamiche del sistema di sviluppo, abbiamo stabilito una tecnica di riduzione delle dimensioni riproducibile e semplice in pesce zebra4, che ha il grande vantaggio in in vivo di imaging Live5.
Zebrafish ha servito come modello di animale vertebrato per studiare diverse discipline della biologia, compresa la biologia dello sviluppo. In particolare, il pesce zebra è ideale per l'imaging Live in vivo6 perché 1) lo sviluppo può procedere normalmente al di fuori della madre e del guscio d'uovo, e 2) gli embrioni sono trasparenti. Inoltre, gli embrioni possono sopportare alcune fluttuazioni di temperatura e ambientali, che permette loro di essere studiati in condizioni di laboratorio. Inoltre, oltre alla perturbazione convenzionale dell'espressione genica per morfolino e l'iniezione di mRNA7,8, i recenti progressi nella tecnologia CRISPR/Cas9 hanno reso la genetica inversa in pesce zebra altamente efficiente9. Inoltre, molte tecniche classiche in embriologia, come il trapianto di cellule o la chirurgia tissutale possono essere applicate4,10,11.
Le tecniche di riduzione delle dimensioni sono state originariamente sviluppate in anfibi e altri animali non vertebrati12. Ad esempio, in Xenopus laevis, un altro modello popolare di animali vertebrati, la bisezione lungo l'asse animale-vegetale allo stadio Blastula può produrre embrioni di dimensioni ridotte12,13. Tuttavia, nelle nostre mani questo approccio in un solo passaggio provoca embrioni dorsalizzati o ventralizzati nel pesce zebra, presumibilmente perché i determinanti dorsali sono distribuiti in modo non uniforme e non si può conoscere la loro localizzazione dalla morfologia degli embrioni. Qui si dimostra un'alternativa tecnica di taglio a due fasi per il pesce zebra che produce embrioni normalmente in via di sviluppo ma più piccoli. Con questa tecnica, le cellule vengono prima rimosse dal palo animale, una regione di cellule ingenue prive di attività dell'organizzatore. Per bilanciare la quantità di tuorlo e cellule, che è importante per epiboly e successiva morfologenesi, il tuorlo viene quindi rimosso. Qui, dettagliamo questo protocollo e forniamo due esempi di invarianza dimensionale nella formazione del modello; la formazione di somite e il patterning del tubo neurale ventrale. In combinazione con l'imaging quantitativo, abbiamo utilizzato la tecnica di riduzione delle dimensioni per esaminare il modo in cui le dimensioni dei somiti e del tubo neurale sono influenzate in embrioni ridotti.
Protocollo
Tutte le procedure relative ai pesci sono state effettuate con l'approvazione del Comitato istituzionale per la cura e l'uso degli animali (IACUC) presso la Harvard Medical School.
1. preparazione degli utensili e dei reagenti
-
Fare un anello di filo per tagliare gli embrioni
- Prendere 20 cm di filo di acciaio inossidabile che è rigido e non corrosivo con un diametro di 40 μm. Loop il filo attraverso in vetro capillare (1,0 mm diametro esterno, 0,5 mm diametro interno, senza filamento), facendo un piccolo anello in alto (lunghezza del loop è 1,0 mm)
- Mettere una piccola goccia di smalto trasparente sulla punta del capillare di vetro tra il loop del filo per tenerlo in posizione. Lasciate asciugare. Assicurarsi di non ottenere alcun smalto sulla porzione di loop, in quanto potrebbe danneggiare gli embrioni.
- Attaccare il capillare di vetro con il loop su una bacchetta di legno (9 "bacchette monouso di bambù rotte a metà) utilizzando il nastro di laboratorio. Lasciare circa 2,5 cm del capillare di vetro che si estende oltre il bastone, in modo che la parte di bacchetta dell'utensile non immergere nell'acqua. Regolare questa lunghezza in preferenza.
-
In alternativa, fare un ago di vetro per tagliare gli embrioni
- Pizzicare un'estremità del vetro pipetta Pasteur con pinze, tenendo l'altro lato con una mano. Riscaldare la parte sottile della pipetta su una lampada a spirito o un bruciatore Bunsen.
- Tirare a mano la pipetta di vetro. La pipetta ideale come diametro di circa 30 μm e una curva delicata (raggio di curvatura = circa 5 mm). Il diametro e la curvatura corretti si ottengono con la pratica e una certa possibilità.
-
Preparazione di metilcellulosa
- Il metilcellulosa è usato per tenere gli embrioni durante il taglio. Fare 2% soluzione di metilcellulosa in 1/3x soluzione di Ringer (116 mM NaCl, 2,9 mM KCl, 1,8 mM CaCl2, e 5 mm 4-(2-idrossietil) -1-piperazineethanesulfonic acid (HEPES; pH 7,2)). Agitare la polvere di metilcellulosa in 1/3x Ringer soluzione a 4 ° c durante la notte.
- Facoltativamente, aggiungere ~ 1,5 mL di fenolo rosso (0,5% in soluzione di stock di DPBS) a 10 mL 2% di soluzione di metilcellulosa, fino a rosso, per rendere la soluzione visibile. Agitare fino a quando il colore diventa uniforme.
2. preparazione di embrioni di zebrafish per la riduzione delle dimensioni chirurgiche
-
Raccogli embrioni
- Mettere uno o due maschi e una o due femmine di pesce zebra in una camera di accoppiamento riempita con molta acqua. Separare maschi e femmine utilizzando un divisorio in plastica. Utilizzare la linea AB per l'imaging di somite (sezione 4) e una linea reporter transgenica di patterning di tubi neurali (NKX 2.2: MEM-GFP, dbx1b: GFPo Olig2: DsRed) per l'imaging di tubi neurali. Lasciateli nella camera durante la notte.
Nota: La scelta degli adulti è importante per ottenere le uova che sopravvivono bene chirurgia. Tipicamente, giovani femmine sane producono uova sane. - La mattina successiva, trasferire la camera in acqua bassa e posizionare la camera con lieve inclinazione. Rimuovere il divisore in modo che il pesce possa accoppiarsi.
- Raccogli le uova versando in un colino da tè. Trasferire le uova in una capsula di Petri con acqua di uovo (per 20x acqua di uovo, 6 g di sale marino istantaneo, 1,5 g CaSO4 e 1 L H2O; usare a 1x). Per una migliore messa in scena, Raccogli le uova subito dopo la deposizione. Collocare gli embrioni in un incubatore a 28,5 ° c.
- Se necessario, iniettare morpholino, mRNA, ecc., a 1 – 4 stadi cellulari a seguito di un protocollo comune7,8. Iniettare mRNA per l'etichetta a membrana fluorescente (MEM-mCherry, MEM-mBFP1, o MEM-mcitrine) per l'imaging del tubo neurale (sezione 5).
- Mettere uno o due maschi e una o due femmine di pesce zebra in una camera di accoppiamento riempita con molta acqua. Separare maschi e femmine utilizzando un divisorio in plastica. Utilizzare la linea AB per l'imaging di somite (sezione 4) e una linea reporter transgenica di patterning di tubi neurali (NKX 2.2: MEM-GFP, dbx1b: GFPo Olig2: DsRed) per l'imaging di tubi neurali. Lasciateli nella camera durante la notte.
-
Dechorionate con Pronasi
- Intorno alla fase 128-Cell a 256 cellule, trasferire embrioni sani in un piatto di vetro da 35 mm riempito con acqua di uovo. Rimuovere il più possibile l'acqua di uovo dal piatto.
- Aggiungere 1 mL di 20 mg/mL di pronasi. Agitare delicatamente gli embrioni spostando la piastra e pipettare delicatamente la soluzione su e giù per aiutare la dechorionation con una pipetta di vetro.
- Quando le Corioni iniziano a perdere elasticità (di solito 1-4 minuti dopo l'aggiunta di pronasi, a seconda della quantità di uova e acqua), aggiungere quanta più acqua di uovo possibile per diluire la pronasi. Valutare la perdita di elasticità toccando delicatamente il corion con pinze; il corion dovrebbe tenere l'ammaccatura senza rimbalzare immediatamente indietro. Trasferire le uova ad un altro piatto con acqua di uovo utilizzando una pipetta di vetro (a questo punto, la maggior parte delle Corioni non sono rotte).
- In alternativa, versare delicatamente gli embrioni dal piatto in un grande bicchiere di vetro da 400 mL riempito con acqua di uovo senza esporre gli embrioni all'aria. Quindi, lasciate che gli embrioni si depositano completamente. Inclinare il becher per far cadere gli embrioni da un lato. Raccogliere questi embrioni utilizzando una pipetta di vetro e trasferire in un nuovo piatto di vetro 35 mm riempito con 1/3x soluzione di Ringer.
- Attendere alcuni minuti fino a quando la maggior parte delle Corioni perdono completamente l'elasticità. Rimuovere le restanti Corioni dagli embrioni, pipettando delicatamente le uova. Rimuovere gli embrioni danneggiati e incubare gli embrioni in un incubatore a 28,5 ° c.
3. riduzione e recupero delle dimensioni chirurgiche
- Preparare un piatto di vetro pulito 35 mm. Diffondere circa 0,5 mL di 2% di metilcellulosa (in 1/3x soluzione di Ringer, con fenolo rosso per aiutare a visualizzare) vicino al centro del fondo del piatto più grande utilizzando una spatola di plastica. Distribuire in modo sottile e uniforme la metilcellulosa ad uno spessore di circa 0,5 mm.
- Versare circa 30 mL di soluzione 1/3x Ringer al lato del piatto e permettere di diffondersi sul resto del piatto, coprendo la cellulosa di metile.
- Collocare gli embrioni dechorionati allo stadio 256-Cell-1K-Cell su 2% metilcellulosa. Regolare l'orientamento degli embrioni sul lato per visualizzare sia le cellule che il tuorlo. (Figura 1)
- Tritare approssimativamente il 30%-40% delle cellule dal blastodermo vicino al palo animale tagliando perpendicolarmente all'asse animale-vegetale utilizzando l'anello di filo (o l'ago di vetro) (Figura 1, pannelli superiori). Dopo aver rimosso le cellule, toccare delicatamente le estremità insieme per aiutare le restanti cellule bastone indietro. In pochi minuti, le cellule morte dovrebbero Slough quando l'embrione comincia a guarire.
- Fare una piccola ferita al tuorlo vicino al palo vegetale invece di "tagliare" il tuorlo (Figura 1 pannelli centrali). Ferire il tuorlo inserendo la membrana dell'uovo con il filo montato. Il tuorlo si rifluirà per pochi minuti dopo aver ferito, e la ferita guarirà (Figura 1 pannelli inferiori).
- Quando il tuorlo smette di uscire, spostare l'embrione usando un Pipet al di fuori della metilcellulosa nello stesso piatto per permettere loro di recuperare meglio.
- Ripetere i passaggi 3.4-3.6 per tutti gli embrioni. Lasciare il piatto stabile per 30 minuti mentre gli embrioni si riprendono.
-
Trasferire gli embrioni in un nuovo piatto con la soluzione 1/3x Ringer fresca e metterli in incubatore 28,5 ° c per consentire loro di recuperare completamente.
- Opzionale Se lo stadio di interesse è la fase precoce della somite, gli embrioni possono essere incubati a 20 ° c dopo essere stati incubati a 28,5 ° c fino allo stadio dello scudo, per regolare i tempi di sperimentazione e Imaging.
4. immagini dal vivo della Somitogenesi zebrafish
- Preparare 100 ml di soluzione di agarosio all'1% aggiungendo 1 g di agarosio a 100 ml di acqua di uovo, riscaldando fino a quando l'agarosio è completamente disciolta. Lasciar raffreddare per 5-10 minuti a una temperatura di 62-72 ° c.
-
Prepara un supporto per l'imaging.
Nota: questa guida è stata sviluppata per essere utilizzata con un microscopio ad ampio campo invertito.- Versare ~ 15 mL di 1% di agarosio in una piastra di Petri in plastica 100 mm x 15 mm.
- Posizionare delicatamente un modello di stampo5 dorsal Mount V1 sul fondo della capsula di Petri. Tenere lo stampo sul fondo utilizzando un peso, come ad esempio 15 mL tubo con acqua.
Nota: Questo è così che gli embrioni sono il più vicino possibile al fondo della capsula di Petri, quando si utilizza un microscopio invertito. Anche se gli embrioni sono montati lateralmente per la somite Imaging, qui dorsal Mount V15 viene utilizzato in quanto tiene gli embrioni meglio a stadi di somite precoce. - Lasciate raffreddare fino a quando l'agarosio è completamente solidificato. Versare in ~ 30 mL di acqua di uovo con 0,01% tricaina, e rimuovere con cautela la muffa da indiscreti delicatamente con pinze.
-
Montare embrioni per immagini somite
- Preparare 1% di agarosio a bassa fusione in 1/3x soluzione di Ringer (o acqua dell'uovo) e tenerlo a 42 ° c. Attendere che la temperatura scende a 42 ° c.
- Sotto un microscopio di dissezione, posizionare un embrione per pozzetto. Pipettare circa 1 μL di agarosio a bassa fusione nel pozzo per regolare finemente le dimensioni del pozzo alle dimensioni dei singoli embrioni che variano in dimensioni, soprattutto tra quelli con e senza riduzione delle dimensioni.
- Orientare rapidamente gli embrioni prima che l'agarosio a bassa fusione sia solidificato in modo che gli embrioni si faccia completamente lateralmente al piatto. Dopo aver montato gli embrioni, posizionare delicatamente il coperchio scivolare nel supporto di agarosio per tenere gli embrioni in posizione. L'orientamento è particolarmente importante per l'imaging a lungo termine della somite perché gli embrioni devono essere montati esattamente lateralmente per tutti i confini somiti per essere chiaramente iminvecchiati in fasi successive.
- Immergere lontano dalla zona di montaggio e manipolare un vetro di copertura di 25 mm x 25 mm in modo che sia 45 gradi offset dall'orientamento del rientro quadrato realizzato dallo stampo. Far scorrere il vetrino coprioggetti sopra lo stampo in questo orientamento fino a quando ogni angolo riposa su un lato diverso dello stampo.
Nota: Anche se questo protocollo è per un microscopio invertito, l'inserimento di un vetro di copertura sulla parte superiore dello stampo è ancora importante in modo che gli embrioni non si muovano durante il trasferimento al microscopio.
-
Imaging processo di formazione di somite
- Preriscaldare il microscopio a 28 ° c in un incubatore costruito con tavole FOAMCORE e un riscaldatore dell'armadio.
- Collocare la capsula di Petri con gli embrioni montati sullo stadio del microscopio. Trova l'embrione montato nel pozzo in alto a sinistra del supporto di agarosio con lente di ingrandimento inferiore, quindi passa l'obiettivo a 10x.
- Impostare l'acquisizione delle immagini.
Nota: Questa istruzione è per campo luminoso. - Trova le condizioni per la potenza della luce, il tempo di esposizione e il condensatore in modo che il contorno della somite possa essere visto chiaramente. Utilizzando le impostazioni z-stack impostare il piano di imaging più basso e più alto desiderato. Impostare il tempo totale e l'intervallo di tempo. Trovare e registrare le posizioni XY di tutti gli embrioni montati in modo che più embrioni possono essere timelapse iminvecchiati contemporaneamente.
- Misurare le lunghezze di PSM e somiti utilizzando Fiji16.
5. Imaging del patterning del tubo neurale
- Preparare 100 ml di soluzione di agarosio all'1% aggiungendo 1 g di agarosio a 100 ml di acqua di uovo, riscaldando fino a quando l'agarosio è completamente disciolta. Lasciar raffreddare per 5-10 minuti a 62-72 ° c. Regolare la tricaina a 0,01%.
-
Preparare un supporto dorsale per l'imaging.
Nota: questa guida è sviluppata per essere utilizzata con un microscopio a fluorescenza verticale. Per i microscopi invertiti coprioggetto piatti fondo sono necessari e l'orientamento di montaggio nel passaggio 3 è capovolto.- Versare in ~ 15 mL di 1% di agarosio in una piastra di Petri in plastica 100 mm x 15 mm. Galleggiare delicatamente uno stampo dorsal Mount V1 sulla superficie dell'agarosio per evitare di introdurre bolle d'aria. Lasciate raffreddare fino a quando l'agarosio è completamente solidificato.
- Rimuovere con cautela lo stampo con pinze o una lama di rasoio. Riempire il piatto con acqua di uovo con 0,01% tricaina e coprire fino all'uso.
-
Monta embrioni per l'imaging di tubi neurali.
- Consente di sviluppare embrioni transgenici o iniettati di dimensioni fluorescenti ridotte e di controllo fino allo stadio di 20-25 somite (approssimativamente 18-22 h dopo la fecondazione). Gli embrioni che esprimono un'etichetta a membrana fluorescente (MEM-mCherry, MEM-mBFP1, o MEM-mcitrine) e un reporter transgenico di patterning di tubi neurali (NKX 2.2: MEM-GFP, dbx1b: GFP, o Olig2: DsRed) vengono utilizzati per l'imaging.
- Sostituire il mezzo dell'acqua dell'uovo in un supporto dorsale preparato con la soluzione di lavoro tricaina 0,01%. Pipettare delicatamente gli embrioni da impartire ai pozzetti del supporto dorsale.
- Manipolare gli embrioni nell'orientamento corretto in modo che la testa sia rivolta in avanti nel supporto e la coda sia rivolta verso la parte posteriore con la porzione dorsale rivolta verso la superficie dell'acqua.
- Orientare l'embrione in modo che la coda sia sdraiata piatta e non rivolta verso il basso verso il fondo del piatto. A volte è utile riposare la porzione posteriore della coda sulla sporgenza laterale del pozzo di montaggio per evitare che la coda si affondi e inavvertitamente immaginando il cervello posteriore. Ripeti per ogni embrione. Assicurarsi con dimensioni ridotte embrioni che non cadono profondamente nei pozzi da impartire.
- Immergere lontano dalla zona di montaggio e manipolare un vetro di copertura di 25 mm x 25 mm in modo che sia 45 ° offset dall'orientamento del rientro quadrato realizzato dallo stampo. Far scorrere il vetrino coprioggetti sopra lo stampo in questo orientamento fino a quando ogni angolo riposa su un lato diverso dello stampo.
- Ruotare lentamente il vetro di copertura fino a quando non cade delicatamente sulla zona di montaggio. Verificare che gli embrioni siano ancora montati nelle corrette posizioni e orientamenti. Se un movimento eccessivo è causato dalla caduta del vetro di copertura, rimuovere delicatamente e ripetere il montaggio dal punto C.
-
Immagine in 3-D il midollo spinale in via di sviluppo.
- Trasportare delicatamente il piatto contenente embrioni montati al microscopio confocale. Per l'imaging Live a lungo termine, accertarsi di utilizzare un microscopio incubato. In caso contrario, le basse temperature sono tollerabili.
- Sotto l'illuminazione di campo chiaro, passare all'embrione per immagine e centrare il campo visivo sulla posizione anteriore-posteriore preferita. Per consentire un confronto dettagliato tra gli embrioni, questa posizione su ciascun embrione deve essere coerente.
- Impostare i parametri di imaging per eccitare e catturare il segnale dalle proteine fluorescenti che vengono imitate. I parametri possono essere sintonizzati con occhio per creare un'immagine desiderata sul campione iniziale. Per abilitare la coerenza delle misurazioni, applicare queste impostazioni a tutti gli embrioni del DataSet. Se sono necessari molti stack z ottimizzare le impostazioni per la velocità.
- Utilizzando le impostazioni z-stack, impostare il piano di imaging più basso e più alto desiderato. Per una qualità ottimale dell'immagine nello stack z, impostate la risoluzione z su quella più alta che sia ottimale per l'impostazione del diaframma. Le buone immagini possono essere generate con una spaziatura z di 1 μm.
- Analizzare i dati di imaging con qualsiasi metodo preferito.
Nota: In questo caso, l'analisi è stata eseguita con script MATLAB personalizzati che consentono una semplice segmentazione delle porzioni neurali di un'immagine e la quantificazione del segnale di imaging.
Risultati
La riduzione del volume di tuorlo è importante per la morfologia normale
Come recentemente descritto in Almuedo-Castillo et al.17, la riduzione delle dimensioni degli embrioni può essere ottenuta senza ridurre il volume del tuorlo. Per confrontare con e senza riduzione del volume di tuorlo, abbiamo eseguito sia il taglio a due fasi (sia Blastula e tuorlo) che la Blastula-solo taglio (Figura 2 e film supplementare 1). Embrioni tritati in due fasi hanno mostrato una morfologia complessiva apparentemente normale rispetto al controllo (solo dechorionation) embrioni, diversi dalla differenza di dimensione, durante le fasi di sviluppo (Vedi Pannelli superiore e centrale in Figura 2). Dall'altro lato, gli embrioni triturati di Blastula mostravano una morfologia peculiare, soprattutto nelle fasi precedenti. Durante l'epibolia, gli embrioni avevano un aspetto ristretto e rientrato (vedere Pannello inferiore per 70% epiboly in Figura 2). Nella fase somica seguente, le strutture linea mediana sono state trovate appiattite (cioè la lunghezza DV è relativamente più corta della lunghezza ml) a molti livelli assiali (vedere pannelli inferiori per 8 e 20 somite in Figura 2). Nelle fasi successive, le strutture del corpo adiacenti al tuorlo, come la metà e il cervello posteriore, e i primi ~ 10 somiti, mostravano ancora una forma relativamente appiattita, probabilmente a causa di una maggiore tensione dal tuorlo relativamente più grande.
Riduzione delle dimensioni della somite negli embrioni ridotti
I somiti sono strutture segmentali che compaiono transitoriamente durante l'embriogenesi e danno origine a vertebre e muscolo scheletrico. Dal mesodermo presomitico (PSM), i somiti sono formati uno ad uno dalla direzione anteriore a quella posteriore in modo periodico (ad esempio 25 minuti per il pesce zebra, 2 h per i topi) (Figura 3a). Abbiamo eseguito l'imaging time lapse della formazione di somite sia per il controllo che per gli embrioni tritati e misurato la dimensione dei somiti più recentemente formati (Figura 3B). In entrambi gli embrioni di controllo e triturati, le dimensioni dei somiti che si sono formate in fasi successive sono risultate più piccole rispetto a quelle delle fasi precedenti. Inoltre, durante le fasi di formazione della somite, gli embrioni tritati avevano somiti più piccoli di quelli degli embrioni di controllo (Figura 3C).
Le altezze dei tubi neurali sono ridotte dopo riduzione delle dimensioni
Per vedere l'effetto della riduzione delle dimensioni dell'embrione sulle dimensioni del tubo neurale, abbiamo eseguito la nostra tecnica di taglio in due fasi su embrioni iniettati MEM-mCherry e hanno immagine le loro corde spinali a 20 HPF utilizzando il nostro sistema di imaging confocale (Figura 4a, B). In questo DataSet, le altezze dei tubi neurali sono state ridotte dopo la riduzione delle dimensioni del 12,4% ± 3,2%, come misurato manualmente utilizzando il codice di analisi immagine personalizzato (Figura 4C). Presi insieme, questi dati mostrano che la riduzione delle dimensioni riduce l'altezza del tubo neurale. Questa tecnica può essere utilizzata per misurare gli effetti della riduzione delle dimensioni sul patterning neurale.
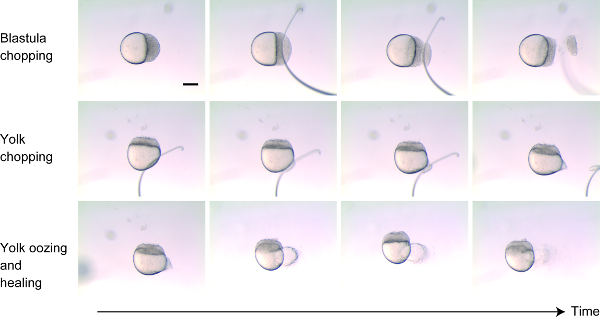
Figura 1 : Tecnica di riduzione delle taglie. Circa il 30%-40% delle cellule sono stati tagliati dal palo animale (pannelli superiori). La membrana che circonda il tuorlo è stata accuratamente ferita in modo che il tuorlo traeva (pannelli centrali). Per i pochi minuti successivi, il tuorlo si è lizzato e poi le ferite su entrambi i blastodermi e il tuorlo guarirono (pannelli inferiori). Barra di scala = 200 μm. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
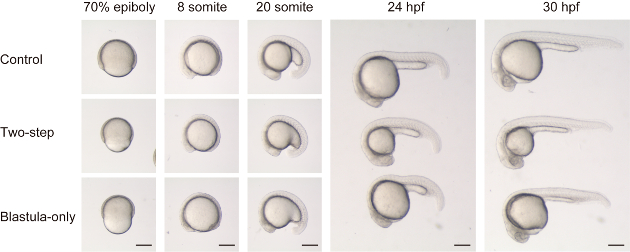
Figura 2 : Confronto tra due metodi di riduzione delle dimensioni. Embrioni di controllo (pannelli superiori, embrioni superiori per 24 HPF e 30 HPF), dimensioni ridotte di embrioni con taglio a due fasi (Blastula e tuorlo, pannelli medi, embrioni medi per 24 HPF e 30 HPF) e dimensioni ridotte di embrioni con taglio solo Blastula (pannelli inferiori, embrioni inferiori per 24 HPF e 30 HPF) vengono confrontati lungo le fasi evolutive. Si noti che in Blastula-solo embrioni tritati, il volume di blastoderma è molto più piccolo rispetto al tuorlo (a 70% epiboly). Di conseguenza, l'embrione ha una forma sproporzionatamente appiattita a stadi somiti (cioè, l'asse DV è relativamente più breve rispetto all'asse AP in embrioni triturati solo in Blastula, rispetto al controllo o a uno tritato a due fasi). Scala BA = 200 μm. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
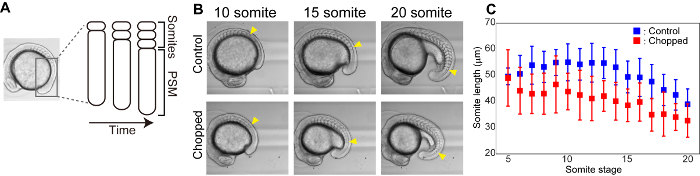
Figura 3 : La riduzione delle dimensioni riduce la lunghezza dei somiti. A) illustrazione schematica della formazione di somite. (B) campo luminoso immagini di controllo e di embrioni triturati nel tempo. Le punte di freccia gialle indicano la somite più recente formata in ogni fase della somite. C) misurazioni della lunghezza della somite (in asse anteriore-posteriore) nel tempo sia per il controllo che per gli embrioni tritati. Le barre di errore rappresentano la deviazione standard. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 4 : La riduzione delle dimensioni riduce l'altezza del tubo neurale. (A-B) Immagini di esempio delle dimensioni normali (A) e ridotte (B) TG (ptch2: Kaede) embrioni che sono stati iniettati nella fase a singola cellula con mRNA MEM-mCherry. Barra di scala = 20 μm. (C) altezze del tubo neurale estratte dalla segmentazione manuale del tubo neurale in ogni pila z. Differenze statisticamente significative sono osservate in media altezza neurale quando i valori vengono confrontati utilizzando un t-test non accoppiato (p = 0,0397). Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Filmato supplementare 1: confronto tra il taglio in due fasi contro la Blastula-solo taglio. Riga superiore = embrioni di controllo, riga centrale = dimensioni ridotte embrioni con due fasi di taglio, riga inferiore = dimensioni ridotte embrioni con Blastula solo taglio. I film sono stati presi ogni 3 min per 12 h. barra di scala = 1 mm. fare clic qui per visualizzare questo video. (Fare clic con il pulsante destro del mouse per scaricarlo).
Discussione
Storicamente, tra gli animali vertebrati, la riduzione delle dimensioni è stata eseguita principalmente utilizzando embrioni anfibi, bisettrice gli embrioni lungo l'asse animale-vegetale in una Blastula fase12. Tuttavia, ci sono principalmente due differenze tra gli embrioni di rana e di pesce zebra quando si dividere gli embrioni. In primo luogo, nella fase in cui gli embrioni di pesce zebra diventano tolleranti di bisettrice (stadio Blastula), l'organizzatore si trova in una zona ristretta di Blastula margin18,19,20,21. Perché non si può dire la posizione dell'organizzatore dalla morfologia degli embrioni, tagliando casualmente l'embrione lungo l'asse animale-vegetale produce embrioni dorsalizzati o ventralizzati. In secondo luogo, a differenza degli embrioni di rana, gli embrioni di pesce zebra attraversano un processo chiamato epiboly, dove le cellule si muovono verso il palo vegetale intorno a un tuorlo separato fino a quando non è completamente circondata da cellule. Se viene rimossa solo una porzione di blastoderma, rimangono meno cellule per inghiottire un tuorlo di volume relativamente più grande e, di conseguenza, la morfologia appare influenzata dopo l'epibolia. Pertanto, impieghiamo il taglio in due fasi in cui tagliamo le blastule vicino al palo animale, per evitare di tagliare l'Organizzatore e ferire la membrana tuorlo, per rendere la dimensione del tuorlo proporzionale alla Blastula.
Oltre al taglio in due fasi, abbiamo trovato il mezzo in cui viene eseguita la chirurgia di riduzione delle dimensioni è fondamentale per il recupero di embrioni dopo l'intervento chirurgico. Tra diversi media che abbiamo provato (acqua di uovo, acqua uovo + albumina, buffer Danieau, L15, L15 + FBS, 1/3x Ringer, 1x Ringer), solo 1/3x Ringer e 1x Ringer ha prodotto alti tassi di sopravvivenza; in altri media, gli embrioni non sono riusciti a riprendersi dalle ferite.
Un importante suggerimento per la risoluzione dei problemi per un basso tasso di sopravvivenza consiste nell'utilizzare embrioni sani provenienti da pesci genitori sani e giovani. Abbiamo notato che anche quando gli embrioni di controllo non di dimensioni ridotte mostrano quasi il 100% del tasso di sopravvivenza, quando la dimensione è ridotta, gli embrioni provenienti da pesci più anziani tendono a mostrare un tasso di sopravvivenza inferiore. Inoltre, si noti che il tasso di sopravvivenza tende a diminuire quando la riduzione delle dimensioni è combinata con ulteriori perturbazioni, come l'iniezione di morfolino.
La semplicità della tecnica di riduzione delle dimensioni qui descritta consente ai ricercatori di applicare questa tecnica senza attrezzature specializzate o allenamento intensivo. Inoltre, poiché la dimensione ridotta embrioni rimangono più piccoli fino a fasi successive di sviluppo (una volta che iniziano a mangiare, la loro dimensione sembra recuperare il ritardo con il pesce di controllo), questa tecnica può essere applicata per lo studio di scala di molti tessuti e organi. Pertanto, questa tecnica consente di combinare la riduzione delle dimensioni e l'imaging Live quantitativo in vivo per studiare il ridimensionamento e il controllo delle dimensioni di vari sistemi.
Divulgazioni
Gli autori non dichiarano alcun interesse concorrente o finanziario.
Riconoscimenti
Il lavoro è stato sostenuto dal programma PRESTO dell'Agenzia giapponese per la scienza e la tecnologia (JPMJPR11AA) e da un Istituto nazionale di salute (R01GM107733).
Materiali
| Name | Company | Catalog Number | Comments |
| 60 mm PYREX Petri dish | CORNING | 3160-60 | |
| Agarose | affymetrix | 75817 | For making a mount for live imaging |
| Agarose, low gelling temperature Type VII-A | SIGMA-ALDRICH | A0701-25G | |
| CaCl2 | EMD | CX0130-1 | For 1/3 Ringer's solution |
| CaSO4 | For egg water | ||
| Cover slip (25 mm x 25 mm, Thickness 1) | CORNING | 2845-25 | |
| Disposable Spatula | VWR | 80081-188 | |
| Foam board | ELMER'S | 951300 | For microscope incubator |
| Forcept (No 55) | FST | 11255-20 | |
| Glass pipette | VWR | 14673-043 | |
| HEPES | SIGMA Life Science | H4034 | For 1/3 Ringer's solution |
| INCUKIT XL for Cabinet Incubators | INCUBATOR Warehouse.com | For microscope incubator | |
| Instant sea salt | Instant Ocean | 138510 | For egg water |
| KCl | SIGMA-ALDRICH | P4504 | For 1/3 Ringer's solution |
| Methyl cellulose | SIGMA-ALDRICH | M0387-100G | |
| NaCl | SIGMA-ALDRICH | S7653 | For 1/3 Ringer's solution |
| Petri dish | Falcon | 351029 | For making a mount for live imaging |
| Phenol red | SIGMA Life Science | P0290 | |
| Pipette pump | BEL-ART PRODUCTS | F37898 | |
| Pronase | EMD Millipore Corp | 53702-250KU | |
| Tricaine-S (MS222) | WESTERN CHEMICAL INC | NC0135573 | |
| Ultra thin bright annealed 316L dia. 0.035 mm Stainless Steel Weaving Wires | Sandra | The wire we used was obtained ~20 years ago and we could not find exactly the same one. This product has the same material and diameter as the one we use. |
Riferimenti
- Cooke, J. Scale of body pattern adjusts to available cell number in amphibian embryos. Nature. 290, 775-778 (1981).
- Driesch, H. Entwicklungsmechanische Studien: I. Der Werthe der beiden ersten Furchungszellen in der Echinogdermenentwicklung. Experimentelle Erzeugung von Theil- und Doppelbildungen. Zeitschrift fur wissenschaftliche Zoologie. , (1892).
- Morgan, T. H. Half embryos and whole embryos from one of the first two blastomeres. Anatomischer Anzeiger. 10, 623-638 (1895).
- Ishimatsu, K., et al. Size-reduced embryos reveal a gradient scaling-based mechanism for zebrafish somite formation. Development. 145, (2018).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods in Molecular Biology. 546, 317-332 (2009).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. Journal of Visualized Experiments. (26), e1217 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Sorlien, E. L., Witucki, M. A., Ogas, J. Efficient Production and Identification of CRISPR/Cas9-generated Gene Knockouts in the Model System Danio rerio. Journal of Visualized Experiments. (138), e56969 (2018).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments. (29), e1394 (2009).
- Mizuno, T., Shinya, M., Takeda, H. Cell and tissue transplantation in zebrafish embryos. Methods in Molecular Biology. 127, 15-28 (1999).
- Cooke, J. Control of somite number during morphogenesis of a vertebrate, Xenopus laevis. Nature. 254, 196-199 (1975).
- Inomata, H., Shibata, T., Haraguchi, T., Sasai, Y. Scaling of dorsal-ventral patterning by embryo size-dependent degradation of Spemann's organizer signals. Cell. 153, 1296-1311 (2013).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454, 335-339 (2008).
- Lauschke, V. M., Tsiairis, C. D., Francois, P., Aulehla, A. Scaling of embryonic patterning based on phase-gradient encoding. Nature. 493, 101-105 (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signalling. Nature Cell Biology. 20, 1032-1042 (2018).
- Koos, D. S., Ho, R. K. The nieuwkoid gene characterizes and mediates a Nieuwkoop-center-like activity in the zebrafish. Current Biology. 8, 1199-1206 (1998).
- Yamanaka, Y., et al. A novel homeobox gene, dharma, can induce the organizer in a non-cell-autonomous manner. Genes and Development. 12, 2345-2353 (1998).
- Jesuthasan, S., Stahle, U. Dynamic microtubules and specification of the zebrafish embryonic axis. Current Biology. 7, 31-42 (1997).
- Schier, A. F., Talbot, W. S. The zebrafish organizer. Current Opinion in Genetics and Development. 8, 464-471 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon