Method Article
Reducción de tamaño quirúrgico del pez cebra para el estudio de la escala de patrón embrionario
En este artículo
Resumen
Aquí describimos un método para reducir el tamaño de los embriones de pez cebra sin interrumpir los procesos normales de desarrollo. Esta técnica permite el estudio de la escala del patrón y la robustez del desarrollo contra el cambio de tamaño.
Resumen
En el proceso de desarrollo, los embriones exhiben una notable capacidad para igualar su patrón corporal con su tamaño corporal; su proporción corporal se mantiene incluso en embriones que son más grandes o más pequeños, dentro de ciertos límites. Aunque este fenómeno de escala ha atraído la atención durante más de un siglo, la comprensión de los mecanismos subyacentes ha sido limitada, debido en parte a la falta de una descripción cuantitativa de la dinámica del desarrollo en embriones de tamaños variados. Para superar esta limitación, desarrollamos una nueva técnica para reducir quirúrgicamente el tamaño de los embriones de pez cebra, que tienen grandes ventajas para la imagen en vivo in vivo. Demostramos que después de la eliminación equilibrada de las células y la yema en la fase blástula en pasos separados, los embriones pueden recuperarse rápidamente bajo las condiciones adecuadas y convertirse en embriones más pequeños pero de otro modo normales. Dado que esta técnica no requiere equipo especial, es fácilmente adaptable y se puede utilizar para estudiar una amplia gama de problemas de escalado, incluida la robustez de los patrones mediada por morfogeno.
Introducción
Los científicos han sabido desde hace tiempo que los embriones tienen una capacidad notable para formar proporciones corporales constantes, aunque el tamaño del embrión puede variar grandemente tanto en condiciones naturales como experimentales1,2,3. A pesar de décadas de estudios teóricos y experimentales, esta robustez a la variación de tamaño, denominada escalado, y sus mecanismos subyacentes siguen siendo desconocidos en muchos tejidos y órganos. Con el fin de captar directamente la dinámica del sistema en desarrollo, establecimos una técnica de reducción de tamaño reproducible y simple en el pez cebra4, que tiene la gran ventaja de la imagen en vivo in vivo5.
El pez cebra ha servido como un animal vertebrado modelo para estudiar múltiples disciplinas de la biología, incluyendo la biología del desarrollo. En particular, el pez cebra es ideal para imágenes en vivo in vivo6 porque 1) el desarrollo puede proceder normalmente fuera de la madre y la cáscara de huevo, y 2) los embriones son transparentes. Además, los embriones pueden soportar algunas fluctuaciones de temperatura y ambientales, lo que les permite ser estudiados en condiciones de laboratorio. También, además de la perturbación convencional de la expresión génica por morfolinos y mRNA injection7,8, los avances recientes en la tecnología CRISPR/Cas9 han hecho que la genética inversa en el pez cebra altamente eficiente9. Además, muchas técnicas clásicas en la embriología, como el trasplante de células o la cirugía de tejidos se pueden aplicar4,10,11.
Las técnicas de reducción de tamaño se desarrollaron originalmente en anfibios y otros animales no vertebrados12. Por ejemplo, en Xenopus laevis, otro modelo animal de vertebrado popular, la bisección a lo largo del eje animal-vegetal en blástula Stage puede producir embriones reducidos de tamaño12,13. Sin embargo, en nuestras manos este enfoque de un solo paso da lugar a embriones dorsalizados o ventralizados en el pez cebra, presumiblemente porque los determinantes dorsales se distribuyen de manera desigual y uno no puede conocer su localización de la morfología de los embriones. Aquí demostramos una técnica alternativa de troceo de dos pasos para el pez cebra que produce embriones normalmente en desarrollo pero más pequeños. Con esta técnica, las células se eliminan por primera vez del polo animal, una región de células ingenuas que carecen de actividad organizadora. Para equilibrar la cantidad de yemas y células, que es importante para la morfogénesis epibolia y posterior, la yema se retira. Aquí, detallamos este protocolo y proporcionamos dos ejemplos de invarianza de tamaño en la formación de patrones; formación de somita y patrón de tubo neural ventral. En combinación con la imagen cuantitativa, utilizamos la técnica de reducción de tamaño para examinar el modo en que los tamaños de las somitas y el tubo neural se ven afectados por el tamaño de los embriones reducidos.
Protocolo
Todos los procedimientos relacionados con el pescado se llevaron a cabo con la aprobación del Comité institucional de atención y uso de animales (IACUC) en la escuela de medicina de Harvard.
1. preparación de herramientas y reactivos
-
Haga un lazo de alambre para picar los embriones
- Tomar 20 cm de alambre de acero inoxidable rígido y no corrosivo con un diámetro de 40 μm. Conecte el alambre a través del capilar de vidrio (diámetro exterior de 1,0 mm, diámetro interior de 0,5 mm, sin filamento), haciendo un pequeño lazo en la parte superior (longitud del lazo es de 1,0 mm)
- Poner una pequeña gota de esmalte de uñas transparente en la punta del capilar de vidrio entre el lazo de alambre para sostenlo en su lugar. Deja secar. Asegúrese de no conseguir ningún esmalte de uñas en la porción del lazo, ya que puede dañar los embriones.
- Fije el capilar de vidrio con el lazo sobre un palillo de madera (palillos desechables de bambú de 9 "rotos por la mitad) usando cinta de laboratorio. Dejar unos 2,5 cm del capilar de vidrio extendiéndose más allá del palillo, para que la parte del palillo de la herramienta no se sumerja en el agua. Ajuste esta longitud a la preferencia.
-
Alternativamente, haga una aguja de vidrio para picar los embriones
- Pellizque un extremo de la pile Pasteur de vidrio con fórceps, mientras sujeta el otro lado con una mano. Calentar la parte delgada de la Piera sobre una lámpara de espiritu o quemador de Bunsen.
- Tire la Piera de vidrio a mano. La Piera ideal como un diámetro de aproximadamente 30 μm y una curva suave (radio de curvatura = aproximadamente 5 mm). El diámetro y la curvatura apropiados se obtienen con la práctica y alguna posibilidad.
-
Preparar metilcelulosa
- La celulosa de metilo se utiliza para sostener los embriones durante el picado. Hacer 2% solución de metilcelulosa en 1/3x solución de Ringer (116 mM NaCl, 2,9 mM KCl, 1,8 mM CaCl2, y 5 mm 4-(2-hidroxietil) -1-piperazineethanesulfonic acid (HEPES; pH 7,2)). Agitar polvo de metilcelulosa en 1/3x solución de Ringer a 4 ° c durante la noche.
- Opcionalmente, añada ~ 1,5 mL de fenol rojo (0,5% en la solución en stock de DPBS) a 10 mL de solución de metilcelulosa al 2%, hasta que esté roja, para que la solución sea visible. Agitar hasta que el color se vuelve uniforme.
2. preparación de embriones de pez cebra para la reducción quirúrgica del tamaño
-
Recoger los embriones
- Coloque uno o dos machos y uno o dos peces cebra hembra en una cámara de apareamiento llena de mucha agua. Separe los machos y las hembras usando un divisor de plástico. Utilice la línea AB para la toma de imágenes por somita (sección 4) y una línea reportera transgénica de patrones de tubos neuronales (NKX 2.2: MEM-GFP, dbx1b: GFPo Olig2: DsRED) para la creación de imágenes de tubo neural. Déjalos en la cámara durante la noche.
Nota: La elección de los adultos es importante para la obtención de óvulos que sobreviven bien la cirugía. Típicamente, las hembras jóvenes sanas producen óvulos sanos. - A la mañana siguiente, transfiera la cámara a aguas poco profundas y coloque la cámara con ligera inclinación. Retire el divisor para que el pez pueda aparearse.
- Recoja los huevos vertiendo en un colador de té. Transferir los huevos a una placa de Petri con agua de huevo (para agua de huevo de 20x, 6 g de sal marina instantánea, 1,5 g CaSO4 y 1 L H2O; usar en 1x). Para una mejor puesta en escena, recoja los huevos justo después del desove. Colocar los embriones en una incubadora de 28,5 ° c.
- Si es necesario, inyecte morpholino, mRNA, etc., a 1 – 4 etapas celulares siguiendo un protocolo común7,8. Inyectar mRNA para la etiqueta de membrana fluorescente (MEM-mCherry, MEM-mBFP1, o MEM-mcitrine) para la toma de imágenes del tubo neural (sección 5).
- Coloque uno o dos machos y uno o dos peces cebra hembra en una cámara de apareamiento llena de mucha agua. Separe los machos y las hembras usando un divisor de plástico. Utilice la línea AB para la toma de imágenes por somita (sección 4) y una línea reportera transgénica de patrones de tubos neuronales (NKX 2.2: MEM-GFP, dbx1b: GFPo Olig2: DsRED) para la creación de imágenes de tubo neural. Déjalos en la cámara durante la noche.
-
El dechorionate usando pronasa
- Alrededor de la etapa de 128 células a 256 células, transfiera embriones sanos a un plato de vidrio de 35 mm lleno de agua de huevo. Retire la mayor cantidad de agua de huevo posible del plato.
- Añadir 1 mL de pronasa de 20 mg/mL. Agitar suavemente los embriones moviendo la placa y pipetear suavemente la solución hacia arriba y hacia abajo para ayudar a la dechorionación usando una Piera de vidrio.
- Cuando las coriones empiezan a perder elasticidad (por lo general 1-4 min después de la adición de pronasa, dependiendo de la cantidad de huevos y agua), añadir tanto agua de huevo como sea posible para diluir pronasa. Evalúe la pérdida de elasticidad tocando suavemente el corión con fórceps; el corión debe sostener la abolladura sin rebotando inmediatamente. Transfiera los huevos a otro plato con agua de huevo usando una Piera de vidrio (en este punto, la mayoría de las coriones no están rotas).
- Alternativamente, vierta suavemente los embriones del plato en un vaso grande de vidrio de 400 mL lleno de agua de huevo sin exponer los embriones al aire. A continuación, deje que los embriones se asientan completamente. Incline el vaso de precipitados para que los embriones caigan a un lado. Recoja estos embriones usando una Piera de vidrio y transfiérese a un nuevo plato de vidrio de 35 mm relleno con la solución de 1/3x Ringer.
- Espere varios minutos hasta que la mayoría de las coriones pierdan la elasticidad por completo. Retire los choriones restantes de los embriones, pipeteando suavemente los huevos. Retirar los embriones dañados e incubar los embriones en una incubadora de 28,5 ° c.
3. reducción de tamaño quirúrgico y recuperación
- Prepare un plato de vidrio limpio de 35 mm. Extender aproximadamente 0,5 mL de 2% de celulosa de metilo (en 1/3x Ringer solución, con fenol rojo para ayudar a visualizar) cerca del centro de la parte inferior del plato más grande usando una espátula de plástico. Finamente y uniformemente esparcir la celulosa de metilo a un espesor de aproximadamente 0,5 mm.
- Vierta aproximadamente 30 mL de solución de 1/3x Ringer al costado del plato y permita que se extienda sobre el resto del plato, cubriendo la celulosa de metilo.
- Colocar embriones dechorionados en la fase de células 256-1K-Cell sobre 2% de celulosa de metilo. Ajuste la orientación de los embriones en el costado para visualizar tanto las células como la yema. (Figura 1)
- Picar aproximadamente un 30%-40% de las células del blastodermo cerca del polo animal cortando perpendiculares al eje animal-vegetal utilizando el lazo de alambre (o la aguja de vidrio) (figura 1, paneles superiores). Después de retirar las células, golpee suavemente los extremos juntos para ayudar a que las células restantes se adhieran hacia atrás. En cuestión de minutos, las células muertas deben quitarse cuando el embrión comienza a sanar.
- Hacer una pequeña herida en la yema cerca del polo vegetal en lugar de "cortar" la yema (figura 1 paneles del medio). Enrollar la yema de huevo con el alambre montado. La yema se suple durante unos pocos minutos después de la herida, y luego se curará (figura 1 paneles inferiores).
- Cuando la yema deje de rebrozar, mueva el embrión usando un Pipet fuera de la celulosa de metilo en el mismo plato para permitirles recuperarse mejor.
- Repita los pasos 3.4-3.6 para todos los embriones. Dejar el plato estable durante 30 min mientras los embriones se recuperan.
-
Transfiera los embriones a un nuevo plato con la solución fresca de 1/3x Ringer y Póntelos en una incubadora de 28,5 ° c para que se recuperen por completo.
- Opcional Si la etapa de interés es la etapa de somita temprana, los embriones pueden ser incubados a 20 ° c después de ser incubados a 28,5 ° c hasta la etapa del escudo, para ajustar el tiempo para la experimentación y la imagen.
4. imágenes en vivo de la Somitogénesis del pez cebra
- Preparar 100 mL de solución de agarosa al 1% añadiendo 1 g de agarosa a 100 mL de agua de huevo, calentando hasta que la agarosa se disuelva por completo. Deje enfriar durante 5-10 min a una temperatura de 62-72 ° c.
-
Prepare un soporte para la toma de imágenes.
Nota: esta guía fue desarrollada para su uso con un microscopio de campo ancho invertido.- Verter ~ 15 ml de agarosa al 1% en una placa de Petri de plástico de 100 mm x 15 mm.
- Coloque suavemente una plantilla de molde de montaje dorsal v15 en la parte inferior de la placa de Petri. Mantenga el molde en la parte inferior utilizando un peso, como un tubo de 15 mL con agua.
Nota: Esto es así que los embriones están tan cerca del fondo de la placa de Petri como sea posible, cuando se utiliza un microscopio invertido. Aunque los embriones se montan lateralmente para la toma de imágenes de somita, aquí se utiliza el montaje dorsal v15 , ya que mantiene los embriones mejor en las etapas tempranas de somita. - Dejar enfriar hasta que la agarosa esté completamente solidificada. Vierta en ~ 30 mL de agua de huevo con 0,01% de tricaína, y retire con cuidado el moho con una suave poda con fórceps.
-
Monte los embriones para imágenes de somita
- Prepare un 1% de Agarose de baja fusión en la solución de 1/3x Ringer (o agua de huevo) y Manténlo a 42 ° c. Espere hasta que la temperatura baje a 42 ° c.
- En un microscopio de disección, coloca un embrión por pozo. Pipetear aproximadamente 1 μL de Agarose de baja fusión en el pozo para ajustar finamente el tamaño del pozo al tamaño de los embriones individuales que varían en tamaño, especialmente entre aquellos con y sin reducción de tamaño.
- Orientar rápidamente los embriones antes de solidificar la agarosa de baja fusión para que los embriones se enfrían completamente lateralmente al plato. Después de montar los embriones, Coloque suavemente el resguardo de la cubierta en el soporte de agarosa para sostener los embriones en su lugar. La orientación es particularmente importante para la toma de imágenes de somita a largo plazo, ya que los embriones deben montarse exactamente lateralmente para que todos los límites de las somitas sean claramente fotografiados en etapas posteriores.
- Sumergir lejos del área de montaje y manipular un vidrio de cubierta de 25 mm x 25 mm de forma que sea 45 grados offset desde la orientación de la sangría cuadrada hecha por el molde. Deslice el Coberto sobre el molde en esta orientación hasta que cada esquina esté descansando de un lado diferente del molde.
Nota: Aunque este protocolo es para un microscopio invertido, la colocación de un vaso de cubierta en la parte superior del molde sigue siendo importante para que los embriones no se muevan mientras se transfieren al microscopio.
-
Proceso de formación de somita por imágenes
- Precalente el microscopio a 28 ° c en una incubadora construida con placas de foamcore y un calentador de gabinete.
- Colocar la placa de Petri con los embriones montados en la etapa del microscopio. Encuentra el embrión montado en el pozo superior izquierdo del soporte de agarosa con lente de aumento inferior, luego cambia el objetivo a 10X.
- Configure la adquisición de imágenes.
Nota: Esta instrucción es para campo brillante. - Encuentre las condiciones para la potencia de luz, el tiempo de exposición y el condensador para que el límite de somita se pueda ver claramente. El uso de la configuración z-Stack establece el plano de imagen más bajo y más alto deseado. Establezca el intervalo de tiempo y hora total. Encuentre y registre las posiciones XY de todos los embriones montados para que múltiples embriones puedan ser imágenes timelapse a la vez.
- Mida las longitudes de PSM y somitas utilizando Fiji16.
5. imagen del patrón de tubo neural
- Preparar 100 mL de solución de agarosa al 1% añadiendo 1 g de agarosa a 100 mL de agua de huevo, calentando hasta que la agarosa se disuelva por completo. Deje enfriar por 5-10 min a 62-72 ° c. Ajuste la tricaína al 0,01%.
-
Prepare un soporte dorsal para la toma de imágenes.
Nota: esta guía está desarrollada para su uso con un microscopio de fluorescencia vertical. Para microscopios invertidos, los platos de fondo son necesarios y la orientación de montaje en el paso 3 se invierte.- Verter en ~ 15 ml de agarosa al 1% en una placa de Petri de plástico de 100 mm x 15 mm. Flotar suavemente un molde dorsal de montaje V1 en la superficie de la agarosa para evitar la introducción de burbujas de aire. Dejar enfriar hasta que la agarosa esté completamente solidificada.
- Retire con cuidado el molde con fórceps o una cuchilla de afeitar. Llene el plato con agua de huevo con 0,01% de Tricaine y cubra hasta su uso.
-
Monte los embriones para la imagen del tubo neural.
- Permitir el tamaño fluorescente transgénico o inyectado-reducido y controlar los embriones para desarrollarse hasta la etapa de somita 20-25 (aproximadamente 18-22 h después de la fertilización). Se utilizan embriones que expresan una etiqueta de membrana fluorescente (MEM-mCherry, MEM-mBFP1o MEM-mcitrine) y un reportero transgénico de patrones de tubos neuronales (NKX 2.2: MEM-GFP, dbx1b: GFPo Olig2: DsRED) para la toma de imágenes.
- Reemplace el medio de agua de huevo en montura dorsal preparada con una solución de trabajo de 0,01% de Tricaine. Pipetear suavemente los embriones para ser fotografiados en los pozos de la montura dorsal.
- Manipular los embriones en la orientación correcta de tal manera que la cabeza esté orientada hacia adelante en el soporte y la cola apunte hacia la parte posterior con la porción dorsal orientada hacia la superficie del agua.
- Orientar el embrión de tal forma que la cola se encuentra plana y no apunta hacia abajo hacia la parte inferior del plato. A veces es útil para descansar la porción posterior de la cola en la repisa lateral del pozo de montaje para evitar que la cola se hunda y accidentalmente la imagen del cerebro posterior. Repita para cada embrión. Asegúrese con los embriones reducidos de tamaño que no caigan profundamente en los pozos para ser fotografiados.
- Sumergir lejos del área de montaje y manipular un vidrio de cubierta de 25 mm x 25 mm de forma que sea de 45 ° offset desde la orientación de la sangría cuadrada hecha por el molde. Deslice el Coberto sobre el molde en esta orientación hasta que cada esquina esté descansando de un lado diferente del molde.
- Gire lentamente la cobertura hasta que caiga suavemente sobre el área de montaje. Compruebe que los embriones sigan montados en las posiciones y orientaciones correctas. Si el exceso de movimiento es causado por la caída de la Coverglass, retire suavemente y repita el montaje del paso C.
-
Imagen en 3-D la médula espinal en desarrollo.
- Transportar suavemente el plato que contiene los embriones montados al microscopio confocal. Para imágenes en vivo a largo plazo, asegúrese de usar un microscopio incubado. De lo contrario, las bajas temperaturas son tolerables.
- Bajo la iluminación de campo claro, navegue hasta el embrión para ver la imagen y centrar el campo de visión en la posición anterior-posterior preferida. Para permitir una comparación detallada entre los embriones, esta posición en cada embrión debe ser consistente.
- Establezca los parámetros de imagen para excitar y capturar la señal de las proteínas fluorescentes que se están imaged. Los parámetros se pueden ajustar con el ojo para crear una imagen deseada en la muestra inicial. Para habilitar la coherencia de la medición, aplique esta configuración a todos los embriones del DataSet. Si se requieren muchas pilas z, optimice la configuración de la velocidad.
- Con la configuración de la pila z, establezca el plano de imagen más bajo y más alto deseado. Para obtener una calidad de imagen óptima en la pila z, establezca la resolución z en la más alta que sea óptima para el ajuste de abertura. Las buenas imágenes se pueden generar con un espaciado z de 1 μm.
- Analice los datos de imágenes por cualquier método preferido.
Nota: En este caso, el análisis se realizó con scripts de MATLAB personalizados que permiten la segmentación simple de las porciones neuronales de una imagen y la cuantificación de la señal de imagen.
Resultados
La reducción del volumen de Yolk es importante para la morfología normal
Como se ha descrito recientemente en Almuedo-Castillo et al.17, la reducción del tamaño de los embriones puede lograrse sin reducir el volumen de la yema. Para comparar con y sin la reducción del volumen de la yema, realizamos tanto el picado de dos pasos (tanto blástula como yema) y el picado de blástula (figura 2 y película complementaria 1). Los embriones cortados en dos etapas mostraron una morfología general aparentemente normal en comparación con los embriones de control (sólo dechorionation), aparte de la diferencia de tamaño, a lo largo de las etapas de desarrollo (ver paneles superiores y medios en la figura 2). Por otro lado, los embriones picados sólo Blastula mostraron una morfología peculiar, especialmente en etapas anteriores. Durante la epibolia, los embriones tenían una apariencia restringida y indentada (ver panel inferior para 70% epiboly en la figura 2). En la siguiente etapa de somita, se descubrió que las estructuras de la línea media eran aplanadas (es decir, la longitud de DV es relativamente más corta que la longitud de ML) a muchos niveles axiales (ver paneles inferiores para 8 y 20 somita en la figura 2). En etapas posteriores, las estructuras del cuerpo adyacentes a la yema, como el cerebro medio y el trasero, y las primeras ~ 10 somitas, todavía mostraban una forma relativamente aplanada, posiblemente debido al aumento de la tensión de la yema relativamente más grande.
Reducción de tamaño de somita en tamaño reducido de embriones
Las somitas son estructuras segmentales que aparecen de manera transitoria durante la embriogénesis y dan lugar a vértebras y músculo esquelético. Desde el mesodermo presomitic (PSM), las somitas se forman una por una desde la dirección anterior a la posterior de manera periódica (por ejemplo, 25 min para pez cebra, 2 h para ratones) (figura 3a). Realizamos imágenes de lapso de tiempo de formación de somitas tanto para el control como para los embriones cortados y midieron el tamaño de la mayoría de las somitas recién formadas (figura 3B). Tanto en el control como en los embriones cortados, se descubrió que los tamaños de somitas que se formaron en etapas posteriores eran más pequeños en comparación con los de las etapas anteriores. Además, a lo largo de las etapas de formación de somita, los embriones cortados tenían somitas más pequeñas que las de los embriones de control (figura 3C).
Las alturas del tubo neural se reducen tras reducir el tamaño
Para ver el efecto de la reducción del tamaño del embrión en el tamaño del tubo neural, realizamos nuestra técnica de troceado de dos pasos en embriones inyectados por MEM-mCherry y le imaginamos sus cuerdas espinales A 20 HPF usando nuestro sistema de imágenes confocales (figura 4A, B). En este conjunto de datos, se redujeron las alturas del tubo neural tras la reducción del tamaño en un 12,4% ± 3,2%, medido manualmente utilizando el código de análisis de imagen personalizado (figura 4C). Tomados en conjunto, estos datos muestran que la reducción de tamaño reduce la altura del tubo neural. Esta técnica se puede utilizar para medir los efectos de la reducción de tamaño en los patrones neuronales.
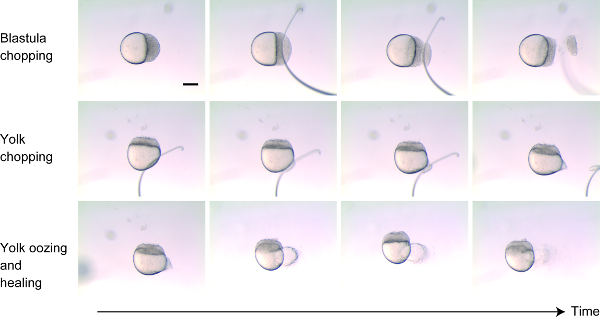
Figura 1 : Técnica de reducción de tamaño. Aproximadamente el 30%-40% de las células fueron cortadas del polo animal (paneles superiores). La membrana que rodea la yema fue cuidadosamente herida para que la yema se rezume (paneles medios). Durante los siguientes pocos minutos, la yema se exalía y luego las heridas en el blastodermo y la yema se curaron (paneles inferiores). Barra de escala = 200 μm. Por favor, haga clic aquí para ver una versión más grande de esta figura.
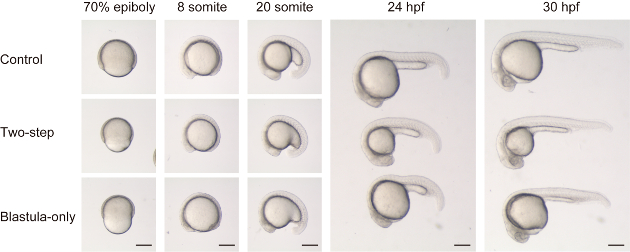
Figura 2 : Comparación entre dos métodos de reducción de tamaño. Los embriones de control (paneles superiores, embriones superiores para 24 HPF y 30 HPF), tamaño reducido embriones con picado de dos pasos (Blastula y yema, paneles medios, embriones medios para 24 HPF y 30 HPF) y tamaño reducido embriones con Blastula-sólo cortar (paneles inferiores, embriones inferiores para 24 HPF y 30 HPF) se comparan a lo largo de las etapas de desarrollo. Tenga en cuenta que en los embriones picados sólo Blastula, el volumen de Blastoderm es mucho menor en comparación con la yema (70% epibolia). Como resultado, el embrión tiene una forma desproporcionadamente aplanada en las etapas de somita (es decir, el eje DV es relativamente más corto en comparación con el eje AP en embriones picados sólo Blastula, en comparación con el control o un dos pasos picado uno). Escala BA = 200 μm. Por favor, haga clic aquí para ver una versión más grande de esta figura.
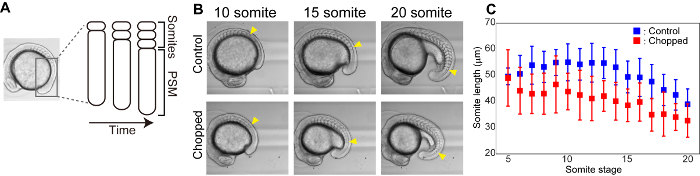
Figura 3 : La reducción de tamaño reduce la longitud de las somitas. (A) Ilustración esquemática de la formación de somitas. (B) campo brillante imágenes de control y embriones cortados a lo largo del tiempo. Las puntas de flecha amarillas indican el somita más recién formado en cada etapa de somita. (C) mediciones de la longitud del somita (en el eje anterior-posterior) a lo largo del tiempo tanto para el control como para los embriones cortados. Las barras de error representan la desviación estándar. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : La reducción de tamaño reduce la altura del tubo neural. (A-B) Imágenes de ejemplo de embriones de tamaño normal (A) y talla reducida (B) TG (ptch2: Kaede) que fueron inyectados en la etapa de célula única con MEM-mcherry mRNA. Barra de escala = 20 μm. (C) las alturas del tubo neural extraídas de la segmentación manual del tubo neural en cada pila z. Las diferencias estadísticamente significativas se observan en la altura media neuronal cuando los valores se comparan utilizando una prueba t no emparejada (p = 0,0397). Por favor, haga clic aquí para ver una versión más grande de esta figura.

Película complementaria 1: comparación entre el picado de dos pasos y el picado de blastula. Fila superior = embriones de control, fila media = tamaño reducido de embriones con dos pasos de picado, fila inferior = tamaño reducido de embriones con blástula solo picado. Las películas se tomaron cada 3 minutos para 12 h. barra de escala = 1 mm. por favor, haga clic aquí para ver este video. (Haga clic con el botón derecho para descargar.)
Discusión
Históricamente, entre los animales vertebrados, la reducción de tamaño se ha realizado principalmente utilizando embriones de anfibios, mediante la bisección de los embriones a lo largo del eje animal-vegetal en una etapa de blástula12. Sin embargo, existen principalmente dos diferencias entre los embriones de rana y pez cebra cuando biseccionamos embriones. En primer lugar, en la etapa en que los embriones de pez cebra se vuelven tolerantes de bisección (blástula Stage), el organizador se encuentra en una zona restringida de blástula margin18,19,20,21. Debido a que uno no puede decir la posición del organizador de la morfología de los embriones, cortar aleatoriamente el embrión a lo largo del eje animal-vegetal produce embriones dorsalizados o ventralizados. En segundo lugar, a diferencia de los embriones de rana, los embriones de pez cebra pasan por un proceso llamado epibolia, donde las células se mueven hacia el polo vegetal alrededor de una yema separada hasta que está completamente rodeada de células. Si sólo se retira una porción de blastodermo, quedan menos células para engullir una yema de volumen relativamente mayor, y como resultado, la morfología aparece afectada después de la epibolia. Por lo tanto, empleamos el picado de dos pasos en el que cortamos blastulae cerca del polo animal, para evitar cortar el organizador, y enrollamos la membrana de la yema, para hacer que el tamaño de la yema sea proporcional a la Blastula.
Además del picado de dos pasos, encontramos que el medio en el que se realiza la cirugía de reducción de tamaño es crítico para la recuperación de embriones después de la cirugía. Entre varios medios que probamos (agua de huevo, agua de huevo + albúmina, tampón Danieau, L15, L15 + FBS, 1/3x Ringer, 1x Ringer), sólo 1/3x Ringer y 1x Ringer produjo altas tasas de supervivencia; en otros medios, los embriones no pudieron recuperarse de las heridas.
Un importante Consejo de solución de problemas para la baja tasa de supervivencia es utilizar embriones sanos de peces parentales sanos y jóvenes. Señalamos que incluso cuando los embriones de control no reducido de tamaño muestran casi el 100% de la tasa de supervivencia, cuando el tamaño se reduce, los embriones de peces mayores tienden a mostrar una tasa de supervivencia más baja. Además, tenga en cuenta que la tasa de supervivencia tiende a disminuir cuando la reducción de tamaño se combina con perturbaciones adicionales, como la inyección de morfolino.
La simplicidad de la técnica de reducción de tamaño descrita aquí permite a los investigadores aplicar esta técnica sin equipo especializado o entrenamiento intensivo. Además, dado que el tamaño reducido de los embriones sigue siendo menor hasta las últimas etapas de desarrollo (una vez que empiezan a comer, su tamaño parece ponerse al día con el pez control), esta técnica se puede aplicar para estudiar la escala de muchos tejidos y órganos. Por lo tanto, esta técnica permite combinar la reducción de tamaño y la imagen en vivo cuantitativa in vivo para estudiar el escalado y el control del tamaño de varios sistemas.
Divulgaciones
Los autores no declaran ningún interés financiero o competidor.
Agradecimientos
El trabajo fue apoyado por el programa PRESTO de la Agencia de ciencia y tecnología de Japón (JPMJPR11AA) y una subvención de los institutos nacionales de salud (R01GM107733).
Materiales
| Name | Company | Catalog Number | Comments |
| 60 mm PYREX Petri dish | CORNING | 3160-60 | |
| Agarose | affymetrix | 75817 | For making a mount for live imaging |
| Agarose, low gelling temperature Type VII-A | SIGMA-ALDRICH | A0701-25G | |
| CaCl2 | EMD | CX0130-1 | For 1/3 Ringer's solution |
| CaSO4 | For egg water | ||
| Cover slip (25 mm x 25 mm, Thickness 1) | CORNING | 2845-25 | |
| Disposable Spatula | VWR | 80081-188 | |
| Foam board | ELMER'S | 951300 | For microscope incubator |
| Forcept (No 55) | FST | 11255-20 | |
| Glass pipette | VWR | 14673-043 | |
| HEPES | SIGMA Life Science | H4034 | For 1/3 Ringer's solution |
| INCUKIT XL for Cabinet Incubators | INCUBATOR Warehouse.com | For microscope incubator | |
| Instant sea salt | Instant Ocean | 138510 | For egg water |
| KCl | SIGMA-ALDRICH | P4504 | For 1/3 Ringer's solution |
| Methyl cellulose | SIGMA-ALDRICH | M0387-100G | |
| NaCl | SIGMA-ALDRICH | S7653 | For 1/3 Ringer's solution |
| Petri dish | Falcon | 351029 | For making a mount for live imaging |
| Phenol red | SIGMA Life Science | P0290 | |
| Pipette pump | BEL-ART PRODUCTS | F37898 | |
| Pronase | EMD Millipore Corp | 53702-250KU | |
| Tricaine-S (MS222) | WESTERN CHEMICAL INC | NC0135573 | |
| Ultra thin bright annealed 316L dia. 0.035 mm Stainless Steel Weaving Wires | Sandra | The wire we used was obtained ~20 years ago and we could not find exactly the same one. This product has the same material and diameter as the one we use. |
Referencias
- Cooke, J. Scale of body pattern adjusts to available cell number in amphibian embryos. Nature. 290, 775-778 (1981).
- Driesch, H. Entwicklungsmechanische Studien: I. Der Werthe der beiden ersten Furchungszellen in der Echinogdermenentwicklung. Experimentelle Erzeugung von Theil- und Doppelbildungen. Zeitschrift fur wissenschaftliche Zoologie. , (1892).
- Morgan, T. H. Half embryos and whole embryos from one of the first two blastomeres. Anatomischer Anzeiger. 10, 623-638 (1895).
- Ishimatsu, K., et al. Size-reduced embryos reveal a gradient scaling-based mechanism for zebrafish somite formation. Development. 145, (2018).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods in Molecular Biology. 546, 317-332 (2009).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. Journal of Visualized Experiments. (26), e1217(2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115(2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113(2009).
- Sorlien, E. L., Witucki, M. A., Ogas, J. Efficient Production and Identification of CRISPR/Cas9-generated Gene Knockouts in the Model System Danio rerio. Journal of Visualized Experiments. (138), e56969(2018).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments. (29), e1394(2009).
- Mizuno, T., Shinya, M., Takeda, H. Cell and tissue transplantation in zebrafish embryos. Methods in Molecular Biology. 127, 15-28 (1999).
- Cooke, J. Control of somite number during morphogenesis of a vertebrate, Xenopus laevis. Nature. 254, 196-199 (1975).
- Inomata, H., Shibata, T., Haraguchi, T., Sasai, Y. Scaling of dorsal-ventral patterning by embryo size-dependent degradation of Spemann's organizer signals. Cell. 153, 1296-1311 (2013).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454, 335-339 (2008).
- Lauschke, V. M., Tsiairis, C. D., Francois, P., Aulehla, A. Scaling of embryonic patterning based on phase-gradient encoding. Nature. 493, 101-105 (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signalling. Nature Cell Biology. 20, 1032-1042 (2018).
- Koos, D. S., Ho, R. K. The nieuwkoid gene characterizes and mediates a Nieuwkoop-center-like activity in the zebrafish. Current Biology. 8, 1199-1206 (1998).
- Yamanaka, Y., et al. A novel homeobox gene, dharma, can induce the organizer in a non-cell-autonomous manner. Genes and Development. 12, 2345-2353 (1998).
- Jesuthasan, S., Stahle, U. Dynamic microtubules and specification of the zebrafish embryonic axis. Current Biology. 7, 31-42 (1997).
- Schier, A. F., Talbot, W. S. The zebrafish organizer. Current Opinion in Genetics and Development. 8, 464-471 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados