Method Article
落射蛍光マウント全体を用いたマウス胚発生中に心臓商工会議所発展の分析
要約
心室固有 MLC 2 v tdTomato レポーター ノックアウトのマウスから解剖マウス胚全体のマウント epifluorescent 顕微鏡を用いたマウス心臓の開発を検討するプロトコルを提案します。このメソッドでは、心室形成労働集約的な組織化学的方法なしマウス心臓の発達過程の各段階を直接可視化することが出来ます。
要約
このプロトコルの目的は、マウス胚の郭清とマウス萌芽期の心室の部屋心室固有蛍光レポーター ノックイン マウス (MLC 2 v tdTomato マウス) を使用して心臓の発達過程の可視化方法の説明です。リニア心臓管形成、ループ、心臓の管および 4 室中隔、心臓の開発が含まれます。これらの複雑なプロセスはすべての脊椎動物で非常に節約されます。マウス胚の心臓は、心の発達研究のため広く使用されています。ただし、彼らの非常に小さなサイズのためマウス胚心を解剖するは、技術的に挑戦的なです。さらに、しばしば心臓室形成の可視化には、in situ ハイブリダイゼーション、β-ガラクトシダーゼ LacZ レポーター マウス、または断面胚心の免疫染色を使用して染色が必要があります。ここでは、マウスの胚中心を細かく分析し、全体のマウント epifluorescent 顕微鏡を用いた MLC 2 v tdTomato マウス心室形成を直接可視化する方法をについて説明します。この方法では、心臓管形成とループ、およびマウス胚のさらなる実験的操作なしの 4 つの商工会議所形成を直接調査することが可能です。MLC 2 v tdTomato 記者ノックイン マウス ラインは、例としてこのプロトコルで使用されますが、このプロトコルは、他の心臓特異蛍光レポーター トランスジェニック マウスのラインに適用できます。
概要
心臓の発達過程室形成は、複数胚の形態的に異なる段階1,2と移り変わり複雑なプロセスです。心臓前駆細胞の三日月形リニア心臓の管を形作るし、伸長と成長の中心のスパイラル形状を形成するループを経る。その隔プロセスの後、心臓の開発は 4 chambered 中心に変換されます。これらのプロセスのいずれかの中断は、発達心臓の欠陥で結果します。したがって、心臓の発達過程室形成の分子機構を理解することが重要です。心臓の開発で多数の先行研究、にもかかわらずこの複雑なプロセスの私達の理解は限られています。
In situ ハイブリダイゼーション、免疫組織化学、および β-ガラクトシダーゼは、LacZ レポーター マウスを用いた染色を広く心臓特定または商工会議所特定構造遺伝子の分類によってマウス心臓開発中に商工会議所の形成を研究に使用されているまたはタンパク質 (例えば、Nppa クーデター TFII Irx4、MLC 2 a、MLC 2 v)3,4,5,6,7,8,9,10。ただし、これらの実験は、マウスの胚を使用して膨大な時間と専門知識、ので必要する必要がありますいくつかの異なる実験手順11を順番に実行します。ここでは、MLC 2 v tdTomato 記者ノックイン マウス12から解剖した胚を使用して発展途上心室を視覚化する単純な全体マウント epifluorescent 顕微鏡法について述べる。以前使用していた方法と比較してこの方法の利点は、実験的バリエーションを作成可能性があります多くの場合複雑な実験手順を避けるためです。このプロトコルの主な目的は、マウス胚および開発の心を解剖し退屈な組織化学的実験なしマウス心臓チャンバーの開発の各段階を確認する方法を説明します。早期の心臓マーカーをラベリング様々 な他トランスジェニック マウス ラインを使用して心臓の開発を評価するためにこのメソッドを簡単に適用できる (例えば、Mesp1Cre: Rosa26EYFP13, Isl1Cre: Rosa26EYFP13Hcn4H2BGFP14Hcn4Cre: ローザ mT/mG14, Nkx2 5Cre: ローザ mT/mG14、Hcn4 eGFP15Isl1Cre: ローザ mT/mG14Nkx2.5Cre: Rosa26tdTomato15、および16の TgMef2c AHF GFP マウス)。
プロトコル
動物のすべてのプロシージャは、ヴァンダービルト大学医療センター機関動物ケアおよび使用委員会の承認を得て行った。
1. マウス胚のコレクションおよび郭清
- チームメイトの 8-10 週齢雌 MLC 2 v tdTomato+/-マウス 8-10 週古い男性 MLC 2 v tdTomato+/-マウスと MLC 2 v tdTomato を取得する+/+、MLC 2 v tdTomato+/-と MLC 2 v tdTomato-/-胚。
- 毎朝膣にプラグのダムをチェックします。膣にプラグ検出の日の正午が E0.5 として考慮されます。
注: 膣にプラグを検出するために膣の検査は (内 8-24 h を性行後) 朝実行必要があります膣にプラグが 1 日を通して失われるので。 - 別の日のポストの coitum (例えば、E8.5、E10.5、E12.5) で妊娠中のダムを安楽死させる頚部転位続いて CO2吸入を使用しています。
- 仰臥位のマウスを置き、解剖時にマウスの頭髪汚染度を避けるためにマウスの腹部に 70% エタノールをスプレーします。
- 皮膚外科はさみと、鉗子を使用して腹壁の切開による腹腔内を開きます。
- 腹腔の背の部分で両側の子宮角を探します。
- 鋭い外科はさみと、鉗子を使用して両側の卵管の上慎重に切断することによって子宮全体を区切ります。
- 10 cm シャーレ氷冷 PBS で切り裂かれた子宮全体を置き、慎重に鋭い外科はさみと、鉗子を使って子宮の角に沿って各羊膜嚢を分離します。
- 転送ピペットを使用して氷冷 PBS でいっぱい 6 ウェル プレートの個々 の井戸にそれぞれの胚を転送します。
- 解剖顕微鏡の下で羊膜の嚢を開き、氷冷 PBS で 6 ウェル プレートの個々 の井戸の鋭い外科はさみや、鉗子を使用して臍帯を切断してそれぞれの胚を公開します。
- 鋭い外科はさみと、鉗子を使用して胚を損なうことがなく、できるだけ胚体外組織をトリムします。
注: 全体のマウス胚全体のマウント epifluorescent イメージングの下記のとおり心を解剖前に実行通常。 - Epifluorescent イメージングの結果と相関する遺伝子多型の鋭い外科はさみ鉗子と 1.5 mL チューブへの転送を使用して、バッファー A の 100 μ L (25 mM 水酸化ナトリウムと 0.2 mM EDTA) で胚の頭をカットします。
- 微細鉗子を用いた胚の胸を開き、肺や血管外科はさみや鉗子を使用してから離れて心を取り除き、転送ピペットを使用して PBS の 12 ウェル プレートのウェルに切り裂かれた胚の心臓を転送します。繊維光学顕微鏡照明と解剖顕微鏡下郭清術のすべてを完了します。
注: 彼らの非常に小さなサイズと壊れやすい構造のため E8.0 または E8.5、マウス胚の心を解剖する技術的に困難だった。初期胚心 (E8.0 と E8.5) は郭清なし全台紙胚内で調べることができます。
2. 全体マウント落射蛍光イメージング
- 解剖顕微鏡、epifluorescent 下マウス胚心 12 ウェル プレートを配置します。
- 微細鉗子を用いた顕微鏡解剖 epifluorescent、下胚の心臓発展途上心室が審査官からすぐ近くに移動します。
- 0.63 x 目的を使用してイメージの焦点を調整 (3.15 x と 18.9 ズーム x) 明るいフィールド モードで。
- 明視野のエクスポー ジャーを取るし、複数の画像をキャプチャします。画像は、1 秒露出で通常得られました。しかし、露光時間が照明とカメラの specificationss によって異なります、各セットアップ用に最適化する必要があります。
- 繊維光学顕微鏡照明を切り、赤い蛍光 (Ex545 nm/Em 605 nm) tdTomato 式を視覚化するためのフィルターを設定します。
- 必要に応じて、イメージの焦点を再調整します。
- 明るさとコントラストを調整、赤い蛍光エクスポー ジャーを取るし、複数の画像をキャプチャします。
注: 次のイメージ設定は通常使用された: 1 s 露光時間、ゲイン、1.0 の彩度、および 1.0 のガンマ補正 × 2。最適な設定は、各実験用に最適化する必要があります。最適な設定を決定すると、同じ設定全体の実験に使用する必要があります。
3. ジェノタイピング
- 100 ° C で 1 時間ステップ 1.12 からサンプルを沸騰します。
- (40 mM トリス塩酸、pH 5.5) 11,360 x gバッファー B の 20 μ L を新しい 1.5 mL チューブに上清の転送 20 μ L で 2 分間遠心し、それらをミックスします。
- 4.5 μ L の DNA のテンプレートとしてステップ 3.2 から混合の上澄みを取る、各特定の前方の 0.5 μ L とそれを組み合わせるし、逆のプライマー (10 μ M)、あらかじめ混合されたポリメラーゼと反応バッファー (2 x) の 10 μ L (材料の表を参照)、し、合計 v に水を追加20 μ L. プライマー シーケンスの年次は、以下の通り。
F1: 5'-TACCCACGGAGAAGAGAAGGACT-3'
R1: 5'-TGGACTTCTTGGAACTGACTCTGT-3'
F2: 5'-ACGGCACGCTGATCTACAAGGT-3'
R2: 5'-TTTGCGCACAGCCCTGGGAT-3' - 次の PCR プログラム (表 1と表 2) ポリメラーゼの連鎖反応 (PCR) を実行します。
- サンプルと 25 分の 1 の x TAE (トリス-酢酸-EDTA) バッファー (40 mM トリス酢酸と 1 mM EDTA) の 140 V で 1% アガロースゲル上の DNA の梯子は PCR バンドのサイズを推定するのに 100 bp の DNA の梯子を使用 PCR を実行します。
- DNA のジェルを UV transilluminator DNA バンドを特定して UV 光をオンにします。
結果
心の開発中に MLC 2 v は心室仕様17の最も早いマーカーと見なされます。図 1に示すように我々 は MLC 2 v tdTomato 記者式心臓の発達過程を検討し、マウス胚と MLC 2 v tdTomato レポーター ノックアウトのマウスからの萌芽期心を解剖しました。MLC 2 v tdTomato レポーター ノックイン マウスの心臓の開発で構成 tdTomato 式は落射蛍光全台紙の画像を用いて可視化 E8.012 (図 2) で早くも。E8.0 でリニア心臓の管で tdTomato の比較的弱い式も E8.5 で強くなります。E10.5 で MLC 2 v tdTomato 記者式全体マウス胚から切り裂かれたループ心臓の心室部分で示された一方、流入管、流出管または将来アトリアで示されていません。E12.5 E13.5、MLC 2 v tdTomato 記者ノックイン マウス胚の切り裂かれた心の全体のマウント epifluorescent イメージング tdTomato 記者が専ら 4 chambered 中心の心室で表されることを示した。類似した E16.5 で切り裂かれたマウス胚における MLC 2 v tdTomato レポーターの心室特異的発現パターンを示した。このメソッドを使用して、我々 は簡単にマウス心臓心室形成を追跡できます。
マウス胚の切り裂かれた開発心全体のマウント epifluorescent イメージング後、遡及マウス胚の頭を使って胚の遺伝子型を確認しました。図 3 aに示すようにプライマーの 2 つのセットを使用して、PCR 遺伝子型別を行った。野生型対立遺伝子を運ぶ胚は、F1 と R1 のプライマー セットを使用して 383 bp PCR の製品を示した。F2 と R2 のプライマーを用いた 497 bp の PCR の製品を示した対立遺伝子ノックアウトの tdTomato を運ぶ胚は、(図 3 b) を設定します。ヘテロ接合体の胚が両方の 383 を示すことによって定義された bp と野生型またはホモ接合体の遺伝子型は単一 383 を示すことによって定められる間、487 の bp バンド bp または 497 bp のバンド、それぞれ。
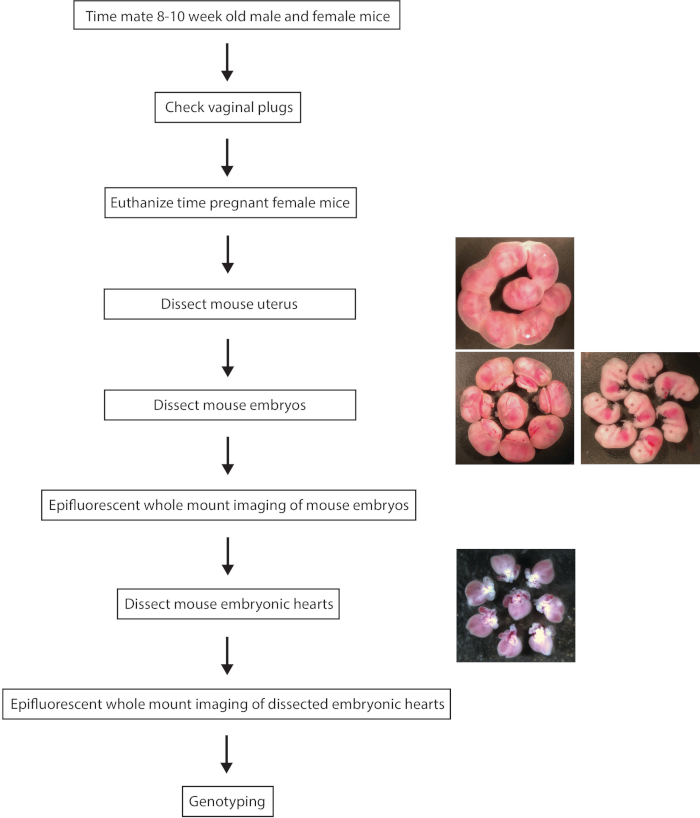
図 1。胚の MLC 2 v tdTomato レポーター マウス中心の全体のマウント epifluorescent イメージングの段階的な実験手順の概要。この図の拡大版を表示するのにはここをクリックしてください。

図 2。胚の開発心代表 epifluorescent 画像解剖 MLC 2 v tdTomato レポーター ノックアウトのマウスから。別の胚の段階で全台紙胚と切り裂かれた心の Epifluorescent イメージング開発心の心室で tdTomato の特異的発現を示します。 (A) E8.0 で全胚、(B) E8.5 で全胚、E9.0 で (C) 全胚、(D) E10.5 で全胚、E13.5 に (E) 全胚、E16.5、(F) 全体胚(G) 胚の心臓原基 E9.0 (H で) 胚の心臓原基 E10.5、E13.5、(私) 胚中心 (J) E16.5 胚中心で。 アトリウム;V、心室;IFT、流入路;しばしば、流出路。スケール バーの (A\u2012F) = 1 mmスケール バーの (G J) = 500 μ m。 この図は、アクセス許可を持つ参照 #12 から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
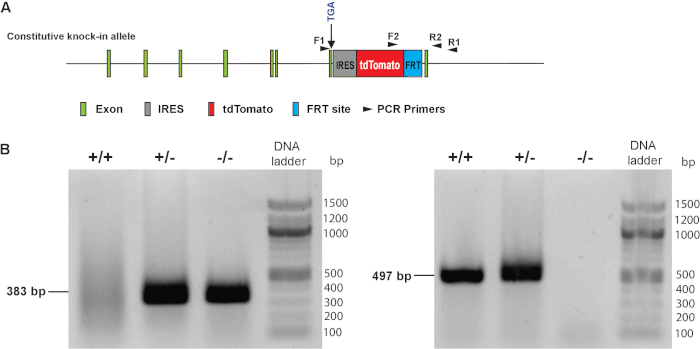
図 3。MLC 2 v tdTomato 記者ノックで胚のジェノタイピング。(A) 遺伝子型プライマー デザインのイラスト。(B) 代表的なジェノタイピング F1 と R1 のプライマー (左) と F2、R2 のプライマー (右) を使用して結果を。+ +: ホモ、+/-: ヘテロ接合され、-/-: 野生型。エクソン: タンパク質の合成に必要な情報が含まれている遺伝子のセグメントIRES: 内部リボゾームのエントリ サイト;FRT: flippase シュプリンガー -組換えターゲット。この図の拡大版を表示するのにはここをクリックしてください。
| ステップ | ° C を気温します。 | 時間 | メモ |
| 1 | 94 | 3 分 | |
| 2 | 94 | 30 s | |
| 3 | 60 | 35 s | |
| 4 | 72 | 35 s | |
| 5 | 38 サイクルの手順 2-4 を繰り返します | ||
| 6 | 72 | 5 分 | |
| 7 | 10 | ホールド |
F1 と R1 のプライマーを使用してテーブル 1: PCR プログラム
| ステップ | ° C を気温します。 | 時間 | メモ |
| 1 | 94 | 3 分 | |
| 2 | 94 | 30 s | |
| 3 | 61.7 | 35 s | |
| 4 | 72 | 35 s | |
| 5 | 38 サイクルの手順 2-4 を繰り返します | ||
| 6 | 72 | 5 分 | |
| 7 | 10 | ホールド |
F2 と R2 のプライマーを使用して表 2: PCR プログラム
ディスカッション
ここで説明する方法は心室または心臓固有の構造遺伝子または蛋白質のラベルに手間のかかる実験を行わず心室の開発を検討する比較的簡単です。したがって、このメソッドは、immunostained 中心部のセクションで発見された多くの場合技術的な変動を最小限に抑えます。
マウスの萌芽期の年齢・胚の心の解剖の正確な推定を含むこのメソッドを正常に実行するための 2 つの重要な手順があります。膣に識別することによってマウスの萌芽期の年齢の雌マウスのプラグを事実上推定します。しかし、膣にプラグの存在、必ずしも妊娠。それだけ性行為がおおよそ 8 ~ 24 時間期間内に発生したことを示します。膣にプラグがある場合でも多くの場合マウスが実際に妊娠しているまたは雌マウスの腹部を調べることによってポストの coitum 定め 10-11 日までないかどうかを決定することは困難です。雌雄マウスの複数のペアを飼育マウスの予想される年齢に胚を得るための安全な繁殖戦略では。その構造に著しい損害なしマウス中心の開発を分離する正確に調べる心臓チャンバー過程中のマウス胚発生の図 1に示すように重要です。注意解剖顕微鏡を解剖、解剖前に各胚の段階で発達心臓解剖学を理解することがこのプロトコルを正常に実行するため必要です。
MLC 2 v tdTomato 記者式は E8.0 で最初に観察された、ので、以前胚の心臓管または心臓三日月ステージ12を調べるため不可能します。以前の心臓マーカーをラベリング様々 なレポーター マウス ライン (例えば Mesp1Cre: Rosa26EYFP13, Isl1Cre: Rosa26EYFP13Hcn4H2BGFP14Hcn4Cre: ローザ mT/mG14, Nkx2 5Cre: ローザ mT/mG14、Hcn4 eGFP15、Isl1Cre: ローザ mT/mG14、および Nkx2.5Cre: Rosa26tdTomato15, TgMef2c AHF GFP16マウス) この資料に記載メソッドを使用して商工会議所開発の初期の段階を調べるために使用できます。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、NIH R03 HL140264 によって支えられた (雄 j.N) とギリアド ・ サイエンシズ研究学者プログラム (雄 j.N)。
資料
| Name | Company | Catalog Number | Comments |
| dissecting microscope | Leica | MZ125 | |
| DNA ladder (100 bp) | Promega | G2101 | |
| epifluorescence dissecting microscope | Leica | M165 FC | |
| GoTaq Green master Mix | Promega | M712 | |
| PCR machine (master cycler) | Eppendorf | 6336000023 |
参考文献
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Paige, S. L., Plonowska, K., Xu, A., Wu, S. M. Molecular regulation of cardiomyocyte differentiation. Circulation Research. 116 (2), 341-353 (2015).
- Lee, K. J., et al. Myosin light chain-2 luciferase transgenic mice reveal distinct regulatory programs for cardiac and skeletal muscle-specific expression of a single contractile protein gene. Journal of Biological Chemistry. 267 (22), 15875-15885 (1992).
- Chen, J., et al. Selective requirement of myosin light chain 2v in embryonic heart function. Journal of Biological Chemistry. 273 (2), 1252-1256 (1998).
- Ross, R. S., Navankasattusas, S., Harvey, R. P., Chien, K. R. An HF-1a/HF-1b/MEF-2 combinatorial element confers cardiac ventricular specificity and established an anterior-posterior gradient of expression. Development. 122 (6), 1799-1809 (1996).
- Christoffels, V. M., et al. Chamber formation and morphogenesis in the developing mammalian heart. Dev Biol. 223 (2), 266-278 (2000).
- Wu, S. P., et al. Atrial identity is determined by a COUP-TFII regulatory network. Developmental Cell. 25 (4), 417-426 (2013).
- Nelson, D. O., Jin, D. X., Downs, K. M., Kamp, T. J., Lyons, G. E. Irx4 identifies a chamber-specific cell population that contributes to ventricular myocardium development. Developmental Dynamics. 243 (3), 381-392 (2014).
- Bao, Z. Z., Bruneau, B. G., Seidman, J. G., Seidman, C. E., Cepko, C. L. Regulation of chamber-specific gene expression in the developing heart by Irx4. Science. 283 (5405), 1161-1164 (1999).
- Kubalak, S. W., Miller-Hance, W. C., O'Brien, T. X., Dyson, E., Chien, K. R. Chamber specification of atrial myosin light chain-2 expression precedes septation during murine cardiogenesis. Journal of Biological Chemistry. 269 (24), 16961-16970 (1994).
- Bardot, P., et al. The TAF10-containing TFIID and SAGA transcriptional complexes are dispensable for early somitogenesis in the mouse embryo. Development. 144 (20), 3808-3818 (2017).
- Zhang, Z., Nam, Y. J. Generation of MLC-2v-tdTomato knock-in reporter mouse line. Genesis. , (2018).
- Ieda, M., et al. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell. 142 (3), 375-386 (2010).
- Liang, X., et al. HCN4 dynamically marks the first heart field and conduction system precursors. Circulation Research. 113 (4), 399-407 (2013).
- Nam, Y. J., et al. Induction of diverse cardiac cell types by reprogramming fibroblasts with cardiac transcription factors. Development. 141 (22), 4267-4278 (2014).
- Spater, D., et al. A HCN4+ cardiomyogenic progenitor derived from the first heart field and human pluripotent stem cells. Nature Cell Biology. 15 (9), 1098-1106 (2013).
- O'Brien, T. X., Lee, K. J., Chien, K. R. Positional specification of ventricular myosin light chain 2 expression in the primitive murine heart tube. Proceedings of the National Academy of Sciences of the United States of America. 90 (11), 5157-5161 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2578-2746
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。