Method Article
Análisis del desarrollo de la cámara cardiaca durante la embriogénesis de ratón usando todo de Monte de epifluorescencia
En este artículo
Resumen
Presentamos los protocolos para examinar el desarrollo del corazón de ratón utilizando microscopía epifluorescente Monte todo en embriones de ratón disecados de ventricular específica MLC-2v-tdTomato reportero knock-en ratones. Este método nos permite visualizar directamente cada etapa de la formación del ventrículo durante el desarrollo del corazón de ratón sin mano de obra intensiva métodos histoquímicos.
Resumen
El objetivo de este protocolo es describir un método para la disección de embriones de ratón y visualización de cámaras ventriculares embrionarias de ratón durante el desarrollo del corazón con ventrículo reportero fluorescente específico knock-en ratones (MLC-2v-tdTomato). Desarrollo del corazón consiste en una formación de tubo lineal de corazón, el tubo de corazón bucle y cuatro de cámara de tabicación. Estos complejos procesos son altamente conservados en todos los vertebrados. El corazón embrionario de ratón ha sido ampliamente utilizado para los estudios del desarrollo del corazón. Sin embargo, debido a su tamaño extremadamente pequeño, disección de corazón de embrión de ratón es un desafío técnico. Además, la visualización de la formación de la cámara cardiaca a menudo necesita hibridación in situ, beta-galactosidasa que manchaba usando ratones de reportero LacZ, o immunostaining del corazón embrionario seccionado. Aquí, describimos cómo diseccionar el corazón embrionario de ratón y visualizar directamente la formación de la Cámara ventricular de MLC-2v-tdTomato ratones utilizando microscopía epifluorescente Monte todo. Con este método, es posible examinar directamente la formación del tubo corazón y bucle y 4 formación de la cámara sin más manipulación experimental de embriones de ratón. Aunque la línea de ratón knock-in de reportero de MLC-2v-tdTomato se utiliza en este protocolo como un ejemplo, este protocolo se puede aplicar a otras líneas de ratón transgénico de reportero fluorescente específica de corazón.
Introducción
Formación de la cámara durante el desarrollo del corazón es un complejo proceso de transición a través de varias etapas embrionarias morfológicamente distintos1,2. La forma crescent de células progenitoras cardíacas de la población forma un tubo lineal corazón y entonces sufre alargamiento y colocación para formar la forma espiral del corazón en desarrollo. Después de su proceso de tabicación, pleno en desarrollo se transforma en el corazón de cuatro cámaras. Interrupción de cualquiera de estos procesos resulta en defectos del desarrollo del corazón. Por lo tanto, es importante entender los mecanismos moleculares subyacentes la formación de la cámara durante el desarrollo del corazón. A pesar de numerosos estudios anteriores en el desarrollo del corazón, nuestra comprensión de este complejo proceso es limitada.
Hibridación in situ, inmunohistoquímica y la beta-galactosidasa coloración utilizando ratones de reportero LacZ han sido ampliamente utilizados para el estudio de formación de cámara durante el desarrollo del corazón de ratón por etiquetado cardiaco específico o compartimiento específicos genes estructurales o proteínas (por ejemplo, Nppa, golpe TFII, Irx4, MLC-2a MLC-2v)3,4,5,6,7,8,9,10. Sin embargo, estos experimentos con embriones de ratón requieren mucho tiempo y conocimientos, porque varios pasos experimentales diferentes tienen que ser realizadas secuencialmente11. Aquí, describimos un método de microscopía epifluorescente de montaje todo simple para visualizar los ventrículos en desarrollo embriones disecados de MLC-2v-tdTomato reportero ratones knock-in12. La ventaja de este método en comparación con los métodos previamente utilizados es evitar complejos pasos experimentales que a menudo pueden crear variaciones experimentales. El objetivo principal de este protocolo es describir cómo diseccionar embriones de ratón y corazones en vías de desarrollo y examinar cada etapa de desarrollo de cámara cardiaca ratón sin experimentos histoquímicos tediosos. Este método se puede aplicar fácilmente para evaluar el desarrollo del corazón con varias otras líneas de ratón transgénico etiquetado marcadores cardiacos tempranos (por ejemplo, Mesp1Cre: Rosa26EYFP13, Isl1Cre: Rosa26EYFP13, Hcn4H2BGFP14, Hcn4Cre: mT Rosa /mG14, Nkx2-5Cre: Rosa mG/mT14, eGFP Hcn415, Isl1Cre: Rosa mG/mT14, Nkx2.5Cre: Rosa26tdTomato15y TgMef2c-AHF-GFP16 ratones).
Protocolo
Animales todos los procedimientos fueron realizados con la aprobación del Comité de uso y Vanderbilt University Medical centro institucional Animal Care.
1. disección y colección de embriones de ratón
- Compañero de 8-10 semanas de edad hembra MLC-2v-tdTomato+- ratones con 8-10 semanas viejo MLC-2v-tdTomato+- ratones machos para obtener MLC-2v-tdTomato+ / +, MLC-2v-tdTomato+- y MLC-2v-tdTomato- / - embriones.
- Compruebe las presas para tapones vaginales todas las mañanas. Mediodía en el día de detección de enchufe vaginal se considera como E0.5.
Nota: Examen Vaginal para la detección de un tapón vaginal debe realizarse por la mañana (dentro de 8-24 h después de la actividad sexual), ya que un enchufe vaginal puede ser perdido durante todo el día. - Eutanasia a las presas embarazadas en diferentes días post coitum (p. ej., E8.5 E10.5 y E12.5) usar la inhalación de CO2 seguido por dislocación cervical.
- Colocar los ratones supinas y rociar etanol al 70% en el abdomen de ratones para evitar la contaminación de pelo de ratón durante la disección.
- Abrir la cavidad abdominal por incisión de la piel y la pared abdominal usando afiladas tijeras quirúrgicas y una pinza.
- Ubicar los cuernos uterinos bilaterales en la parte dorsal de la cavidad abdominal.
- Separar el útero entero cortando cuidadosamente por encima de los oviductos en ambos lados con afiladas tijeras quirúrgicas y una pinza.
- Colocar el útero entero disecado en una placa de Petri con PBS helado de 10 cm y Separe cuidadosamente cada saco amniótico en el cuerno uterino con afiladas tijeras quirúrgicas y una pinza.
- Transferir cada embrión en pocillos individuales de 6 bien la placa con PBS helado usando una pipeta de transferencia.
- Con un microscopio de disección, abrir un saco amniótico y exponer cada embrión por el cordón umbilical con tijeras quirúrgicas agudas y una pinza en un pozo individual de una 6 bien la placa con PBS helado de corte.
- Recorte hacia fuera de los tejidos extra embrionarios tanto como sea posibles sin dañar el embrión usando afiladas tijeras quirúrgicas y una pinza.
Nota: Proyección de imagen de todo Monte epifluorescente de embrión de ratón todo generalmente se realiza antes de disecar el corazón en desarrollo tal como se describe a continuación. - Cortar la cabeza de embrión con afiladas tijeras quirúrgicas y una pinza y transfiéralo a un tubo de 1,5 mL con 100 μl de buffer A (25 mM NaOH y 0,2 mM EDTA) para que genotipificación para correlacionar con los resultados de la proyección de imagen epifluorescente.
- Abre el cofre del embrión con unas pinzas finas, quitar el corazón a los pulmones y vasculatura usando afiladas tijeras quirúrgicas y pinzas y transferir el corazón embrionario disecado en un pozo de una placa bien 12 con PBS utilizando una pipeta de transferencia. Todos los procedimientos de disección se completan con un microscopio de disección con un iluminador de microscopio óptico de fibra.
Nota: Fue técnicamente difícil de diseccionar el corazón embrionario de ratón E8.0 o E8.5, debido a su tamaño extremadamente pequeño y frágil estructura. Corazón embrionario temprano (es decir, E8.0 y E8.5) puede ser examinada en el embrión de todo Monte sin disección.
2. proyección de imagen de epifluorescencia whole-mount
- Coloque la placa bien 12 con corazones embrionarios de ratón bajo una epifluorescente microscopio de disección.
- Bajo un microscopio con unas pinzas finas de disección de epifluorescente, coloque el corazón embrionario que desarrollo ventrículos están situados cerca del examinador.
- Ajustar el enfoque de la imagen usando un objetivo de 0.63 x (zoom rango entre x 3.15 y 18,9 x) en el modo de campo brillante.
- Tomar exposiciones de campo brillante y capturar varias imágenes. Las imágenes fueron obtenidas generalmente por una segunda exposición. Sin embargo, tiempos de exposición pueden variar dependiendo de la iluminación y cámara specificationss y deben optimizarse para cada configuración.
- Apague un iluminador de microscopio óptico de fibra y coloque el filtro de la fluorescencia roja (Ex545 nm/Em 605 nm) visualizar la expresión de tdTomato.
- Vuelva a ajustar el enfoque de la imagen si es necesario.
- Ajustar brillo y contraste, tomar exposiciones fluorescentes rojo y capturar varias imágenes.
Nota: La configuración de la imagen siguiente fue utilizada generalmente: tiempo de 1 exposición, 2 x ganancia, saturación de 1,0 y corrección gamma de 1,0. El ajuste óptimo debe optimizarse para cada experimento. Una vez determinada la configuración óptima, la misma configuración debe ser utilizado para un experimento completo.
3. genotipificación
- Hervir las muestras del paso 1.12 por 1 h a 100 ° C.
- Centrifugar durante 2 min a 11.360 x g, transferir 20 μl del sobrenadante a un tubo nuevo de 1,5 mL con 20 μl de tampón B (40 mM Tris HCl, pH 5.5) y mezclar.
- Tomar 4.5 μl del sobrenadante mixto del paso 3.2 como una plantilla de ADN, combinar con 0,5 μl de cada uno de avance específico y cartillas reversas (10 μm), 10 μl de tampón de reacción y polimerasa premezclado (2 x) (véase Tabla de materiales) y luego añadir agua para un v total olume de 20 μl. secuencias de la cartilla están como abajo.
F1: 5'-TACCCACGGAGAAGAGAAGGACT-3'
R1: 5'-TGGACTTCTTGGAACTGACTCTGT-3'
F2: 5'-ACGGCACGCTGATCTACAAGGT-3'
R2: 5'-TTTGCGCACAGCCCTGGGAT-3' - Ejecutar una reacción en cadena de polimerasa (PCR) con el siguiente programa PCR (tabla 1 y tabla 2).
- Ejecutar PCR muestras y escalera de DNA en un gel de agarosa al 1% a 140 V en buffer x TAE (acetato de-Tris-EDTA) 1 (40 mM Tris acetato y 1 mM EDTA) durante 25 minutos usan escalera 100 bp ADN para estimar el tamaño de las bandas PCR.
- Colocar el gel de la DNA en un transiluminador UV para identificar las bandas de ADN y gire a la luz en el ultravioleta.
Resultados
Durante el desarrollo del corazón, MLC-2v se considera ser el marcador más temprano para Cámara ventricular especificación17. Como se muestra en la figura 1, diseca el corazón embrionario de MLC-2v-tdTomato reportero knock-en ratones y embriones todo ratón y examinado MLC-2v-tdTomato expresión de reportero durante el desarrollo del corazón. En MLC-2v-tdTomato reportero knock-en ratones, expresión constitutiva tdTomato en pleno desarrollo se visualiza a través de la proyección de imagen de todo Monte epifluorescencia tan temprano como a las E8.012 (figura 2). Relativamente débil expresión de tdTomato en el tubo del corazón lineal en E8.0 se hace fuerte en E8.5. En E10.5, MLC-2v-tdTomato reportero expresión fue demostrada en la porción ventricular del corazón disecado enrollado de un embrión de ratón entero, mientras que no fue demostrado en el tracto de entrada, el tracto de salida o las aurículas futuro. En E12.5-E13.5, todo Monte epifluorescente proyección de imagen del corazón disecado de embrión de ratón knock-in reportero MLC-2v-tdTomato demostró que el reportero de tdTomato se expresa exclusivamente en los ventrículos del corazón de cuatro cámaras. Similar patrón de expresión específico ventricular de MLC-2v-tdTomato reportero fue demostrado en el embrión de ratón disecado en E16.5. Usando este método, podemos localizar fácilmente a la formación de la Cámara ventricular durante el desarrollo del corazón de ratón.
Después de todo Monte epifluorescente imagen de embriones de ratón o corazones en desarrollo disecada, confirmamos retrospectivamente el genotipo del embrión utilizando la cabeza de embriones de ratón. Usando dos sistemas de cartillas como se ilustra en la Figura 3A, se realizó un genotipado PCR. Los embriones que llevan el alelo de tipo salvaje demostraron un producto PCR bp 383 usando el primer F1 y R1. Los embriones que el tdTomato knock-in alelo mostraron el producto PCR bp 497 utilizando la cartilla de F2 y R2 set (figura 3B). Heterozigóticos embriones fueron definidos por demostrar tanto el 383 bp y las 487 bandas de bp, mientras que el tipo salvaje o genotipo homocigótico se determinó por demostrar una solo 383 bp o 497 banda bp, respectivamente.
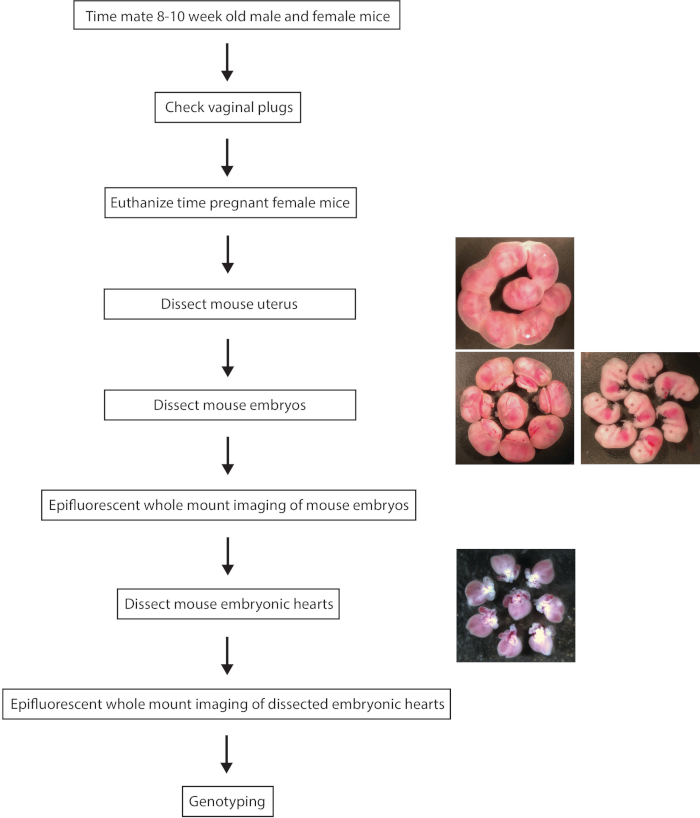
Figura 1. Esquema del procedimiento experimental paso a paso para epifluorescente Monte toda la proyección de imagen de los corazones de ratón embrionarios de MLC-2v-tdTomato reportero. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Representante epifluorescente imágenes de embriones enteros y desarrollo corazones disecaron de MLC-2v-tdTomato reportero knock-en ratones. Epifluorescente la proyección de imagen de corazones disecados y Monte todo embriones en diferentes etapas embrionarias demuestra expresión específica de tdTomato en los ventrículos del corazón de desarrollo. El embrión entero (A) en E8.0 (B) embrión entero en E8.5, (C) todo embrión en E9.0, embrión todo (D) en los E10.5, (E) embrión entero en E13.5, (F) embrión entero en E16.5, (G) corazón embrionario en E9.0, (H ) Corazón embrionario en E10.5, el corazón () embrionario en E13.5 y corazón embrionario (J) en E16.5. Un, atrio; V, ventrículo; IFT, tracto de entrada; MENUDO, tracto de salida. Escala de la barra (A\u2012F) = 1 mm; Escala de la barra (G-J) = 500 μm. Esta figura ha sido modificada de referencia #12 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
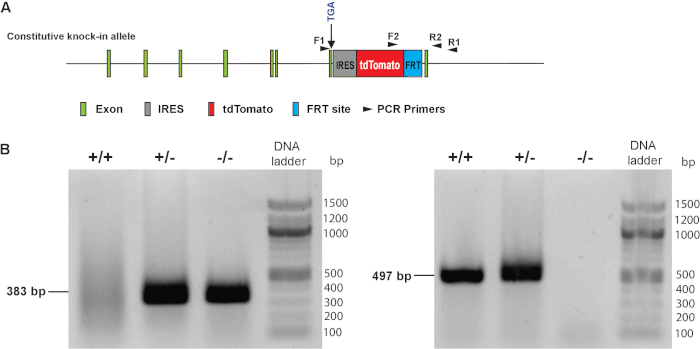
Figura 3. Genotipificación de MLC-2v-tdTomato reportero knock-in embriones. (A) ilustración del primer diseño de genotipificación. (B) representante genotipado resultados utilizando primers F1 y R1 (izquierda) y las cartillas de F2 y R2 (derecha). + / +: homocigotos, +/-: heterocigoto,- / -: tipo salvaje. Exón: un segmento de un gen que contiene la información necesaria para la síntesis de proteínas; IRES: Sitio de la entrada interna del ribosoma; FRT: flippase recombinaserecombinación objetivo. Haga clic aquí para ver una versión más grande de esta figura.
| Paso | Temp ° C | hora | Nota |
| 1 | 94 | 3 min | |
| 2 | 94 | 30 s | |
| 3 | 60 | 35 s | |
| 4 | 72 | 35 s | |
| 5 | Repita los pasos 2-4 en 38 ciclos | ||
| 6 | 72 | 5 min | |
| 7 | 10 | Mantenga |
Tabla 1: Programa PCR utilizando primers F1 y R1
| Paso | Temp ° C | hora | Nota |
| 1 | 94 | 3 min | |
| 2 | 94 | 30 s | |
| 3 | 61.7 | 35 s | |
| 4 | 72 | 35 s | |
| 5 | Repita los pasos 2-4 en 38 ciclos | ||
| 6 | 72 | 5 min | |
| 7 | 10 | Mantenga |
Tabla 2: Programa PCR usando las cartillas F2 y R2
Discusión
El método descrito aquí es relativamente simple examinar el desarrollo de la Cámara ventricular, sin realizar experimentos que requieren mucho trabajo para etiqueta proteínas o genes estructurales cardiacos específicos o ventriculares. Por lo tanto, este método reduce al mínimo la variabilidad técnica que se encuentra a menudo en las secciones de corazón immunostained.
Hay dos pasos fundamentales para realizar con éxito este método como estimación precisa de la edad embrionaria de ratones y disección de corazón embrionario. Prácticamente calculamos la edad embrionaria de los ratones identificando vaginal tapones en ratones femeninos. Sin embargo, la presencia de un tapón vaginal no necesariamente indica embarazo. Sólo indica que la relación sexual ocurrió dentro de un período aproximado de 8 a 24 h. Incluso si se encuentran tapones vaginales, a menudo es difícil determinar si los ratones están realmente embarazados o no hasta 10-11 días post coitum examinando el abdomen de ratones femeninos. Múltiples pares de ratones machos y hembras de cría es una estrategia de reproducción segura para obtener la edad del ratón embriones. Aislar desarrollar corazones de ratón sin daños significativos en sus estructuras es fundamental examinar con precisión el desarrollo de la cámara cardiaca durante la embriogénesis del ratón como se muestra en la figura 1. Disección cuidadosa bajo un microscopio de disección y la comprensión del desarrollo anatomía cardiaca en cada etapa embrionaria antes de la disección son necesarios para la realización con éxito de este protocolo.
Puesto que la expresión del reportero de MLC-2v-tdTomato se observó por primera vez en E8.0, no es posible examinar el anterior corazón embrionario tubo o cardiaca etapa media luna12. Las distintas líneas de ratón reportero etiquetado anteriores marcadores cardiacos (por ejemplo, Mesp1Cre: Rosa26EYFP13, Isl1Cre: Rosa26EYFP13, Hcn4H2BGFP14, Hcn4Cre: Rosa mG/mT14, Nkx2-5Cre: Rosa mG/mT14, eGFP Hcn415 Isl1Cre: Rosa mT/mG14y Nkx2.5Cre: Rosa26tdTomato15, ratones de16 TgMef2c-AHF-GFP) puede utilizarse para examinar las primeras etapas de desarrollo de la cámara utilizando el método descrito en este artículo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por los NIH R03 HL140264 (Y.-J. N) y Gilead Sciences (Y.-J. programa de investigación N).
Materiales
| Name | Company | Catalog Number | Comments |
| dissecting microscope | Leica | MZ125 | |
| DNA ladder (100 bp) | Promega | G2101 | |
| epifluorescence dissecting microscope | Leica | M165 FC | |
| GoTaq Green master Mix | Promega | M712 | |
| PCR machine (master cycler) | Eppendorf | 6336000023 |
Referencias
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Paige, S. L., Plonowska, K., Xu, A., Wu, S. M. Molecular regulation of cardiomyocyte differentiation. Circulation Research. 116 (2), 341-353 (2015).
- Lee, K. J., et al. Myosin light chain-2 luciferase transgenic mice reveal distinct regulatory programs for cardiac and skeletal muscle-specific expression of a single contractile protein gene. Journal of Biological Chemistry. 267 (22), 15875-15885 (1992).
- Chen, J., et al. Selective requirement of myosin light chain 2v in embryonic heart function. Journal of Biological Chemistry. 273 (2), 1252-1256 (1998).
- Ross, R. S., Navankasattusas, S., Harvey, R. P., Chien, K. R. An HF-1a/HF-1b/MEF-2 combinatorial element confers cardiac ventricular specificity and established an anterior-posterior gradient of expression. Development. 122 (6), 1799-1809 (1996).
- Christoffels, V. M., et al. Chamber formation and morphogenesis in the developing mammalian heart. Dev Biol. 223 (2), 266-278 (2000).
- Wu, S. P., et al. Atrial identity is determined by a COUP-TFII regulatory network. Developmental Cell. 25 (4), 417-426 (2013).
- Nelson, D. O., Jin, D. X., Downs, K. M., Kamp, T. J., Lyons, G. E. Irx4 identifies a chamber-specific cell population that contributes to ventricular myocardium development. Developmental Dynamics. 243 (3), 381-392 (2014).
- Bao, Z. Z., Bruneau, B. G., Seidman, J. G., Seidman, C. E., Cepko, C. L. Regulation of chamber-specific gene expression in the developing heart by Irx4. Science. 283 (5405), 1161-1164 (1999).
- Kubalak, S. W., Miller-Hance, W. C., O'Brien, T. X., Dyson, E., Chien, K. R. Chamber specification of atrial myosin light chain-2 expression precedes septation during murine cardiogenesis. Journal of Biological Chemistry. 269 (24), 16961-16970 (1994).
- Bardot, P., et al. The TAF10-containing TFIID and SAGA transcriptional complexes are dispensable for early somitogenesis in the mouse embryo. Development. 144 (20), 3808-3818 (2017).
- Zhang, Z., Nam, Y. J. Generation of MLC-2v-tdTomato knock-in reporter mouse line. Genesis. , (2018).
- Ieda, M., et al. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell. 142 (3), 375-386 (2010).
- Liang, X., et al. HCN4 dynamically marks the first heart field and conduction system precursors. Circulation Research. 113 (4), 399-407 (2013).
- Nam, Y. J., et al. Induction of diverse cardiac cell types by reprogramming fibroblasts with cardiac transcription factors. Development. 141 (22), 4267-4278 (2014).
- Spater, D., et al. A HCN4+ cardiomyogenic progenitor derived from the first heart field and human pluripotent stem cells. Nature Cell Biology. 15 (9), 1098-1106 (2013).
- O'Brien, T. X., Lee, K. J., Chien, K. R. Positional specification of ventricular myosin light chain 2 expression in the primitive murine heart tube. Proceedings of the National Academy of Sciences of the United States of America. 90 (11), 5157-5161 (1993).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados