Method Article
ペントサン解析手法ジュート バイオマスと酸性イオン液体を用いた糖モノマーへの変換に存在
要約
水の触媒としてブレンステッド酸性イオン液体 (金具) の存在と再生可能な非食用リグノ セルロース系バイオマス (すなわちジュート) から C5 糖 (キシロースとアラビノース) の合成のためのプロトコルを提案します。金具触媒展示従来のミネラル酸触媒よりもよりよい触媒性能 (H2SO4と HCl)。
要約
最近、イオン液体 (ILs) は、熱的安定性、低い蒸気圧、非可燃性、高い熱容量と可変溶解度、酸味などその顕著な特性のために貴重な薬品バイオマスを物価安定政策に使用されます。ここでは、ブレンステッド酸性 1-methyl-3-(3-sulfopropyl)-imidazolium 水素硫酸 IL の触媒量を用いたワンポット プロセスのジュート バイオマスの存在のペントサンから C5 糖 (キシロースとアラビノース) の合成法を紹介します。酸性の IL は、実験室で合成し、その純度を理解するため NMR 分光学的手法を用いた特徴します。保釈のさまざまなプロパティは、酸の強さ、熱・熱水安定性、触媒が高温 (250 ° C) 安定と非常に高い酸強度 (Ho 1.57) を所有していることを示したなど計測されます。酸性の IL は糖とフルフラールにペントサンの 90% に変換します。したがって、本研究で提示方法は、リグノ セルロース系バイオマスの他の種類のペントサン濃度の評価にも使用できます。
概要
バイオマスでは、だから持続可能な安価で、化石資源とは異なり均等化石原料を交換する有望な候補の一つになって、再生可能エネルギーと化学のソースとして大きな可能性があります。リグノ セルロース系バイオマスの推定生産は1年ごと 1460 億トンです。リグノ セルロース系バイオマス主にその 3 つの主要な構成成分としてヘミセルロース、セルロース、リグニンで構成されます。リグニンはフェニルプロパノイド ユニットから作られた芳香族ポリマーです。その一方で、セルロースとヘミセルロースは、リグノ セルロース系バイオマスの多糖類部分です。セルロースは、β(1→4) ガラクシド結合で接続されているグルコース単位ヘミセルロースは成っている C5 糖、C6 糖と糖酸 β (1→4)、β (1 → 3) と (1→6) β グリコシド結合2,3で一緒にリンクされている一方で構成されます。種々 のリグノ セルロース系バイオマス(バガス、もみ殻、小麦わら等)、と共にジュート リグノ セルロース バイオマスも非常に大量 (約98 %2014 年に世界の合計のジュートの生産と比較してアジアで生成されます。バングラデシュ ジュート バイオマス 2014年4で世界一 (10 トン6 x 3.39) ジュート バイオマスの総生産と比較して 10 トン6 x 1.34 を作り出す間、インドはジュート バイオマスの 10 トン6 x 1.96 を生成します。この非食用のバイオマスの利用は、食料需要と競合しません。したがって、それはさまざまな付加価値を合成の在庫としてそれを使用する有益な化学物質(キシロース、アラビノース、フルフラール、5-ヒドロキシメチルフルフラール (HMF) 等)。フルフラールと HMF は米国エネルギー省によるとバイオマス5から派生した上位 30 ビルディング ブロック化学物質の一部としてと見なされます。フルフラールは、キシロースやヘミセルロースから直接に得られるし、多くの重要な化学物質に変換することができます。フルフリル アルコール、メチル フラン テトラヒドロ フランは、フルフラール6から得られる重要な化学物質です。したがって、ジュート バイオマスなどリグノ セルロース系バイオマスの C5 糖と他の重要な化学物質への変換は、重要なトピックです。
広範な報告が様々 な触媒リグノ セルロース系バイオマスの値への変換法に利用可能な追加の化学物質。無機酸 (HCl と H2SO4) 糖 (ペントース、ヘキソース糖) にヘミセルロースとリグノ セルロース系バイオマスの変換用触媒(アンバー、HMOR、HUSY、サポ 44 等)が大幅に用い・ フラン (フルフラールと HMF)7,8。再利用性と無機酸の腐食性は、主要な問題です。しかし、固体酸触媒とより高い温度や圧力が必要触媒の表面で反応が発生するためです。これらの問題を克服するために最近 ILs は触媒や溶剤9,10、11,12,13,14としてバイオマスの物価安定政策のために報告されます。イルの溶媒としての使用は、コストが高く、製品の分離の難しさを作成する ILs の下の蒸気圧のためより良い方法ではありません。したがって、それは付加価値にバイオマス変換 (少量) で触媒として水溶媒系でリサイクル可能な IL を使用することが不可欠の化学物質。
ペントサン ジュート バイオマスの存在のすべての前処理なし糖モノマーへの直接変換のための触媒として 1-methyl-3-(3-sulfopropyl) イミダゾリウム水素硫酸酸性イルを使用する方法を紹介します。一般的には、バイオマス前処理に ILs の非常に大きな量を使用に対しリグノ セルロース系バイオマス10,15,16,17の前処理 ILs が報告されます。したがって、触媒としてイルを使用して化学物質追加治療なしのリグノ セルロース系バイオマスの変換に有利です。さらに、現在の仕事、様々 な芳香族モノマー18に変換することができます Klason メソッドを使用してジュート バイオマスでリグニン濃度を計算します。
プロトコル
仕事を提示で使用されるいくつかの化学物質が有毒で発がん性です。合成 IL とバイオマス処理を実行するときは、すべての適切な安全対策を使用してください。
1. 酸性の IL の準備
- 50 mL の丸底フラスコに 1, 3 - プロパンスルトンの 7.625 モルを追加し、ゴムキャップでフラスコを閉じます。
- ゆっくりと 1, 3-propanesultone の 7.625 モルに 7.625 m モルの 1 methylimidazole を追加 (10 分) (1 mL) 注射器を使用して 0 の ° C で。
- 1 methylimidazole と 1, 3-propanesultone の完全な付加の後で乾燥トルエンの 15 mL を追加し、固体両性イオンを取得する 120 ° C で 16 時間の混合物を還流します。
- ろ過を併用したトルエンから、双性イオンを分離し、40 ml のトルエンの双性イオンを洗ってください。双性イオンを乾燥、オーブン温度を 80 ° C に設定します。オーブンの温度 80 ° C に達すると、サンプルをおいて 4 h のオーブンと乾燥の双性イオンを使用して、次の手順で。
- 双性イオン (両性イオンと硫酸の等しいモル) を含む丸底フラスコに硫酸を追加 1,000 μ L マイクロ ピペットを使用しています。その後、丸底フラスコを還流冷却器に接続します。熱、希望の IL を取得する 12 h 110 ° C で混合物をかき混ぜなさい。
注: 硫酸と両性イオンの反応の溶剤なし実行されます。 - 酸性の IL の合成後、 1H と13C の NMR 分光学を使用してそれを特徴付けます。
2 ハメットの酸度 (Ho) 定量法
- 1 L メスフラスコに 10 mg のp- ニトロアニリン インジケーターを追加し、蒸留水 1 L に希釈するを追加します。2 分間手でよくソリューションを振るし、水 (空のソリューション) でp-ニトロアニリンをミックスに 1 時間のためのソリューションを残します。
- 1.59 m モル酸触媒の H+イオンを追加 (HCl/H2SO4/酸性 IL) pニトロアニリン指示薬と振る (試料) を混合の手による溶液 50 mL に。
現在の仕事で使用されるすべての酸触媒に注意してください (HCl、H2SO4、および酸性 IL) ハメットの酸度 (Ho) の定量の 50 mL 指示薬 (表 1) に個別に追加されます。 - 空のソリューション (pニトロアニリン ソリューション) と試料溶液 (触媒pニトロアニリン ソリューションを含む) の UV 測定を行い、 p-ニトロアニリンの Amax を特定します。
- 最後に [I] unprotonated とpニトロアニリン、サンプル ソリューションの Amax 値を使用して [IH+] プロトン化インジケーター ソリューションのモル濃度を計算します。2次方程式を用いたHoを計算します。
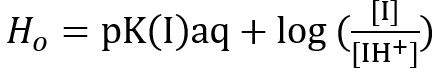 式 1
式 1
pK(I)aqは、pK、水pニトロアニリン インジケーターの (pKa = 0.99)、および [I] と [IH+] インジケーター ソリューション、unprotonated、プロトン化のモル濃度は、それぞれ。
3. ジュート バイオマスの分析
-
ペントサンの分析
注: ジュート バイオマスはオーブン オーブンで 16 時間 105 ° C で乾燥しました。- 1 L 丸底フラスコに乾燥オーブン ジュート バイオマスの 3 g を追加し、それに 3.85 N HCl 溶液 100 mL を追加します。
- 蒸留装置にフラスコを接続し、攪拌とソリューションは、沸騰を開始するように加熱を開始します。
- 3.85 N HCl ジュート バイオマスと塩酸溶液を含む丸底フラスコに滴下漏斗の使用の 250 mL を追加します。
- 3.85 N 塩酸溶液を滴下し追加することによって、蒸留中に丸底フラスコで定容 (100 mL) を維持します。
- 220 mL の留出油を収集する場合は、実験を停止します。蒸留水 500 mL に収集した留出液を希釈しています。
- 紫外・可視分光計を使用してサンプルを分析し、記録、吸光度 280 nm。
- ペントサン % 希釈、吸光度の値を使用して次の式に従ってを確認します。
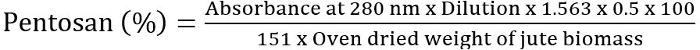 方程式 2
方程式 2
注: このメソッドはペントサン分析9,19パルプ ・紙業界 (竜) 法の技術的な協会を呼び出されます。2 ~ 3 回の実験を繰り返し、ペントサン % の平均値を取る。必要に応じて、最適な制限に吸光度を得るため収集した留出液を希釈します。
-
リグニンの解析
注: は、リグニン分析のため使用する前にジュートのバイオマス存在の湿気を除去します。オーブンで水分を除去する 16 h 105 ° C でジュート バイオマスを維持します。- 50 mL バイアルにジュート バイオマスの 1 g を追加し、だから 72 wt% H2の 15 mL を追加4バイアル ジュート バイオマス。30 ° C 2 時間攪拌設備でホット プレートを使用して混合物をかき混ぜなさい。
- 1 L 丸底フラスコに 150 mL の蒸留水を追加し、消化バイオマス サンプル (バイアルに存在) をフラスコに転送します。
- 195 mL の水で瓶を洗浄し、洗浄液を丸底フラスコ消化バイオマスを含む 1 L に転送。
- 部屋の温度に丸底フラスコを冷却し、4 時間のためのソリューションを逆流します。12 h 不溶性リグニンと灰に落ち着くを待ちます。
- G2 るつぼを使用する灰と不溶性のリグニンを取得するソリューションをフィルター処理します。不溶性の固体酸フリーにお湯 150 mL で洗います。
- オーブンで 16 h 60 ° C で固体 (リグニン + 灰) を乾燥し、さらにそれを乾燥し、オーブンで 1 時間 105 ° C。
- サンプルをおいて、デシケータとサンプルを冷却するとき、重量を取る。この段階で得られるリグニンを含み灰、したがって裸眼リグニンと呼ばれるが。
- 空気の存在下で 5 h 650 ° C で得られたサンプルを熱することによって灰の補正を行います。以下の数式を使用して灰補正を決定します。
 式 3
式 3
4. 変換ペントサンのジュート バイオマスから糖に
- 高圧、高温のバッチ炉 (160 mL パー炉) に乾燥オーブン ジュート バイオマスの 2 g を追加します。酸性 IL の 0.24 g と水 60 mL を加えるし、160 ° C に温度を上げる
- 原子炉は 160 ° C に加熱しながら、攪拌速度を 200 rpm にセットします。160 ° C の温度に達すると、600 rpm に攪拌速度が向上します。
- 1 h の反応を続けます。200 rpm に攪拌速度が低下し、加熱を停止します。
- 部屋の温度に冷却する原子炉を許可します。攪拌を停止、原子炉を開き、反応混合物から固体を分離します。高速液体クロマトグラフィーを用いた反応混合物の分析を実行します。
結果
ペントサンとバイオマスから回復したリグニンの正確な量は、リグノ セルロース系バイオマスの種類によって異なります。リグノ セルロース系バイオマスのさまざまな場所から収集された類似した種類はペントサンとリグニンの濃度の異なるを持つことができます。本研究で使用されるジュート バイオマスには 20 wt% ペントサンと 14 wt% リグニンが含まれています。
無機酸の触媒活性の比較を図 1に示します (H2SO4と HCl) およびジュート バイオマスの C5 糖への変換の酸性 IL。反応は、酸触媒 (すなわち、H+の 1.59 mmol) の同じ酸の量を使用して 160 の ° c (1 h) 水で行われました。非酸性 IL と酸性 IL は、同様のモル濃度 (0.79 モル) で使用されます。触媒の活性は、ブレンステッド酸 (1-ブチル-3-メチルイミダゾリウム塩化) なしの IL でさらに比較されます。
図 2は、 1H、 13C NMR 解析本研究で使用される酸性の IL を示しています。酸性 il (1H と13C) の NMR スペクトルは、酸 IL 以外余分なピークを示していますこれは、合成した酸性の IL が純粋であるを確認します。図 3は、リグニン分離前にジュート バイオマスの x 線回折とジュート バイオマスから分離リグニンの XRD を示します。
表 1は、すべての触媒のハメットの酸度関数 (Ho) 分析を示します。酸強度の測定について説明しますpニトロアニリン インジケーターを使用して分析を行った。

図 1: C5 糖とフルフラールにジュートのバイオマス存在ペントサンの変換。反応条件: ジュート バイオマス 2 g、H+の触媒 1.59 モル (IL と酸性の IL が同じで使用されるモルすなわち、0.79 モル)、60 mL の水、160 ° C、1 h.この図の拡大版を表示するのにはここをクリックしてください。
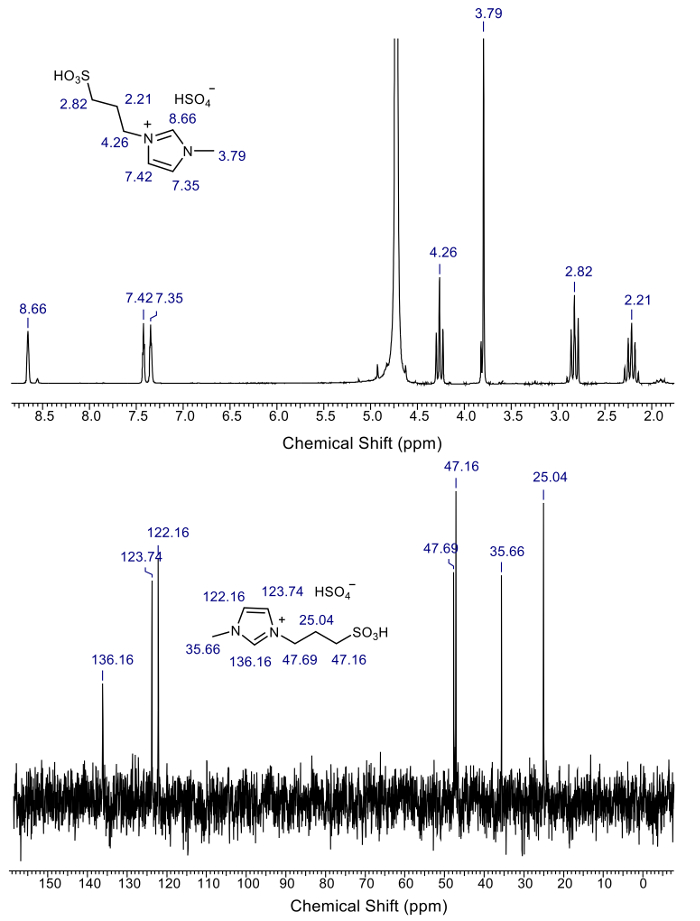
図 2: 1H と13C nmr による酸性 il (1-methyl-3-(3-sulfopropyl)-imidazolium 水素硫酸塩).この図の拡大版を表示するのにはここをクリックしてください。
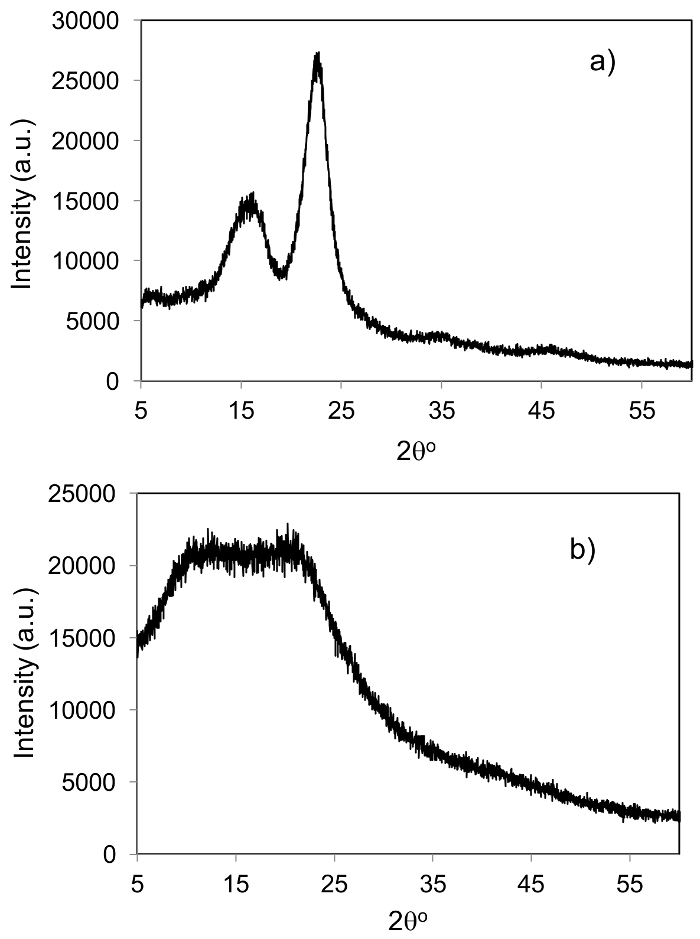
図 3: x 線回折。(、) ジュート バイオマスと (b) の x 線回折リグニンの x 線回折から抽出されたジュート バイオマス。この図の拡大版を表示するのにはここをクリックしてください。
| 触媒 | 最大 | [I] % | [IH+] % | H0 |
| 空白 | 0.991 | 100 | 0 | -- |
| HCl | 0.753 | 76 | 24 | 1.5 |
| H24 | 0.8 | 80.72 | 19.28 | 1.62 |
| 酸性 IL | 0.787 | 79.4 | 20.6 | 1.57 |
| 非酸性の IL | 0.991 | 100 | -- | -- |
表 1: ハメットの酸度関数の決定 (Ho) 各種触媒の。すべての測定で触媒 (1.59 モル H+) はpニトロアニリン水溶液の水 50 mL と混合 ( p-ニトロアニリンの 10 mg は、1 L の水、 p-ニトロアニリンの pKa に追加されました = 0.99)。
ディスカッション
C5 糖モノマーは H2など様々 な均質なブレンステッド酸性触媒を用いた実証にジュート バイオマス変換に存在する、ペントサンなど4、塩酸および酸性 IL。さらに、酸性の IL の触媒の結果は酸味 (1-ブチル-3-メチルイミダゾリウム塩化) なし IL を比較しました。すべての反応は、160 ° c 水でパー オートクレーブで行われました。酸性の IL の使用法を示したこの作品で使用される均一の酸と比較して最高のペントサン変換 (無機酸 H2SO4と HCl)。無機酸表示利回りが低いに対し、酸性 IL が高い C5 糖収量 (76%) を示すことが示唆 (HCl 49%、H24 57 %c5 糖収量ので) ペントサン糖に変換。ミネラル酸触媒と酸性 IL は、異種触媒酸性度の影響を避けるために類似した酸量 (H+の 1.59 モル) で使用されます。反応は、非酸性の IL を使用して、非常に低い C5 糖収量を示した触媒なしに運ばれます。これはペントサン無機酸に比べて糖モノマー化の優れた触媒である酸性 IL を意味します。さらに、イリノイの酸性度は、非酸性の IL の似たような型がこの反応でアクティブではないためこの反応に不可欠です。
C5 糖モノマー (76%) とフルフラール (12%) の非常に高い収率を生成するため、酸性の IL をペントサン リグノ セルロース系バイオマスの存在の分析の使用もできます。このメソッドは、3.85 N HCl と反応時間 (約24 時間) を使用して、セクション 3.1 で説明されている手法と比較してより優れています。酸性の IL を使用して得られた糖をさらにフラン (フルフラール及び様々 なフラン誘導体) に変換またはキシリトールやアラビトールに水素化できます。もっと重要なは、このメソッドを使用してだはペントサン加水分解製品として C5 糖を回復することが可能。ただし、ペントサンの回復はペントサンを濃 HCl19のフランに低下させるためにセクション 3.1 で説明した方法から可能。ILs は下の蒸気圧を有し、したがって、このプロセスを環境的により安全になりますプロセス中に IL 蒸発量の減少の可能性があります。また、腐食性および HCl のリサイクルは、塩酸前処理20,21の主要な問題です。その一方で、ペントサン変換過程で酸性の IL の触媒量の使用はリサイクルできます。
ハメットの酸度 (Ho) 結果が酸性の IL が高い酸強度の測定であることを示した (Ho = 1.57) に比べて H2SO4 (Ho = 1.62);したがって、それは SO4触媒では H2より優先されます。ただし、酸性の IL は HCl と比較して低い酸強度を持っています。リグノ セルロース系バイオマスの2に多糖類と良いイオン-双極子相互作用のために有益である HCl 触媒よりそれにもかかわらず、実行します。さらに、現在の仕事で使用される酸性の IL は 300 ° C の温度 (熱重量分析を用いた分析) 以下熱安定性それは 180 ° C の温度 (酸性 IL 3 h 180 ° C で 60 mL の水で加熱 0.6 g) 下熱水安定2.
さらに、ジュートのバイオマスからのリグニンの分離 Klason メソッド (セクション 3.2) を使用して実行されます。現在の仕事で使用されるジュート バイオマスには 14 wt% リグニンが含まれています。ジュート バイオマスから抽出分離リグニンは純粋で、はるかに少ない灰 (< 1%)、さらに芳香族モノマーに変換することができますが含まれています。
ペントサンとリグニン濃度の分析は、無機酸を使用して行われます (HCl と H2SO4)。また、ペントサン ジュート バイオマス C5 糖 (76%)、5-10% オリゴマーとフルフラール (12%) の優れた収率を示し, 反応で現在の変換に使用される酸性の IL が任意の外部なし酸性の IL の少量を使用して水で行われました。圧力と前処理。また、酸性の IL 展示以上 90% ペントサン変換 (C5 糖、フルフラール、オリゴマーの利回りの助けを借りて、ペントサンの変換を求めた)。
ペントサン ジュート バイオマスの存在の C5 糖への変換法を開発しているが、この方法はジュートのバイオマス存在ペントサン濃度の定量のため適用することができます。また、ペントサン濃度その他の種々 のリグノ セルロース系バイオマスの存在は、現在のメソッドを使用して決定できます。
開示事項
何を開示する必要があります。
謝辞
科学省と台湾の技術 (ほとんど) に感謝したいと思います (104-2628-E-002-008-MY3; 105-2218-E-155-007; 105-2221-E-002-003-MY3; 105-2221-E-002-227-MY3; 105-2622-E-155-003-CC2) と国立台湾でトップ大学プロジェクトの目的資金調達サポートの大学 (105R7706)。サブプロジェクトの高等教育品質向上プロジェクト (HEQEP)、完全な提案 #2071 を通じてこの仕事の一部の資金を世界銀行に感謝しております。この作品は、ウーロンゴン大学 AIIM (金資金) でも部分的に支持されました。
資料
| Name | Company | Catalog Number | Comments |
| 1-Methylimidazole | Sigma Aldrich | M50834 | |
| 1,3-Propanesultone | Sigma Aldrich | P50706 | Moisture sensitive |
| p-nitroaniline | Sigma Aldrich | 185310 | |
| Toluene | J. T. Baker | 9460-03 | |
| Sulfuric acid | Honeywell-Fluka | 30743 | Highly corrosive |
| Hydrochloric acid | Honeywell-Fluka | 30719 | Highly corrosive |
| 1-butyl-3-methylimidazolium chloride | Sigma Aldrich | 900856 | Highly hygroscopic |
| D(+)-Xylose | Acros Organics | 141001000 | |
| L(+)-Arabinose | Acros Organics | 104981000 | |
| UV-Spectrometer | JASCO | V-670 | |
| Parr reactor | Parr USA | Seriese 4560 | |
| Parr reactor controller | Parr USA | Seriese 4848 | |
| High pressure liquid chromatography (HPLC) | JASCO | Seriese LC-2000 | |
| Digital hot plate stirrer | Thermo Scientific | SP142020-33Q Cimarec | |
| Oven furnace | Thermal Scientific | FB1400 Thermolyne blast oven furnace |
参考文献
- Demirbaş, A. Biomass resource facilities and biomass conversion processing for fuels and chemicals. Energy Convers. Manage. 42 (11), 1357-1378 (2001).
- Matsagar, B. M., Dhepe, P. L. Brönsted acidic ionic liquid-catalyzed conversion of hemicellulose into sugars. Catal. Sci. Technol. 5 (1), 531-539 (2015).
- Matsagar, B. M., Dhepe, P. L. Effects of cations, anions and H+ concentration of acidic ionic liquids on the valorization of polysaccharides into furfural. New J Chem. 41 (14), 6137-6144 (2017).
- Costa Lopes, A. M., Morais, A. R. C., Łukasik, R. M. Sustainable Catalytic Strategies for C5-Sugars and Biomass Hemicellulose Conversion Towards Furfural Production. Production of Platform Chemicals from Sustainable Resources. , 45-80 (2017).
- Matsagar, B. M., Munshi, M. K., Kelkar, A. A., Dhepe, P. L. Conversion of concentrated sugar solutions into 5-hydroxymethyl furfural and furfural using Bronsted acidic ionic liquids. Catal. Sci. Technol. 5 (12), 5086-5090 (2015).
- Gürbüz, E. I., et al. Conversion of Hemicellulose into Furfural Using Solid Acid Catalysts in γ-Valerolactone. Angew Chem Int Ed. 52 (4), 1270-1274 (2013).
- Filiciotto, L., Balu, A. M., Van der Waal, J. C., Luque, R. Catalytic insights into the production of biomass-derived side products methyl levulinate, furfural and humins. Catal Today. 302, 2-15 (2017).
- Matsagar, B. M., et al. Direct Production of Furfural in One-pot Fashion from Raw Biomass Using Brønsted Acidic Ionic Liquids. Sci. Rep. 7 (1), 13508 (2017).
- Gschwend, F. J. V., et al. Pretreatment of Lignocellulosic Biomass with Low-cost Ionic Liquids. J Vis Exp. (114), e54246 (2016).
- Xu, F., et al. Transforming biomass conversion with ionic liquids: process intensification and the development of a high-gravity, one-pot process for the production of cellulosic ethanol. Energy Environ. Sci. 9 (3), 1042-1049 (2016).
- Sun, J., et al. One-pot integrated biofuel production using low-cost biocompatible protic ionic liquids. Green Chem. 19 (13), 3152-3163 (2017).
- Nguyen, C. V., et al. Combined treatments for producing 5-hydroxymethylfurfural (HMF) from lignocellulosic biomass. Catal Today. 278 (Part 2), 344-349 (2016).
- Yan, N., Yuan, Y., Dykeman, R., Kou, Y., Dyson, P. J. Hydrodeoxygenation of Lignin-Derived Phenols into Alkanes by Using Nanoparticle Catalysts Combined with Brønsted Acidic Ionic Liquids. Angew Chem Int Ed. 49 (32), 5549-5553 (2010).
- Weerachanchai, P., Lee, J. -. M. Recyclability of an ionic liquid for biomass pretreatment. Bioresour. Technol. 169 (Supplement C), 336-343 (2014).
- Shill, K., et al. Ionic liquid pretreatment of cellulosic biomass: Enzymatic hydrolysis and ionic liquid recycle. Biotechnol Bioeng. 108 (3), 511-520 (2011).
- Tadesse, H., Luque, R. Advances on biomass pretreatment using ionic liquids: An overview. Energy Environ. Sci. 4 (10), 3913-3929 (2011).
- Agirrezabal-Telleria, I., Gandarias, I., Arias, P. L. Production of furfural from pentosan-rich biomass: Analysis of process parameters during simultaneous furfural stripping. Bioresour. Technol. 143 (Supplement C), 258-264 (2013).
- Yingying, L., et al. An Improved Method for Determination of Pentosans in Pulps using Dual-Wavelength Spectroscopy. BioResources. 11 (3), 6801-6807 (2016).
- Kumar, A. K., Sharma, S. Recent updates on different methods of pretreatment of lignocellulosic feedstocks: a review. Bioresour. Bioprocess. 4 (1), 7 (2017).
- Kumar, P., Barrett, D. M., Delwiche, M. J., Stroeve, P. Methods for Pretreatment of Lignocellulosic Biomass for Efficient Hydrolysis and Biofuel Production. Ind. Eng. Chem. Res. 48 (8), 3713-3729 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved