Method Article
郭清とコロナのスライス標本マウス下垂体腺の開発
要約
下垂体腺の解剖し、マウスを開発から下垂体のコロナ セクションを準備するためのプロトコルを提案します。
要約
下垂体または下垂体は重要な内分泌臓器の恒常性に不可欠なホルモンを分泌します。別の胚起源と機能と 2 つの腺で構成されています — 後葉と下垂。小型で細長い楕円形と繊細な開発マウス下垂体です。マウス下垂体の単一のスライスで下垂前葉と後葉の両方を表示する冠状断面お勧めします。
このプロトコルの目的は、マウスを開発してからの手入れが行き届いた組織アーキテクチャで適切な下垂体のコロナ セクションを達成することです。このプロトコルでは解剖およびマウスを開発から正常下垂体腺を処理する方法詳細に述べる。まず、マウス解剖前にホルムアルデヒドの transcardial 灌流を固定です。3 つの異なる解剖技術はマウスの年齢に応じてそのまま下垂体腺を取得に適用されます。胎児マウス高齢者胚日 (E) 17.5 18.5 と新生児を 4 日間に、蝶形骨、腺、および三叉神経を含む全体のセッラ地域は解剖します。子犬の高齢生後 (P) 5-14、下垂体腺、三叉神経接続は全体として解剖しました。以上 3 週齢のマウスに、下垂体腺は周囲の組織から無料解剖慎重に。コロナ セクションを満たすを取得するランドマークとして周囲の組織を使用して、適切な方向に下垂体腺を埋め込む方法も表示されます。これらのメソッドは、マウスの開発に下垂体腺の組織学的・発達的特徴を分析に役立ちます。
概要
下垂体または下垂体が恒常性1,2のために不可欠なホルモンを分泌する重要な内分泌器官です。解剖学的, 下垂体腺、後葉と下垂から成る「2 台」構造です。これらの部品がある異なる胚起源と機能非常に異なる。後葉は神経外胚葉由来、オキシトシンと抗利尿ホルモンを分泌します。下垂ラトケ嚢に由来、成長ホルモン、プロラクチン、甲状腺刺激ホルモン、卵胞刺激ホルモン、黄体形成ホルモン、副腎皮質刺激ホルモンを含むホルモンのリリースを担当し、メラニン細胞刺激ホルモンの3,の4,5。
下垂体腺は、マウス頭蓋骨の蝶形骨 (鞍) の背側表面にかかっている、壊れやすい茎によって脳の床にアタッチされます。三叉神経と前方視交叉6、7それは横方向に囲まれています。腺は細長い楕円形で、その軸に垂直に頭を。背側表面の後葉と下垂することができます簡単に区切られ、背側内側領域と腹の横と、後者の拡張を占める前者で。生後発達期下垂体のサイズが誕生8,9後最初の月に急速に増加します。それにもかかわらず、マウス下垂体は、まだ 1.9 mg の平均重量と 〜 3 mm の長軸径サイズで非常に小さい大人10, 生後 21 (P21) で 2 〜 2.5 mm と P0 でわずか 1 〜 1.5 mm の長軸径。
マウス下垂体の単一のスライスで下垂前葉と後葉の両方を表示する冠状断面お勧めします。ただし、いくつかの技術的なスキルは、非常に小さなサイズと異なる解剖学マウスを開発から下垂体腺のコロナ セクションを満たすを取得する必要があります。このビデオの記事でマウス下垂体腺を分析し、さまざまな開発段階で下垂体のコロナ セクションを準備する方法を示します。
プロトコル
c57bl/6 マウス特定病原体フリーの条件で飼育しています。すべての動物実験、動物実験、第二軍医大学の倫理委員会で承認されたガイドラインに準拠しています
。1。 郭清の生後開発下垂
- 実行麻酔: 低体温症を誘導するために砕いた氷を新生児マウス (P0 - P5) を配置。マウスの年齢の 5 日間以上、麻酔を誘導するために 5% ウレタン (体重の 30 μ L/g) を腹腔内注入します。テール/足指つまみレスポンスを評価します。マウスが有害な刺激への応答後にのみ続行します 。
- そっと前足をテーピングで (上向きの顔、背中に横たわって) 仰臥位でマウスをセキュリティで保護し、あることが作業面にグルタミ固定化学発煙のフードの中に (すなわち、発泡スチロール).
- Transcardial 潅流を行う。
- マウス胸部を中心 (やその他の胸部臓器) を公開する手術ハサミで切っています 。
- は鈍い鉗子との心臓の鼓動をセキュリティで保護、26 G (0.45 mm) 針を左心室に挿入します。針が満ちているヘパリン リン酸緩衝生理食塩水 10 mL のシリンジに接続されている (PBS; 亜硝酸ナトリウム 5 mg/mL と 10 U/mL のヘパリンを添加した、pH 7.4 では、使用する前に 37 ° C に暖かい)。すぐに高級ハサミで右房をカットし、右心房を出る流体がクリアされるまで、温かみのある PBS で体を灌流を開始
。 注: おおよそ 5-10 mL の PBS を新生児マウスに必要な大人のマウスの 10-20 mL PBS 。
- の場所で針し 4% パラホルムアルデヒド (PFA; pH 7.4) で満たされた別の注射器に変更します。10 mL と 20 mL の定着剤を灌流新生児と P21 マウスそれぞれ
。 注意: PFA は有毒です。それは、皮膚と呼吸器の炎症、目の損傷を引き起こすかもしれません。手袋を着用し、化学のフードの下で動作します 。
- PFA 固定マウスの首をはねるし、頭蓋骨骨ハサミで切り開いて。
- は、小さな鉗子で頭蓋底から後脳を慎重に持ち上げます。トルコ鞍の最初の兆候で停止解除しますが、保持する菱脳、下垂体茎と高級ハサミで脳の基部に接続する神経線維に切る。下垂体は脳と離れて解除されていないことを確認重要なこの手順です 。
- は、脳を持ち上げておいてし、下垂体腺を完全に公開する脳全体を削除します。横の三叉神経下垂体など全体セッラ地域をカットとハサミ (約 3 × 5 mm 2) で蝶形骨下 。
- 35 mm ディッシュや冷たい 4 %2 mL を含む 6 ウェル プレートの 1 つの井戸に切り裂かれたティッシュを入れて PFA (pH 7.4)。P0 - 脳下垂体 P7、P14 脳下垂体、P21 - P28 脳下垂体および大人の脳下垂体の 3 h の 1.5 h の 1 h の 40 分のための 4 ° C で組織を修正します 。
- 下垂体のさらに解離
- 洗浄 10 ml の PBS、固定ティッシュ 5 変更、各 15 分。その周囲の組織とともに新生児の下垂と蝶形骨の下には、脱水症状に直接処理できます。5 日間よりも古いマウスから下垂体腺を分離する必要がありますただし、実体顕微鏡下で更なる 。
- は、1 mL の PBS を含む 35 mm ディッシュに固定組織を置きます。P5 の-P14 脳下垂体の微細鉗子、はさみ、骨と神経の結合膜を削除し、慎重に鞍を残して、全体として一緒に横方向の三叉神経下垂を分離します。結合膜による分離腺と神経が接続されている、" H "-外観 ( 図 1 b) を希望します 。
- の P21 および大人脳下垂体神経および下垂体周囲の結合膜を削除し、周囲の組織から腺を無料します。レンズ クリーニング ティッシュ ペーパーと下垂体組織をラップし、埋め込みカセットに入れて
。 注: 折り返しの小さな下垂体でレンズのティッシュ ペーパーを洗浄標本の潜在的な損失を防ぐため、パラフィン包埋手順で組織の整合性を維持するのに役立ちます。それは低温埋め込み手順で小瓶で処理される場合、下垂体をラップする必要がない可能性があります 。
2。埋め込みと押しますパラフィン
- 脱水 15 分 50%、65%、75%、95% のエタノール溶液でカセットを埋め込むことで標本。P21 と古い腺は、純粋なエタノール、P0 - の 3 分の 3 つの変更によって腺 P4、P5 の-P14 腺と各 5 分の 4 分を脱水後。キシレンと明確 3、P0 から各 3 分腺 P4、P5 の-P14 腺と各 5 分の 4 分の変更 P21 および古い腺。P0 - P4 腺の溶融パラフィン ワックス、3 変更、7 分に潜入し、8 分 2 回続いて 6 分一度 P5 の古い腺
。 注: ティッシュの処理のパラメーターを最適経験的調整できます。高品質のセクションを得るためには、十分以上の脱水は避けてください。同じはキシレンを使用して組織をクリアするためです 。
コンソール システムを埋め込み組織に 埋め込み時の向き - カセットから取り外し、溶融パラフィン ワックスで半分いっぱい基本金型に入れます。埋め込みの下垂体の適切な向きはコロナ セクションを満たすため不可欠です 。
- の P21 および成人下垂体腺は、その短い軸基本型 (断面) の底面に垂直に下垂を配置します。蝶形骨と三叉神経解剖学的ランドマークとして P0 - P4 と P5 の-P14 脳下垂体をそれぞれ使用します。三叉神経または基本型の底面に垂直な蝶形骨の横の板片を方向づける 。 ワックスが冷却板に半固体になるまで、
- では目的の位置に温めた微細鉗子で優しくティッシュを保持します。溶融パラフィン ワックス金型をトップします。ワックスが完全に固化するまでを冷却するためパラフィン ブロックを許可します
。 注: 18.5 日下垂体 (E18.5) は新生児下垂体と同じ方法で扱うことができます。脳下垂体 (ラトケ ' s ポーチ) 未満の E16.5 を頭全体が埋め込まれ、基本型の底面に垂直な (後頭部の口) から矢状軸に指向する必要があります 。
- 10 〜 20 分のための-20 ° C でパラフィン ブロックを寒さし、切ってミクロトームに薄膜 (4 μ m の厚みが望ましい) のスライス。満足のいくコロナ セクションを取得するには、断面中にパラフィン ブロックの位置を微調整します。次の手順でスライスの抜け防止のためポリリジン コート ガラス スライド上に組織スライスをマウントします
。 注: また、標本 15% で脱水されることができます 30% (W/V) ショ糖液 (PBS) で同じ向き法を用いた低温埋め込み化合物に埋め込まれ、すぐにドライアイスで凍結、底に沈むまで 4 ° c。クライオスタットを用いた 8-10 μ m のスライスに凍結するティッシュのブロックをカットします。ただし、低温部には、形態はパラフィン セクションに劣る頻繁 。
3。H & E 染色と蛍光ラベリング
- 暖かい熱スライド 55 ° c ブロック、キシレン、2 つの変更、4 分は、各 dewax。95% エタノール二度と 75% エタノール 2 回、各 3 分サンプルを脱水します。シェーカー上で 5 分間蒸留水でスライドを洗うです 。
- の H & 染色、ミョウバン ヘマトキシリン溶液 6 分間のセクションを染色、スケルトンスナイパーの洗浄45 s と再度 2 分間流水ですすぎの 0.2% アンモニア水を 2 分間 ing 水道水を区別します。1 分と 2 分のエオシン染色順次脱水、消去、およびマウントの 95% エタノールでセクションを脱水します 。 蛍光標識
- は、メタノールを含む 3% H 2 O 2 と 0.01% ナン 3 内因性ペルオキシダーゼを不活化する室温で 20 分間のセクションを扱います。沸騰 2 分加温の圧力鍋で検索バッファー (1 mM EDTA と 1 mM トリス-HCl、pH 7.4) のセクション 37 で 30 分のブロック バッファー (PBS で 5% ヤギ血清) のセクションによって抗原を取得 ° C
- 4 で一晩ブロック バッファーで希釈したウサギ抗成長ホルモン (GH) 抗体 (1:2, 000) またはウサギ抗グリア線維性酸性蛋白 (GFAP) 抗体 (1:2, 000) セクションをインキュベート ° C
- 37 で 35 分間インキュベート二次抗体 (ヤギ抗うさぎ IgG HRP、ブロック バッファーに 1: 300) とセクション ° C
- 、室温で 15 分間ビオチニル パスチラミドシグナル (1:50 0.3% H 2 O 2 を含むトリス緩衝生理食塩水) を使用して信号を増幅してストレプトアビジン Alexa594 または 488 (37 ° C、30 分バッファーのブロックに 1: 300) を視覚化します 。
- Counterstain 室温で 5 分間の核を DAPI (PBS で 50 mg/L) と
。 注: パスチラミドシグナル信号増幅 (TSA) システムを使用して信号を増幅する必要ない場合があります。信号を可視化する蛍光標識二次抗体を使用ことができますまたは、します 。
- 蛍光顕微鏡を用いて取得画像搭載 DAPI、テキサス赤と FITC フィルター セット × 4/0.13 × 40/0.75 目標と 5.0 メガピクセルのカメラ。それぞれ、イメージング DAPI、アレクサ 488-Alexa 594 ステンドのセクションに、360、488、および 594 nm のレーザー光の波長を使用しています。レーザー パワーを最適化 (一般に 0.8 を使用) と各チャンネルの所望のレベルに露光時間。画像集録ソフトウェアの制御の下でイメージをキャプチャし、その後画像処理ソフトウェアを用いた蛍光画像をオーバーレイします 。
結果
このプロトコルはマウスを開発から下垂体腺を分析する手法を示す.新生児マウス下垂体, 三叉神経と下を含む全体のセッラ地域の蝶形骨は頭蓋底からうち解剖されました。小型で繊細な下垂体腺はプロセス (図 1 a) の中にそのまま残った。5 日間以上のマウスの横の三叉神経に接続されている下垂体腺は当時孤立しました。マウスがよく保持されていた P7 から分離した下垂体腺 (図 1 b) の総構造。P21 マウス新生仔マウスのそれと比較すると顕著下垂体腺のサイズを増加しました。下垂体腺は周囲組織 (図 1) を削除中目に見えない破損と正常に分離されました。
下垂体の単一のスライスで下垂前葉と後葉の最大の領域を表示するには、冠状断面お勧めします。切り裂かれた下垂体腺はコロナ セクションの満足を達成するために正しく方向づけられました。H & よく示した染色電子保存形態下垂体の後葉 P0、P7、および P21 下垂体腺 (図 2) で。
加工スライスも蛍光ラベリングと互換性があった。たとえば、下垂と下垂体の GH と GFAP、特定の反応を示した (図 3)。
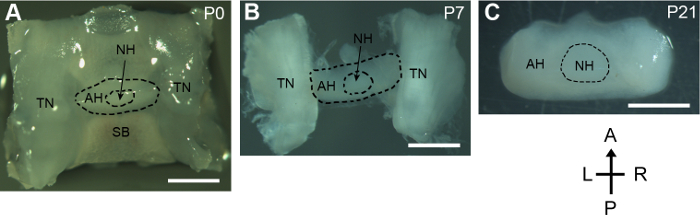
図 1: 生後開発下垂体腺の解剖します。切り裂かれた下垂体腺と P0, P7, と P21 のマウスから周囲の組織の背景色。A, 前面;P、後部;L、左;R、右;SB、蝶形骨;テネシー州、三叉神経;ああ、下垂体;NH、下垂体。スケール バー、1 mm.この図の拡大版を表示するのにはここをクリックしてください。
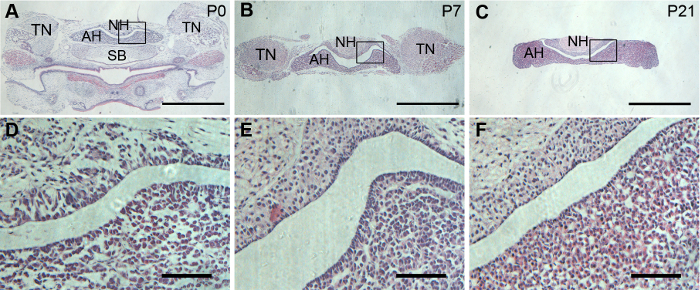
図 2: マウス下垂体腺の組織像。代表 H & P21、P7、P0 のマウスから下垂体のコロナ セクションで染色します。(A B、およびC)、コロナ脳下垂体の低倍率ビュー。(D E、およびF) は、それぞれ (A B、およびC) の組み立てられた区域の拡大です。スケール バー = 1 mm (A、B、および C)。 (D、E、および F) 20 μ m。この図の拡大版を表示するのにはここをクリックしてください。
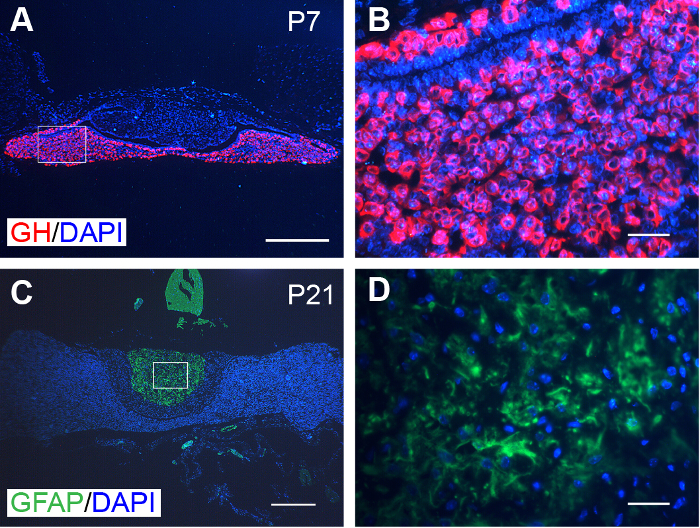
図 3: 下垂体腺の代表的な免疫蛍光染色します。(A) GH (赤) だった P7 マウスから下垂体特異的に発現します。(B) (C) A. GFAP (緑) で囲まれた範囲の拡大鏡イメージだった P21 マウス下垂体特異的に発現します。(D) C. 核で囲まれた範囲の拡大鏡イメージが DAPI (青) に染まっていた。スケールバー = 300 μ m (A、C);・ 30 μ m (B、D)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ネズミの脳下垂体を開発するための小さくて壊れやすい機能と解剖学的特徴6,8により適切なコロナ セクションを得ることが技術的に困難だった。いくつかの研究グループは従って萌芽期・新生児下垂体11,12の形態を分析する半ば矢状のセクションを選んだ。下垂体の半ば矢状断面が前方、中間を示すことができるでも、単一のスライスで後頭葉は、これらの 3 つの葉の最大ビューを表示することができます、冠状断面が非常に好ましい。特に、下垂体とアポトーシスの数を数えると、細胞の増殖の面積と体積の測定などの定量化研究のコロナ セクションは彼らの代表面で半ば矢状セクションに優れています。下垂体腺の解剖し、マウスを開発から下垂体のコロナ セクションの準備に役立つ方法を紹介します。
処理中に下垂体腺を損傷しないように、いくつかのテクニックは、このプロトコルで使用されています。まず、マウス解剖前にホルムアルデヒドの transcardial 灌流を固定です。この固定だけでなく臓器の構造を維持するだけでなく、自動蛍光13になりがちな赤い血液細胞を削除することができます。第二に、全体セッラ地域は下垂体手術難しいツールに触れることを避けるために解剖しました。元の位置で下垂体を維持し、向きを埋め込むための目印にもなって周囲の組織を助けます。これらの方法を採用、若い動物から小さい生後脳下垂体郭清が可能ながら、望ましくない損傷の確率を減らすこと。
このプロトコルでは、術も血流によって事前に固定されていないマウスの下垂体を分離する可能です。その場合、不要な損傷を避けるために多くの注意をすべきである、腺はできるだけ早くも解剖する必要があります。
開発マウス脳下垂体はサイズが非常に小さいので、埋め込む際、正しくそれらを回転するのには非常に困難だった。このプロトコルは、オリエンテーション手順をより簡単に作り、目印として三叉神経や蝶形骨を使用します。適切な方向の脳下垂体はコロナ セクションの満足を達成するために不可欠です。
要約すると、改良された下垂体解離とさまざまな開発段階でマウスに適しているプロトコルを埋め込むを提供します。発達障害研究14の in situハイブリダイゼーション、免疫組織化学的日常的組織の分析に使用するマウス下垂体腺のコロナ セクションを満たすこれらのプロシージャのアプリケーションを取得できます。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、国家自然科学基金、中国の (31201086、31470759、31671219) と上海自然科学財団 (12ZR1436900) からの補助金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Surgical scissors-straight | JinZhong | J21010 | can be purchased from other vendors |
| Fine scissors-strainght | JinZhong | WA1010 | can be purchased from other vendors |
| Blunt forceps | JinZhong | JD1020 | can be purchased from other vendors |
| Fine forceps | Dumont | RS-5015 | for isolation of the pituitary |
| 26G (0.45mm) needle | HongDa | for transcardial perfusion | |
| Syringe (1 mL) | BD | 300841 | can be purchased from other vendors |
| Syringe (10 mL) | BD | can be purchased from other vendors | |
| 35mm dish | Corning | 430165 | can be purchased from other vendors |
| Lens cleaning paper | ShuangQuan | can be purchased from other vendors | |
| Anatomical microscope | OLYMPUS | SZX-ILLB2-200 | can be purchased from other vendors |
| Embedding cassette | Thermo Fisher | 22-272423 | can be purchased from other vendors |
| Tissue embedding console system | KEDEE | KD-BM11 | can be purchased from other vendors |
| Microtome | Thermo Fisher | HM315R | can be purchased from other vendors |
| Superfrost-Plus slides | Thermo Fisher | 22-037-246 | can be purchased from other vendors |
| Cover glass | Thermo Fisher | 12-543 | can be purchased from other vendors |
| Fluorescence microscope | OLYMPUS | BH2-RFCA | can be purchased from other vendors |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Urethane | BBI | EB0448 | |
| NaCl | Sigma | S9625 | for PBS |
| KCl | Sigma | P9541 | for PBS |
| Na2HPO4.12H2O | Sigma | 71650 | for PBS |
| K2HPO4 | Sigma | P2222 | for PBS |
| NaNO2 | Sigma | 237213 | |
| Heparin Sodium Injection | SPH | H31022051 | for perfusion saline |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Ethanol | SCR | 10009218 | |
| Xylene | SCR | 10023418 | |
| Paraffin | Thermo Fisher | 8330 | |
| Hematoxylin | Sigma | H9627 | for H&E staining |
| Eosin Y | Sigma | E4009 | for H&E staining |
| rabbit anti growth hormone (GH) | National Hormone | for immunostaining | |
| antibody | Pituitary Program | ||
| Rabbit anti-mouse GFAP antibody | Sigma | G9269 | for immunostaining |
| Goat anti-rabbit IgG, HRP | Jackson | 111-035-003 | for immunostaining |
| TSA system | NEN Life Science Products | NEL700 | for immunostaining |
| Streptavidin, Alexa Fluor 594 | Thermo Fisher | S32356 | for immunostaining |
| Anti-FITC Alexa Fluor 488 | Thermo Fisher | A11090 | for immunostaining |
参考文献
- Fauquier, T., Lacampagne, A., Travo, P., Bauer, K., Mollard, P. Hidden face of the anterior pituitary. Trends Endocrinol Metab. 13 (7), 304-309 (2002).
- Haedo, M. R., et al. Regulation of pituitary function by cytokines. Horm Res. 72 (5), 266-274 (2009).
- Zhu, X., Gleiberman, A. S., Rosenfeld, M. G. Molecular physiology of pituitary development: signaling and transcriptional networks. Physiol Rev. 87 (3), 933-963 (2007).
- Bancalari, R. E., Gregory, L. C., McCabe, M. J., Dattani, M. T. Pituitary gland development: an update. Endocr Dev. 23, 1-15 (2012).
- Kelberman, D., Rizzoti, K., Lovell-Badge, R., Robinson, I. C., Dattani, M. T. Genetic regulation of pituitary gland development in human and mouse. Endocr Rev. 30 (7), 790-829 (2009).
- Peker, S., Kurtkaya-Yapicier, O., Kilic, T., Pamir, M. N. Microsurgical anatomy of the lateral walls of the pituitary fossa. Acta Neurochir (Wien). 147 (6), 641-648 (2005).
- Wolpert, S. M., Molitch, M. E., Goldman, J. A., Wood, J. B. Size, shape, and appearance of the normal female pituitary gland. AJR Am J Roentgenol. 143 (2), 377-381 (1984).
- Carbajo-Perez, E., Watanabe, Y. G. Cellular proliferation in the anterior pituitary of the rat during the postnatal period. Cell Tissue Res. 261 (2), 333-338 (1990).
- Nantie, L. B., Himes, A. D., Getz, D. R., Raetzman, L. T. Notch signaling in postnatal pituitary expansion: proliferation, progenitors, and cell specification. Mol Endocrinol. 28 (5), 731-744 (2014).
- Tzou, S. C., Landek-Salgado, M. A., Kimura, H., Caturegli, P. Preparation of mouse pituitary immunogen for the induction of experimental autoimmune hypophysitis. J Vis Exp. (46), (2010).
- Budry, L., et al. Related pituitary cell lineages develop into interdigitated 3D cell networks. Proc Natl Acad Sci U S A. 108 (30), 12515-12520 (2011).
- Wilson, D. B., Wyatt, D. P. Histopathology of the pituitary gland in neonatal little (lit) mutant mice. Histol Histopathol. 7 (3), 451-455 (1992).
- Jonkers, B. W., Sterk, J. C., Wouterlood, F. G. Transcardial perfusion fixation of the CNS by means of a compressed-air-driven device. J Neurosci Methods. 12 (2), 141-149 (1984).
- Cao, D., et al. ZBTB20 is required for anterior pituitary development and lactotrope specification. Nat Commun. 7, 11121 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved