Method Article
Dissection et préparation de tranches coronales de développer la glande pituitaire souris
Dans cet article
Résumé
Nous présentons un protocole pour disséquer les glandes pituitaires et préparer hypophysaires sections coronales des pays en développement de la souris.
Résumé
La glande pituitaire ou hypophyse est un organe endocrine sécrétant des hormones essentielles pour l’homéostasie. Il se compose de deux glandes avec origines embryonnaires distinctes et les fonctions — la neurohypophyse et l’adénohypophyse. L’hypophyse en développement de souris est minuscule et délicat avec une forme ovale allongée. Une section coronale est préférée à afficher l’adénohypophyse et la neurohypophyse en une seule tranche de l’hypophyse de la souris.
Le but du présent protocole est d’atteindre la bonne sections coronales hypophysaires avec des architectures de tissu bien préservé des pays en développement de la souris. Dans ce protocole, nous décrivons en détail comment disséquer et traiter des glandes pituitaires correctement des pays en développement de la souris. Tout d’abord, les souris sont fixés par transcardial perfusion de formaldéhyde avant la dissection. Puis les trois techniques différentes de dissection sont appliquées pour obtenir les hypophyses intacts selon l’âge de la souris. Chez les souris foetales de jours embryonnaires (E) 17,5-18,5 et nouveaux-nés vers le haut à 4 jours, les régions de sella entière y compris le sphénoïde, glandes et des nerfs trijumeau sont disséquées. Pour les petits âgés jours (P) 5-14, les glandes pituitaires reliés aux nerfs trijumeau sont disséqués dans son ensemble. Pour les souris âgé de plus de 3 semaines, les glandes pituitaires sont soigneusement disséqués gratuite les tissus environnants. Nous affichons également comment intégrer les glandes pituitaires dans une orientation appropriée en utilisant les tissus environnants comme repères pour obtenir satisfaisant des sections coronales. Ces méthodes sont utiles dans l’analyse des caractéristiques histologiques et du développement des glandes pituitaires dans le développement des souris.
Introduction
La glande pituitaire ou hypophyse est un organe endocrine sécrétant des hormones essentielles pour l’homéostasie1,2. Anatomiquement, l’hypophyse est une structure '' two-in-one'', consistant en la neurohypophyse et l’adénohypophyse. Ces pièces ont très différemment de fonction et différentes origines embryonnaires. La neurohypophyse est dérivée de l’ectoderme neural et sécrète de l’ocytocine et l’hormone antidiurétique. L’adénohypophyse provient de la poche de Rathke et est responsable de la libération d’hormones dont l’hormone de croissance, prolactine, hormone stimulant la thyroïde, hormone folliculo - stimulante, hormone lutéinisante, hormone corticotrope, et hormone folliculostimulante de mélanocytes –3,4,5.
La glande pituitaire repose sur la surface dorsale de l’OS sphénoïde (selle turcique) du crâne de souris et est fixée sur le plancher du cerveau par une tige fragile. Il est entouré latéralement par les nerfs trijumeau et vers l’avant par le chiasma6,7. La glande a une forme ovale allongée avec son grand axe perpendiculaire à celui de la tête. Sur sa face dorsale, la neurohypophyse et l’adénohypophyse peuvent facilement être délimités, avec l’ancien occupant la région médiane dorsale et la dernière s’étendant latéralement et sur le ventre. Pendant le développement postnatal, la taille de l’hypophyse augmente rapidement durant le premier mois après la naissance de8,9. Néanmoins, l’hypophyse de la souris est toujours très petite taille avec un poids moyen de 1,9 mg et d’un diamètre d’axe de ~ 3 mm en adulte10, axe de diamètre de 2 à 2,5 mm au 21e jour (P21) et seulement 1 à 1,5 mm au P0.
Une section coronale est préférable pour afficher l’adénohypophyse et neurohypophyse en une seule tranche de l’hypophyse de la souris. Toutefois, certaines compétences techniques sont nécessaires pour obtenir satisfaisant coronales sections des glandes pituitaires des pays en développement de souris grâce à sa taille exceptionnellement petite et anatomie distincte. Dans cet article en vidéo, nous démontrons comment disséquer les hypophyses souris et préparer les sections coronales hypophysaires aux stades de développement différents.
Protocole
souris C57BL/6 sont élevés dans des conditions spécifiques exempts de micro-organismes pathogènes. Toutes les méthodes expérimentales animales sont en conformité avec les directives approuvées par le Comité d’éthique à l’Université de médecine militaire de seconde et animalier.
1. dissection de Postnatal développant hypophyse
- Perform anesthésie : placer la souris néonatales (P0 - P5) sur la glace pilée pour induire l’hypothermie. Pour les souris âgées de 5 jours, injecter 5 % uréthane (30 µL/g de poids corporel) par voie intrapéritonéale pour induire l’anesthésie. Évaluer les réponses pour queue/orteil pincées. Poursuivre uniquement après que la souris ne répond pas aux stimuli nocifs.
- Garantir la souris en décubitus dorsal (couché sur le dos, face vers le haut) en enregistrant doucement les pattes de devant et pattes sur une surface de travail qui peut être épinglé (c.-à-d., mousse de styrol) à l’intérieur d’une hotte chimique.
- Effectuer perfusion transcardial.
- Couper la cage thoracique de souris avec des ciseaux chirurgicaux pour exposer le cœur (et les autres organes thoraciques).
- Fixer le cœur battant avec une pince émoussée et insérer une aiguille 26G (0,45 mm) dans le ventricule gauche. L’aiguille est attachée à une seringue de 10 mL remplie avec du sérum physiologique hépariné tamponnée au phosphate (PBS ; additionné de nitrite de sodium 5 mg/mL et 10 U/mL héparine, pH 7,4, chauffé à 37 ° C avant utilisation). Immédiatement coupé l’oreillette droite avec des ciseaux fins et commencent à perfuse le corps avec du PBS chaud jusqu'à ce que le liquide sortant de l’oreillette droite est clair.
NOTE : Environ 5 à 10 mL de PBS est nécessaire pour les souris néonatales et 10-20 mL de PBS de souris adultes. - Maintenir l’aiguille en place et mettre en place une autre seringue remplie de paraformaldéhyde à 4 % (PFA ; pH 7,4). Perfuse 10 mL et 20 mL de fixateur pour néonatale et P21 souris, respectivement.
ATTENTION : PFA est toxique. Il peut causer des irritations respiratoires et la peau et des lésions oculaires. Porter des gants et travailler sous une hotte chimique.
- Décapiter la souris PFA-correction et couper l’OS crânien ouvert avec des ciseaux.
- , Soulevez doucement le cerveau postérieur de la base du crâne avec une petite pince. Dès les premiers signes de la selle turcique, arrêt levage mais maintenez le cerveau postérieur, couper la tige pituitaire et les fibres nerveuses se connecter à la base du cerveau avec des ciseaux fins. Cette étape est essentielle pour s’assurer que l’hypophyse n’est pas levé de loin avec le cerveau.
- Puis garder le cerveau de levage et enlever tout le cerveau afin d’exposer l’hypophyse entièrement. Couper la région entière sella dont la glande pituitaire, les nerfs trijumeau latérales et le dessous sphénoïde avec des ciseaux (environ 3 x 5 mm 2).
- Mettre le tissu découpé dans un plat de 35 mm ou d’un puits d’une plaque de 6 puits contenant 2 mL froid 4 % PFA (pH 7,4). Fixer le tissu à 4 ° C pendant 40 min pour P0 - P7 hypophyses, 1 h pour P14 hypophyses, 1,5 h pour P21 - P28 hypophyses et 3 h pour adultes hypophyses.
- Dissociation plus d’hypophyse
- laver le tissu fixe avec 10 mL de PBS, 5 changements, 15 min chacun. L’hypophyse néonatale ainsi que ses tissus environnants et les sous sphénoïde peuvent être traitées directement à la déshydratation. Toutefois, des glandes pituitaires de souris plus de 5 jours doit être dissociés sous un microscope stéréo.
- Mettre le tissu fixe dans un plat de 35 mm contenant 1 mL de PBS. Pour P5 - P14 hypophyses, retirer les membranes conjonctives entre les nerfs et les os avec des ciseaux et des pinces fines et isoler soigneusement l’hypophyse ainsi que latérales nerfs trijumeau dans son ensemble, mais laissant la selle turcique. La glande isolée et les nerfs sont reliés par des membranes conjonctives avec une " H "-comme l’aspect ( Figure 1 b).
- Pour P21 et adulte hypophyses, enlever les nerfs et les membranes conjonctives autour de la glande pituitaire et libérer la glande les tissus environnants. Enroulez le tissu hypophysaire avec papier-tissu de nettoyage pour lentilles et mettez-la dans une cassette d’encastrement.
NOTE : Enveloppant l’hypophyse minuscule avec papier-tissu de nettoyage pour lentilles contribue à prévenir toute perte potentielle de spécimens et de préserver l’intégrité des tissus dans la procédure suivante d’enrobage de paraffine. Il n’est peut-être pas nécessaire d’envelopper l’hypophyse s’il est traité dans une petite bouteille dans la procédure cryo-embedding.
2. Paraffine Embedding et sectionnement
- déshydrater les spécimens en incorporant des cassettes avec des solutions d’éthanol 50 %, 65 %, 75 % et 95 % pour 15 min chacun. Par la suite déshydrater avec 3 changements d’éthanol pur, 3 min de chaque pour P0 - P4 glandes, 4 min de chaque pour P5 - P14 glandes et 5 min chacun pour P21 et glandes plus âgés. Clair avec xylène, 3 changements, 3 min de chaque pour P0 - P4 glandes, 4 min de chaque pour P5 - P14 glandes et à 5 min de chaque pour P21 et glandes plus âgés. Infiltrer avec cire de paraffine fondue, 3 changements, 7 min de chaque pour P0 - P4 glandes, et 8 min deux fois suivi par 6 min une fois pour P5 et glandes âgées.
Remarque : Les paramètres optimaux pour le traitement des tissus peuvent être ajustés empiriquement. Pour obtenir des Articles de haute qualité, déshydratation insuffisante ou plue devrait être évitée. Le même est vrai pour dégager le tissu à l’aide de xylène. - L' orientation lors de l’incorporation sur un tissu intégrant le système de la console, retirer l’échantillon de la cassette et le placer dans un moule à base remplie à moitié avec de la cire de paraffine fondue. L’orientation correcte de la glande pituitaire encastrement est essentielle pour satisfaire les sections coronales.
- Pour P21 et adulte hypophyses, positionner l’hypophyse avec son axe court perpendiculairement à la surface de fond d’un moule (le plan de section). Utilisez sphénoïde OS et nerfs trijumeau comme points de repère anatomiques pour P0 - P4 et P5 - P14 hypophyses, respectivement. Orienter les spécimens avec leurs nerfs trijumeau ou lame transversale des os sphénoïde perpendiculaires à la surface de fond d’un moule.
- Tenez délicatement le tissu dans la position désirée avec une pince fine chauffée jusqu'à ce que la cire devienne semi-solide sur une plaque de refroidissement. Remplir le moule avec la cire de paraffine fondue. Laissez le bloc de paraffine refroidir jusqu'à ce que la cire est complètement solidifiée.
Remarque : L’hypophyse à jour embryonnaire 18,5 (E18.5) peut être traitée de la même manière que l’hypophyse néonatale. Mais la glande pituitaire (Rathke ' pochettes s) âgés de moins de E16.5 devrait être intégrée avec la tête entière et orientée avec l’axe sagittal (de bouche à la protubérance occipitale) perpendiculaire à la surface de fond d’un moule.
- Refroidir le bloc de paraffine à-20 ° C pendant 10-20 min et puis le couper en fines tranches (4 µm d’épaisseur est préféré) avec un microtome. Pour obtenir des sections coronales satisfaisantes, affiner la position des blocs de paraffine pendant la découpe. Monter les tranches de tissus sur lames de verre enduit de polylysine pour éviter le détachement des tranches dans les procédures suivantes.
Remarque : Vous pouvez également spécimens peuvent être déshydratés dans 15 %, 30 % (P/V) des solutions de saccharose (dans du PBS) à 4 ° C jusqu'à ce qu’ils déposent au fond, incorporé dans l’enrobage cryo composé utilisant la même méthode d’orientation et rapidement gelé sur la glace sèche. Ensuite, couper les blocs de tissus congelés en tranches de 8 à 10 mm à l’aide d’un cryostat. La morphologie des cryo-sections, cependant, est souvent inférieure aux sections de paraffine.
3. H & E coloration et Immunofluorescence Labeling
- chaude les diapositives sous une chaleur bloquent à 55 ° C et déparaffinage xylène, 2 changements, 4 min. Déshydrater les échantillons avec deux fois plus d’éthanol à 95 % et 75 % éthanol deux fois, 3 min chaque. Laver les lames avec l’eau distillée pendant 5 min sur un agitateur.
- Pour H & E coloration, détachant les sections en solution l’hématoxyline alun pendant 6 min, rincer dans runnl’eau du robinet pendant 2 min, ING se différencient avec 0,2 % d’eau ammoniaque pour 45 s et re-rincer à l’eau courante pendant 2 min. Puis déshydrater les sections avec l’éthanol à 95 % pour 1 min et la tache avec de l’éosine à 2 min. séquentiellement déshydratent, effacer et Mont.
- En immunofluorescence labeling
- traite les sections avec du méthanol contenant 3 % H 2 O 2 et 0,01 % NaN 3 pendant 20 min à température ambiante pour inactiver les peroxydases endogènes. Récupérer les antigènes en faisant bouillir des sections dans le tampon d’extraction (EDTA 1 mM et 1 mM Tris-HCl, pH 7,4) dans un autocuiseur pendant 2 min. laisser incuber les sections avec un tampon de blocage (5 % de sérum de chèvre dans du PBS) pendant 30 min à 37 ° C.
- Incuber les sections avec des anticorps de lapin anti-croissance hormone (GH) (1:2, 000) ou des anticorps de lapin anti-gliales protéine fibrillaire acide (GFAP) (1:2, 000) diluées dans un tampon bloquant toute la nuit à 4 ° C.
- Incuber des sections avec l’anticorps secondaire (chèvre du anti-lapin IgG-HRP, 1 : 300 dans un tampon bloquant) pendant 35 min à 37 ° C.
- Amplifier les signaux à l’aide de Biotinyl Tyramide (01:50 dans une solution saline tamponnée de Tris contenant 0,3 % H 2 O 2) pendant 15 min à température ambiante et de visualiser avec la Streptavidine-Alexa594 ou 488 (1 : 300 dans le blocage de tampon, 30 min, 37 ° C).
- Contre-coloration les noyaux au DAPI (50 mg/L dans du PBS) pendant 5 min à température ambiante.
Remarque : Il n’est peut-être pas nécessaire amplifier le signal à l’aide du système d’Amplification de Signal Tyramide (TSA). Par ailleurs, un anticorps secondaire conjugué fluorescence permet de visualiser le signal.
- D’acquérir des images à l’aide d’un microscope à fluorescence équipé DAPI, Texas Red et jeux de filtres FITC, × 4/0,13 × 40/0,75 objectifs et appareil photo 5,0 mégapixels. Utilisez la 360, 488 et longueurs d’onde de 594 nm laser pour imagerie DAPI Alexa 488 - sections et colorés à Alexa 594, respectivement. Optimiser la puissance du laser (0,8 servait généralement) et durée d’exposition aux niveaux souhaités pour chaque canal. Capturer l’image sous le contrôle du logiciel d’acquisition image et superposer les images de fluorescence ultérieurement à l’aide de logiciels de traitement d’image.
Résultats
Ce protocole présente une méthode pour disséquer les glandes pituitaires des pays en développement de la souris. Pour la souris néonatale, des régions entières sella contenant la glande pituitaire, les nerfs trijumeau et le dessous sphénoïde ont été disséqués à partir de la base du crâne. L’hypophyse minuscule et délicate sont restés intact au cours du processus (Figure 1 a). Pour les souris plus de 5 jours, les glandes pituitaires attachés aux nerfs trijumeau latérales ont été ensuite isolés. La structure brute de la glande pituitaire isolée de la P7 souris a été bien conservée (Figure 1 b). La souris de P21, la taille de la glande pituitaire a été augmentée remarquablement comparée à celle de la souris néonatale. L’hypophyse a avec succès isolé avec dommages invisibles tout en éliminant ses tissus environnants (Figure 1).
Pour afficher la région maximale d’adénohypophyse et neurohypophyse en une seule tranche de l’hypophyse, une section coronale est préférée. Les glandes pituitaires disséqués ont été correctement orientés pour atteindre satisfaisant des sections coronales. H & E coloration montrent bien préservé de morphologie de l’adénohypophyse tant neurohypophyse dans glandes pituitaires P0, P7 et P21 (Figure 2).
Les tranches transformés sont également compatibles avec immunofluorescence labeling. À titre d’exemple, l’adénohypophyse et la neurohypophyse a montré un immunomarquage spécifique de GH et GFAP, respectivement (Figure 3).
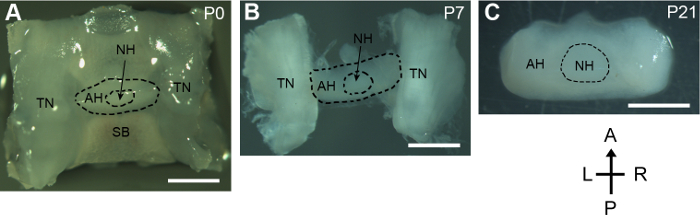
Figure 1 : Dissection des hypophyses en développement postnatals. Vue dorsale des hypophyses disséqués et les tissus environnants de souris P0, P7 et P21. A, antérieure ; P, postérieur ; L, gauche ; R, droite ; SB, sphénoïde ; TN, nerf trijumeau ; AH, adénohypophyse ; NH, la neurohypophyse. Échelle de barres, de 1 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
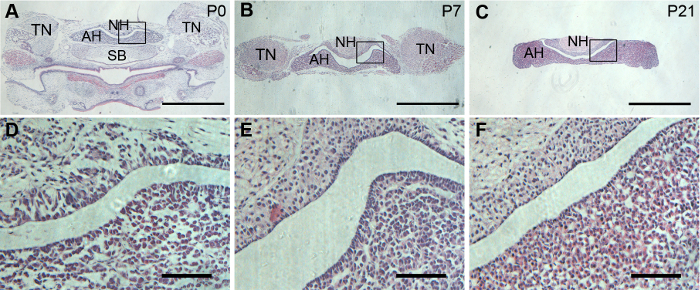
Figure 2 : histologie des glandes pituitaires souris. Représentant H & E coloration sur des souris P0, P7 et P21, les coupes coronales hypophysaires. (A, Bet C) sont vues de faible grossissement des hypophyses coronales. (D, Eet F) sont respectivement l’élargissement des zones encadrées dans (A, Bet C). Barreaux de l’échelle = 1 mm de (A, B et C) ; et 20 µm (D, E et F). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
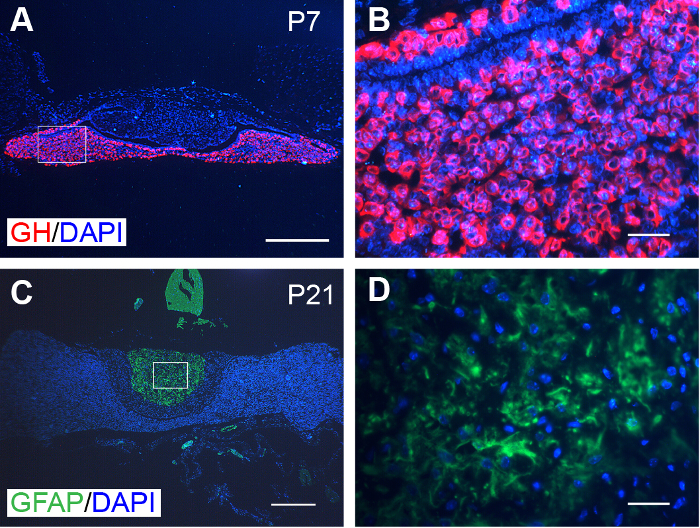
Figure 3 : immunofluorescence représentatifs sur les glandes pituitaires. (A) GH (rouge) a été spécifiquement exprimé dans l’adénohypophyse des souris P7. (B) Magnified image de la zone encadrée en A. (C) GFAP (vert) a été spécifiquement exprimé dans la neurohypophyse de souris P21. (D) Magnified image de la zone encadrée en C. noyaux ont été colorés au DAPI (bleu). Echelle = 300 µm (A et C) ; et 30 µm (B et D). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Pour développer des hypophyses murins, il a été techniquement difficile d’obtenir des sections coronales appropriées en raison de leurs caractéristiques de minuscules et fragiles et les particularités anatomiques6,8. Certains groupes de recherche a donc choisi des sections misagittal d’analyser la morphologie embryonnaire et néonatale hypophysaire11,,12. Bien que la section longitudinal de l’hypophyse est également capable de montrer antérieure, intermédiaire, et les lobes postérieurs en une seule tranche, la section coronale est hautement préférable car il peut montrer une vue maximale de ces trois lobes. En particulier, pour des études de quantification, comme la détermination du volume et de la région de l’hypophyse et compter le nombre de l’apoptose et la prolifération de cellules, sections coronales sont supérieures aux sections longitudinal sur le plan de leur représentant. Nous présentons ici une méthode utile pour disséquer les glandes pituitaires et préparer hypophysaires sections coronales des pays en développement de la souris.
Pour éviter d’endommager les glandes pituitaires au cours du processus, plusieurs techniques ont été utilisées dans le présent protocole. Tout d’abord, les souris sont fixés par transcardial perfusion de formaldéhyde avant la dissection. Ce fixatif permet non seulement de préserver l’architecture de l’orgue mais aussi pour éliminer les globules rouges qui se traduisent souvent par auto fluorescence13. En second lieu, la région entière sella est disséquée pour éviter de toucher l’hypophyse avec n’importe quel outils durs-chirurgicale. Les tissus environnants aident à garder la glande pituitaire dans sa position d’origine et également servir de points de repère pour l’incorporation de l’orientation. Avec ces méthodes employées, petits postnatals hypophyses de jeunes animaux peuvent être disséqués, tout en réduisant la probabilité de dommages non désirés.
La procédure de dissection dans le présent protocole est également applicable pour isoler murine pituitaire qui n’a pas été préalablement fixé par perfusion. Dans ce cas, plus de prudence devrait être prises pour éviter tout dommage non désiré et la glande devrait également être disséquée aussi rapidement que possible.
Hypophyses murines en développement étant très petites taille, il a été très difficile à orienter correctement lors de l’incorporation. Ce protocole utilise les nerfs trijumeau ou OS sphénoïde comme repères, faire les étapes d’orientation beaucoup plus facile. Hypophyses correctement orientés sont essentielles pour parvenir à satisfaire les sections coronales.
En résumé, nous offrons une meilleure dissection hypophysaire et incorporation de protocole, qui convient aux souris, aux stades de développement différents. Application de ces procédures peut obtenir satisfaction coronales sections des hypophyses murins à utiliser pour l’analyse de routine histologie, immunohistochimie, hybridation in situ et développement en recherche14.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par les subventions de la Fondation de sciences naturelles nationales de la Chine (31201086, 31470759 et 31671219) et la Fondation des sciences naturelles de Shanghai (12ZR1436900).
matériels
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Surgical scissors-straight | JinZhong | J21010 | can be purchased from other vendors |
| Fine scissors-strainght | JinZhong | WA1010 | can be purchased from other vendors |
| Blunt forceps | JinZhong | JD1020 | can be purchased from other vendors |
| Fine forceps | Dumont | RS-5015 | for isolation of the pituitary |
| 26G (0.45mm) needle | HongDa | for transcardial perfusion | |
| Syringe (1 mL) | BD | 300841 | can be purchased from other vendors |
| Syringe (10 mL) | BD | can be purchased from other vendors | |
| 35mm dish | Corning | 430165 | can be purchased from other vendors |
| Lens cleaning paper | ShuangQuan | can be purchased from other vendors | |
| Anatomical microscope | OLYMPUS | SZX-ILLB2-200 | can be purchased from other vendors |
| Embedding cassette | Thermo Fisher | 22-272423 | can be purchased from other vendors |
| Tissue embedding console system | KEDEE | KD-BM11 | can be purchased from other vendors |
| Microtome | Thermo Fisher | HM315R | can be purchased from other vendors |
| Superfrost-Plus slides | Thermo Fisher | 22-037-246 | can be purchased from other vendors |
| Cover glass | Thermo Fisher | 12-543 | can be purchased from other vendors |
| Fluorescence microscope | OLYMPUS | BH2-RFCA | can be purchased from other vendors |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Urethane | BBI | EB0448 | |
| NaCl | Sigma | S9625 | for PBS |
| KCl | Sigma | P9541 | for PBS |
| Na2HPO4.12H2O | Sigma | 71650 | for PBS |
| K2HPO4 | Sigma | P2222 | for PBS |
| NaNO2 | Sigma | 237213 | |
| Heparin Sodium Injection | SPH | H31022051 | for perfusion saline |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Ethanol | SCR | 10009218 | |
| Xylene | SCR | 10023418 | |
| Paraffin | Thermo Fisher | 8330 | |
| Hematoxylin | Sigma | H9627 | for H&E staining |
| Eosin Y | Sigma | E4009 | for H&E staining |
| rabbit anti growth hormone (GH) | National Hormone | for immunostaining | |
| antibody | Pituitary Program | ||
| Rabbit anti-mouse GFAP antibody | Sigma | G9269 | for immunostaining |
| Goat anti-rabbit IgG, HRP | Jackson | 111-035-003 | for immunostaining |
| TSA system | NEN Life Science Products | NEL700 | for immunostaining |
| Streptavidin, Alexa Fluor 594 | Thermo Fisher | S32356 | for immunostaining |
| Anti-FITC Alexa Fluor 488 | Thermo Fisher | A11090 | for immunostaining |
Références
- Fauquier, T., Lacampagne, A., Travo, P., Bauer, K., Mollard, P. Hidden face of the anterior pituitary. Trends Endocrinol Metab. 13 (7), 304-309 (2002).
- Haedo, M. R., et al. Regulation of pituitary function by cytokines. Horm Res. 72 (5), 266-274 (2009).
- Zhu, X., Gleiberman, A. S., Rosenfeld, M. G. Molecular physiology of pituitary development: signaling and transcriptional networks. Physiol Rev. 87 (3), 933-963 (2007).
- Bancalari, R. E., Gregory, L. C., McCabe, M. J., Dattani, M. T. Pituitary gland development: an update. Endocr Dev. 23, 1-15 (2012).
- Kelberman, D., Rizzoti, K., Lovell-Badge, R., Robinson, I. C., Dattani, M. T. Genetic regulation of pituitary gland development in human and mouse. Endocr Rev. 30 (7), 790-829 (2009).
- Peker, S., Kurtkaya-Yapicier, O., Kilic, T., Pamir, M. N. Microsurgical anatomy of the lateral walls of the pituitary fossa. Acta Neurochir (Wien). 147 (6), 641-648 (2005).
- Wolpert, S. M., Molitch, M. E., Goldman, J. A., Wood, J. B. Size, shape, and appearance of the normal female pituitary gland. AJR Am J Roentgenol. 143 (2), 377-381 (1984).
- Carbajo-Perez, E., Watanabe, Y. G. Cellular proliferation in the anterior pituitary of the rat during the postnatal period. Cell Tissue Res. 261 (2), 333-338 (1990).
- Nantie, L. B., Himes, A. D., Getz, D. R., Raetzman, L. T. Notch signaling in postnatal pituitary expansion: proliferation, progenitors, and cell specification. Mol Endocrinol. 28 (5), 731-744 (2014).
- Tzou, S. C., Landek-Salgado, M. A., Kimura, H., Caturegli, P. Preparation of mouse pituitary immunogen for the induction of experimental autoimmune hypophysitis. J Vis Exp. (46), (2010).
- Budry, L., et al. Related pituitary cell lineages develop into interdigitated 3D cell networks. Proc Natl Acad Sci U S A. 108 (30), 12515-12520 (2011).
- Wilson, D. B., Wyatt, D. P. Histopathology of the pituitary gland in neonatal little (lit) mutant mice. Histol Histopathol. 7 (3), 451-455 (1992).
- Jonkers, B. W., Sterk, J. C., Wouterlood, F. G. Transcardial perfusion fixation of the CNS by means of a compressed-air-driven device. J Neurosci Methods. 12 (2), 141-149 (1984).
- Cao, D., et al. ZBTB20 is required for anterior pituitary development and lactotrope specification. Nat Commun. 7, 11121(2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon