Method Article
Disección y preparación del segmento Coronal de desarrollo de hipófisis de ratón
En este artículo
Resumen
Presentamos un protocolo para diseccionar las glándulas pituitaria y preparar pituitarias secciones coronales de desarrollar ratones.
Resumen
La glándula pituitaria o hipófisis es un importante órgano endocrino que secreta hormonas esenciales para la homeostasis. Consta de dos glándulas con funciones y orígenes embrionarios separados, la neurohipófisis y la adenohipófisis. La hipófisis de ratón en desarrollo es pequeño y delicado con una forma oval alargada. Una sección coronal es preferida para mostrar la adenohipófisis y la neurohipófisis en una sola rebanada de la hipófisis de ratón.
El objetivo de este protocolo es lograr la correcta secciones coronales pituitarias con arquitecturas de tejido preservado de desarrollar ratones. En este protocolo, se describe en detalle cómo diseccionar y glándulas pituitarias correctamente de desarrollar ratones. En primer lugar, ratones son fijados por perfusión de transcardial del formaldehído antes de la disección. Luego se aplican tres diferentes técnicas de disección para obtener las glándulas pituitaria intactas dependiendo de la edad de los ratones. Para ratones fetales a partir de 17.5-18.5 días embrionarios (E) y los recién nacidos hasta 4 días, las regiones de sella todo incluyendo el hueso esfenoides, glándulas y nervios de trigeminal se disecan. Para cachorros edad postnatales días (P) 5-14, las glándulas pituitaria conectados con los nervios de trigeminal son disecados en su conjunto. Para ratones de 3 semanas de edad, las glándulas pituitarias se disecan con cuidado gratis de los tejidos circundantes. También nos muestra cómo incrustar las glándulas pituitarias en una orientación adecuada mediante el uso de los tejidos circundantes como puntos de referencia para obtener satisfacción de secciones coronales. Estos métodos son útiles en el análisis de características histológicas y del desarrollo de las glándulas de la hipófisis en el desarrollo de ratones.
Introducción
La glándula pituitaria o hipófisis es un importante órgano endocrino que secreta hormonas esenciales para la homeostasis1,2. Anatómicamente, la glándula pituitaria es una estructura de '' dos en uno '' que consiste en la neurohipófisis y la adenohipófisis. Estas piezas tienen función y diferente origen embrionario muy diferentemente. La neurohipófisis deriva del ectodermo neural y segrega oxitocina y hormona antidiurética. La adenohipófisis se origina de la bolsa de Rathke y es responsable de la liberación de hormonas, incluyendo hormona del crecimiento, prolactina, tirotropina, hormona folículo estimulante, hormona luteinizante, hormona adrenocorticotrópica, y hormona estimulante de melanocitos3,4,5.
La glándula pituitaria se basa en la superficie dorsal del hueso esfenoides (silla turca) del cráneo de ratón y se une a la planta del cerebro por un tallo frágil. Lateralmente está rodeado por los nervios trigémino y anterior por el quiasma óptico6,7. La glándula tiene una forma oval alargada con su eje perpendicular a la de la cabeza. En su superficie dorsal, la neurohipófisis y la adenohipófisis pueden fácilmente ser demarcadas, con el anterior ocupando la región medial dorsal y extender este último lateral y ventralmente. Durante el desarrollo postnatal, el tamaño de la hipófisis aumenta rápidamente en el primer mes después de nacimiento8,9. Sin embargo, la hipófisis de ratón todavía es muy pequeña en tamaño con un peso promedio de 1,9 mg y un diámetro de eje largo de ~ 3 mm en adultos10, un diámetro de eje largo de 2-2.5 mm en el día postnatal 21 (P21) y sólo 1-1.5 mm en P0.
Una sección coronal es preferida para mostrar en una sola rebanada de la hipófisis de ratón la adenohipófisis y neurohipófisis. Sin embargo, algunas habilidades técnicas se requieren para obtener satisfacción de secciones coronales de glándulas pituitarias de desarrollar ratones debido a su tamaño excepcionalmente pequeño y la distinta anatomía. En este artículo de vídeo, nos muestran cómo diseccionar glándulas pituitarias de ratón y preparar las secciones coronales pituitarias en diversas etapas del desarrollo.
Protocolo
ratones C57BL/6 se crían en condiciones libres de patógenos específicas. Todos los métodos experimentales de animales están en conformidad con las directrices aprobadas por el cuidado Animal y Comité de ética en la Universidad de medicina militar de segunda.
1. disección de Postnatal desarrollo de glándula pituitaria
- realizar anestesia: poner ratones neonatales (P0 - P5) en hielo picado para inducir hipotermia. Para los ratones mayores de 5 días de edad, inyectar 5% uretano (30 μl/g de peso corporal) por vía intraperitoneal para inducir anestesia. Evaluar las respuestas para toe cola pinches. Proceder sólo después de que el ratón no responde a los estímulos nocivos.
- Garantizar el ratón en la posición supina (acostado boca arriba con la cara hacia arriba) con una cinta suavemente las patas delanteras y fursuit a una superficie de trabajo que es capaz de ser fijado (es decir, espuma de poliestireno) dentro de una campana química.
- Realizar la perfusión transcardial.
- Corte la caja torácica de ratón con tijeras quirúrgicas para exponer el corazón (y otros órganos torácicos).
- Garantizar el corazón con el fórceps romos e Inserte una aguja 26G (0,45 mm) en el ventrículo izquierdo. La aguja está conectada a una jeringa de 10 mL llenada con solución salina heparinizada tamponada de fosfato (PBS; complementado con nitrito de sodio 5 mg/mL y 10 U/mL heparina, pH 7,4, calentar a 37 ° C antes de usar). Inmediatamente corte el atrio derecho con unas tijeras finas y comienzan a inundar el cuerpo con el PBS caliente hasta que el líquido que sale de la aurícula derecha es claro.
Nota: Aproximadamente 5-10 mL de PBS es necesario para los ratones neonatales y 10-20 mL de PBS para los ratones adultos. - Mantener la aguja en el lugar y cambiar a otra jeringa llenado con paraformaldehído al 4% (PFA, pH 7,4). Perfusión de 10 mL y 20 mL de fijador para neonatal y P21 ratón, respectivamente.
PRECAUCIÓN: El PFA es tóxico. Puede causar irritaciones respiratorias y la piel y daños oculares. Guantes y trabajar bajo una campana química.
- Decapitar el ratón fijo de PFA y cortar el hueso del cráneo abierto con tijeras.
- Levante suavemente el cerebelo de la base del cráneo con pinzas pequeñas. En el primer signo de la silla turca, parada de elevación pero mantenga el cerebelo, corta el tallo pituitario y las fibras nerviosas de conexión a la base del cerebro con unas tijeras finas. Este paso es vital para asegurar que la hipófisis no se levanta, con el cerebro.
- Luego seguir levantando el cerebro y retire todo el cerebro para exponer completamente la glándula pituitaria. Cortar la región sella todo incluyendo la glándula pituitaria, laterales de los nervios de trigeminal y debajo del hueso esfenoides con tijeras (aproximadamente 3 x 5 mm 2).
- Poner el tejido disecado en un plato de 35 mm o un pocillo de una placa de 6 pozos que contienen 2 mL frío 4% PFA (pH 7.4). Fijar el tejido en 4 ° C por 40 min para P0 - P7 pituitaries, 1 h para P14 pituitaries, 1,5 h de P21 - P28 pituitaries y 3 h para adultos pituitaries.
- Mayor disociación del pituitary
- Lave el tejido fijo con 10 mL de PBS, 5 cambios, 15 minutos cada uno. La glándula pituitaria neonatal junto con los tejidos circundantes y por debajo del hueso esfenoidal pueden procesarse directamente a la deshidratación. Sin embargo, se debe disociar glándulas pituitarias de los ratones mayores de 5 días más un microscopio estéreo.
- Poner el tejido fijo en un plato de 35 mm que contiene 1 mL de PBS. P5 - P14 pituitaries, quitar las membranas conectivas entre los nervios y el hueso con finas pinzas y tijeras y aislar cuidadosamente la hipófisis junto con los nervios de trigeminal lateral como un todo, pero dejando el turcica del sella. Los aislados de la glándula y los nervios están conectados por membranas de tejido conectivas con una " H "-como el aspecto ( figura 1B).
- Para P21 y adulto pituitaries, quitar los nervios y membranas de tejido conectivas alrededor de la glándula pituitaria y sin la glándula de los tejidos circundantes. Envolver el tejido hipofisario con papel de seda para limpiar lentes y ponerlo en un cassette inclusión.
Nota: Envolver la hipófisis pequeña con papel de seda para limpiar lentes ayuda a prevenir cualquier posible pérdida de especímenes y preservar la integridad del tejido en el siguiente procedimiento de inclusión en parafina. No puede ser necesario envolver la hipófisis si se procesa en una pequeña botella en el procedimiento de inclusión de cryo.
2. Incorporación de parafina secciones
- deshidratar los especímenes en la encajadura casetes con soluciones de etanol 50%, 65%, 75% y 95% por 15 min. Posteriormente deshidratar con 3 cambios de etanol puro, 3 min para P0 - P4 glándulas, 4 min para P5 - P14 glándulas y 5 min para P21 y glándulas mayores. Claro con xileno, 3 cambios, 3 min para P0 - P4 glándulas, 4 min para P5 - P14 glándulas y 5 min para P21 y glándulas mayores. Infiltrarse con cera de parafina fundida, 3 cambios, 7 min de P0 - P4 glándulas, y 8 min dos veces seguida de 6 min una vez para P5 y glándulas mayores.
Nota: Los parámetros óptimos para el proceso de tejido pueden ser ajustados empíricamente. Para obtener secciones de alta calidad, debe evitarse la deshidratación insuficiencia o excedente. Lo mismo vale para limpiar el tejido con xileno. - Orientación cuando incrustar
- en un sistema de la consola, para inclusión tisular retirar la muestra del cassette y lo coloca en un molde base lleno hasta la mitad con cera de parafina fundida. La orientación correcta de la glándula pituitaria incrustación es esencial para satisfacer las secciones coronales.
- Para P21 y adulto las glándulas pituitaria, posición de la glándula pituitaria con su eje corto perpendicular a la superficie inferior de un molde de base (el plano de sección). Utilice los huesos esfenoides y los nervios de trigeminal como puntos de referencia anatómicos para P0 - P4 y P5 - P14 pituitaries, respectivamente. Orientar las muestras con sus nervios de trigeminal o lámina transversal de los huesos esfenoides perpendiculares a la superficie inferior de un molde base.
- Suavemente Sujete el tejido en la posición deseada con el fórceps fino calentado hasta que la cera se vuelve semi sólida en una placa de enfriamiento. Completar el molde con cera de parafina fundida. Permitir que el bloque de parafina se enfríe hasta que la cera se solidifica completamente.
Nota: La glándula pituitaria en el día embrionario 18.5 (E18.5) puede ser tratada de la misma manera como la hipófisis neonatal. Pero los pituitaries (Rathke ' bolsas s) menores E16.5 debe ser integrado con toda la cabeza y orientado con el eje sagital (de boca al occiput) perpendicular a la superficie inferior de un molde base.
- Enfriar el bloque de parafina a-20 ° C durante 10-20 minutos y luego córtela en finas rodajas (4 μm de grosor se prefiere) con un micrótomo. Para obtener secciones coronales satisfactorias, ajustar la posición de bloques de parafina durante el seccionamiento. Montar los cortes de tejido en portaobjetos recubiertos polylysine para evitar desprendimiento de láminas en los siguientes procedimientos.
Nota: Como alternativa, muestras pueden ser deshidratadas en 15%, 30% (P/V) soluciones de sacarosa (en PBS) a 4 ° C hasta que hunda hasta el fondo, incrustado en cryo-incrustar compuesto utilizando el mismo método de orientación y rápidamente congelada en hielo seco. Luego cortar los bloques de tejido congelado de 8-10 μm con un criostato. La morfología de cryo-secciones, sin embargo, es a menudo inferior a parafina secciones.
3. H & E coloración y etiquetado inmunofluorescencia
- caliente las diapositivas en un calor bloquean a 55 ° C y dewax con xileno, 2 cambios, 4 min. Deshidratan las muestras con etanol al 95% dos veces y el etanol del 75% dos veces, 3 minutos cada uno. Lavar los portaobjetos con agua destilada durante 5 min en un agitador.
- De H & E coloración, mancha las secciones de solución de hematoxilina de alumbre durante 6 min., enjuagar en runnagua corriente por 2 min, diferenciar con 0.2% amoniaco agua para 45 s y volver a enjuagar en agua durante 2 minutos. Luego deshidratar las secciones con etanol al 95% por 1 min y tinción con eosina durante 2 minutos secuencialmente deshidratan, claro y monten.
- Etiquetado de inmunofluorescencia
- trata las secciones con metanol que contenga 3% H 2 O 2 y 0.01% NaN 3 por 20 min a temperatura ambiente para inactivar peroxidasas endógenas. Recuperar antígenos hirviendo cortes en el tampón de recuperación (1 mM EDTA y 1 mM Tris-HCl, pH 7,4) en una olla a presión durante 2 minutos incubar las secciones con solución amortiguadora de bloqueo (5% de suero de cabra en PBS) durante 30 min a 37 ° C.
- Incubar secciones con anticuerpos hormona del crecimiento (GH) (1:2, 000) o anticuerpos de la proteína ácida fibrilosa anti-glial (GFAP) conejo (1:2, 000) diluidas en solución amortiguadora de bloqueo durante la noche a 4 ° C.
- Incubar secciones con anticuerpo secundario (cabra anti-conejo IgG-HRP, 1:300 en solución amortiguadora de bloqueo) durante 35 min a 37 ° C.
- Amplificar las señales usando Biotinyl Tyramide (1:50 en solución salina tamponada con Tris que contenga 0.3% H 2 O 2) por 15 min a temperatura ambiente y visualizar con estreptavidina Alexa594 o 488 (1:300 en el bloqueo de almacenador intermediario, 30 min, 37 º C).
- Contratinción los núcleos con DAPI (50 mg/L de PBS) durante 5 minutos a temperatura ambiente.
Nota: Puede no ser necesario amplificar la señal mediante el sistema de amplificación de señal de Tyramide (TSA). Alternativamente, un anticuerpo secundario conjugado fluorescencia puede utilizarse para visualizar la señal de.
- Adquirir imágenes mediante un microscopio de fluorescencia equipado con DAPI, Texas Red y sistemas de filtro FITC, × 4/0,13 × 40/0.75 objetivos y cámara de 5.0 megapíxeles. Uso la 360, 488 y 594 nm láser las longitudes de onda de imágenes DAPI, Alexa 488 - y las secciones manchadas de Alexa 594, respectivamente. Optimizar la energía del laser (0.8 fue utilizado generalmente) y tiempo de exposición a los niveles deseados para cada canal. Capturar la imagen bajo el control del software de adquisición de imagen y superponer las imágenes de fluorescencia posteriormente utilizando software de procesamiento de imagen.
Resultados
Este protocolo presenta un método para disecar glándulas pituitarias de desarrollar ratones. Para el ratón neonatal, las regiones de sella todo que contiene la glándula pituitaria, los nervios de trigeminal y la parte inferior se diseca hueso esfenoides de la base del cráneo. La hipófisis pequeña y delicada permaneció intacta durante el proceso (figura 1A). Para los ratones mayores de 5 días, las glándulas pituitaria conectadas a los nervios de trigeminal lateral entonces fueron aislados. La estructura gruesa de la glándula pituitaria aislada de la P7 ratón fue bien preservado (figura 1B). Para el ratón de P21, el tamaño de la glándula pituitaria se incrementó notablemente en comparación con la del ratón neonatal. La glándula pituitaria fue exitosamente aislada con daño invisible mientras los tejidos circundantes (figura 1).
Para ver la máxima región de adenohipófisis y neurohipófisis en una sola rebanada de la hipófisis, se prefiere una sección coronal. Las glándulas pituitarias disecadas fueron correctamente orientadas para lograr satisfacer las secciones coronales. H & E coloración mostró bien preservada morfología de adenohipófisis y neurohipófisis en glándulas pituitarias P0, P7 y P21 (figura 2).
Las láminas procesadas también eran compatibles con inmunofluorescencia de etiquetado. Por ejemplo, la adenohipófisis y la neurohipófisis demostrada immunolabeling específico de GH y GFAP, respectivamente (figura 3).
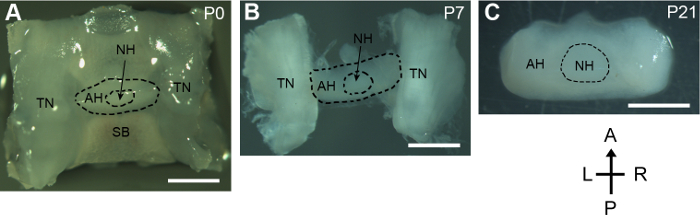
Figura 1: disección de desarrollo postnatal las glándulas pituitaria. Vista dorsal de glándulas pituitarias disecadas y los tejidos circundantes de los ratones P0, P7 y P21. A anterior; P, posterior; L, izquierda; R, derecho; SB, hueso esfenoides; TN, nervio trigémino; AH, adenohipófisis; NH, neurohipófisis. Escala de barras, 1 mm. haga clic aquí para ver una versión más grande de esta figura.
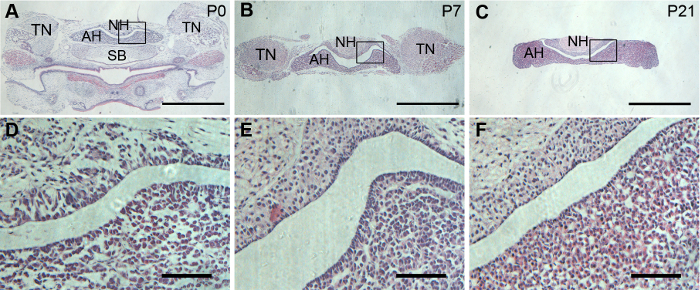
Figura 2: histología de las glándulas hipófisis de ratón. Representante H & E tinción pituitaria cortes coronales de ratones P0, P7 y P21. (A, By C) están vistas bajo ampliación de pituitaries coronales. (D, Ey F) son la ampliación de las áreas enmarcadas en (A, By C), respectivamente. Barras de escala = 1 mm en (A, B y C); y 20 μm (D, E y F). Haga clic aquí para ver una versión más grande de esta figura.
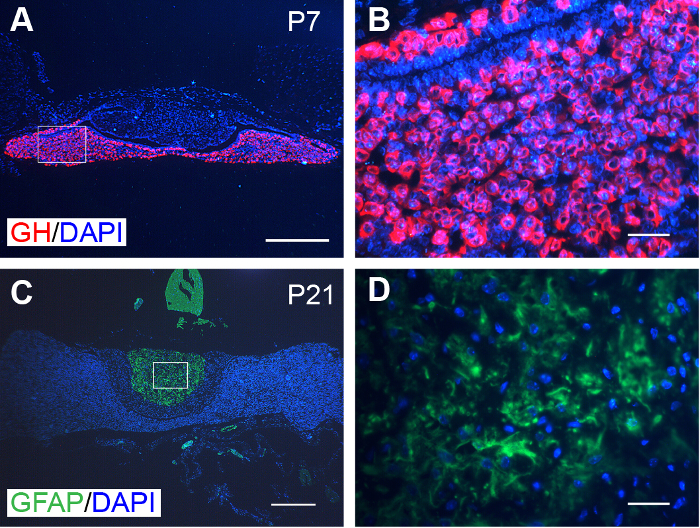
Figura 3: coloración inmunofluorescente representativas sobre las glándulas pituitaria. (A) GH (rojo) se expresó concretamente en la adenohipófisis de los ratones P7. (B) imagen ampliada de la zona enmarcada en A. (C) GFAP (verde) se expresó concretamente en la neurohipófisis de ratones de P21. (D) imagen ampliada del área enmarcada en C. núcleos fueron teñidos con DAPI (azul). Barra de escala = 300 μm (A y C); y 30 μm (B y D). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Para el desarrollo de pituitaries murinos, ha sido técnicamente difícil de obtener secciones coronales adecuadas debido a su diminutas y frágil características y características anatómicas únicas6,8. Algunos grupos de investigación así eligieron secciones sagital para analizar la morfología embrionaria y neonatal pituitaria11,12. Aunque la sección sagital de la hipófisis también es capaz de mostrar anterior, intermedia, y los lóbulos posteriores en una sola rebanada, la sección coronal es altamente recomendado: puede mostrar una vista máxima de estos tres lóbulos. En particular, para los estudios de cuantificación, como la determinación del volumen y área de la glándula pituitaria y contando el número de apoptosis y proliferación de las células, secciones coronales son superiores a las secciones sagital en términos de su representante. Aquí, presentamos un método útil para diseccionar las glándulas pituitaria y preparar pituitarias secciones coronales de desarrollar ratones.
Para evitar dañar las glándulas pituitarias durante el proceso, varias técnicas se han utilizado en este protocolo. En primer lugar, ratones son fijados por perfusión de transcardial del formaldehído antes de la disección. Este fijador no sólo ayuda a preservar la arquitectura del órgano sino también a eliminar glóbulos rojos, que a menudo resultan en auto fluorescencia13. En segundo lugar, se diseca la región entera sella para evitar tocar la glándula pituitaria con herramientas duras quirúrgica. Los tejidos circundantes ayudan a mantener la glándula pituitaria en su posición original y también sirven como puntos de referencia para incluir orientación. Con estos métodos, más pequeños postnatales pituitaries de animales más jóvenes pueden ser disecados, reduciendo la probabilidad de daños no deseados.
El procedimiento de la disección en este protocolo también es aplicable a aislar pituitaria murino que no se ha fijado previamente por la perfusión. En ese caso, debe tener más precaución para evitar daños indeseados y la glándula también debe ser diseccionada como rápidamente como sea posible.
Desde pituitaries murinos en desarrollo son muy pequeños en tamaño, ha sido muy difícil de orientarle correctamente cuando incrustar. Este protocolo utiliza los nervios de trigeminal o huesos esfenoides como puntos de referencia, haciendo mucho más fácil los pasos de la orientación. Correctamente orientados pituitaries son esenciales para lograr satisfacer las secciones coronales.
En Resumen, le ofrecemos una mejor disección hipofisaria e incrustación de protocolo, que es conveniente para los ratones en diversas etapas del desarrollo. Aplicación de estos procedimientos puede obtener satisfacción de secciones coronales de murinas glándulas pituitarias que se utilizará para el análisis de la histología rutinaria, inmunohistoquímica, hibridación en situ y desarrollo de la investigación14.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por las becas de la Fundación de Ciencias naturales nacionales de China (31201086, 31470759 y 31671219) y la Fundación de Ciencias naturales de Shanghai (12ZR1436900).
Materiales
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Surgical scissors-straight | JinZhong | J21010 | can be purchased from other vendors |
| Fine scissors-strainght | JinZhong | WA1010 | can be purchased from other vendors |
| Blunt forceps | JinZhong | JD1020 | can be purchased from other vendors |
| Fine forceps | Dumont | RS-5015 | for isolation of the pituitary |
| 26G (0.45mm) needle | HongDa | for transcardial perfusion | |
| Syringe (1 mL) | BD | 300841 | can be purchased from other vendors |
| Syringe (10 mL) | BD | can be purchased from other vendors | |
| 35mm dish | Corning | 430165 | can be purchased from other vendors |
| Lens cleaning paper | ShuangQuan | can be purchased from other vendors | |
| Anatomical microscope | OLYMPUS | SZX-ILLB2-200 | can be purchased from other vendors |
| Embedding cassette | Thermo Fisher | 22-272423 | can be purchased from other vendors |
| Tissue embedding console system | KEDEE | KD-BM11 | can be purchased from other vendors |
| Microtome | Thermo Fisher | HM315R | can be purchased from other vendors |
| Superfrost-Plus slides | Thermo Fisher | 22-037-246 | can be purchased from other vendors |
| Cover glass | Thermo Fisher | 12-543 | can be purchased from other vendors |
| Fluorescence microscope | OLYMPUS | BH2-RFCA | can be purchased from other vendors |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Urethane | BBI | EB0448 | |
| NaCl | Sigma | S9625 | for PBS |
| KCl | Sigma | P9541 | for PBS |
| Na2HPO4.12H2O | Sigma | 71650 | for PBS |
| K2HPO4 | Sigma | P2222 | for PBS |
| NaNO2 | Sigma | 237213 | |
| Heparin Sodium Injection | SPH | H31022051 | for perfusion saline |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Ethanol | SCR | 10009218 | |
| Xylene | SCR | 10023418 | |
| Paraffin | Thermo Fisher | 8330 | |
| Hematoxylin | Sigma | H9627 | for H&E staining |
| Eosin Y | Sigma | E4009 | for H&E staining |
| rabbit anti growth hormone (GH) | National Hormone | for immunostaining | |
| antibody | Pituitary Program | ||
| Rabbit anti-mouse GFAP antibody | Sigma | G9269 | for immunostaining |
| Goat anti-rabbit IgG, HRP | Jackson | 111-035-003 | for immunostaining |
| TSA system | NEN Life Science Products | NEL700 | for immunostaining |
| Streptavidin, Alexa Fluor 594 | Thermo Fisher | S32356 | for immunostaining |
| Anti-FITC Alexa Fluor 488 | Thermo Fisher | A11090 | for immunostaining |
Referencias
- Fauquier, T., Lacampagne, A., Travo, P., Bauer, K., Mollard, P. Hidden face of the anterior pituitary. Trends Endocrinol Metab. 13 (7), 304-309 (2002).
- Haedo, M. R., et al. Regulation of pituitary function by cytokines. Horm Res. 72 (5), 266-274 (2009).
- Zhu, X., Gleiberman, A. S., Rosenfeld, M. G. Molecular physiology of pituitary development: signaling and transcriptional networks. Physiol Rev. 87 (3), 933-963 (2007).
- Bancalari, R. E., Gregory, L. C., McCabe, M. J., Dattani, M. T. Pituitary gland development: an update. Endocr Dev. 23, 1-15 (2012).
- Kelberman, D., Rizzoti, K., Lovell-Badge, R., Robinson, I. C., Dattani, M. T. Genetic regulation of pituitary gland development in human and mouse. Endocr Rev. 30 (7), 790-829 (2009).
- Peker, S., Kurtkaya-Yapicier, O., Kilic, T., Pamir, M. N. Microsurgical anatomy of the lateral walls of the pituitary fossa. Acta Neurochir (Wien). 147 (6), 641-648 (2005).
- Wolpert, S. M., Molitch, M. E., Goldman, J. A., Wood, J. B. Size, shape, and appearance of the normal female pituitary gland. AJR Am J Roentgenol. 143 (2), 377-381 (1984).
- Carbajo-Perez, E., Watanabe, Y. G. Cellular proliferation in the anterior pituitary of the rat during the postnatal period. Cell Tissue Res. 261 (2), 333-338 (1990).
- Nantie, L. B., Himes, A. D., Getz, D. R., Raetzman, L. T. Notch signaling in postnatal pituitary expansion: proliferation, progenitors, and cell specification. Mol Endocrinol. 28 (5), 731-744 (2014).
- Tzou, S. C., Landek-Salgado, M. A., Kimura, H., Caturegli, P. Preparation of mouse pituitary immunogen for the induction of experimental autoimmune hypophysitis. J Vis Exp. (46), (2010).
- Budry, L., et al. Related pituitary cell lineages develop into interdigitated 3D cell networks. Proc Natl Acad Sci U S A. 108 (30), 12515-12520 (2011).
- Wilson, D. B., Wyatt, D. P. Histopathology of the pituitary gland in neonatal little (lit) mutant mice. Histol Histopathol. 7 (3), 451-455 (1992).
- Jonkers, B. W., Sterk, J. C., Wouterlood, F. G. Transcardial perfusion fixation of the CNS by means of a compressed-air-driven device. J Neurosci Methods. 12 (2), 141-149 (1984).
- Cao, D., et al. ZBTB20 is required for anterior pituitary development and lactotrope specification. Nat Commun. 7, 11121(2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ISSN 2578-2746
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.