Method Article
細菌の増殖の高精度、高スループットの分析
要約
細菌の成長の定量的評価はシステム レベルの現象として微生物生理学の理解に不可欠です。システム生物学への関心のキーの対象は、細菌の増殖の高精度、高スループットの分析を可能にする、実験的操作および分析的なアプローチのためのプロトコルを紹介します。
要約
細菌の増殖は、近代の微生物生理学の開発だけでなくシステム レベルでの細胞動態の調査、中心的な概念です。最近の研究では、細菌の増殖とゲノムの削減とトランスクリプトームの再編成など、ゲノム全体のイベント間の相関を報告しています。正しく細菌の増殖を分析は、遺伝子の機能と細胞成分の成長に依存した調整を理解することにとって重要です。したがって、高スループット方法で細菌の増殖の正確な定量的評価が必要です。新興の技術開発は、細菌の増殖を研究するために使用されるメソッドの更新が可能な新しい実験的なツールを提供しています。ここで紹介したプロトコルでは、細菌の増殖の再現性と正確な評価のための非常に最適化された実験手順をマイクロ プレート リーダーを採用しています。このプロトコルは、いくつかの成長を評価に使用した前述のエシェリヒア属大腸菌の緊張。プロトコルの主な手順は次のとおりです: 再現性のある結果、高スループット成長評価の 96 ウェルのプレートの使用の 2 つの大きな手動計算とテストを繰り返して多数の小さな瓶で細胞株の準備(すなわち、最大成長率と人口密度) のパラメーター成長ダイナミクスを表します。伝統的なコロニー形成単位 (CFU) 試金、ガラス管で寒天プレート上で培養している細胞をカウントと比較して本法が効率的ですと成長変化の詳細の時間的な記録を提供しますより厳格です低い人口密度で検出限界。要約すると、この方法は結論を概念や理論的な観察をする使用ことができます細菌の増殖の正確かつ再現可能な高スループット分析のため有利です。
概要
微生物学的研究は、しばしば細菌細胞の培養と細菌の生理1,2,3の基礎的な現象を表す細菌の増殖曲線の評価開始します。基本的な文化の原則は、細菌培養は基本的な方法論研究発表文献や教科書で広く利用可能です。ベンチのレベルに実質的な伝統的に注目されている成長媒体の最適化と培養条件しますが、成長率を制御する、微生物生理学の一層の理解を提供するだろう可能性が高いされていません。広範囲に研究4。指数関数的に増殖する細菌、細胞の状態の重要なパラメーターは成長率は、ゲノム、トランスクリプトーム、プロテオーム5,6,7,8 と調整が報告されています。.従って、細菌の増殖の定量的評価は微生物生理学を理解するため重要です。
細菌の増殖を評価するには、バイオマスを推定する実験手法確立9,10と光濁度など、生化学的、物理的または生物学的パラメーターの検出に基づいています。さらに、成長変化の動的特性をキャプチャするための分析手法はよく確立された非線形モデル11,12,13, たとえば、ロジスティック方程式に基づいています。成長ダイナミクスは文化の細胞の成長の時間サンプリングによる光濁度を測定またはコロニー形成単位 (CFU) 試金の実行によって一般に取得されます。これらの培養と検出法の制限は、データ ポイントは個体群動態の本当の反射の測定間隔時間で多くの場合、ため培養条件 (例えば温度の変化と曝気) は、サンプリング時に邪魔されてます。文化・解析技術は、技術と理解の最近の進歩を使用して更新する必要があります。マイクロ プレート リーダーの最近の進歩は、細菌の増殖のリアルタイム観察を可能し、人件費を大幅に削減します。これらの高度なデバイスを使用して、細菌の増殖に関する最新の研究は、高スループット測定14,15分析法を報告しています。
このプロトコルの目的は、最終的に成長率を決定する方法と、どのような要因に影響を与える成長率の質問に対処する量的研究の価値があるでしょう高スループット方法で正確な成長ダイナミクスを評価することです。プロトコル細菌の増殖での再現性と正確な定量の考慮する必要がありますすべての要因に対処します。実験方法と分析は、メイン テキストで詳細に説明します。このメソッドでは、高スループット方法で細菌の増殖の正確かつ再現性の高い分析ができます。微生物学者たちは、その実験的証拠から追加の量的な結果を導き出すにこのプロトコルを使用できます。このプロトコルは、概念的な結論を描画するまたは成長の理論的概要を達成するためにしようとするシステムバイオロジーの研究も使用できます。
プロトコル
1 成長培地を準備する
注: 最小媒体 M63 の化学組成は次のように: 62 ミリメートル K 2 HPO 4、39 mM KH 2 PO 4、15 mM (NH 4) 2。 など 4、1.8 μ M FeSO 4、15 μ M チアミン HCl、0.2 mM MgSO 4、および 22 mM グルコース。M63 は 3 つの原液を混合することによって作られた: 5 X ソリューション、20% ブドウ糖と MgSO 4 チアミン ソリューション。4 ですべてのソリューションを格納 ° C
- 電気ピペットと使い捨ての血清ピペットを使用して FeSO 4 ソリューションを準備する 5 X ソリューション
- を準備する ddH 2 O を 50 mL の遠心管に追加します。0.06 mL 0.01 M 塩酸を追加 36 mg FeSO 4-7 H 2 O を取得してよく混ぜる塩酸を追加する、P-200 を使用します 。
- 160 mL ddH 2 O メスシリンダーで測定し、500 mL ビーカーに追加。この順序で、次を追加します: 10.72 g K 2 HPO 4、5.24 g KH 2 PO 4、2.0 g (NH 4) 2 SO 4、および 0.5 mL FeSO 4 ソリューション (1.1.1 の手順で準備).
- 2 M 島を追加することによって 7.0 に pH を調整精度 pH メーターを使用しています。測定シリンダー内の溶液を注ぐ、ddH 2 O を 200 mL の容量に追加します。250 mL ろ過装置 (PVDF、0.22 μ M) を使用して、ソリューションを滅菌します 。
- 20% グルコース溶液を準備する
- 200 mL ddH 2 O のメスシリンダーを測定し、500 mL ビーカーに注ぐ。混合磁性攪拌器を使用して中のグルコース 50 グラムを追加します。250 mL の容量にメスシリンダーでソリューションを希釈します。1.1.3 の手順で説明するようにソリューションを滅菌します 。
- MgSO 4 チアミン ソリューションを準備する
- 500 mL ビーカーに 150 mL ddH 2 O を追加。電磁攪拌機で混合しながらメスシリンダーでチアミン HCl と MgSO 4-7 H 2 o. Dilute ソリューション 10 g 1.0 g を 200 mL の容量に追加します。1.1.3 の手順で説明するようにソリューションを滅菌します 。
- 最小媒体 M63 を準備
- 5 X ソリューション、20% ブドウ糖溶液、MgSO 4 チアミン ソリューション、電子ピペット、P-200 ピペットおよびクリーン ベンチで 200 μ L ピペット チップを配置します 。
- 155.8 mL ddH 2 O のメスシリンダーを測定し、500 mL ビーカーに注ぐ 。
- 5 X 溶液及び 4 mL 20% ブドウ糖溶液 40 mL を加える電子ピペットと使い捨ての血清ピペットを使用して測定 ddH 2 o.0.2 mL、P-200 と MgSO 4 チアミン ソリューションを追加します。1.1.3 の手順で説明するようにソリューションを滅菌します 。
2。グリセロール ストックを準備する
- 細胞培養
注: ひずみ銀行組織から (例えば、W3110 およびその減らされたゲノム) 細菌の緊張があります。系統は、通常寒天のコロニーの形で得られます。- シリコーン ゴム栓、電子ピペット、P-1,000、1,000 μ L ピペット チップ、P-200、200 μ L ピペット チップ、クリーン ベンチのターゲット株 (板の植民地) と 5 つの滅菌ガラス管を配置します 。
- は、シリコーン ゴム栓を開く前にブンゼン バーナーのガラス管の口を公開します。チューブが開かれた後、炎にシリコーン ゴム栓を公開し、ガラス管にキャップを軽く配置します 。
- 電子ピペットと使い捨ての血清ピペットを使って 1 つのガラス管と他の 4 本のチューブに 4.5 mL M63 に 5 mL M63 を追加します 。
- P-200 tip を使用してコロニーをピックアップし、5 mL M63 を含むガラス管で接種します 。
- 渦管に懸濁液を作る。ソリューションを 10 倍希釈して、4.5 mL M63 を含む 4 つの管の 1 つにこの溶液 0.5 mL を移すことで 。
- を繰り返して残りのチューブ 2.1.5 手順で説明します。5 つの異なる濃度の希釈系列 (1、10、100、1000 の希釈液と 10,000) 準備が整いました 。
- は、ガラス管や手順 2.1.2 シリコーン ゴム栓の口を殺菌します。ストッパーとチューブをキャップします。シリコーン ゴム栓をしわなく汚染を防止します 。
- は、5 つのチューブが、37 ° C で予め温めておいた揺れインキュベーター、200 rpm で振る。一晩、または 10 に 30 h. 文化を孵化させなさい
- グリセロール ストックの文化の選択
- クリーン ベンチにあらかじめ加温室温 M63 媒体、P-1,000、1,000 μ L ピペット チップ、使い捨てのキュベットを配置します 。
- 追加 1000 μ L P-1、000 と使い捨てのキュベットに M63。分光光度計のキュヴェットを使い捨て、固定波長 600 でプログラムを起動 nm、およびメジャー空白 。
- 5 つのガラス管を振動インキュベーターからクリーン ベンチに移動します 。
- 破棄 M63 使い捨てのキュベットから P-1、000 と同じ使い捨てのキュベットに 1,000 μ L 文化を追加。2.2.2 の手順で説明されているように細胞培養 (外径 600) の光濁度を測定します
。 注: 任意の汚染を回避し、正確な測定を達成するために、ガラス管と前述の火炎と渦サンプリング前に文化にストッパーを公開します。細胞密度が低い場合は特に信頼性の高い結果を得るに繰り返し測定が推奨されます 。
- 5 つの細胞培養、早いの指数的な成長段階にあるものを選択 (外径 600 - 0.01 0.05) グリセロール ストック
。 注: 複数の文化が密度を最適な範囲内にあれば、0.05 に最も近い選択一般的です 。
- テストを繰り返してのグリセロールを作る
。 注: これは 10 株を準備するため、説明します。実験的要件に応じて拡大または縮小量が可能です。- 滅菌 60% グリセリン溶液を置いて、10 滅菌 1.5 mL マイクロ チューブ、P-1,000、P-200、1,000 と 200 μ L ピペット チップ、マイクロ チューブはクリーン ベンチの上に立ちます 。
- 追加の 250 μ L 滅菌ピペットで 60% グリセリン溶液と 1.5 mL マイクロ チューブとミックスするカルチャを選択したセルの 750 μ L.
注: 在庫量は変数ですが常に細胞培養に 60% のグリセロールの 1:3 の比を維持この結果、15% のグリセロールの最終的な集中にします 。
- 残り 9 マイクロ チューブ マイクロ チューブ スタンドに置き、各管に 2.3.2 の手順で作製した混合物の 100 μ L を分注します。将来使用するための 10 の同一のグリセロールがあります 。
- -80 でディープ フリーザーで在庫を保管 ° C
3。成長曲線を取得
- マイクロ プレート リーダーを設定します
。 注: の用語プレート リーダーで使用される特定の言葉遣いがここで使用される引用符ショー (材料の表を参照してください)。- オープン ソフトウェア。開いている " プロトコル " の " タスク マネージャー " を選択、" 新規作成 "。選択 " 標準プロトコル ".
- オープン " プロシージャ "、し設定を調整します。オープン " 設定温度 "、選択と " インキュベーターに "。設定 " 温度 " 37 ° c と " グラデーション " 0 ° c. チェック " 予熱 " 次のステップに進む前に。オープン " 運動を開始 "、" 実行時 " 24時 00分: 00 または 48:00:00 と " 間隔 " 00時 30分: 00 または 1:00
。 注: それは全体の 96 ウェル プレートを読むこと約 1 分かかります 。
- オープン " 振る " セットと " を振るモード " として " 線形 "。チェック " Constitution シェイク " 設定 " 周波数 " 567 cpm で。オープン " 読み取り "、チェック " 吸光度 "、" エンドポイント、カイネティック " と " グレーティングモノクロ メーター " 設定 " 波長 " 600 にします。 。
- クリック " 検証 " の手順が正しいことを確認します。クリックして " 保存 " を将来使用するための新しいプログラムとして保存します 。
- リアルタイム成長の記録
- 96 ウェル プレートに接種培養の位置を指示する 96 ウェル プレート ピクトグラム (8 × 12 テーブル) を描画します。テーブルを印刷および実験のための参照としてそれを使用します
。 注: 蒸発のため、マイクロ プレートの端に位置する井戸は空白媒体を含める必要がありますのみです 。
- 場所滅菌 96 ウェル フラット プレートの蓋、P-1000、1000 μ L ピペット チップ、P-200、200 μ L ピペット チップ、いくつか 1.5 mL マイクロ チューブ、8 マルチ チャンネル ピペット、滅菌試薬槽、室温、M63、グリセロールクリーン ベンチの株 (2.3 の手順で準備).
- は、試薬リザーバーに約 25 mL M63 を追加します。次の手順この貯水池の在庫を使用します 。
- 追加 900 μ L シリアルの希薄を作るための準備としてマイクロ チューブに M63 。
- は、室温でグリセロール ストックを解凍します。900 μ L を追加解凍グリセロール ストックと渦に M63。これは、結果、元のグリセロール ストックの 10 倍希釈で 。
- M63 と渦の 900 μ L を含む別のマイクロ チューブに 10 倍希釈の転送 100 μ L。これは、結果、100 希釈で 。
- 3.2.6 希釈の必要な数を達成するまで手順を繰り返します 。
- 200 μ L M63 を使用してマイクロ プレートの端に井戸を埋める 8 ch ピペット (P-200).
注: これらの井戸は空白として使用できます 。
それぞれの - 負荷 200 μ L 希釈手順 3.2.4 - 参照テーブル (手順 3.2.1) によるとマイクロ プレートのウェルに 3.2.7 に調製した試料です。渦希釈サンプル前に複数の井戸で同じサンプル読み込みと負荷に変化、プレート上の場所 。
- プレート リーダーの 96 ウェル マイクロ プレートを配置します 。
- オープン " 今すぐ読む " の " タスク マネージャー " プログラム (セクション 3.1) を選択。クリックして " OK " 測定を開始します。データ分析 (セクション 4) のための新しい実験ファイルとして録音を保存します 。
- 96 ウェル プレートに接種培養の位置を指示する 96 ウェル プレート ピクトグラム (8 × 12 テーブル) を描画します。テーブルを印刷および実験のための参照としてそれを使用します
4。データ分析
- エクスポート テキスト ファイルとして USB メモリ リアルタイム成長率データ (セクション 3.2) の結果固執します
。 注: 96 ウェル フォーマットされた結果 (曲線) はリアルタイムでプレート リーダーに表示されます。(OD 値) の時間のレコードをテーブルとしてエクスポートできます。行と列を表すよく数字 (例えば A1、B1) と測定時間 (例えば 00時 00分: 59)、それぞれします 。
- 表計算ソフトでテキスト ファイルを開きます 。
- 96 ウェル マイクロ プレートの時間外径 600 読み取りをさらに分析するための新しいワークシートにコピーします 。
- バック グラウンド読み込み、減算時間各サンプルの読み込みが時間のゼロも
。 注意: 便宜上、空白の平均値井戸含む M63 (ステップ 3.2.8) は、バック グラウンド値として使用できます 。
- は、最大の人口密度を推定する 5 つの連続した OD 600 読み取りの平均を計算します
。 注: 5 つの連続した OD 600 読み取りの最大平均値は対応する成長曲線の最大外径 600 として定義します 。
- 外径 φ 600 の連続する値のすべてのペアの次の式を適用することで成長率、μ (h -1) の計算:
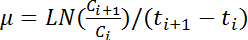
注: この式の C は 私 と C + 1 は、任意の 2 年連続時間の点 (t は 私 と t + 1、OD 600 値を表すそれぞれ)。LN は自然対数を示します 。
4.6 のステップにしたがって - 計算外径 600 時間に基づいて時間をかけて成長率の変化を読み取ります。平均と最大の成長率を推定する 5 つの連続した成長率の標準偏差を計算します
。 注: 最小の標準偏差と最大平均値が対応する成長曲線の最大成長率として定義します 。
5。96 ウェル読み取り (オプション) の世界的なバイアスを確認する
注: 両方のプレート リーダーと消耗の 96 ウェル プレートは、バイアス測定を引き起こすことができます。高精度で再現性のある量的な結果を達成するために 96 ウェル プレートの世界的なバイアスを確認することを強く推奨します
。- セクション 3.2.2 で説明したようにバイアスのテストの 96 ウェル プレート、プレート リーダーを準備します 。
- 滅菌 50 mL 遠心チューブに追加 20 mL M63。同じ遠心管と渦にグリセロール ストックを追加します。滅菌試薬リザーバーに懸濁溶液を移します 。
- 8 ch ピペットを使用して懸濁溶液 200 μ L を 96 ウェル プレートに転送します 。
- プレート リーダーの 96 ウェル プレートを配置し、測定を開始します 。
- 外径 600 時間のレコードを読み取り、セクション 4 で説明されているように分析します。各ウェルの 96 ウェル読み取りの位置バイアスを決定するための計算された最大成長率と人口密度を比較します 。
結果
この方法は、(数時間数日から分) からまでのさまざまな時間間隔で複数の光学濃度測定は、96 ウェル フォーマットのリーダーを用いた連続、高スループット方法で動的な細菌の増殖をキャプチャする手段を提供します。各種ゲノムを表現する大腸菌の品揃えの成長曲線を正確に取得するには、単一の実験 (図 1 a) に。記述法と比較して (CFU の試金) の従来の方法は一般的に長いサンプリング時間間隔 (図 1 b) が必要で、複数の文化が必要な場合は、労働集約的です。さらに、CFU の試金のための文化サンプリングたび繰り返し測定のため使用ことはできません細胞培養の少量の使用が必要です。さらに、検出の時間ポイントの限られた数は、成長率と最大外径 φ600の正しい計算に必要なサンプリング ポイントを見落とす可能性があります。しかし、CFU アッセイ、検出下限は、103 - 104セル/mL、光濁度測定より桁違いに少なくとも 2 つを作る (外径600= 0.001 は、約 10 の検出限界は、5-106セル/mL)。記載されているメソッドは、成長ダイナミクスのシステム レベルの研究の実用的かつ効率的な実験ツールを提供します。
このプロトコルの主な利点は、一般的なグリセロール ストックから繰り返し測定がかかることです。複数の細胞培養様々 な希釈率で指数関数的成長初期におけるだ非常に有用な研究者がどんなスケールで培養時間を決定することができます予期しないイベントのため文化を有する飽和を避けるため繰り返される養殖、普通株式は、成長の高度と同様の結果を示されるプロトコル セクション 2.2 (図 2 a) で説明されている異なる希釈率を使用して開始 5 文化の一つの調製の測定ダイナミクスの解析。複数成長曲線繰り返しと独立した測定値 (N = 6) のも重なって (図 2 b、上部パネル)、指数段階 ( 、特に中にほとんど差異 (図 2 b、底板) と図 2 b、影付きの領域)。この方法が再現性の高い結果を提供することが示唆されました。
96 ウェル読み取りのグローバルのバイアスを推定することをお勧めします。現在のメソッドでグローバルのバイアスは野生型大腸菌の成長を監視することによって推定プロトコル セクション 5 で説明したように、W3110 をひずみ。たとえば、データ操作とデバイス エラーの両方から派生した世界的な変動を表す (図 3 a)、96 の井戸の中で有意な変化を示した成長曲線から成長率が計算されます。これらのエラーは、プレート上の様々 な場所で複数の井戸に同じサンプルを読み込むことによってマスキングできます。対照的に、最大外径600を示した結果は、明確な位置依存型バイアス漸進的な変更は、垂直方向に沿って認められた、つまり、最大外径600から徐々 に増加列 2 の井戸列 11 96 ウェル プレート (図 3 b)。偏った結果を避けるためには、同じサンプルを繰り返し測定のため 96 ウェル プレートの両側にある井戸にロードする推奨します。最大外径600値で立地のバイアスは、加熱効率のシールによって決定されている蒸発量の変化に起因すると見なされます。端の井 96 ウェル マイクロ プレートの真ん中に井戸と比較して、マイクロ プレートのシール効果から生じる様々 な蒸発速度を反映して、比較的高い値を示す傾向があった。さらに、同じバイアス テストを受ける他の 96 ウェル マイクロ プレートは、井戸がプレートに位置していたに基づいて同様の方向の変更を示したので、バイアスの範囲は、プレート リーダーに頼るかもしれません。したがって、最大の人口密度を決定する研究で 96 ウェル読み取りのグローバルのバイアスを評価することが重要です。加熱や振動、効率と 96 ウェル マイクロ プレートによる彼らの特定のグローバル先入観を持ってすべて市販プレート リーダーは主シール効率によって区別されます。
細菌の増殖の体系的な分析のためこのメソッドを設計し、2 つの主要なパラメーター、すなわちさまざまなシステム生物学、進化論などの分野で一般的に適用される成長率と細胞密度を分析する使用することができ、生態学16,17。スプレッドシートを使用して、手動で計算を導入して、成長率と細胞密度の評価パラメーターを生成する raw 読み取りのプロセスを示します。成長の時給は、最初セクション 4.6 データ セットとして経時変化と成長率 (図 4 b) のプロトコルに従って成長曲線 (図 4 a) の生のリードから計算されます。手段とすべての 5 つの連続した成長率の標準偏差は順番に取得した (図 4-D)、標準偏差を最小と最大の平均成長率は、成長の最大成長率として定義されています。曲線 (図 4-D 強調表示されます)。最大の細胞密度 (外径600) が同様に分析 (図 4E-F)。計算された成長率と細胞密度はその後さらに分析を受けます。記述の計算が自動的に実行できる計算プラットフォーム (プログラミング言語) を使用して例えばR と Python。

図 1 成長曲線は、多様な方法で取得しました。(A)成長曲線の複数買収。4 つの別の成長曲線高スループット方法で得られた様々 なゲノムを表現するエシェリヒア属大腸菌の緊張。エシェリヒア属大腸菌細胞は最小限の中型 M63 で育ったし、OD600読み取りで変化を 1 h 間隔でマイクロ プレート リーダーによって記録しました。系統左から右は、野生型大腸菌W3110 に (番号 0) とその削減ゲノム数 1、10、18 (前述5)、それぞれ。CFU の試金を使用して、 (B)の成長曲線野生型大腸菌 (番号 0)が培養され数時間にわたって示された時点でサンプリングされました。CFU アッセイを用いた成長変化を推定しました。白丸は、記録やサンプリング ポイントを示します。この図の拡大版を表示するのにはここをクリックしてください。
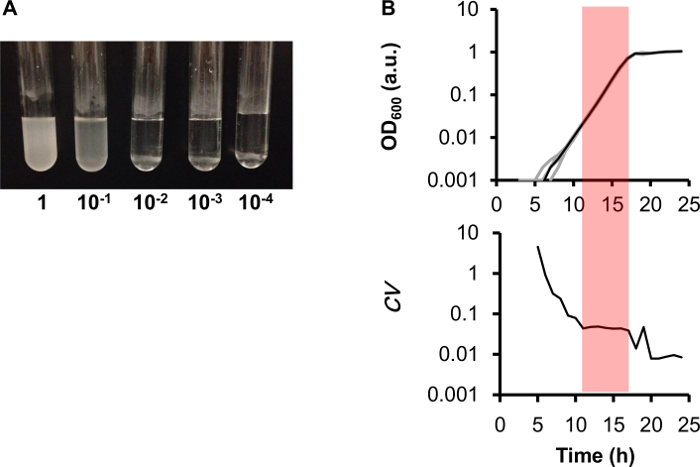
図 2。再現性のある繰り返し測定。(A)一晩文化様々 な希釈率のs. E. 大腸菌のセルに 1 から 10,000 折る、示される様々 な複数の希釈率でチューブに接種しました。細胞は、約 12 時間 200 rpm で振とうしながら 37 ° C で培養しました。(左から右に) 5 つの細胞培養の最終的な OD600値は 1.51、0.74、0.05、0.008 0.001 であった。外径600 0.05 の文化は、共通のグリセロール ストックの使用されました。(B)再現性の高い測定。6 独立した成長曲線 (トップ、グレー線) 同大腸菌系統・ マイクロ プレートと共通のグリセロール ストックの 2 つのバイアルの六つの位置から計算します。黒い線は、六つの成長曲線の平均値を表します。六つの繰り返された測定の変動 (CV) の係数が計算される (下) と安定した低ポイントはピンク色でシャドウされます。この図の拡大版を表示するのにはここをクリックしてください。
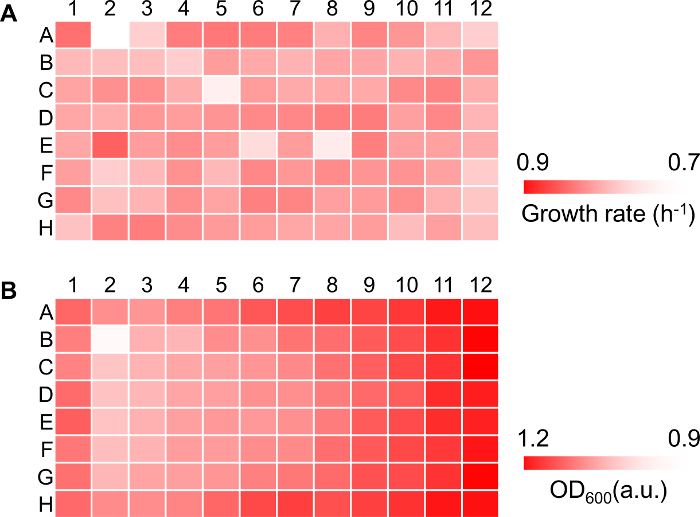
96-well フォーマットの図 3 グローバル バイアス。(A)熱マップの成長率。エシェリヒア属大腸菌細胞の在庫は最小限中 M63 で中断され、96 ウェル マイクロ プレート (12 × 8 テーブルとして表されます) ので均等にロードします。外径600に変更は、プロトコルのセクション 5 で説明したよう、マイクロ プレート リーダーを使用して得られました。白から赤へのグラデーションは、成長率を 0.7 から 0.9 h-1に示します。(B)最大外径 φ600のヒートマップ。白から赤へのグラデーションは、1.2 0.9 から最大外径の600の値を示します。成長率と最大外径 φ600の計算は、図 4で説明されています。この図の拡大版を表示するのにはここをクリックしてください。

成長曲線の図 4 解析。(A)成長曲線の生データ。1 時間ごとの外径600読み取りは培養時間に対してプロットされます。白丸は、サンプリング時間を示します。(B)時間は、成長率の変化します。2 つの連続した OD600読み取りの間成長時給は、4.6 に記載されている数式に従って計算されます。(C)は、成長率を意味します。スムーズな成長率を与える 5 つの連続した成長率の平均値が計算されます。(D)標準偏差の平均成長率。同じの 5 つの連続した成長率の標準偏差が計算されます。標準偏差を最小と最大の成長率は、赤色でハイライトされます。(E)は、外径600を意味します。滑らかな OD600を決定する 5 つの連続した OD600の値の平均値が計算されます。(F)の標準偏差は、外径 φ600の値を意味します。同じ 5 つの連続した OD600値の標準偏差を計算します。最小の標準偏差と最大外径600は、赤色でハイライトされます。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
プロトコルの重要なステップには、普通株式の指数関数的に成長のセルやマイクロ プレートの様々 な位置に複数の井戸で同じサンプルのレプリケーションの準備が含まれます。以前は、微生物学者は、一晩前文化から文化を始めた。このメソッドは、細菌の増殖のタイムラグを減らすことができます、再現性のある成長曲線を実現することは困難です。図 2のように、共通のグリセロールを使用して独立した測定結果ほぼ同じ成長曲線を再現性と正確な結果を提供します。図 3に示すように、さまざまな場所で井戸与えるわずかに異なる読み取り測定の世界的なバック グラウンドと見なされます。細菌の成長の定量的評価、この背景を検討してください。実験的レプリケーションの種類豊富なプレートの場所で複数の井戸にサンプルの接種は世界的なバイアスを考慮する勧めします。
エラーの処理のほかに由来する実験装置と物資のトラブルシューティングおよび修正は考慮されなければなりません。いくつかの高度なマイクロ プレート リーダーが市販されています。彼らは光の波長、暖房または冷却のモードの調整法などの特性、方法および揺れの周波数で変動幅を示します。我々 の経験に基づいて、液量の変化に大きく影響外径600読み取りますので高スループット研究で蒸発を対処する必要があります。蒸発は、マイクロ プレート リーダーとプレートのアーキテクチャによって使用される暖房の方法が原因です。市販マイクロ プレート リーダーで暖房の 2 つのモード、温風による暖房とホット プレートで加熱します。このプロトコルで使われるマイクロ プレート リーダーは、マイクロ プレートの中が吹く暖かい空気にすぐに干上がってしまうため蒸発を抑える加熱法としてホット プレートを使用しました。プレートも慎重に選択する必要があります。(蓋) と異なる 96年ウェル マイクロ プレートは、蒸発の異なったレベルを引き起こします。この方法は、蒸発を減らす深い屋根付きふた付きプレート フォーマットを利用しています。
また、研究では、成長曲線の固定相解析を必要とする場合、方法とマイクロ プレート リーダーで揺れの周波数すべきアカウント。培養中の揺れにより成長細胞がメディアで均一に中断されます。不適切な振動や低周波は、よく周囲または低いまたは実際の読み取りよりも高い偽の読み取りの結果、高密度の中央でのスタックのセルを引き起こす可能性があります。記述されているメソッドを使用して線形、双方向揺れ。8 形振動モードはおそらく十分なが、揺れの円形モードお勧めしません。
このメソッドの主要な制限は、細胞培養液の蒸発です。最大培養量が小さいので大きな蒸発を引き起こすすなわち、200 μ L、37 ° C で培養。したがって、このメソッドは、さらに 48 h. より長く培養に適して、光検出 (外径600) はこれらの密度に限定されるため、低密度の細胞培養を避けてください。総合的に考えると、非常に遅い成長細胞/株または非常に低い初期濃度文化は好ましくないと彼らは長い時間を必要とする、外径 φ600の検出限界値以下。
このメソッドは、体系的な調査に非常に有利な高精度、高スループットの測定を得られます。代表的な結果としては、この方法により簡単かつ再現性をもって様々 なゲノムやメディアでの大腸菌の品揃えを評価は5。従来管で養殖と異なる時点でサンプルを手動で測定の方法と比較して、説明の方法はより少ない労働と時間の集中的です。将来のアプリケーションと法の開発実験操作と解析の自動化を含むと見なされます。自動計測とロボット アプリケーションは、細胞の成長を評価し、細菌、哺乳類細胞を用いたサバイバル テストの実行の非常に効率的かつ信頼性の高い方法に します。
開示事項
平土屋にありがとう CFU アッセイの例を提供します。この仕事は部分的に財政的に文部科学研究 (C) 号 26506003 の (BWY) に文部科学省から。
謝辞
著者が明らかに何もありません。
資料
| Name | Company | Catalog Number | Comments |
| K2HPO4 | Wako | 164-04295 | |
| KH2PO4 | Wako | 166-04255 | |
| (NH4)2SO4 | Wako | 019-03435 | |
| MgSO4-7H2O | Wako | 138-00415 | |
| Thiamine-HCl | Wako | 201-00852 | |
| glucose | Wako | 049-31165 | |
| HCl | Wako | 080-01066 | |
| Iron (II) sulfate heptahydrate (FeSO4-7H2O) | Wako | 094-01082 | |
| KOH | Wako | 168-21815 | |
| Glycerol | Wako | 075-00611 | |
| Centrifuge tube (50 mL, sterilized) | WATSON | 1342-050S | |
| Pipette Tips, 200 µL | WATSON | 110-705Y | |
| Pipette Tips, 1,000 µL | WATSON | 110-8040 | |
| Microtube (1.5 mL) | WATSON | 131-715C | |
| 8 multichannel-pipette | WATSON | NT-8200 | |
| PASORINA STIRRER | AS ONE | 2-4990-02 | |
| Glass cylinder (200 mL) | AS ONE | 1-8562-07 | |
| Precision pH mater | AS ONE | AS800 / 1-054-01 | |
| Pipetman P-200 | GILSON | 1-6855-05 | |
| Pipetman P-1000 | GILSON | 1-6855-06 | |
| Disposable Serolocical Pipettes (10 mL) | SANPLATEC | SAN27014 | |
| Disposable Serolocical Pipettes (25 mL) | SANPLATEC | SAN27015 | |
| Microtube stand | BM Bio | 801-02Y | |
| Vortex | BM Bio | BM-V1 | |
| Corning Costar 96-well microplate with lid (Flat bottom, Clear) | Sigma-Aldrich | Corning, 3370 | |
| Corning Costar reagent reservoir (50 mL) | Sigma-Aldrich | Corning, 4870 | |
| Stericup GV PVDF (250 mL, 0.22 µM) | Merck Millipore | SCGVU02RE | |
| Pipet-Aid XP | DRUMMOND | 4-000-101 | |
| Bioshaker (BR-23UM MR) | TAITEC | 0053778-000 | |
| Disposal cell (1.5 mL) | Kartell | 1938 / 2-478-02 | |
| DU 730 Life Science UV/Vis Spectrophotometer | Beckman Coulter | A23616 | |
| EPOCH2 | BioTek | 2014-EP2-002 / EPOCH2T | |
| Beaker (500 mL) | IWAKI | 82-0008 | |
| BIO clean bench | Panasonic | MCV-B131F | |
| Glass tubes | NICHIDEN RIKA GLASS | P-10M~P-30 /101019 | |
| Silicone rubber stoppers | ShinEtsu Polymer | T-19 | |
| Bacterial strains | Strain bank organization; National Bio Resource Project (NBRP) in Japan |
参考文献
- Kovarova-Kovar, K., Egli, T. Growth kinetics of suspended microbial cells: from single-substrate-controlled growth to mixed-substrate kinetics. Microbiol Mol Biol Rev. 62 (3), 646-666 (1998).
- Soupene, E., et al. Physiological studies of Escherichia coli strain MG1655: growth defects and apparent cross-regulation of gene expression. J Bacteriol. 185 (18), 5611-5626 (2003).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Egli, T. Microbial growth and physiology: a call for better craftsmanship. Front Microbiol. 6, 287 (2015).
- Kurokawa, M., Seno, S., Matsuda, H., Ying, B. W. Correlation between genome reduction and bacterial growth. DNA Res. 23 (6), 517-525 (2016).
- Matsumoto, Y., Murakami, Y., Tsuru, S., Ying, B. W., Yomo, T. Growth rate-coordinated transcriptome reorganization in bacteria. BMC Genomics. 14, 808 (2013).
- Nahku, R., et al. Specific growth rate dependent transcriptome profiling of Escherichia coli K12 MG1655 in accelerostat cultures. J Biotechnol. 145 (1), 60-65 (2010).
- Dai, X., et al. Reduction of translating ribosomes enables Escherichia coli to maintain elongation rates during slow growth. Nat Microbiol. 2, 16231 (2016).
- Madrid, R. E., Felice, C. J. Microbial biomass estimation. Crit Rev Biotechnol. 25 (3), 97-112 (2005).
- Harris, C. M., Kell, D. B. The estimation of microbial biomass. Biosensors. 1 (1), 17-84 (1985).
- Yates, G. T., Smotzer, T. On the lag phase and initial decline of microbial growth curves. J Theor Biol. 244 (3), 511-517 (2007).
- Kargi, F. Re-interpretation of the logistic equation for batch microbial growth in relation to Monod kinetics. Lett Appl Microbiol. 48 (4), 398-401 (2009).
- Peleg, M., Corradini, M. G. Microbial growth curves: what the models tell us and what they cannot. Crit Rev Food Sci Nutr. 51 (10), 917-945 (2011).
- Sprouffske, K., Wagner, A. Growthcurver: an R package for obtaining interpretable metrics from microbial growth curves. BMC Bioinformatics. 17, 172 (2016).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Mol Biol Evol. 31 (1), 232-238 (2014).
- Hermsen, R., Okano, H., You, C., Werner, N., Hwa, T. A growth-rate composition formula for the growth of E.coli on co-utilized carbon substrates. Mol Syst Biol. 11 (4), 801 (2015).
- Engen, S., Saether, B. E. r- and K-selection in fluctuating populations is determined by the evolutionary trade-off between two fitness measures: Growth rate and lifetime reproductive success. Evolution. 71 (1), 167-173 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved