Method Article
Analisi precisa, High-throughput di crescita batterica
In questo articolo
Riepilogo
Valutazione quantitativa della crescita batterica è essenziale per comprendere la fisiologia microbica come un fenomeno di livello dei sistemi. Un protocollo per la manipolazione sperimentale e un approccio analitico vengono introdotti, per consentire analisi precisa, ad alta velocità di crescita batterica, che è un tema chiave di interesse in biologia dei sistemi.
Abstract
Crescita batterica è un concetto centrale nello sviluppo della moderna fisiologia microbica, così come nelle indagini di dinamica cellulare a livello di sistemi. Studi recenti hanno riferito le correlazioni tra la crescita batterica e gli eventi di genoma, come riorganizzazione di riduzione e del trascrittoma di genoma. Analizzare correttamente la crescita batterica è cruciale per capire il coordinamento di crescita-dipendente delle funzioni geniche e componenti cellulari. Di conseguenza, la precisa valutazione quantitativa della crescita batterica in un modo ad alta velocità è richiesta. Gli sviluppi tecnologici emergenti offrono nuovi strumenti sperimentali che consentono aggiornamenti dei metodi utilizzati per studiare la crescita batterica. Il protocollo introdotto qui impiega un lettore di micropiastre con una procedura sperimentale altamente ottimizzata per la valutazione precisa e riproducibile di crescita batterica. Questo protocollo è stato usato per valutare la crescita di diversi ceppi di Escherichia coli in precedenza. Le fasi principali del protocollo sono come segue: la preparazione di un gran numero di cellule Stock in piccole fiale per ripetuti test con risultati riproducibili, l'uso di piastre a 96 pozzetti per valutazione di crescita ad alta velocità e il calcolo manuale delle due grandi parametri (cioè, crescita massima frequenza e densità di popolazione) che rappresenta il tasso di crescita. Rispetto ai tradizionali test di unità (CFU) formanti colonie, che conta le celle che sono coltivate in tubi di vetro nel tempo su piastre di agar, il presente metodo è più efficiente e fornisce documenti più dettagliati temporale dei cambiamenti di crescita, ma ha una più rigorosa limite di rilevabilità a bassa densità. In sintesi, il metodo descritto è vantaggioso per l'analisi di alto-rendimento preciso e riproducibile della crescita batterica, che può essere utilizzata per trarre conclusioni concettuale o effettuare osservazioni teoriche.
Introduzione
Studi microbiologici spesso iniziano con la cultura delle cellule batteriche e la valutazione delle curve di crescita batterica, che rappresentano un fenomeno fondamentale della fisiologia batterica1,2,3. Principi di cultura di base sono ampiamente disponibili nella letteratura di ricerca pubblicata e libri di testo perché la coltura batterica è una metodologia fondamentale. A livello di banco, notevole attenzione è stata concentrata tradizionalmente su ottimizzando la crescita media e condizioni di coltura, ma controllando il tasso di crescita, che sarebbe probabilmente fornire anche una maggiore comprensione della fisiologia microbica, non è stato estesamente studiato4. Per i batteri in crescita esponenziale, un parametro chiave dello stato cellulare è il tasso di crescita, che è stato segnalato per essere coordinato con il genoma, trascrittoma e proteoma5,6,7,8 . Pertanto, la valutazione quantitativa della crescita batterica è cruciale per capire la fisiologia microbica.
Per valutare la crescita batterica, i metodi sperimentali usati per stimare la biomassa sono affermati9,10 e si basano sulla rilevazione di parametri biochimici, fisici o biologici, come torbidità ottico. Inoltre, i metodi analitici utilizzati per catturare le proprietà dinamiche dei cambiamenti di crescita comunemente sono basati su modelli non lineari consolidati11,12,13, ad esempio, logistiche equazioni. Tasso di crescita è generalmente acquisite mediante campionamento temporizzato della crescita delle cellule in coltura da misura della torbidità ottico o eseguire dosaggi di formanti colonie (CFU) unità. La limitazione di questi metodi di rilevamento e di coltura è che i punti dati non sono un vero riflesso della dinamica di popolazione, poiché gli intervalli di misurazione sono spesso in ore e poiché la condizione di cultura (ad esempio, variazioni di temperatura e aerazione) è disturbato al momento del campionamento. Tecniche di analisi e cultura devono essere aggiornate utilizzando recenti sviluppi nella tecnologia e nella comprensione. Gli avanzamenti recenti in lettori di micropiastre consentono l'osservazione in tempo reale di crescita batterica e ridurre notevolmente i costi di manodopera. Utilizzando questi dispositivi avanzati, gli ultimi studi sulla crescita batterica sono riportati metodi analitici per misure ad alta velocità14,15.
Lo scopo del presente protocollo è quello di valutare la dinamica di crescita precise in un modo ad alta velocità, che si riveleranno utile per studi quantitativi che, infine, affrontare le questioni di come viene determinato il tasso di crescita e fattori che influenzano il tasso di crescita. Il protocollo risolve tutti i fattori che dovrebbero essere presi in considerazione per la quantificazione precisa e ripetibile di crescita batterica. Il metodo sperimentale e l'analisi sono descritti dettagliatamente nel testo principale. Questo metodo permette l'analisi precisa e riproducibile della crescita batterica in un modo ad alta velocità. Microbiologi possono utilizzare questo protocollo per derivare ulteriori risultati quantitativi da loro evidenza sperimentale. Questo protocollo è utilizzabile anche per gli studi in biologia dei sistemi che tentano di trarre conclusioni concettuale o per ottenere una panoramica teorica della crescita.
Protocollo
1. preparare il mezzo di crescita
Nota: la composizione chimica di M63 medio minimo è il seguente: 62 mM K 2 HPO 4, 39mm KH 2 PO 4, 15mm (NH 4) 2 SO 4, 1,8 µM FeSO 4, 15 µM tiamina-HCl, 0,2 mM MgSO 4 e 22 millimetri di glucosio. M63 è fatto mescolando tre soluzioni di riserva: soluzione X cinque, 20% glucosio e soluzione di MgSO 4 della tiamina. Conservare tutte le soluzioni a 4 ° C.
- Preparare la soluzione di cinque X
- per preparare FeSO 4 soluzione, utilizzare una pipetta elettrica e una pipetta sierologica per aggiungere ddH 2 O a una provetta da centrifuga da 50 mL. Utilizzare un P-200 per aggiungere 0,06 mL HCl 36mg FeSO 4 M HCl. aggiungere 0.01-7h 2 O e mescolare bene.
- Misurare 160 mL ddH 2 O in un cilindro graduato e aggiungerlo a un becher da 500 mL. Aggiungere il codice seguente in questo ordine: 10,72 g K 2 HPO 4, 5,24 g KH 2 PO 4, 2,0 g (NH 4) 2 SO 4 e 0,5 mL di soluzione di 4 FeSO (preparata al punto 1.1.1).
- Utilizzando un misuratore di pH di precisione, regolare il pH a 7.0 con l'aggiunta di 2 M di KOH. Versare la soluzione in un cilindro graduato e aggiungere ddH 2 O a un volume totale di 200 mL. Sterilizzare la soluzione utilizzando un'unità di filtrazione da 250 mL (PVDF, da 0,22 µM).
- Preparazione della soluzione di glucosio 20%
- misurare 200 mL ddH 2 O in un cilindro graduato e versarlo in un recipiente di 500 mL. Continuando a mescolare con un agitatore magnetico, aggiungere 50 g di glucosio. Diluire la soluzione in un cilindro graduato per un volume totale di 250 mL. Sterilizzare la soluzione, come descritto al punto 1.1.3.
- Preparazione della soluzione di tiamina MgSO 4
- aggiungere 150 mL ddH 2 O in un becher da 500 mL. Continuando a mescolare con un agitatore magnetico, è necessario aggiungere 1,0 g di tiamina-HCl e 10 g di MgSO 4-7 H 2 O. Diluire la soluzione in un cilindro graduato per un volume totale di 200 mL. Sterilizzare la soluzione, come descritto al punto 1.1.3.
- Preparazione minima media M63
- posto la soluzione X cinque, la soluzione di glucosio 20%, la soluzione di MgSO 4 della tiamina, una pipetta elettronica, una pipetta P-200 e puntali per pipette 200-µ l su un banco pulito.
- Misurare 155,8 mL ddH 2 O in un cilindro graduato e versarlo in un becher da mL 500.
- Usando la pipetta elettronica e pipette sierologiche monouso, aggiungere 40 mL di soluzione X cinque e 4 mL di soluzione di 20% glucosio al ddH misurato 2 O. Quindi, aggiungere 0,2 mL di soluzione di MgSO 4 della tiamina con il P-200. Sterilizzare la soluzione, come descritto al punto 1.1.3.
2. Preparare il brodo di glicerolo
- cella cultura
Nota: I ceppi batterici (ad es., W3110 e suo genoma ridotto) sono disponibili da organizzazioni della banca di ceppo. I ceppi sono ottenuti solitamente sotto forma di colonie su piastre di agar.- Posto cinque tubi di vetro sterilizzati con tappi di gomma del silicone, una pipetta elettronica, P-1,000, puntali per pipette 1.000-µ l, P-200, puntali per pipette 200-µ l e i ceppi di destinazione (colonie su piastre) su un banco pulito.
- Esporre la bocca del tubo di vetro di un becco Bunsen prima di aprire il tappo di gomma del silicone. Esporre il tappo di gomma del silicone alla fiamma dopo il tubo è aperto e poi leggermente posizionare il tappo sul tubo di vetro.
- Utilizzare la pipetta elettronica e pipette sierologiche monouso per aggiungere uno dei tubi di vetro e 4,5 mL M63 nelle altre quattro provette 5 mL M63.
- Utilizzare la punta di P-200 per prendere una Colonia e inoculare e nel tubo di vetro contenente 5 mL M63.
- Vortex il tubo per fare una sospensione. Quindi, la soluzione diluita 10 volte da trasferire 0,5 mL di questa soluzione a uno dei quattro tubi contenente 4,5 mL M63.
- Ripetere il procedimento descritto al punto 2.1.5 per i rimanenti tubi. Una serie di diluizioni con cinque diverse concentrazioni (diluizioni di 1, 10, 100, 1000 e 10.000) è ora pronto.
- Sterilizzare le foci dei tubi di vetro e i tappi di gomma di silicone come descritto al punto 2.1.2. Le provette con i tappi di Cap. Non arricciando i tappi di gomma di silicone per evitare contaminazione.
- Posizionare i cinque tubi in un'incubatrice di agitazione pre-riscaldata a 37 ° C e agitare a 200 giri/min. Incubare la cultura durante la notte o per h. 10-30
- Selezione della cultura per lo stock di glicerolo
- inserire il mezzo di temperatura pre-riscaldato M63, P-1,000, puntali per pipette 1.000-µ l e una cuvetta monouso su un banco pulito.
- Aggiungere 1000 µ l M63 a una cuvetta monouso con un P-1, 000. Disponga la provetta monouso con uno spettrofotometro, avviare il programma a una lunghezza d'onda fissa di 600 nm e misura lo spazio in bianco.
- Spostare i tubi di cinque vetro dall'incubatrice che agita il banco pulito.
- Scartare M63 dalla cuvette monouso e aggiungere 1.000 µ l cultura per la stessa cuvetta monouso con un P-1, 000. Misurare la torbidità ottica della coltura delle cellule (OD 600) come descritto al punto 2.2.2.
Nota: Per evitare qualsiasi contaminazione e per ottenere una misura precisa, esporre i tubi di vetro e i tappi per la fiamma come descritto e vortice la cultura prima del campionamento. Per garantire risultati affidabili, misurazioni ripetute sono raccomandate, in particolare quando la densità cellulare è bassa. - Dei cinque colture cellulari, scegliere quello che è in fase di crescita esponenziale precoce (OD 600 = 0,01 - 0,05) per lo stock di glicerolo.
Nota: Se le colture multiple hanno densità all'interno della gamma ottima, quella più vicina a 0,05 è comunemente selezionata.
- Le scorte di glicerolo per ripetuti test.
Nota: Questo è descritto per la preparazione di dieci titoli. Quantità maggiori o minori possono essere fatti secondo i requisiti sperimentali.- Posto la soluzione di glicerolo 60% sterilizzata, dieci sterilizzato microprovette da 1,5 mL, P-1,000 e P-200, puntali per pipette 1.000 e 200 µ l e una microprovetta stare su un banco pulito.
- Aggiungere 250 µ l di soluzione di glicerolo di 60% e 750 µ l della cultura cella selezionata nella microprovetta 1,5 mL e mescolare sterilizzati pipettando.
Nota: Il volume di stock è variabile, ma sempre mantenere un rapporto di 1:3 di 60% glicerolo alla coltura delle cellule; Questo si traduce in una concentrazione finale di glicerolo al 15%. - Inserire i restanti nove microprovette nello stand conetti e pipettare 100 µ l della miscela preparata al punto 2.3.2 in ogni provetta. Ora ci sono dieci scorte di glicerolo identici per un utilizzo futuro.
- Conservare le scorte in un congelatore a -80 ° C.
3. Acquisendo le curve di crescita
- impostare il lettore di micropiastre.
Nota: I termini riportati in virgolette Visualizza il fraseggio specifico utilizzato il lettore della piastra utilizzato qui (Vedi la tabella materiali).- Apri il software. Aperto " protocolli " in " Task Manager " e scegliere " Crea nuovo ". Scegliere " protocollo Standard ".
- Open " Procedure " e regolare le impostazioni. Aperto " impostare la temperatura di " e selezionare " incubatore su ". Impostare " temperatura " a 37 ° C e " gradiente " a 0 ° C. Check " Preheat " prima di continuare con il passaggio successivo. Aperto " avviare Kinetic ", set " Runtime " per 24:00:00 o 48:00:00, e " intervallo " per 00:30:00 o 01:00.
Nota: Ci vuole circa 1 minuto per leggere un intero 96 piastra ben. - Open " Shake " e impostare " Shake modalità " come " lineare ". Verifica " Constitution Shake " e impostare " frequenza " al cpm 567. Aperto " lettura ", controllare " assorbanza ", " Endpoint/cinetica ", e " monocromatori. " Set " lunghezza d'onda " a 600.
- Clic " Validate " per confermare che la procedura è corretta. Fare clic su " salvare " per salvarlo come un nuovo programma per un uso futuro.
- Registrazione di crescita in tempo reale
- disegnare un pittogramma di piastra a 96 pozzetti (8 × 12 tavolo) per indicare le posizioni dei campioni inoculati cultura sulla piastra 96 pozzetti. Stampare la tabella e utilizzarlo come riferimento per l'esperimento.
Nota: I pozzetti situati sui bordi della micropiastra devono contenere solo mezzo vuoto a causa di evaporazione. - Posto un piatto sterilizzato di 96 pozzetti fondo micropiastra con coperchio, P-1000, puntali per pipette 1000-µ l, P-200, puntali per pipette 200-µ l, diversi microprovette da 1,5 mL, una pipetta multicanale 8, un serbatoio del reagente sterilizzato, temperatura ambiente M63 e glicerolo scorte (preparate al punto 2.3) su un banco pulito.
- Aggiungere circa 25 mL M63 per il serbatoio del reagente. Utilizzare questo stock di serbatoio per tutti i passaggi seguenti.
- µ L aggiungere 900 M63 per microprovette in preparazione per effettuare diluizioni seriali.
- Scongelare il brodo di glicerolo a temperatura ambiente. µ L 900 M63 alla Stock in glicerolo scongelati e vortice. Questo si traduce in una diluizione di 10 volte del titolo originale glicerolo.
- Trasferire 100 µ l della diluizione 10 volte ad un'altra microprovetta contenente 900 µ l di M63 e vortex. Questo si traduce in una diluizione di 100 volte.
- Ripetere il punto 3.2.6 fino al raggiungimento del numero desiderato di diluizioni.
- Riempire i pozzetti al bordo della micropiastra con 200 µ l M63 utilizzando una pipetta a 8 canali (P-200).
Nota: Questi pozzi possono essere utilizzati come il vuoto. - Carico 200 µ l di ogni campione preparato nei passaggi 3.2.4 - 3.2.7 dei pozzetti di micropiastra secondo la tabella di riferimento (punto 3.2.1) diluito. Vortice il priore di campioni diluiti a carico e carico lo stesso campione in pozzi multipli alle varie posizioni sulla piastra.
- Appoggiare la micropiastra a 96 pozzetti al lettore di piastra.
- Open " lettura ora " in " Task Manager " e scegliere il programma (sezione 3.1). Fare clic su " OK " per avviare la misurazione. Salvare la registrazione come un nuovo file sperimentale per l'analisi dei dati (sezione 4).
- disegnare un pittogramma di piastra a 96 pozzetti (8 × 12 tavolo) per indicare le posizioni dei campioni inoculati cultura sulla piastra 96 pozzetti. Stampare la tabella e utilizzarlo come riferimento per l'esperimento.
4. Analisi dei dati
- esportazione i risultati dei dati in tempo reale del tasso di crescita (sezione 3.2) da una memoria USB stick come un file di testo.
Nota: Un risultati formattati 96 pozzetti (curve) visualizzerà il lettore della piastra in tempo reale. I record orari (valori OD) possono essere esportati come un tavolo; le righe e le colonne rappresentano i numeri ben (ad esempio, A1, B1) e il tempo di misurazione (ad es., 00:00:59), rispettivamente. - Aprire il file di testo con un software di foglio di calcolo.
- Copiare le letture di 600 OD orarie della micropiastra 96 pozzetti in un nuovo foglio di lavoro per ulteriori analisi.
- Subtract background legge al tempo zero dalla legge orarie di ciascun campione ben.
Nota: Per comodità, il valore medio del bianco pozzetti contenenti M63 (punto 3.2.8) può essere utilizzato come il valore background. - Calcolare la media dei cinque consecutivi OD 600 letture per stimare la densità di popolazione massima.
Nota: Il valore medio più grande dei cinque consecutivi OD 600 legge è definito come il massimo OD 600 della curva corrispondente crescita. - Calcolare il tasso di crescita, µ (h -1), applicando la seguente equazione per tutte le coppie di valori consecutivi di OD 600:
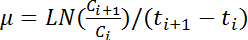
Nota: In questa equazione, C i e C i + 1 rappresentano i valori di 600 OD di due qualsiasi punti di volta consecutiva (t i e t i + 1, rispettivamente). LN indica il logaritmo naturale. - Calcola i cambiamenti nel tasso di crescita nel corso del tempo basati su orario OD 600 legge secondo punto 4.6. Calcolare la media e la deviazione standard dei cinque tassi di crescita consecutiva di stimare il tasso di crescita massima.
Nota: La media più grande con la più piccola deviazione standard è definita come il tasso di crescita massima della curva corrispondente crescita.
5. Confermando la tendenza globale del legge 96 pozzetti (opzionale)
Nota: entrambe la piastra reader e la piastra a 96 pozzetti consumabili possono causare misurazioni distorte. Per ottenere risultati quantitativi altamente precisi e riproducibili, confermando la tendenza globale della piastra 96 pozzetti è altamente raccomandato.
- Preparare la piastra a 96 pozzetti e il lettore di piastre per il bias test come descritto nella sezione 3.2.2.
- Aggiungere 20 mL M63 a una provetta da centrifuga da 50 mL sterilizzato. Aggiungere il brodo di glicerolo alla stessa provetta da centrifuga e vortice. Trasferire la soluzione sospesa ad un serbatoio di reagente sterilizzato.
- Utilizzare una pipetta a 8 canali per trasferire 200 µ l della soluzione sospesa la piastra a 96 pozzetti.
- Appoggiare la piastra a 96 pozzetti al lettore di piastra e avviare la misurazione.
- Record oraria OD 600 legge e analizzare come descritto nella sezione 4. Confronta la densità di tasso e popolazione di crescita massima calcolata di ciascun pozzetto per determinare la localizzazione bias del legge 96 pozzetti.
Risultati
Il metodo descritto fornisce un mezzo per catturare la dinamica crescita batterica in modo continuo, ad alta velocità utilizzando un lettore di formato da 96 pozzetti che prende misurazioni multiple di densità ottica a vari intervalli di tempo (da minuti a ore o giorni). Le curve di crescita di un assortimento di ceppi di Escherichia coli che esprimono vari genomi possono essere acquisite proprio in un singolo esperimento (Figura 1A). In confronto il metodo descritto, il metodo tradizionale (il saggio dei CFU) generalmente richiede più lunghi intervalli di tempo di campionamento (Figura 1B) ed è alta intensità di manodopera se coltura multipla è necessario. Inoltre, ogni tempo di campionamento di cultura per il dosaggio CFU richiede l'uso di un piccolo volume di coltura delle cellule che non può essere utilizzato per misure ripetute. Inoltre, un numero limitato di punti di tempo per il rilevamento potrebbe perdere i punti di campionamento che sono necessari per il corretto calcolo il tasso di crescita e la massima OD600. Tuttavia, il saggio CFU ha un limite di rilevabilità inferiore, 103 - 104 cellule/mL, che lo rende almeno due ordini di grandezza più sensibile dell'analisi ottica torbidità (OD600= 0,001, che ha un limite di rilevabilità di circa 105 -106 cellule/mL). Il metodo descritto fornisce un pratico ed efficiente strumento sperimentale per gli studi di livello dei sistemi sulle dinamiche di crescita.
Un vantaggio chiave di questo protocollo è che ci vogliono misure ripetute da uno stock di glicerolo comune. Avendo più colture cellulari a diverse velocità di diluizione in fase iniziale di crescita esponenziale è molto utile perché permette ai ricercatori di determinare il tempo di cultura in qualsiasi lasso di tempo ed evita avendo saturato culture a causa di eventi imprevedibili. Ripetute misurazioni degli stock comuni, che sono stati preparati da uno dei cinque culture avviate utilizzando i tassi differenti di diluizione come descritto nel protocollo sezione 2.2 (Figura 2A), ha presentato i risultati altamente simili della crescita e coltura analisi delle dinamiche. Più curve di crescita di misurazioni ripetute e indipendente (N = 6) sovrapposte bene (Figura 2BPannello superiore), con piccola variazione (Figura 2BPannello inferiore), in particolare durante la fase esponenziale ( Figura 2B, area ombreggiata). Questi risultati indicano che il metodo descritto garantisce risultati altamente riproducibili.
Si consiglia vivamente di stimare il bias globale del legge 96 pozzetti. Nel presente metodo, la tendenza globale è stimata monitorando la crescita del selvaggio-tipo e. coli ceppo W3110 come descritto nel protocollo sezione 5. Ad esempio, i tassi di crescita calcolato dalle curve di crescita ha mostrate significative variazioni tra 96 pozzetti (Figura 3A), che rappresenta la fluttuazione globale derivata da sia la manipolazione dei dati e gli errori del dispositivo. Questi errori possono essere mascherati caricando lo stesso campione in pozzi multipli alle varie posizioni sulla piastra. Al contrario, la massima OD600 ha mostrato un chiara posizione-dipendente bias per i risultati, come cambiamenti graduali sono stati osservati lungo la direzione verticale, vale a dire il massimo OD600 aumentato gradualmente dai pozzetti della colonna 2 a quelli di colonna 11 sulla piastra 96 pozzetti (Figura 3B). Per evitare i risultati parziali, lo stesso campione è raccomandato da caricare nei pozzetti situati su entrambi i lati della piastra 96 pozzetti per misure ripetute. Il bias tra piazze in valori massimi di600 OD è presupposto per derivare dalla variazione nei tassi di evaporazione, che sono determinate da riscaldamento e l'efficienza di tenuta. Confrontato con i pozzi nel mezzo la micropiastra a 96 pozzetti, i pozzi che si trova ai bordi tendevano a mostrare valori relativamente più elevati, che riflettono i tassi di evaporazione varia derivanti dall'effetto di tenuta della micropiastra. Inoltre, poiché altri 96 pozzetti sottoposto alla prova stessa polarizzazione ha mostrato i simili cambiamenti direzionali basati su dove si trovava il pozzo sulla piastra, nella misura della polarizzazione potrebbe dipendere il lettore di piastre. Pertanto, è importante valutare il pregiudizio globale del 96 pozzetti si legge negli studi che determinano la densità della popolazione massima. I lettori di micropiastre commercialmente disponibili che tutti hanno i loro specifici pregiudizi globale causato il riscaldamento e scuotendo l'efficienza e la a 96 pozzetti in gran parte si differenziano per l'efficienza di tenuta.
Questo metodo è progettato per l'analisi sistematica di crescita batterica, e può essere utilizzato per analizzare due parametri principali, vale a dire, densità delle cellule e del tasso di crescita, che comunemente vengono applicate in un'ampia varietà di campi, come la biologia dei sistemi, evoluzione, e ecologia16,17. Il calcolo manuale utilizzando il foglio di calcolo è stato introdotto per indicare l'elaborazione del raw legge per produrre i parametri valutati della densità delle cellule e del tasso di crescita. Le tariffe orarie di crescita sono calcolate in primo luogo dal crude letture della curva di crescita (Figura 4A) secondo il protocollo sezione 4.6 come un set di dati di cambiamenti sequenziali nei tassi di crescita (Figura 4B). I mezzi e le deviazioni standard di ogni cinque tassi di crescita consecutivi vengono acquistate in modo sequenziale (Figura 4-D), e il maggior tasso di crescita media con la più piccola deviazione standard è definito come il tasso di crescita massima della crescita curva (Figura 4-D, evidenziato). La densità delle cellule maximal (OD600) viene analizzata allo stesso modo (Figura 4E-F). La densità di tasso e delle cellule di crescita calcolati vengono successivamente sottoposti a ulteriore analisi. Si noti che i calcoli descritti possono essere automaticamente eseguiti utilizzando piattaforme computazionali (linguaggi di programmazione), per esempio, R e Python.

Figura 1 curve di crescita acquistate con diversi metodi. (A) acquisizioni Multiple di curve di crescita. Curve di crescita di quattro diversi ceppi di e. coli che esprimono vari genomi sono stati ottenuti in un modo ad alta velocità. Le cellule di Escherichia coli sono state coltivate in M63 medio minimo, e le modifiche in OD600 letture sono state registrate da un lettore di micropiastre a intervalli di 1-h. I ceppi da sinistra a destra sono del tipo selvatico Escherichia coli W3110 (numero 0) e suoi genomi ridotti numeri 1, 10 e 18 (descritto in precedenza5), rispettivamente. (B) curva di crescita ottenuto usando l'analisi CFU. Il selvaggio-tipo cellule di Escherichia coli (numero 0) sono state coltivate e sono state provate nei punti di tempo indicato sopra parecchie ore. Le modifiche di crescita sono state stimate usando l'analisi CFU. Cerchi aperti indicano la registrazione o punti di campionamento. Clicca qui per visualizzare una versione più grande di questa figura.
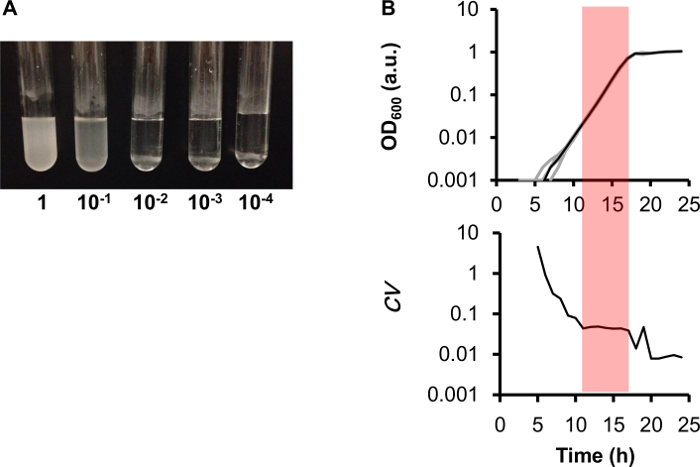
Figura 2. Misurazioni ripetute riproducibile. Culture durante la notte (A) del tasso di diluizione varias. le cellule di Escherichia coli sono state inoculate in tubi a più tassi di diluizione, che varia da 1-a 10,000-fold, come indicato. Le cellule sono state coltivate a 37 ° C con agitazione a 200 giri/min per circa 12 h. I valori di600 OD finali delle colture cinque cellulari (da sinistra a destra) erano 1,51, 0,74, 0,05, 0,008 e 0,001, rispettivamente. La cultura con OD600 di 0,05 è stata utilizzata per lo stock di glicerolo comune. (B) misure altamente riproducibili. Sei curve di crescita indipendente (linee top, grigie) dello stesso ceppo di e. coli sono state acquisite e calcolate da sei posizioni su micropiastra e due flaconcini di stock comuni glicerolo. La linea nera rappresenta la media delle curve di sei crescita. I coefficienti di variazione (CV) delle sei misurazioni ripetute sono stato calcolato (in basso), e i punti più bassi costanti vengono copiati nella rosa. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 3 Bias globale del formato 96-well. Mappa di calore (A) dei tassi di crescita. Lo stock di cellule di e. coli è stato sospeso in M63 medio minimo e caricato ugualmente nei 96 pozzetti della micropiastra (rappresentato come una tabella di 12 × 8). Le modifiche in OD600 sono state ottenute utilizzando il lettore di micropiastre, come descritto nella sezione 5 del protocollo. La gradazione dal bianco al rosso indica i tassi di crescita da 0,7 a 0,9 h-1. Mappa di calore (B) della massima OD600. La gradazione dal bianco al rosso indica i valori massimi di600 OD da 0,9 a 1,2. I calcoli per il tasso di crescita e massima OD600 sono come descritto in Figura 4. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 analisi delle curve di crescita. (A) dati grezzi delle curve di crescita. Le letture di600 OD orarie vengono confrontate con il tempo di cultura. Cerchi aperti indicano i tempi di campionamento. (B) temporale cambia nei tassi di crescita. Tariffe orarie di crescita tra due consecutivi OD600 letture sono calcolate secondo l'equazione descritto in 4.6. (C) significa tassi di crescita. La media dei tassi di crescita consecutiva cinque sono calcolati per dare tassi di crescita regolare. (D) deviazioni Standard dei tassi di crescita media. Viene calcolata la deviazione standard dei tassi di crescita consecutiva cinque stesso. Il tasso di crescita massima con la più piccola deviazione standard è evidenziato in rosso. (E) dire OD600. La media di cinque valori consecutivi di600 OD è calcolata per determinare la liscia OD600. (F) deviazioni Standard di OD600 valori medi. Viene calcolata la deviazione standard degli stessi cinque consecutivi OD600 valori. La massima OD600 con la più piccola deviazione standard è evidenziato in rosso. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Fasi critiche nel protocollo prevedono la preparazione di un fondo comune delle cellule e la replica di stessi campioni in pozzi multipli in diverse posizioni sulla micropiastra in crescita esponenziale. Microbiologi avviato in precedenza, la cultura da una pre-cultura durante la notte. Mentre questo metodo può ridurre il tempo di ritardo di crescita batterica, è difficile da realizzare curve di crescita riproducibile. Come mostrato nella Figura 2, le misure indipendenti utilizzando le scorte di glicerolo comune ha provocato le curve di crescita quasi identici, che forniscono risultati precisi e riproducibili. Come mostrato nella Figura 3, pozzi in varie località dare letture leggermente diverse, che è considerato il fondo globale delle misurazioni. Per la valutazione quantitativa della crescita batterica, questo sfondo dovrebbe essere considerato. Inoculazione di campioni da pozzi multipli alle posizioni di vario piastra per replica sperimentale si consiglia vivamente di conto per bias globale.
Oltre alla gestione degli errori, la modifica e la risoluzione dei problemi derivati dalle forniture di dispositivi sperimentali dovrebbe essere considerati. Diversi lettori di micropiastre avanzate sono disponibili in commercio. Essi mostrano una variazione larga caratteristiche, ad esempio il metodo di regolazione della lunghezza d'onda di luce, la modalità di riscaldamento o raffreddamento e le modalità e la frequenza di agitazione. Basandoci sulla nostra esperienza, evaporazione deve essere indirizzate a studi di alto-rendimento perché le variazioni di volume liquido notevolmente influenzano OD600 letture. Evaporazione è causato dal metodo di riscaldamento utilizzato dai lettori di micropiastre e l'architettura di micropiastre. Le due modalità di riscaldamento comunemente implementate in lettori di micropiastre commerciale riscaldamento di aria calda e riscaldamento con un piatto caldo. Il lettore di micropiastre utilizzato nel presente protocollo utilizzato la piastra calda come un metodo di riscaldamento per ridurre evaporazione, in quanto il mezzo in micropiastra sarebbe asciugare rapidamente nel soffiando aria calda. Micropiastre anche dovrebbero essere accuratamente selezionate. A different 96 pozzetti (con coperchi) causano diversi livelli di evaporazione. Il metodo descritto utilizza il formato di piastra con un coperchio rivestito profondo, che riduce l'evaporazione.
Inoltre, se lo studio richiede l'analisi di fase stazionaria della curva di crescita, quindi le modalità e la frequenza di agitazione nel lettore di micropiastre deve tener conto. Agitazione durante cultura assicura che le cellule crescenti sono sospesi uniformemente nei media. Improprio di agitazione o di bassa frequenza può causare le cellule impilare intorno al bordo ben o al centro ad un'alta densità, con conseguente letture false che sono sia inferiore o superiore rispetto alla lettura effettiva. Il metodo descritto usi bidirezionale lineare, agitazione. Mentre la modalità di agitazione a forma di 8 è probabilmente sufficiente, si consiglia la modalità circolare di agitazione.
La limitazione principale di questo metodo è l'evaporazione del terreno di coltura delle cellule. Poiché il volume di massimo cultura è piccolo, cioè, 200 µ l, incubazione a 37 ° C provoca significative evaporazione. Così, questo metodo non è adatto per la coltura più di 48 h. Inoltre, colture cellulari di bassa densità dovrebbero essere evitati perché rilevamento ottico (OD600) è limitato a queste densità. Quando considerati insieme, molto lente crescite cellule/ceppi o culture molto bassa concentrazione iniziale non sono preferite, come richiedono più tempo e sono inferiori al limite di rilevazione di OD600.
Questo metodo produce misurazioni precise, ad alta produttività, che sono altamente vantaggiosi per indagini sistematiche. Come un risultato rappresentativo, questo metodo consente di valutare un assortimento di ceppi di Escherichia coli con varie sequenze genomiche e/o medio facilmente e riproducibile5. Rispetto ai metodi tradizionali di coltura in tubi e misurazione manualmente di campioni in diversi momenti, il metodo descritto è meno manodopera e tempo intensivo. Applicazioni future e lo sviluppo del metodo si presuppone che coinvolgono l'automazione di manipolazione sperimentale e analisi computazionale. Applicazione automatica di misurazione e robotica porterà ad un metodo altamente efficiente e affidabile di valutando la crescita delle cellule ed eseguendo test di sopravvivenza utilizzando cellule batteriche e di mammifera.
Divulgazioni
Ringraziamo Kohei Tsuchiya per fornire l'esempio di analisi CFU. Questo lavoro è stato parzialmente finanziariamente supportato da una sovvenzione per ricerca scientifica (C) n. 26506003 (con BWY) dal Ministero della pubblica istruzione, cultura, sport, scienza e tecnologia, Giappone.
Riconoscimenti
Gli autori non hanno nulla a rivelare.
Materiali
| Name | Company | Catalog Number | Comments |
| K2HPO4 | Wako | 164-04295 | |
| KH2PO4 | Wako | 166-04255 | |
| (NH4)2SO4 | Wako | 019-03435 | |
| MgSO4-7H2O | Wako | 138-00415 | |
| Thiamine-HCl | Wako | 201-00852 | |
| glucose | Wako | 049-31165 | |
| HCl | Wako | 080-01066 | |
| Iron (II) sulfate heptahydrate (FeSO4-7H2O) | Wako | 094-01082 | |
| KOH | Wako | 168-21815 | |
| Glycerol | Wako | 075-00611 | |
| Centrifuge tube (50 mL, sterilized) | WATSON | 1342-050S | |
| Pipette Tips, 200 µL | WATSON | 110-705Y | |
| Pipette Tips, 1,000 µL | WATSON | 110-8040 | |
| Microtube (1.5 mL) | WATSON | 131-715C | |
| 8 multichannel-pipette | WATSON | NT-8200 | |
| PASORINA STIRRER | AS ONE | 2-4990-02 | |
| Glass cylinder (200 mL) | AS ONE | 1-8562-07 | |
| Precision pH mater | AS ONE | AS800 / 1-054-01 | |
| Pipetman P-200 | GILSON | 1-6855-05 | |
| Pipetman P-1000 | GILSON | 1-6855-06 | |
| Disposable Serolocical Pipettes (10 mL) | SANPLATEC | SAN27014 | |
| Disposable Serolocical Pipettes (25 mL) | SANPLATEC | SAN27015 | |
| Microtube stand | BM Bio | 801-02Y | |
| Vortex | BM Bio | BM-V1 | |
| Corning Costar 96-well microplate with lid (Flat bottom, Clear) | Sigma-Aldrich | Corning, 3370 | |
| Corning Costar reagent reservoir (50 mL) | Sigma-Aldrich | Corning, 4870 | |
| Stericup GV PVDF (250 mL, 0.22 µM) | Merck Millipore | SCGVU02RE | |
| Pipet-Aid XP | DRUMMOND | 4-000-101 | |
| Bioshaker (BR-23UM MR) | TAITEC | 0053778-000 | |
| Disposal cell (1.5 mL) | Kartell | 1938 / 2-478-02 | |
| DU 730 Life Science UV/Vis Spectrophotometer | Beckman Coulter | A23616 | |
| EPOCH2 | BioTek | 2014-EP2-002 / EPOCH2T | |
| Beaker (500 mL) | IWAKI | 82-0008 | |
| BIO clean bench | Panasonic | MCV-B131F | |
| Glass tubes | NICHIDEN RIKA GLASS | P-10M~P-30 /101019 | |
| Silicone rubber stoppers | ShinEtsu Polymer | T-19 | |
| Bacterial strains | Strain bank organization; National Bio Resource Project (NBRP) in Japan |
Riferimenti
- Kovarova-Kovar, K., Egli, T. Growth kinetics of suspended microbial cells: from single-substrate-controlled growth to mixed-substrate kinetics. Microbiol Mol Biol Rev. 62 (3), 646-666 (1998).
- Soupene, E., et al. Physiological studies of Escherichia coli strain MG1655: growth defects and apparent cross-regulation of gene expression. J Bacteriol. 185 (18), 5611-5626 (2003).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Egli, T. Microbial growth and physiology: a call for better craftsmanship. Front Microbiol. 6, 287 (2015).
- Kurokawa, M., Seno, S., Matsuda, H., Ying, B. W. Correlation between genome reduction and bacterial growth. DNA Res. 23 (6), 517-525 (2016).
- Matsumoto, Y., Murakami, Y., Tsuru, S., Ying, B. W., Yomo, T. Growth rate-coordinated transcriptome reorganization in bacteria. BMC Genomics. 14, 808 (2013).
- Nahku, R., et al. Specific growth rate dependent transcriptome profiling of Escherichia coli K12 MG1655 in accelerostat cultures. J Biotechnol. 145 (1), 60-65 (2010).
- Dai, X., et al. Reduction of translating ribosomes enables Escherichia coli to maintain elongation rates during slow growth. Nat Microbiol. 2, 16231 (2016).
- Madrid, R. E., Felice, C. J. Microbial biomass estimation. Crit Rev Biotechnol. 25 (3), 97-112 (2005).
- Harris, C. M., Kell, D. B. The estimation of microbial biomass. Biosensors. 1 (1), 17-84 (1985).
- Yates, G. T., Smotzer, T. On the lag phase and initial decline of microbial growth curves. J Theor Biol. 244 (3), 511-517 (2007).
- Kargi, F. Re-interpretation of the logistic equation for batch microbial growth in relation to Monod kinetics. Lett Appl Microbiol. 48 (4), 398-401 (2009).
- Peleg, M., Corradini, M. G. Microbial growth curves: what the models tell us and what they cannot. Crit Rev Food Sci Nutr. 51 (10), 917-945 (2011).
- Sprouffske, K., Wagner, A. Growthcurver: an R package for obtaining interpretable metrics from microbial growth curves. BMC Bioinformatics. 17, 172 (2016).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Mol Biol Evol. 31 (1), 232-238 (2014).
- Hermsen, R., Okano, H., You, C., Werner, N., Hwa, T. A growth-rate composition formula for the growth of E.coli on co-utilized carbon substrates. Mol Syst Biol. 11 (4), 801 (2015).
- Engen, S., Saether, B. E. r- and K-selection in fluctuating populations is determined by the evolutionary trade-off between two fitness measures: Growth rate and lifetime reproductive success. Evolution. 71 (1), 167-173 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon