Method Article
加速動脈硬化家兎モデル: 内腸骨動脈バルーン傷害の方法論的視点
要約
動脈硬化症の動物モデルは、メカニズムを理解してプラークの開発や破断、先進国の死亡原因を防止するための新しいアプローチを調査するために不可欠です。このプロトコルは、ウサギ腸骨動脈の動脈硬化性プラークを誘発するのにバルーン傷害と高コレステロール食の組み合わせを使用します。
要約
動脈硬化性プラークの開発と破壊に続く冠動脈閉塞による急性冠症候群は、先進世界での死の主要な原因です。ニュージーランド ホワイト (nzw 種) ウサギは、アテローム性動脈硬化の研究の動物モデルとして広く使用されます。彼らは動脈硬化食事にうんざりした自発的な病変を開発します。ただし、これは 4-8 ヶ月の長い時間を必要があります。さらに強化し、粥状動脈硬化を促進、動脈硬化の食事と機械的血管内皮傷害の組み合わせがしばしば利用されます。家兎動脈硬化性プラークを誘導するため提示された手順は、動脈硬化の飼料 NZW ウサギの左総腸骨動脈の内皮細胞を破壊するのにバルーンカテーテルを使用します。バルーンカテーテルによるこのような機械的な損傷は、時間依存的新生内膜脂質の蓄積を開始する炎症反応の連鎖を誘発します。次のバルーン傷害ショー新生内膜肥厚広範な脂肪浸潤、高平滑筋細胞内容マクロファージの存在と動脈硬化性プラークには、泡沫細胞が派生しました。この手法、シンプルで再現性のある、内腸骨動脈内長の制御のプラークを生成します。全体の手順は 20-30 分以内に完了します。手順は、安全低死亡率では、実質的な内膜肥厚病変に高い成功を提供しています。バルーンカテーテルのプロシージャは、2 週間以内動脈硬化症における動脈傷害の結果を誘発しました。このモデルは病の病理を調査するため使用することができます画像診断と新しい治療戦略を評価します。
概要
動脈硬化性プラークの破裂は、先進国1死の主要な原因の 1 つです。過去十年にわたって研究は、プラークの進展に関与するいくつかの分子・細胞メカニズムを展開してきた、病気の進行の複雑なメカニズムを解明するだけでなく、新しいテストにも努力が必要まだ続けている治療近づきます。動脈硬化症を研究するいくつかの動物モデルを提案されています。遺伝子操作、コレステロール供給または機械的内皮損傷動脈硬化マウス、ウサギ、ミニブタなどのほとんどの動物モデルで共有標準戦略であります。これらのうち、NZW ウサギは、正常ラットおよびマウスでは、食餌療法のコレステロール2,3,4は大幅吸収しない中コレステロールの食事療法に敏感です。ウサギは自発的にコレステロール豊富な食事療法5,6にうんざりしたいくつかの線維性のコンポーネントとマクロファージの豊富な大動脈病変を開発します。しかし、動脈硬化 plaquesby コレステロール食事療法だけで6,7を給餌を誘発する 4-8 ヶ月の長い準備時間は実験的設定のほとんどのための主な欠点です。比較的短時間で病変を誘導するための追求、Baumgarter、ステューダー8でコレス トロールが高い食事療法およびバルーン傷害の組み合わせを開発しました。この手法の全体的な目標は、高コレステロール血症ウサギにおける泡沫細胞 (人間の脂肪のストリークに類似) 2 週間以内で構成される動脈硬化性プラークを誘導するためです。本手法では、nzw 種高コレステロール血症ウサギの腸骨動脈に高度なバルーンカテーテルを用いた Baumgarter の法に基づく動脈壁損傷の手順について説明します。
コレステロール豊富な食事と一緒に解消の内皮化が誘起されるバルーン傷害、動脈硬化に します。バルーン傷害はアテローム性動脈硬化病変の形成を加速し、均一なサイズと分布のプラークが生成されます。内膜肥厚は傷害の後の数日以内時間と内膜細胞浸潤の開始の期間にわたって増加します。実質的なマクロファージと脂肪筋はバルーン傷害の 7 ~ 10 日後現われ始めるし、アメリカ心臓協会分類 II 型病変として表されます。ウサギ バルーン傷害は、しばしば大動脈プラークの組成を研究する実行されます。新生内膜内皮細胞間接着分子の高レベルを表しています。プラークは、内側と外の変化に関連付けられます。動脈硬化病変、脂質、増殖平滑筋細胞 (SMCs)、コラーゲン線維と再生内皮の下で蓄積、大抵タイプ II 本質的に炎症性細胞の構成されます。原則としてひと大動脈9,10で報告に類似していたウサギのプラクの位相分布、大動脈腸骨動脈と比較してサイズは大きくより大きい長さのプラークになります。しかし、動脈硬化家兎のサイトとして総腸骨動脈を使用しての主な利点は、アクセシビリティ、ひと冠動脈11、制服病変開発12、高組織率に筋肉のコンテンツの類似性活動13と一貫性のある容器寸法ひと冠動脈形態と血管造影のエンドポイントに商業的に製造されたデバイスの評価に匹敵します。生きている動物のウサギ腸骨動脈のプラークを分析する侵襲的、非侵襲的な方法を検討しました。磁気共鳴画像 (MRI) をさらに 2.35 テスラ MR システム14の助けを借りての使用については以前のレポート、血管内超音波 (IVUS) や光コヒーレンス断層法 (OCT) カテーテルを適切にすることができます画像に適用ウサギ腸骨動脈で動脈硬化プラーク。総腸骨動脈は、高解像度の超音波を使用して超音波検査バリアフリーと大動脈は、この手法で調べることができます。
過去 10 年間でさらにプラーク進行15とプラーク回帰16のメカニズムを理解するバルーン傷害のこの家兎モデルをしました。さらに、モデルは、スタチン系薬剤、標準的な抗血小板剤、抗酸化剤17,18エベロリムスなどの薬剤溶出ステントなどの新規治療薬の影響を研究に使用されていますかゾタロリムス溶出ステント19,20新生内膜肥厚。このモデルは、血管内カテーテル21近赤外蛍光イメージングを調査する使用されています。
プロトコル
、スイス連邦獣医局、スイス連邦共和国 (FR 2015/58)、フリブール州の獣医のオフィスによって承認されたこの実験的プロトコル
。注: 3.2 2.8 キロの間の重量を量る雄 NZW ウサギが使用されました。動物は、従来の条件 (12 h 光と暗いサイクル、アドリブの水と食糧を提供) の下で収容されました。バルーン侵食前に動物は 1 週間中に、彼らは通常の食事の飼料で飼育した順応しました。順化 1 週間後ウサギは高脂肪 (8.6%) から成る動脈硬化の食事療法に切り替えていたし、全体の調査の持続期間のための 205 mg/kg (1%) のコレステロールの食事療法の飽和脂肪酸。左総腸骨動脈のバルーン傷害を行ったダイエット開始後 1 週間、2 週間または 4 週間バルーン傷害の後の動物が犠牲になった
。1 術前手順
- ガラス ビーズ滅菌器やその他機器に使用する前にすべての手術器具を滅菌します。 。
- 準備とバルーン カテーテルのアセンブリをチェックします。
- アタッチ 1 mL ルアーロック シリンジはバルーンカテーテルのルアーロック部分に食塩に満ちています。閉じ込められた空気の欠席の理由を慎重に監視します。漏れの注射器のプランジャーを押して適切なバルーンの膨張を確認してください 。
- ウサギの重量を量るし、オンに 37 に thermopad ° C
- /Ml 0.01 mg/kg の投与量を皮下注入 0.3 mg の濃度のブプレノルフィン ソリューションを使用します 。
- 麻酔 5% イソフルランと 10-15 分のための部屋に誘導 5 L/min O 2 ウサギ
- は、手術のプラットフォーム上に保存加熱パッドに麻酔下のウサギを配置します。パッチや温度、呼吸、および心電図監視にクリップを配置します 。
- は、ウサギの鼻をマシンに適した麻酔マスクに接続します。イソフルラン (2.5 L/min O 2 4.0%) で麻酔を維持します。(筋肉の緊張の欠如とギャグと耳介反射の喪失によって示される) 適切な anesthetization を確認します 。
- は、角膜の乾燥を防ぐために両方の目に眼軟膏を適用されます。滅菌手術用シートで公開される下肢のみでウサギをドレープします 。
2。外科プロトコル
- 動物のバリカンを使用して膝の関節のすぐ下の腹側領域から髪を削除します 。
- 皮膚をきれいにし緩い毛を取除く適切な消毒剤との区域を綿棒します 。
- 伏在動を見つけて、約 1.5 cm の小さな皮膚切開は、メスを使用して長さ 。
- 大腿静脈と大腿神経を損傷することがなく小さなカーブタイプ鉗子と伏在動のごく一部を公開します 。
- は、伏在動の下に 2 つの緩い合字ループ (5-0 絹糸) を置き、動脈の遠位端に向かって 1 つの合字ループを結ぶ。合字の内腸骨動脈から血流を停止する上記の微小血管クランプを配置します 。
- 局所動脈を拡張し、血管攣縮を防ぐためにパパベリンの一滴を適用します 。
- タイの合字の助けを借りて伏在動を持ち上げて確認、24 を使用して小さな切開切開ゲージ針します 。
- 微細鉗子で切開フラップを上げるし、動脈の内腔に静脈ピックや誘導針をゆっくりと挿入します 。
- は、2 フランス語肺葉動脈塞栓を伏在動脈に挿入します。静脈ピックおよび血管クランプ削除します 。
- 6 のマーク (20-25 cm) の位置に大体対応するまでカテーテルを進める 2 5 cm 腸骨の分岐上 。
- 0.1 mL 通常生理食塩水 1 mL の注射器を使用して、または 6 のわずかな圧力で風船を膨らませる 16 , 22 で説明するように規制手動空気入れを使用して atm 。
- 鉗子でバルーンカテーテルを押しながら戻って腸骨の arterytoward を 6 cm カテーテルを回転させながら挿入のポイントをドラッグします 。
- 注射器のピストンを引いてバルーンをしぼませる 。
- 完全な内皮細胞の侵食を確実に 2.10 に 2.13 の手順を 3 回繰り返します 。
- カテーテルを外し、すぐに出血を止めるため切開の真上結紮ループを結ぶ 。
- は傷の周囲の適切な防腐剤すべてを適用し、綿棒に血の塊。5-0 縫合糸で皮膚切開を閉じるし、消毒ポビドン ヨード溶液による手術サイト 。
- 手順 2.1 に 2.16 側のカテーテルを用いた腸骨 。
- 目から眼軟膏を綿棒します 。
3。術後ケア
- 管理 sulfadoxine 40 mg/kg とトリメトプリム 8 mg/kg または手術後すぐに他の適した抗生物質 。
- 麻酔回復期間中にきれいなオートクレーブ檻に入れられた熱パッド上にウサギを維持します 。
- 監視パッチとクリップを削除します 。
- 回復後、ホームの檻にウサギを戻る。ブプレノルフィン 0.05 を皮下注入 - 0.1 mg/kg のポスト - 48 h. もう 2 週間か 4 週間の続行動脈硬化の食事療法のすべての 6-12 h 作動します 。
4。組織の収穫とプラークの組成分析
- (初期の薄いプラーク) の 2 週間、3 週間バルーン傷害の後前述のように同様の方法でイソフルランを使用してウサギを麻酔します 。
- 胸腔内を開き、intracardial デスメタルでウサギを安楽死させる 。
- は、 23 で説明したように総腸骨動脈を分離します。
- 簡単に、腹部を開くし、後腹膜を公開します。腸骨の分岐に向けて大動脈をトレースし、分岐上に結ぶ。慎重に公開し、左右の腸骨動脈を分離する周囲の組織を削除します 。
- Dissect 両方の腸骨動脈をして冷たいリン酸緩衝生理食塩水でそれらを浸します。鉗子の助けを借りて、血栓を除去します。動脈内プラークの厚さを特徴付けるための 4-6 セグメントに各総腸骨動脈を分割します 。
- すぐに凍結する液体窒素を使用して最適な切削温度化合物を含む金型で動脈セグメントを埋め込み、クライオスタットを使用して 24-70 ° c. の準備 5 μ m 厚いセクションにそれを維持します 。
- 実行組織や蛍光抗体の免疫染色形態計測、プラークの脂質および細胞内容 10 , 25 で説明したようします
。 注: 簡単に言えば、リン酸緩衝生理食塩水 (PBS) で動脈のセクションを洗い、0.2% を使用してを permeabilize トリトン。PBS のセクションを洗い、抗 α-SM アクチン (レバレッジ) や RAM11 抗体 (レバレッジ) 37 ° C で 1 時間のセクション 30 分加温 2% ウシ血清アルブミンと非特定のサイトをブロックします。PBS でセクションをすすぎ、PBS で再び 37 ° c. の洗浄で 30 分の適切な二次抗体とインキュベートしてヘキストを追加 (5 μ g/mL) 10 分間核の検出にします 。
結果
総腸骨動脈のバルーン傷害は、(図 1) の合併症もなく正常に実行されました。20 〜 30 分の怪我のため手術時間の合計は、のみ 1 つの腸骨動脈、および両方の動脈の損傷のための 35 〜 45 分を行います。ウサギはバルーン損傷後 1 h 以内に回復。すべての動物は、有意な体重を失うことがなく健康な登場。感染症、浮腫や動脈血栓症発生しませんでした。創傷部は縫合のサイトでいくつかの軽度の線維化以外にも正常であった。動脈硬化食事餌やりの 4 週間、続いてウサギ展示高コレステロール血症 44 ± 18 mM/l。
図 2 a図 2 e、および図 2 iを右無傷腸骨動脈 (バルーン損傷にさらされていない) 通常の外観と。(図 2および図 3) 2 週間で動脈硬化性プラークの発展につながる血管壁の構造変化にバルーン傷害およびコレステロール dietresulted の組み合わせ。ため無傷バルーン負傷した腸骨動脈は、同じ動物から分離された.豊富な脂質浸潤 (8.7 ± 1.7% 脂質領域) (図 2および図 3) 平滑筋細胞の遊走と増殖 (図 4)、同様にトリガー イベントとしてバルーン傷害に増殖血管応答結果内腔領域 (1.4 ± 0.2 mm2) の減少、併用で内膜-メディアの厚さ比 (1.5 ± 0.2) およびプラーク (0.8 ± 0.2 mm2) の増加につながるマクロファージ (図 4) の募集 (図 3) 観察 2週間後バルーン傷害です。RAM 11 は、特にターゲットにウサギ マクロファージの細胞質に対するモノクローナル抗体です。Α-SM アクチン筋肉アクチンを識別し、血管での血管平滑筋細胞と反応します。これらの抗体は、マクロファージや平滑筋細胞でウサギの内膜肥厚病変を勉強する以前に使用されています。これらの変更は時間とメディア/内膜中膜厚比 (2.6 ± 0.2) と内腔縮小 (0.7 ± 0.1 mm2) のなお一層の増加とともに進化し続けます (図 2および図 3) バルーン損傷後 4 週間を指摘されました。この手法は、時間をかけて開発し、2 〜 4 週間後調査された動脈硬化性プラークの健全な発展に します。
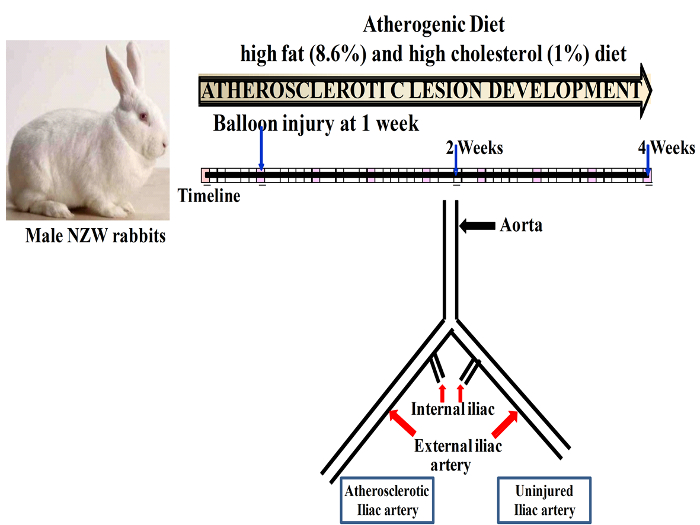
図 1: バルーン損傷プラークの進展のタイムラインを示す略図。この図の拡大版を表示するのにはここをクリックしてください。

図 2: バルーン傷害誘導ウサギ腸骨動脈のアテローム性動脈硬化します。非負傷からのセクションを染色 Movat pentachrome (A ~ D)、ヘマトキシリン ・ エオジン (E H) とオイル赤い O (-L) の代表的なイメージ (、E、私)、2 週間ポスト バルーン損傷 (B, F, J) (n = 5) と 4 週間ポストバルーン傷害 (C, G, K) (n = 3) 動脈硬化の食事療法の腸骨動脈セグメント供給 NZW ウサギ。D、H および L のスケール バーは 100 μ m スケールの他の画像バー = 500 μ m. Labelled B はイメージの内腔、内膜、IEL (内弾性板)、ウナギ (外弾性板)。メディアは、IEL とウナギとの間の領域です。この図の拡大版を表示するのにはここをクリックしてください。
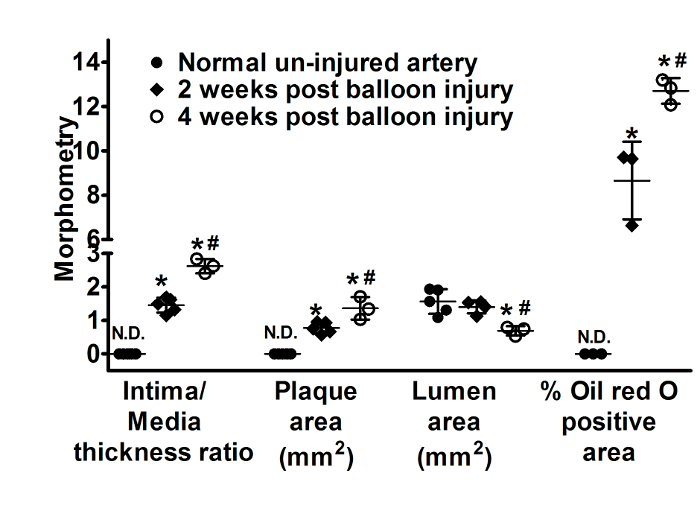
図 3: プラークの形態計測的解析します。バルーンが 2 で動脈を負傷、散布プロット番組内膜/メディア厚比、プラーク、内腔領域の領域および % オイル赤い O 正領域非負傷したコントロールから腸骨動脈セクション、(n = 5)、4 週間 (n = 3)。データは、平均 ± SD. として表示されます * p < 0.05対非負傷した動脈、#p < 0.05対4 週間ポスト バルーン傷害。N.d. を示す検出されません。プラーク エリアは、O 正地域総断面容器壁領域のパーセントを表します油赤中 IEL 領域から内腔領域を差し引くことによって計算されます。この図の拡大版を表示するのにはここをクリックしてください。
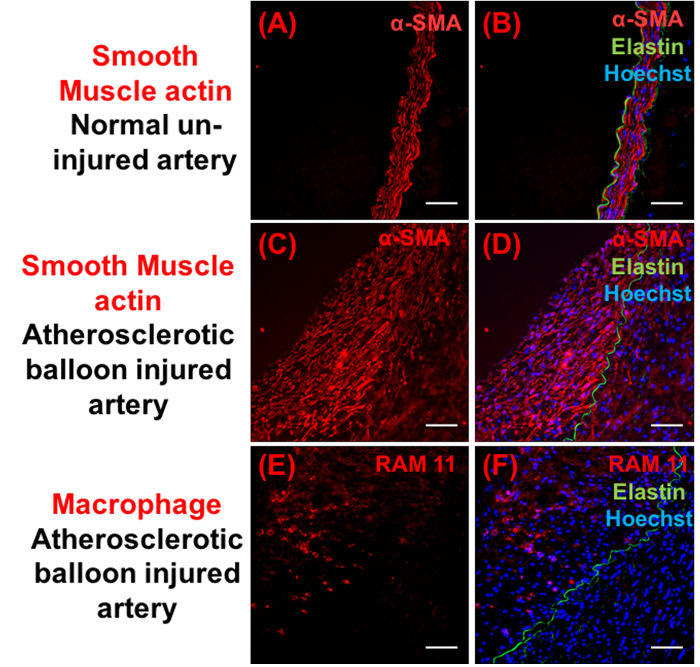
図 4: プラークの組成の免疫組織化学的解析します。Α-平滑筋アクチン (赤) (A-D) とマクロファージ (RAM 11) 陽性細胞 (赤) (E ・ F) を示す代表的なイメージ。右側のパネルは、ヘキスト (青) とエラスチン (グリーン) それぞれマージされた画像を表示します。スケールバー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ウサギ腸骨動脈のアテローム性動脈硬化モデルは動脈硬化研究で広く使用されます。このプロトコルでウサギは急速にコレステロールの食事療法のみで開発された自発的な病変と比較してより厳しいと高度なプラクを開発しました。重要なは、動物は手術から迅速に回復します。
粥状動脈硬化のための主要な刺激は、血管内皮細胞を傷つける、distends 容器壁26バルーンカテーテルによる機械的損傷です。この手順は、マクロファージの募集そして脂質蓄積 hypercholestorolemic ダイエット、血管平滑筋細胞の遊走および増殖、強化されたマトリックスに関連付けられている炎症によって特徴づけられる改造反応を誘導します。合成、および時間依存の方法15,16で侵襲的新生内膜の確立。バルーンカテーテルを挿入するプロシージャの最も重要な部分です。強制的にバルーンを挿入することを避けるために注意を行使する必要があります。末梢の伏在動脈、総腸骨動脈にアクセスするための使用は、技術を簡素化します。総腸骨動脈は、頸動脈カット-下り27,28を前述のようを介してアクセスすることができます。しかし、頚動脈経由で総腸骨動脈を評価する高度な外科の専門知識と血管造影装置などの追加機器が必要です。また、致命的な出血29につながる内頚静脈への損傷のようなプロシージャ関連の合併症に関連付けられます。パパベリンなど局所血管拡張薬の使用は、血管を広げるし、バルーン カテーテル30に対する動脈壁の抵抗を削減するのに役立ちます。これらに直接の関連が新生内膜形成31インフレ圧力とバルーンのサイズを慎重に考慮する必要があります。希望のレベルよりも高いレベルにバルーンの過膨満感は、血管壁の破裂につながる可能性があります。これは血と堅牢な血栓形成内腔と外側表面26両方の漏れの可能性があります。
動物は、その血管内皮細胞障害をようにバルーン傷害の前に 1 〜 2 週間の豊富な食事療法が高コレステロール血症の設定で発生した脂質を供給しなければなりません。また新しいダイエットに適応する動物に役立ちます。この手法は、ウサギの高度なプラクを誘導する、プラークの形態を観察した人間から異なります。自発の人間の病変は、そのまま内部弾性層32サブ内皮の領域に制限されます。ここでは、4 週間は線維化のコアを示さなかったまで研究の実施。アテローム性動脈硬化病変のまま実質的なマクロファージ浸潤と脂肪の連続のようです。
多くの小規模および大規模な動物モデルは、粥状動脈硬化6を理解するために使用されています。バルーン傷害ウサギ腸骨動脈モデルは、イメージング10,32,33プラーク進化、新規ドラッグデリバリー システム新しい治療薬の効果を研究に使用されています。単一または複数のバルーンの injurieshave は総腸骨動脈34,35, 頸動脈36,37, と大動脈10,38で行われています。本手法の利点は、頚動脈の使用と比較して大きなプラークは、ボリュームと厚さの開発です。さらに、対側の腸骨がコントロールとして使用され、したがって29動物間の変動が減少します。ウサギ腸骨動脈バルーン傷害は、安全かつ簡単にここで説明した方法を使用して実行できます。プラークは時間依存の方法で成長する、動脈の全長にわたって均一です。他の動脈硬化家兎モデルは渡辺遺伝性高脂血症 (WHHL) モデル、低密度リポタンパク質受容体欠乏症と遺伝子組み換え動物モデルなども開発されています。バルーン損傷モデルは、定義されているサイトに病変を生成する WHLL ウサギにも適用できます。
ウサギ腸骨動脈とひと冠動脈プラークの違いがあります。確かに、高度な動脈硬化病変を開発し、人間39で観測されたプラーク破裂のモデルを作成する試みでいくつかの代替手順を設けています。たとえば、不安定プラーク形成はバルーン傷害16を施行したウサギで 8 週後コレステロール食を排除することによって誘導されました。その他の変更手続きは、プラーク破裂のメカニズム、動脈硬化で血栓形成と血栓の成長を評価するラッセルクサリヘビ毒10とそれに続く繰り返しバルーン傷害40など薬理学的トリガーを使用します。血管。ラッセルクサリヘビ毒は、血栓症につながる凝固カスケードを活性化する酵素を含んでいます。プラークの組織因子40によるトロンビン生成に繰り返しバルーン傷害の結果。家兎モデルを含む動物モデル結果を人間に完全に推定可能性がありますないことに留意。しかし、これらのモデルを評価し、新しい薬理学的介入の有効性を比較するための便利なツールがあります。慎重に外挿は、病因、病態、ひと動脈硬化の治療の知識を広げるため高コレステロール血症とプラークの組成の学位に関連して行う必要があります。ここにモデル提示プラーク進化に関与するメカニズムを研究し、プラーク安定化/回帰に向けて新たな抗動脈硬化治療法の効果を検討するのに役立ちます。
開示事項
著者は競合する金銭的な利益を宣言しません。
謝辞
この作品は、スイスの国立科学財団助成 150271 によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Charles River laboratories,France | Cre:KBL(NZW) | |
| Cholesterol rich diet | Ssniff spezialdiäten | Ssniff EF K High Fat and Cholesterol | |
| Glass bead sterilizer-Germinator 500 | VWR, Leicestershire, UK | 101326-488 | |
| Fogarty balloon embolectomy catheters, 2 French | Edwards Lifesciences, Switzerland | 120602F | For single use only |
| Luer Lock Syringe | Becton, Dickinson and Company, USA | 309628 | |
| Thermopad Type 226 | Solis, Switzerland AG | 397387 | |
| Buprenorphine- Temgesic | Reckitt Benckiser AG, Switzerland | 7.68042E+12 | |
| Isoflurane | Piramal Critical Care, Inc, Bethlehem, PA 18017 | 2667-46-7 | |
| Anaesthesia machine-combi-vet Base Anesthesia System | Rothacher Medical GmbH, Switzerland | CV 30-301-A | |
| Cardell touch veterinary vital signs monitor | Midmark, Ohio, USA | 8013-001 | |
| Ophthalmic ointment-Humigel | Virbac, France | ||
| Animal hair clippers | Aesculap AG, Germany | GT420 | |
| Disinfectant-Betadine solution | MundipharmaMedicalCompany, Switzerland | 14671-1203 | |
| Dumont #7 Forceps | FST Germany | 11274-20 | |
| Medium and small microscissors | Medline International Switzerland Sàrl | UC4337 | |
| Microvascular clamps | FST, Germany | 18051-28 | |
| Papaverine | ESCA chemicals, Switzerland | RE 356 803 | |
| Vein Pick | Harvard Apparatus, Cambridge, UK | 72-4169 | For single use only |
| Saline | Laboratorium Dr. G. Bichsel AG, , Switzerland | 1330055 | |
| Polysorb 5-0 suture | Covidien AG, Switzerland | UL 202 | Monofilament |
| Sulfadoxine and Trimethoprim-Trimethazol | Werner Stricker AG, Switzerland | Swissmedic Nr. 50'361 | |
| Antiseptic- Octenisept | Schülke & Mayr AG, Switzerland | GTIN: 4032651214068 | |
| Phosphate Buffered Saline | Roth | 1058.1 | |
| Isobutanol-2-Methylbutane | Sigma-Aldrich, Switzerland | M32631-1L | |
| Optimum Cutting Temperature compound-Tissue-Tek | VWR Chemicals, Belgium | 25608-930 | |
| Cryostat | Leica, Glattbrugg, Switzerland | Leica CM1860 UV | |
| Glass slide- Superfrost Plus | Thermo Scientific | 4951PLUS4 | |
| Mayer's Haematoxylin | Sigma-Aldrich, Switzerland | MHS32-1L | |
| Eosin 0.5% aq. | Sigma-Aldrich, Switzerland | HT110232-1L | |
| Oil Red O | Sigma-Aldrich, Switzerland | O0625-25G | |
| α-smooth muscle actin antibody | Abcam, UK. | ab7817 | |
| Macrophage Clone RAM11 antibody | DAKO, Switzerland | M063301 | |
| Hoechst | Abcam, UK. | ab145596 | |
| Goat polyclonal Secondary Antibody (Chromeo 546) | Abcam, UK. | ab60316 | |
| Alexa Fluor 488/547 | Abcam, UK. | ||
| Glycergel Mounting Medium, Aqueous | DAKO, Switzerland | C056330 | |
| Hematoxylin for Movat pentachrome staining | Sigma-Aldrich, Switzerland | H3136-25G | |
| Ferric chloride for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 157740-100G | |
| Iodine for Movat staining | Sigma-Aldrich, Switzerland | 207772-100G | |
| Potassium iodide for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 60400-100G-F | |
| Alcian blue for Movat staining | Sigma-Aldrich, Switzerland | A5268-10G | |
| Strong Ammonia for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 320145-500ML | |
| Brilliant crocein MOO for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 210757-50G | |
| Acid Fuchsin for Movat pentachrome staining | Sigma-Aldrich, Switzerland | F8129-50G | |
| Sodium Thiosulfate for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 72049-250G | |
| Phosphotungstic acid for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 79690-100G | |
| Crocin for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 17304-5G | |
| EUKITT for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 03989-100ML |
参考文献
- Mozaffarian, D., et al. Heart disease and stroke statistics--2015 update: a report from the American Heart Association. Circulation. 131, e29-e322 (2015).
- Boone, L. R., Brooks, P. A., Niesen, M. I., Ness, G. C. Mechanism of resistance to dietary cholesterol. J Lipids. 2011, 101242 (2011).
- Kapourchali, F. R., et al. Animal models of atherosclerosis. World J Clin Cases. 2, 126-132 (2014).
- Carter, C. P., Howles, P. N., Hui, D. Y. Genetic variation in cholesterol absorption efficiency among inbred strains of mice. J Nutr. 127, 1344-1348 (1997).
- Kolodgie, F. D., et al. Hypercholesterolemia in the rabbit induced by feeding graded amounts of low-level cholesterol. Methodological considerations regarding individual variability in response to dietary cholesterol and development of lesion type. Arterioscler Thromb Vasc Biol. 16, 1454-1464 (1996).
- Singh, V., Tiwari, R. L., Dikshit, M., Barthwal, M. K. Models to study atherosclerosis: a mechanistic insight. Curr Vasc Pharmacol. 7, 75-109 (2009).
- Dornas, W. C., Oliveira, T. T., Augusto, L. E., Nagem, T. J. Experimental atherosclerosis in rabbits. Arq Bras Cardiol. 95, 272-278 (2010).
- Baumgartner, H. R., Studer, A. [Effects of vascular catheterization in normo- and hypercholesteremic rabbits]. Pathol Microbiol (Basel). 29, 393-405 (1966).
- Tanaka, H., et al. Sustained activation of vascular cells and leukocytes in the rabbit aorta after balloon injury. Circulation. 88, 1788-1803 (1993).
- Phinikaridou, A., Hallock, K. J., Qiao, Y., Hamilton, J. A. A robust rabbit model of human atherosclerosis and atherothrombosis. J Lipid Res. 50, 787-797 (2009).
- Nakazawa, G., et al. Drug-eluting stent safety: findings from preclinical studies. Expert Rev Cardiovasc Ther. 6, 1379-1391 (2008).
- Aikawa, M., et al. Lipid lowering by diet reduces matrix metalloproteinase activity and increases collagen content of rabbit atheroma: a potential mechanism of lesion stabilization. Circulation. 97, 2433-2444 (1998).
- Jeanpierre, E., et al. Dietary lipid lowering modifies plaque phenotype in rabbit atheroma after angioplasty: a potential role of tissue factor. Circulation. 108, 1740-1745 (2003).
- Durand, E., et al. Magnetic resonance imaging of ruptured plaques in the rabbit with ultrasmall superparamagnetic particles of iron oxide. J Vasc Res. 44, 119-128 (2007).
- Stadius, M. L., et al. Time course and cellular characteristics of the iliac artery response to acute balloon injury. An angiographic, morphometric, and immunocytochemical analysis in the cholesterol-fed New Zealand white rabbit. Arterioscler Thromb. 12, 1267-1273 (1992).
- Khanna, V., et al. Cholesterol diet withdrawal leads to an initial plaque instability and subsequent regression of accelerated iliac artery atherosclerosis in rabbits. PLoS One. 8, e77037 (2013).
- Zou, J., et al. Effect of resveratrol on intimal hyperplasia after endothelial denudation in an experimental rabbit model. Life Sci. 68, 153-163 (2000).
- Li, M., Zhang, Y., Ren, H., Zhang, Y., Zhu, X. Effect of clopidogrel on the inflammatory progression of early atherosclerosis in rabbits model. Atherosclerosis. 194, 348-356 (2007).
- Nakazawa, G., et al. Evaluation of polymer-based comparator drug-eluting stents using a rabbit model of iliac artery atherosclerosis. Circ Cardiovasc Interv. 4, 38-46 (2011).
- Van Dyck, C. J., et al. Resolute and Xience V polymer-based drug-eluting stents compared in an atherosclerotic rabbit double injury model. Catheter Cardiovasc Interv. 81, E259-E268 (2013).
- Abran, M., et al. Validating a bimodal intravascular ultrasound (IVUS) and near-infrared fluorescence (NIRF) catheter for atherosclerotic plaque detection in rabbits. Biomed Opt Express. 6, 3989-3999 (2015).
- Kanamasa, K., et al. Recombinant tissue plasminogen activator prevents intimal hyperplasia after balloon angioplasty in hypercholesterolemic rabbits. Jpn Circ J. 60, 889-894 (1996).
- Pai, M., et al. Inhibition of in-stent restenosis in rabbit iliac arteries with photodynamic therapy. Eur J Vasc Endovasc Surg. 30, 573-581 (2005).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. CSH Protoc. 2008, (2008).
- Chaytor, A. T., Bakker, L. M., Edwards, D. H., Griffith, T. M. Connexin-mimetic peptides dissociate electrotonic EDHF-type signalling via myoendothelial and smooth muscle gap junctions in the rabbit iliac artery. Br J Pharmacol. 144, 108-114 (2005).
- Zhang, W., Trebak, M. Vascular balloon injury and intraluminal administration in rat carotid artery. J Vis Exp. (94), (2014).
- Maillard, L., et al. Effect of percutaneous adenovirus-mediated Gax gene delivery to the arterial wall in double-injured atheromatous stented rabbit iliac arteries. Gene Ther. 7, 1353-1361 (2000).
- Sharif, F., et al. Gene-eluting stents: adenovirus-mediated delivery of eNOS to the blood vessel wall accelerates re-endothelialization and inhibits restenosis. Mol Ther. 16, 1674-1680 (2008).
- Lee, J. M., et al. Development of a rabbit model for a preclinical comparison of coronary stent types in-vivo. Korean Circ J. 43, 713-722 (2013).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods Mol Med. 139, 1-30 (2007).
- Asada, Y., et al. Effects of inflation pressure of balloon catheter on vascular injuries and subsequent development of intimal hyperplasia in rabbit aorta. Atherosclerosis. 121, 45-53 (1996).
- Dornas, W. C., Oliveira, T. T., Augusto, L. E., Nagem, T. J. Experimental atherosclerosis in rabbits. Arq Bras Cardiol. 95, 272-278 (2010).
- Waksman, R., et al. PhotoPoint photodynamic therapy promotes stabilization of atherosclerotic plaques and inhibits plaque progression. J Am Coll Cardiol. 52, 1024-1032 (2008).
- Fernandez-Parra, R., et al. Pharmacokinetic Study of Paclitaxel Concentration after Drug-Eluting Balloon Angioplasty in the Iliac Artery of Healthy and Atherosclerotic Rabbit Models. J Vasc Interv Radiol. 26, 1380-1387 (2015).
- Dussault, S., Dhahri, W., Desjarlais, M., Mathieu, R., Rivard, A. Elsibucol inhibits atherosclerosis following arterial injury: multifunctional effects on cholesterol levels, oxidative stress and inflammation. Atherosclerosis. 237, 194-199 (2014).
- Manderson, J. A., Mosse, P. R., Safstrom, J. A., Young, S. B., Campbell, G. R. Balloon catheter injury to rabbit carotid artery. I. Changes in smooth muscle phenotype. Arteriosclerosis. 9, 289-298 (1989).
- Miyake, T., et al. Prevention of neointimal formation after angioplasty using nuclear factor-kappaB decoy oligodeoxynucleotide-coated balloon catheter in rabbit model. Circ Cardiovasc Interv. 7, 787-796 (2014).
- Fulcher, J., Patel, S., Nicholls, S. J., Bao, S., Celermajer, D. Optical coherence tomography for serial in vivo imaging of aortic plaque in the rabbit: a preliminary experience. Open Heart. 2, e000314 (2015).
- Abela, O. G., et al. Plaque Rupture and Thrombosis: the Value of the Atherosclerotic Rabbit Model in Defining the Mechanism. Curr Atheroscler Rep. 18, 29 (2016).
- Yamashita, A., Asada, Y. A rabbit model of thrombosis on atherosclerotic lesions. J Biomed Biotechnol. 2011, 424929 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。