Method Article
家兔加速动脉粥样硬化模型的研究--髂动脉球囊损伤的方法学观察
摘要
动物模型的动脉粥样硬化是必不可少的了解机制和研究新的方法, 以防止斑块的发展或破裂, 在工业化世界的主要死因。该方案采用球囊损伤和胆固醇丰富的饮食组合, 诱导兔髂动脉动脉粥样硬化斑块。
摘要
在动脉粥样硬化斑块发育和破裂后冠状动脉闭塞引起的急性冠状动脉综合征是工业化国家死亡的主要原因。新西兰白 (NZW) 兔被广泛用作动脉粥样硬化研究的动物模型。当动脉粥样硬化饮食时, 它们会产生自发的损伤;然而, 这需要很长的时间 4-8 月。为了进一步加强和加速动脉粥样硬化, 动脉粥样硬化饮食和机械内皮损伤的结合经常被使用。提出了一种诱导家兔动脉粥样硬化斑块的方法, 用气囊导管阻断动脉粥样硬化饮食喂养的 NZW 兔左髂动脉内皮细胞。这种由气囊导管引起的机械损伤诱发了一连串的炎症反应, 引发了膜的脂质堆积。球囊损伤后动脉粥样硬化斑块显示膜增厚, 脂质浸润广泛, 平滑肌细胞含量高, 巨噬细胞衍生泡沫细胞存在。该技术简单, 重现性好, 在髂动脉内产生受控长度的斑块。整个程序在 20-30 分钟内完成。该手术是安全的低死亡率, 也提供了很大的成功获得大量内膜病变。气囊导管诱发动脉损伤的方法在两周内导致动脉粥样硬化。该模型可用于疾病病理学、诊断影像学的研究和新的治疗策略的评价。
引言
易损性动脉粥样硬化斑块破裂是工业化国家的主要死因之一1。尽管过去几十年的研究已经展现了一些分子和细胞机制参与了斑块的进展, 但仍然需要继续努力, 不仅要解开疾病进展的复杂机制, 还要测试新的治疗方法.已经提出了几种动物模型来研究动脉粥样硬化。基因操作、胆固醇喂养或机械内皮损伤是多数动物模型的共同的标准策略包括小鼠、兔子或者小型。在这些, NZW 兔子是敏感的胆固醇饮食, 而正常的大鼠和小鼠不显着吸收膳食胆固醇2,3,4。家兔自发地发展出富含巨噬细胞的主动脉病变, 当喂食富含胆固醇的饮食时5,6。然而, 4-8 月的长期准备时间诱导动脉粥样硬化 plaquesby 喂养胆固醇饮食单独6,7是大多数实验设置的主要缺点。为了在较短的时间内诱导病变, Baumgarter 和施图德博土8开发了高胆固醇饮食和球囊损伤的结合。这项技术的总目标是诱导2周内高家兔的动脉粥样硬化斑块 (类似于人的脂肪条纹)。本技术介绍了基于 Baumgarter 方法的动脉壁损伤过程, 采用气囊导管进入 NZW 高兔髂动脉。
加上胆固醇丰富的饮食, 由气球引起的损伤导致损伤将导致动脉粥样硬化。球囊损伤加速动脉粥样硬化病变的形成, 并产生均匀大小和分布的斑块。内膜增厚超过一段时间, 内中膜细胞浸润在损伤后数日内开始增加。脂肪条纹与大量巨噬细胞开始出现后 7-10 天的气球损伤, 并表示为 II 型病变根据分类的美国心脏协会。兔的球囊损伤常在主动脉中进行, 以研究斑块的组成。膜内皮表达高水平的细胞间黏附分子。斑块与内侧解剖和外的变化有关。动脉粥样硬化病变由脂质、增殖性平滑肌细胞 (校董)、胶原纤维和在再生内皮下积聚的炎症细胞组成, 主要为 II. 型。兔斑块的拓扑分布类似于人类脉的报告9,10原则上, 与髂动脉相比, 大动脉的大小更大, 并且会产生更大长度的斑块。然而, 利用髂动脉作为动脉粥样硬化部位的主要优势是其可获得性, 其肌肉含量与人冠状动脉的相似性11, 均匀病变的发展为12, 高组织因子活动13和一致的血管尺寸, 可与人冠状动脉相媲美, 允许对商业制造的设备进行评估, 以进行形态学和血管造影终点。对活体动物的兔髂动脉斑块进行了侵入性和无创的分析研究。以前的报告描述了使用磁共振成像 (MRI) 的帮助下, 2.35-特斯拉先生系统14此外, 血管内超声 (IVUS) 或光学相干断层扫描 (OCT) 导管可适当应用于图像兔髂动脉动脉粥样硬化斑块。髂动脉可用于超声成像时, 使用高分辨率声像和主动脉也可以探索与该技术。
在过去的十年中, 这种兔气球损伤模型有助于进一步了解斑块进展的机制15和斑块回归16。此外, 该模型已被用来研究新的治疗剂, 如他汀类药物, 标准抗血小板药物, 抗氧化剂17,18和药物洗脱支架, 如司或zotarolimus 洗脱支架19,20膜增厚。该模型还用于研究近红外荧光成像导管的血管内成像21。
研究方案
该试验方案已获州兽医局、弗里堡和瑞士联邦兽医局批准 (FR 2015/58).
注意: 使用2.8 到3.2 公斤之间的雄性 NZW 兔子。动物被安置在常规情况下 (12 h 光和黑暗的周期, 提供广告随意水和食物)。在气球剥脱之前, 动物被驯化了1周, 在这期间, 他们被喂食正常饮食。经过1周的驯化, 家兔被转换为动脉粥样硬化饮食由高脂肪 (8.6%), 和饱和脂肪酸与205毫克/千克胆固醇 (1%) 饮食的整个研究期间。在2周或4周的球囊损伤后, 左髂动脉的球囊损伤在1周后进行, 而动物则被处死.
1. 术前程序
- 在使用玻璃珠消毒器或其他合适的仪器之前对所有手术器械进行消毒。
- 准备并检查球囊导管总成。
- 在气囊导管的口锁部分安装一个1毫升的口锁注射器, 装上生理盐水。仔细监测没有被困的空气。通过按压注射器的柱塞, 检查泄漏并确保适当的气球膨胀.
- 称量兔子并打开 thermopad 到37和 #176; C.
- 在0.3 毫克/毫升的浓度下使用丁丙诺啡溶液. 注射0.01 毫克/千克皮下的剂量.
- 麻醉5% 异氟醚和5升/分 O 2 在感应腔中为 10-15 min
- 将麻醉兔子放在手术台上的加热垫上。放置补丁和剪辑, 以监测温度, 呼吸和心电图.
- 将兔子的吻附着在与合适的麻醉机相连的面罩上。保持麻醉与异氟醚 (4.0% 与2.5 升/分钟 O 2 )。确认适当的麻醉 (表现为缺乏肌肉张力和失去呕吐和片反射). 将眼部软膏涂抹在眼睛上, 防止角膜干燥。用不育的手术片将兔子披上, 只有下肢外露.
2。手术协议
- 用动物理发钳从膝关节下方的腹侧移除毛发.
- 用适当的消毒剂擦拭区域以清洁皮肤并去除松散的毛发.
- 定位隐动脉, 用手术刀做一个长度约1.5 厘米的小皮肤切口.
- 在不损伤股静脉和股神经的情况下, 用小弯曲钳暴露一小部分隐动脉.
- 将两个松散的结扎环 (5-0 丝) 放在隐动脉下方, 并将一条结扎回路绑在动脉远端。在绷带上方放置一个微血管夹, 以阻止髂动脉的血流.
- 局部应用一滴罂粟碱来扩张动脉, 防止血管痉挛.
- 用绑结扎的帮助抬起隐动脉, 用24口径的针头做一个小的切开切口.
- 用细钳将切口瓣抬高, 慢慢地将静脉穿刺或引导针插入动脉腔内.
- 将2法国福格蒂动脉栓导管插入隐动脉。取出静脉穿刺和微血管夹.
- 将导管推进至第六标记 (20-25 厘米), 相应于髂分岔处大约2-5 厘米的位置.
- 使用1毫升的注射器或在额定压力 6 atm 上充气气球用一个被调控的手动充气, 如描述在 16 , 22 .
- 在旋转导管的同时, 用钳夹住气囊导管, 并通过髂 arterytoward 在插入点上向后拖6厘米.
- 通过拉回注射器的柱塞来使气球泄气.
- 重复步骤2.10 到2.13 三次, 以确保完全的内皮剥脱.
- 卸下导管并立即将切开站点上方的结扎环绑住以停止出血.
- 在伤口周围涂抹适当的防腐剂, 拭去血块。用5-0 缝线闭合皮肤切口, 用聚维酮碘溶液消毒手术部位.
- 重复步骤2.1 至2.16 对侧髂使用新的导管.
- 从眼睛拭去眼部药膏.
3。术后护理
- 在手术后立即管理磺胺40毫克/千克和苄8毫克/千克或任何其他合适的抗生素.
- 在麻醉恢复期间, 将兔子放在一个清洁的蒸压笼中.
- 删除监视修补程序和剪辑.
- 恢复后, 将兔子返回到他们的家庭笼子。注射皮下丁丙诺啡 0.05-0.1 毫克/千克术每 6-12 ĥ 48 h. 继续动脉粥样硬化饮食, 再过两个星期或四周.
4。斑块组成的组织采集与分析
- 在两周后 (对于早期薄斑块) 或三周的气球损伤, 麻醉用异氟醚与上述类似的方式使用了兔子.
- intracardial 失血打开胸腔和安乐兔.
- 隔离髂动脉, 如 23 所述。
- 简要地打开腹部并露出后。追踪主动脉向髂分岔, 并将其系在分岔之上。仔细清除周围的组织, 以揭露和孤立髂动脉.
- 解剖两个髂动脉并将它们浸泡在 ice-cold 磷酸盐缓冲盐水中。在镊子的帮助下取出血块。将每个髂动脉分成 4-6 段, 以描述整个动脉中斑块的厚度.
- 立即将动脉段嵌入到包含最佳切削温度复合物的模具中, 使用液氮对齐冻结, 并将其保持在-70 和 #176; c. 使用低温中描述的5和 #181; m 厚剖面, 如 24 .
- 执行组织学、免疫荧光或免疫组化染色, 如 10 、 25 中所述的形态测量学、斑块脂质和细胞含量。 注: 简要地, 用磷酸缓冲盐 (PBS) 和 permeabilize 用0.2% 海卫一冲洗动脉部分。用 PBS 冲洗切片, 用2% 牛血清白蛋白阻断非特定部位30分钟. 在37和 #176 上孵育 1 h 的部分; 具有抗 #945 的 C; SM 肌动蛋白 (1:200) 或 RAM11 抗体 (1:200)。用 pbs 冲洗切片, 用适当的二次抗体孵育30分钟, 在37和 #176; c. 再次用 pbs 洗涤, 并添加赫斯特 (5 和 #181; g/毫升), 10 分钟以检测细胞核.
结果
髂动脉球囊损伤无并发症 (图 1) 成功完成。总手术时间范围从20至30分钟的伤害只在一个髂动脉, 35 至45分钟的伤害, 在两个动脉。兔在球囊损伤后1小时内恢复。所有的动物都健康, 没有明显的体重减轻。无感染、水肿或动脉血栓形成。缝合部位除轻度纤维化外, 伤口面积正常。在4周的动脉粥样硬化饮食喂养后, 家兔高胆固醇血症的44±18毫米/升。
数字 2A、图 2E和图 2I显示右侧未受伤的髂动脉 (不受气球损伤), 正常出现。气球损伤和胆固醇 dietresulted 的组合到血管壁的结构变化导致动脉粥样硬化斑块的发展在二个星期 (图 2和图 3)。未受伤和气球损伤的髂动脉是从同一动物中分离出来的。增生性血管反应的气球损伤作为触发事件导致广泛的脂质浸润 (8.7 ±1.7% 脂质区域) (图 2和图 3), 平滑肌细胞迁移和增殖 (图 4), 以及作为招募巨噬细胞 (图 4) 导致内膜-介质厚度比增加 (1.5 ± 0.2), 和斑块面积 (0.8 ± 0.2 mm2) 随管腔面积的减少 (1.4 ± 0.2 mm2) (图 3) 观察到2星期在气球损伤以后。RAM-11 是一种专门针对兔巨噬细胞细胞质的单克隆抗体。α-SM 肌动蛋白识别肌肉肌动蛋白和反应血管平滑肌细胞在血管。这些抗体以前被用来研究巨噬细胞和平滑肌细胞在兔内膜病变。这些变化随着时间的推移继续演变, 并进一步增加内膜/媒体厚度比 (2.6 ± 0.2) 和腔收缩 (0.7 ± 0.1 mm2) (图 2和图 3) 在气球受伤后4周被注意到。这项技术导致动脉粥样硬化斑块的蓬勃发展, 随着时间的推移发展, 并在2至4周后进行研究。
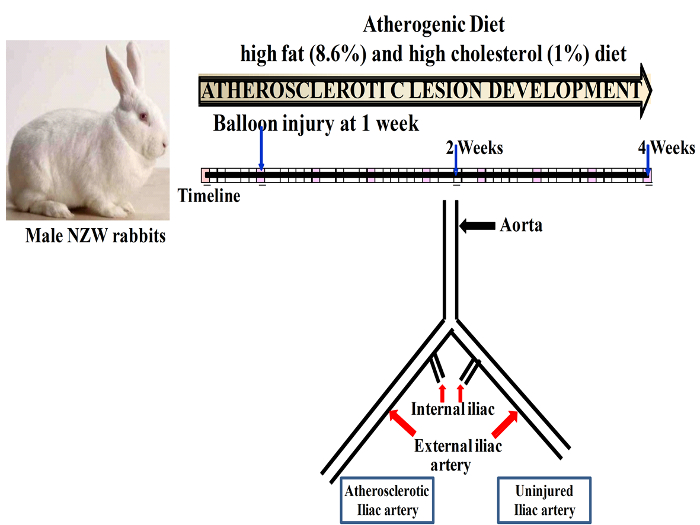
图 1: 示意图表示, 说明在气球受伤后斑块进展的时间线.请单击此处查看此图的较大版本.

图 2: 兔髂动脉球囊损伤引起的动脉粥样硬化.Movat pentachrome (A-D) 的代表性图像, 苏木精-曙红 (E-H) 和油红色 O (I. L) 染色部分从 un-injured (a, E, I), 2 周后气球损伤 (B, F, J) (n=5) 和4周后球囊损伤 (C、G、K) (n=3) 髂动脉段动脉粥样硬化喂养 NZW 兔。D、H 和 L 的刻度线为100µm. 其他图像的刻度线 = 500 µm. 图像 B 中的标签是流明, 内膜, IEL (内部弹性叶片) 和鳗鱼 (外弹性板)。媒体是 IEL 和鳗鱼之间的区域。请单击此处查看此图的较大版本.
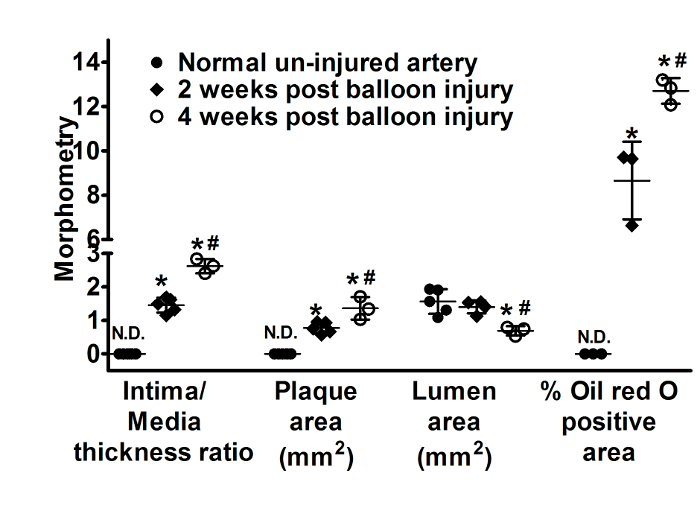
图 3: 斑块的形态分析.散射图显示髂动脉段的内膜/中层厚度比值、斑块面积、流明面积和油红 O 阳性区, 从 un-injured 控制、球囊损伤动脉 2 (n = 5) 和4周 (n = 3)。数据显示为平均± p 和 #60; 0.05 vs un-injured 动脉, #p 和 #60; 0.05 vs 4 周后气球损伤。北达科他州表示未检测到。斑块面积的计算方法是从 IEL 区减去流明面积, 而油红色 O 阳性面积代表总横断面容器壁面积的百分比。请单击此处查看此图的较大版本.
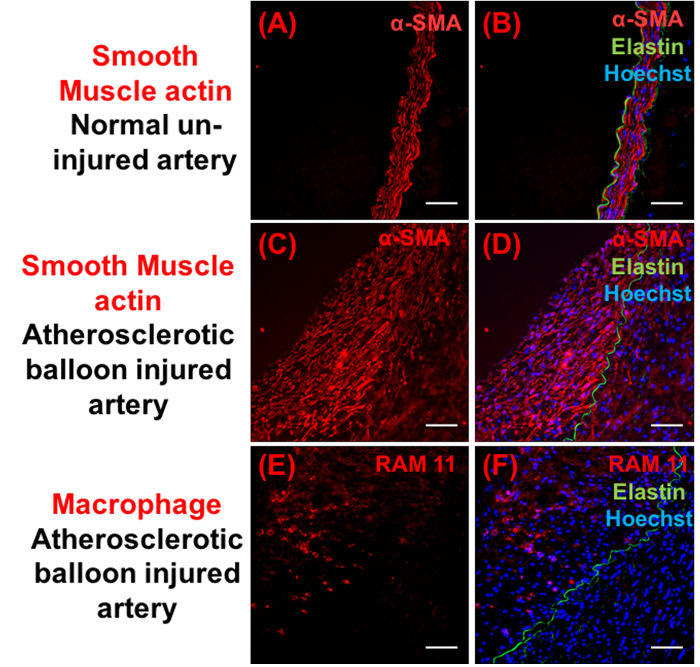
图 4: 斑块成分的免疫组织化学分析.有代表性的图像显示α平滑肌肉肌动蛋白 (红色) (A-D) 和巨噬细胞 (RAM 11) 阳性细胞 (红色) (e-F)。右面板显示各自合并的图像与赫斯特 (蓝色) 和弹性蛋白 (绿色)。缩放栏 = 100 µm.请单击此处查看此图的较大版本.
讨论
兔髂动脉粥样硬化模型广泛应用于动脉粥样硬化的研究。与这个协议兔子迅速地开发了更加严厉和先进的匾与自发损伤开发与仅胆固醇膳食。重要的是, 动物从手术中迅速恢复。
动脉粥样硬化的主要刺激是由气囊导管造成的机械损伤, 它会伤害内皮细胞, 扩张血管壁26。这一过程诱发重塑反应的特点是炎症与巨噬细胞的招募和脂质积累时, 与 hypercholestorolemic 饮食, 血管平滑肌细胞迁移和增殖, 增强基质合成, 并建立一个侵入性的膜在时间依赖性时尚15,16。插入气囊导管是手术过程中最关键的部分。为了避免强行插入气球, 必须小心谨慎。利用外周隐动脉可获得髂总动脉, 简化了该技术。髂动脉也可以通过颈动脉降低访问, 如前所述27,28。然而, 评估髂动脉经颈动脉需要高度的外科专业知识和额外的设备, 如血管造影单位。它也与手术相关的并发症, 如颈静脉损伤导致致命出血29。使用局部扩张剂, 如罂粟碱有助于扩张血管和减少阻力的动脉壁对气球导管30。通货膨胀压力和气球大小必须被仔细考虑, 因为这些有直接协会在膜形成31。气球的过度膨胀比期望的水平更高的程度可能导致血管壁破裂。这可能导致血液泄漏和强健的血栓形成在流明和在外在表面26。
在气球损伤之前, 动物必须在1或2周内喂食富含脂肪的食物, 以确保内皮损伤发生在高的环境中。它也帮助动物适应新的饮食。虽然这项技术诱导兔的高级斑块, 斑块的形态学不同于观察的人。自发的人的损伤被限制到 sub-endothelial 区域与一个原封内部弹性层数32。在这里, 进行了直到4周的研究显示没有纤维化的核心。动脉粥样硬化病变仍然类似于脂肪的条纹与大量巨噬细胞浸润。
许多小型和大型动物模型已用于理解动脉粥样硬化6。采用兔髂动脉球囊损伤模型, 研究新的治疗剂、新型药物传递系统、斑块演变及影像学的效果10、32、33。单个或多个气球 injurieshave 在髂动脉中进行34,35, 颈动脉36,37, 和主动脉10,38。所提出的方法的优点是发展大斑块体积和厚度相比, 使用颈动脉。此外, 对侧髂骨可以作为一个控制, 因此减少 inter-animal 的变异性29。兔髂动脉的球囊损伤可以安全、方便地使用本文所述的方法进行。斑块发展的时间依赖的方式, 是均匀的整个长度的动脉。其他动脉粥样硬化兔模型也被开发, 如渡边可遗传高脂 (WHHL) 模型, 基因改良动物模型与低密度脂蛋白受体缺乏症。气球损伤模型也可应用于 WHLL 兔, 在一个明确的部位产生病变。
兔髂动脉与人冠状动脉斑块有差异。事实上, 已经建立了一些替代性的程序, 试图发展晚期动脉粥样硬化病变, 并建立一个模型的斑块破裂, 在人类的观察39。例如, 在经过8周的兔球囊损伤后, 消除了不稳定的斑块形成,16。其他修改的程序使用药理触发器, 如罗素的毒蛇毒液10和随后的重复气球损伤40评估动脉粥样硬化斑块破裂、血栓和血栓生长的机制船只.罗素的毒蛇毒液含有蛋白酶, 激活凝血级联导致血栓形成。反复球囊损伤导致凝血酶产生的斑块组织因子40。应该指出, 动物模型的结果, 包括兔子模型可能无法完全推断人类。然而, 这些模型可能是一个有用的工具, 评估和比较新的药理干预的功效。必须对高胆固醇血症的程度和斑块的组成进行仔细的推断, 以扩大对人动脉粥样硬化的病因、病理生理学和治疗的认识。这个模型有助于研究斑块演化所涉及的机制, 并探讨新的抗治疗对斑块稳定/回归的影响。
披露声明
作者声明没有竞争的金融利益。
致谢
这项工作得到了瑞士国家科学基金会赠款150271的支持。
材料
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Charles River laboratories,France | Cre:KBL(NZW) | |
| Cholesterol rich diet | Ssniff spezialdiäten | Ssniff EF K High Fat and Cholesterol | |
| Glass bead sterilizer-Germinator 500 | VWR, Leicestershire, UK | 101326-488 | |
| Fogarty balloon embolectomy catheters, 2 French | Edwards Lifesciences, Switzerland | 120602F | For single use only |
| Luer Lock Syringe | Becton, Dickinson and Company, USA | 309628 | |
| Thermopad Type 226 | Solis, Switzerland AG | 397387 | |
| Buprenorphine- Temgesic | Reckitt Benckiser AG, Switzerland | 7.68042E+12 | |
| Isoflurane | Piramal Critical Care, Inc, Bethlehem, PA 18017 | 2667-46-7 | |
| Anaesthesia machine-combi-vet Base Anesthesia System | Rothacher Medical GmbH, Switzerland | CV 30-301-A | |
| Cardell touch veterinary vital signs monitor | Midmark, Ohio, USA | 8013-001 | |
| Ophthalmic ointment-Humigel | Virbac, France | ||
| Animal hair clippers | Aesculap AG, Germany | GT420 | |
| Disinfectant-Betadine solution | MundipharmaMedicalCompany, Switzerland | 14671-1203 | |
| Dumont #7 Forceps | FST Germany | 11274-20 | |
| Medium and small microscissors | Medline International Switzerland Sàrl | UC4337 | |
| Microvascular clamps | FST, Germany | 18051-28 | |
| Papaverine | ESCA chemicals, Switzerland | RE 356 803 | |
| Vein Pick | Harvard Apparatus, Cambridge, UK | 72-4169 | For single use only |
| Saline | Laboratorium Dr. G. Bichsel AG, , Switzerland | 1330055 | |
| Polysorb 5-0 suture | Covidien AG, Switzerland | UL 202 | Monofilament |
| Sulfadoxine and Trimethoprim-Trimethazol | Werner Stricker AG, Switzerland | Swissmedic Nr. 50'361 | |
| Antiseptic- Octenisept | Schülke & Mayr AG, Switzerland | GTIN: 4032651214068 | |
| Phosphate Buffered Saline | Roth | 1058.1 | |
| Isobutanol-2-Methylbutane | Sigma-Aldrich, Switzerland | M32631-1L | |
| Optimum Cutting Temperature compound-Tissue-Tek | VWR Chemicals, Belgium | 25608-930 | |
| Cryostat | Leica, Glattbrugg, Switzerland | Leica CM1860 UV | |
| Glass slide- Superfrost Plus | Thermo Scientific | 4951PLUS4 | |
| Mayer's Haematoxylin | Sigma-Aldrich, Switzerland | MHS32-1L | |
| Eosin 0.5% aq. | Sigma-Aldrich, Switzerland | HT110232-1L | |
| Oil Red O | Sigma-Aldrich, Switzerland | O0625-25G | |
| α-smooth muscle actin antibody | Abcam, UK. | ab7817 | |
| Macrophage Clone RAM11 antibody | DAKO, Switzerland | M063301 | |
| Hoechst | Abcam, UK. | ab145596 | |
| Goat polyclonal Secondary Antibody (Chromeo 546) | Abcam, UK. | ab60316 | |
| Alexa Fluor 488/547 | Abcam, UK. | ||
| Glycergel Mounting Medium, Aqueous | DAKO, Switzerland | C056330 | |
| Hematoxylin for Movat pentachrome staining | Sigma-Aldrich, Switzerland | H3136-25G | |
| Ferric chloride for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 157740-100G | |
| Iodine for Movat staining | Sigma-Aldrich, Switzerland | 207772-100G | |
| Potassium iodide for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 60400-100G-F | |
| Alcian blue for Movat staining | Sigma-Aldrich, Switzerland | A5268-10G | |
| Strong Ammonia for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 320145-500ML | |
| Brilliant crocein MOO for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 210757-50G | |
| Acid Fuchsin for Movat pentachrome staining | Sigma-Aldrich, Switzerland | F8129-50G | |
| Sodium Thiosulfate for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 72049-250G | |
| Phosphotungstic acid for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 79690-100G | |
| Crocin for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 17304-5G | |
| EUKITT for Movat pentachrome staining | Sigma-Aldrich, Switzerland | 03989-100ML |
参考文献
- Mozaffarian, D., et al. Heart disease and stroke statistics--2015 update: a report from the American Heart Association. Circulation. 131, e29-e322 (2015).
- Boone, L. R., Brooks, P. A., Niesen, M. I., Ness, G. C. Mechanism of resistance to dietary cholesterol. J Lipids. 2011, 101242 (2011).
- Kapourchali, F. R., et al. Animal models of atherosclerosis. World J Clin Cases. 2, 126-132 (2014).
- Carter, C. P., Howles, P. N., Hui, D. Y. Genetic variation in cholesterol absorption efficiency among inbred strains of mice. J Nutr. 127, 1344-1348 (1997).
- Kolodgie, F. D., et al. Hypercholesterolemia in the rabbit induced by feeding graded amounts of low-level cholesterol. Methodological considerations regarding individual variability in response to dietary cholesterol and development of lesion type. Arterioscler Thromb Vasc Biol. 16, 1454-1464 (1996).
- Singh, V., Tiwari, R. L., Dikshit, M., Barthwal, M. K. Models to study atherosclerosis: a mechanistic insight. Curr Vasc Pharmacol. 7, 75-109 (2009).
- Dornas, W. C., Oliveira, T. T., Augusto, L. E., Nagem, T. J. Experimental atherosclerosis in rabbits. Arq Bras Cardiol. 95, 272-278 (2010).
- Baumgartner, H. R., Studer, A. [Effects of vascular catheterization in normo- and hypercholesteremic rabbits]. Pathol Microbiol (Basel). 29, 393-405 (1966).
- Tanaka, H., et al. Sustained activation of vascular cells and leukocytes in the rabbit aorta after balloon injury. Circulation. 88, 1788-1803 (1993).
- Phinikaridou, A., Hallock, K. J., Qiao, Y., Hamilton, J. A. A robust rabbit model of human atherosclerosis and atherothrombosis. J Lipid Res. 50, 787-797 (2009).
- Nakazawa, G., et al. Drug-eluting stent safety: findings from preclinical studies. Expert Rev Cardiovasc Ther. 6, 1379-1391 (2008).
- Aikawa, M., et al. Lipid lowering by diet reduces matrix metalloproteinase activity and increases collagen content of rabbit atheroma: a potential mechanism of lesion stabilization. Circulation. 97, 2433-2444 (1998).
- Jeanpierre, E., et al. Dietary lipid lowering modifies plaque phenotype in rabbit atheroma after angioplasty: a potential role of tissue factor. Circulation. 108, 1740-1745 (2003).
- Durand, E., et al. Magnetic resonance imaging of ruptured plaques in the rabbit with ultrasmall superparamagnetic particles of iron oxide. J Vasc Res. 44, 119-128 (2007).
- Stadius, M. L., et al. Time course and cellular characteristics of the iliac artery response to acute balloon injury. An angiographic, morphometric, and immunocytochemical analysis in the cholesterol-fed New Zealand white rabbit. Arterioscler Thromb. 12, 1267-1273 (1992).
- Khanna, V., et al. Cholesterol diet withdrawal leads to an initial plaque instability and subsequent regression of accelerated iliac artery atherosclerosis in rabbits. PLoS One. 8, e77037 (2013).
- Zou, J., et al. Effect of resveratrol on intimal hyperplasia after endothelial denudation in an experimental rabbit model. Life Sci. 68, 153-163 (2000).
- Li, M., Zhang, Y., Ren, H., Zhang, Y., Zhu, X. Effect of clopidogrel on the inflammatory progression of early atherosclerosis in rabbits model. Atherosclerosis. 194, 348-356 (2007).
- Nakazawa, G., et al. Evaluation of polymer-based comparator drug-eluting stents using a rabbit model of iliac artery atherosclerosis. Circ Cardiovasc Interv. 4, 38-46 (2011).
- Van Dyck, C. J., et al. Resolute and Xience V polymer-based drug-eluting stents compared in an atherosclerotic rabbit double injury model. Catheter Cardiovasc Interv. 81, E259-E268 (2013).
- Abran, M., et al. Validating a bimodal intravascular ultrasound (IVUS) and near-infrared fluorescence (NIRF) catheter for atherosclerotic plaque detection in rabbits. Biomed Opt Express. 6, 3989-3999 (2015).
- Kanamasa, K., et al. Recombinant tissue plasminogen activator prevents intimal hyperplasia after balloon angioplasty in hypercholesterolemic rabbits. Jpn Circ J. 60, 889-894 (1996).
- Pai, M., et al. Inhibition of in-stent restenosis in rabbit iliac arteries with photodynamic therapy. Eur J Vasc Endovasc Surg. 30, 573-581 (2005).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. CSH Protoc. 2008, (2008).
- Chaytor, A. T., Bakker, L. M., Edwards, D. H., Griffith, T. M. Connexin-mimetic peptides dissociate electrotonic EDHF-type signalling via myoendothelial and smooth muscle gap junctions in the rabbit iliac artery. Br J Pharmacol. 144, 108-114 (2005).
- Zhang, W., Trebak, M. Vascular balloon injury and intraluminal administration in rat carotid artery. J Vis Exp. (94), (2014).
- Maillard, L., et al. Effect of percutaneous adenovirus-mediated Gax gene delivery to the arterial wall in double-injured atheromatous stented rabbit iliac arteries. Gene Ther. 7, 1353-1361 (2000).
- Sharif, F., et al. Gene-eluting stents: adenovirus-mediated delivery of eNOS to the blood vessel wall accelerates re-endothelialization and inhibits restenosis. Mol Ther. 16, 1674-1680 (2008).
- Lee, J. M., et al. Development of a rabbit model for a preclinical comparison of coronary stent types in-vivo. Korean Circ J. 43, 713-722 (2013).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods Mol Med. 139, 1-30 (2007).
- Asada, Y., et al. Effects of inflation pressure of balloon catheter on vascular injuries and subsequent development of intimal hyperplasia in rabbit aorta. Atherosclerosis. 121, 45-53 (1996).
- Dornas, W. C., Oliveira, T. T., Augusto, L. E., Nagem, T. J. Experimental atherosclerosis in rabbits. Arq Bras Cardiol. 95, 272-278 (2010).
- Waksman, R., et al. PhotoPoint photodynamic therapy promotes stabilization of atherosclerotic plaques and inhibits plaque progression. J Am Coll Cardiol. 52, 1024-1032 (2008).
- Fernandez-Parra, R., et al. Pharmacokinetic Study of Paclitaxel Concentration after Drug-Eluting Balloon Angioplasty in the Iliac Artery of Healthy and Atherosclerotic Rabbit Models. J Vasc Interv Radiol. 26, 1380-1387 (2015).
- Dussault, S., Dhahri, W., Desjarlais, M., Mathieu, R., Rivard, A. Elsibucol inhibits atherosclerosis following arterial injury: multifunctional effects on cholesterol levels, oxidative stress and inflammation. Atherosclerosis. 237, 194-199 (2014).
- Manderson, J. A., Mosse, P. R., Safstrom, J. A., Young, S. B., Campbell, G. R. Balloon catheter injury to rabbit carotid artery. I. Changes in smooth muscle phenotype. Arteriosclerosis. 9, 289-298 (1989).
- Miyake, T., et al. Prevention of neointimal formation after angioplasty using nuclear factor-kappaB decoy oligodeoxynucleotide-coated balloon catheter in rabbit model. Circ Cardiovasc Interv. 7, 787-796 (2014).
- Fulcher, J., Patel, S., Nicholls, S. J., Bao, S., Celermajer, D. Optical coherence tomography for serial in vivo imaging of aortic plaque in the rabbit: a preliminary experience. Open Heart. 2, e000314 (2015).
- Abela, O. G., et al. Plaque Rupture and Thrombosis: the Value of the Atherosclerotic Rabbit Model in Defining the Mechanism. Curr Atheroscler Rep. 18, 29 (2016).
- Yamashita, A., Asada, Y. A rabbit model of thrombosis on atherosclerotic lesions. J Biomed Biotechnol. 2011, 424929 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。