Method Article
競争力の移植は、造血幹細胞のフィットネスを評価します
要約
This protocol provides step-by-step guidelines for setting up competitive mouse bone marrow transplant experiments to study hematopoietic stem/progenitor cell function without prior purification of stem cells by cell sorting.
要約
The gold standard definition of a hematopoietic stem cell (HSC) is a cell that when transferred into an irradiated recipient will have the ability to reestablish blood cell production for the lifespan of the recipient. This protocol explains how to set up a functional assay to compare the HSC capacities of two different populations of cells, such as bone marrow from mice of two different genotypes, and how to analyze the recipient mice by flow cytometry. The protocol uses HSC equivalents rather than cell sorting for standardization and discusses the advantages and disadvantages of both approaches. We further discuss different variations to the basic protocol, including serial transplants, limiting dilution assays, homing assays and non-competitive transplants, including the advantages and preferred uses of these varied approaches. These assays are central for the study of HSC function and could be used not only for the investigation of fundamental HSC intrinsic aspects of biology but also for the development of preclinical assays for bone marrow transplant and HSC expansion in culture.
概要
造血が損傷、放射線と細胞死によって失われた血液細胞の補充を確実に再生プロセスです。この処理は、主に成人の骨髄に存在する造血幹細胞(HSC)によって保証されます。また、造血幹細胞は、自己免疫疾患、血液悪性腫瘍および免疫不全1で治療目的のために使用することができます。よりよいそれらの増殖拡大と到達し、移植後のレシピエントの骨髄を生着する能力を含む、HSC機能を制御する機構を理解する必要性が存在します。最近の研究は、将来に向かって約50%の純度2-4に大人のHSCおよび胎児HSCを豊かにするSLAMファミリーメンバーCD150及びCD48を含むいくつかの細胞表面マーカーを、報告しているが、機能的な造血幹細胞のためのゴールドスタンダード尺度はへのin vivo再増殖アッセイのまま血液cを再確立する能力を決定します照射されたホスト5のエル生産。
in vivoでのクローン再増殖アッセイは、最初にティルとマカロック6が開発し、以来、洗練され、拡張されました。もともと定義されているように、HSCは自己複製と分化を通じて生涯の血液細胞の生産を確保します。異なる血液細胞系統(Tリンパ球、Bリンパ球、顆粒球、単球)、および連続移植を介して、自己再生能力の分析を介して分化する能力を:照射レシピエントへのHSCの転送は、このように我々が評価することを可能にします。アッセイは、通常、機能性および/ またはHSCの2つの集団の量の比較を伴うだろう、 例えば 、細胞が造血幹細胞の維持や拡大に影響を与える可能性が別の因子で処理または未処理された異なる遺伝子型または細胞の2匹のマウスから来ます文化インチドナーキメラ、または転送されたドナーのHSCトンの貢献O血液細胞産生は、受信者、またはホストからのドナー細胞を区別する細胞表面マーカーまたは他の方法を用いて、末梢血および骨髄にフローサイトメトリー解析によって決定することができます。最も広く使用されているマーカーは確かに私たちは下記の実施例のために選択した遺伝子PtprcまたはCD45白血球抗原7のための2つの対立遺伝子です。
クローン再増殖アッセイは、競合的または非競合的のいずれかであることができます。非競合的設定では、対照および試験HSCは別個のレシピエントマウスに移し、各細胞型のための結果は、他の独立したであろう。競争力のある設定では、試験および対照両方HSCの機能は、競合他社HSCの集団に対して測定されます。ここで説明するプロトコルは、競争力のある設定を使用しても、非競合的状況に適合させることができます。どちらのアプローチは、その利点と限界を持っている、と私たちは中に詳細にそれらを比較します討論。我々はまた、移植されたHSCの数の株式を確保するための様々なアプローチを説明し、希釈アッセイ(LDA)を制限することにより、HSCの定量化のためのアッセイを適合させ、結果の解釈のための成功と失敗の移植の両方の例を提供する方法について説明します。
プロトコル
このプロトコルで説明されているすべての手順は、制度上の動物の倫理委員会によって承認され、動物実験ガイドラインにカナダの評議会に従ってきました。
注意:滅菌/特定病原体フリーの住宅事情を維持するために、生物学的安全キャビネットまたは層流フードの内側に生きたマウスのダイレクトなハンドリングに関連するすべての手続きを行っています。適切に動物に提供される装置、住宅資材、飼料と水を抑制し、クリーンまたはケージを滅菌します。注射のための血液採取のためにのみ、滅菌、使い捨ての針を使用してください。無菌技術は、移植の準備中に重要です。
レシピエントマウスの作製
- 時間をかけて末梢血および骨髄再構成の個々のフォローアップを有効にするには、耳のノッチ(またはローカルの動物倫理委員会8によって承認された他の方法)とレシピエントマウスを識別します。移植後のフォローアップのためのマウスを計量。米国(25g未満)7〜12週齢での電子のレシピエントマウス。
注:提供された例では、CD45.1 + CD45.2 +レシピエントマウスは、コンジェニックB6.SJLマウスとC57BL / 6マウスを交配することによって家の中で飼育しました。 - 造血活性を破壊するために450ラドの2用量でレシピエントマウスに照射。移植前、移植の前に最初の投与日及び第二の1〜2時間を与えます。
注:X線またはガンマ線は、両方の適切な設備の利用可能性に応じて使用することができます。
ドナーと競合骨髄細胞の調製
- ドナー(試験および対照を、CD45.2 +)を安楽死させると、競合他社(CD45.1 +; B6.SJL)頸椎脱臼や地元の動物倫理委員会によって承認された方法を用いて、続いてCO 2窒息によりマウス。
- 空のペトリ皿中または滅菌ガーゼ上で、オープン広い背中、足にマウスを置き、私は(清潔な作業面を維持します)生物学的安全キャビネットをnside。 70%エタノール/ 30%Hと皮膚と毛を湿ら2 O(v / v)です。
- 手術用ブレードまたは鋭いハサミで足を切断してください。脚部に沿って皮膚を開き、鋸歯状の鉗子を用いて皮膚を引き離すカット。余分な筋肉を切り取ります。
- 足の骨を引っ張ると反力として骨盤に対してはさみの刃を使用して大腿骨を脱臼。膝頭から脛骨と大腿骨を外し、筋肉や腱の残りのビットを削除します。 6ウェル組織培養プレート2-3ミリリットル中に骨を滅菌リン酸緩衝生理食塩水(PBS)を配置。
- 5ミリリットル滅菌PBSで骨を洗い流すことによって骨髄細胞を収集します。
- ピンセットで軽く骨を持ち、骨の一端に満たした1mlシリンジに取り付けた25 Gの針を挿入します。プランジャーを押して、15ミリリットルコニカルチューブに細胞を収集します。骨の中心が白になるまで、必要に応じて繰り返します。
- 繰り返しに針を通すことにより細胞を解離単一細胞懸濁液を得ます。気泡や過剰な力を避けてください。注:この段階で、細胞生存率を改善するために、わずかに大きい針(22 G)を使用します。
- 均一な細胞懸濁液を確実にし、破片や凝集塊を除去するために70μmのナイロンストレーナを介して細胞を渡します。
- 血球計数器を用いて細胞計数のためにアリコートを削除します。 4℃で5分間、200×gで、残りの細胞懸濁液を遠心。滅菌PBS(10 8細胞/ ml)に、必要に応じて細胞密度を再調整します。細胞を氷上に保管してください。
3.ドナー細胞HSC同等の確立
- フローサイトメトリー染色のために5ミリリットル丸底ポリスチレンチューブに3×10 6個の細胞(30μL)と同等のものを転送します。 (2.5 / mlの最終濃度(PBS、0.1%ウシ血清アルブミン(BSA)および1mM EDTAを補充した)、染色緩衝液で希釈)、非特異的染色をブロックするためにCD16 / CD32に対する非標識抗体の等量を加えます。 RTで5分間インキュベート。
- 、ビオチン化リネージュカクテル(B220、CD3e、のCD11b、GR1、TER119)のSca1、CD117、CD135、CD150:染色緩衝液中で調製90μlの蛍光標識抗体のマスターミックスを追加します。光から保護して30分間、氷上でインキュベートします。
注:適切な希釈は、抗体のロットごとに決定されるべきです。本研究で用いた希釈液のための材料の表を参照してください。 - 未結合抗体を除去するために4℃で5分間、200×gで細胞、ボルテックスおよび遠心分離に2ミリリットルの染色バッファーを追加します。フリックにより上清と再懸濁ペレットをデカント。
- 染色緩衝液で希釈した10μlの蛍光色素結合ストレプトアビジンは( 材料表を参照)を追加します。光から保護し、20分間、氷上でインキュベートします。未結合ストレプトアビジンを除去するためのステップ3.3のように洗ってください。
- 少なくとも6つの検出器9とフローサイトメーターを用いて細胞サンプルを取得します。林の周波数を決定する-のSca1 + CD117 + CD135 - CD150 +細胞(HSCを推定) 図2に示すように、以前に10,11を報告しました 。
注意:その集団内の機能HSCの頻度は1/3と1/5 2,12の間に推定することができます。 - 以下および図2で説明するように、ベースラインのような1つのサンプル(典型的には、競合他社、この例ではB6.SJL CD45.1 +)を使用して、すべてのサンプル11の推定HSC当量を確立します。
- 以下の式を使用して、必要な細胞の数を計算します。
HSCを#transplanted /受信者= 5×10 5細胞のxは(ベースラインサンプルのために決定されるように、この数は、野生型C57BL / 6マウスを、75と125の間に通常ある)HSC頻度を推定10-12。
注: 図2では、試料Aのために、結果は139のHSCです。
(他のサンプルのため、 図2の例のサンプルB)の合計#移植された細胞=#トランスHSC / HSC頻度を植えました。
注: 図2では、試料Bの場合、結果は197826(または約2×10 5)総骨髄細胞です。
- 以下の式を使用して、必要な細胞の数を計算します。
- 上記で得られた結果を用いて、各サンプルのため移植片受容者ごとに必要な細胞の総数を計算します。
注意:この数は、ベースラインサンプル(競合他社)のために5×10 5であるべきです。- レシピエントマウスの数でステップ3.7から得られた数を乗算し、シリンジ内のデッドボリュームを補うために、少なくとも2つのさらなるマウスについての十分な細胞を追加します。
- ステップ3.6で計算され、滅菌PBSを使用して、注射当たり200μlのための最終的な音量を調整すると1 HSC当量比:( 例えば 、CD45.1 +)競合他社と1の試験細胞(CD45.2 +)を混ぜます。
注:5レシピエントマウスのグループが提案ボリュームは、このように3.5×10 6競技者の骨髄細胞を含有する1.4以上mlである(またはであろうために973 図2のサンプルA)の推定のHSC、およびテストセルの等価数は( 図2に、サンプルBの等価)は197826×7 = 1384782骨髄細胞であろう。
4.骨髄移植
- 血管の拡張を確実にするために、横尾静脈をより見やすくするために、赤加熱ランプとステップ1.2で照射レシピエントマウスをウォームアップ。
- 27 G針(または小さい)を装備した1ミリリットルツベルクリン注射器を準備します。吸引し(3レシピエントマウス用)調製した細胞懸濁液の約750μlの。シリンジ内に気泡がないことを確認してください。
- 拘束装置にマウスを挿入します。尾を調べ、尾の両側にはっきりと見えるはず外側尾静脈を探します。エタノールで注射部位を拭きます。 、アップベベル針を挿入し、皮膚に平行で、静かにプランジャーを押してください。注射は簡単にする必要があります。力再ある場合quiredは、針が静脈ではありません。
注意:古いマウスは厚い皮を持って、より困難な静脈を見つけることができます。針が静脈内にない場合は、最初の注射部位に注射針の近位を挿入します。 - 針を外し、出血を止めるために数秒間滅菌ガーゼで注射部位を押してください。きれいなケージにマウスを転送します。
注意:針があまりにも鈍くなることがあり、その後3回の注射のために同じ注射器と針を使用してください。 - 移植後のフォローアップのために、最初の5日間、マウスを再水和するために滅菌PBSを皮下1ミリリットルを注入。感染を防ぐために水を飲んで抗生物質を追加します(必要に応じて、オプション)。最初の3週間は2〜3日ごとにマウスを計量し、その移植前の体重(またはローカルの動物倫理委員会によって決定される)以上の15から20までパーセントを失ったマウスを安楽死させます。
末梢血の5.分析
- 一滴の血液を収集する(Approx。 EDTAチューブに50-100μl)を。
- 下顎静脈から血液を採取するには、顎骨の下に位置するヘアレススポットに近い顔の皮膚を穿刺し、血液13の滴を受け取るために捕集管を配置するために、ランセットまたは22 G針を使用しています。多系列再構成に従うように、移植後4、8、12および16週目に血液を採取します。
- ステップ5.1.1で採取した血液の低下に1ミリリットル新たに調製したRT赤血球溶解バッファー(9部0.16 M NH 4 Clで+ 1部0.17 Mトリス塩酸pHは7.65)を追加します。混合し、フローサイトメトリーに適した5ミリリットルの丸底ポリスチレンチューブにサンプルを移します。 RTで4分間放置してみましょう。
- 氷冷PBSの4ボリュームを追加します。エンド・ツー・エンドを回して混合し、氷上ですぐに転送します。 4℃で200×gで遠心分離10分。
- フリックにより上清と再懸濁ペレットをデカント。上清を明確にし、赤でなければなりません。簡単にバッファと渦を染色2ミリリットルを追加します。 200 XGAで5分間遠心トン4°C。
- フリックにより上清と再懸濁ペレットをデカント。
- CD45.1、CD45.2、CD3e、CD19、GR1:ステップ3.3から3.1に詳述さ一般的なプロトコルを使用して染色、フローサイトメトリーと、次のマスターミックスのための抗体を続行します。
- 少なくとも6つの検出器9とフローサイトメーターを用いて細胞サンプルを取得します。 図3に設けられた分析テンプレートを使用して、各試料中の各系統(CD19 + Bリンパ球、CD3e + Tリンパ球、GR1 明るい顆粒球)および10,11を公開としてドナー由来細胞の頻度を決定します。
骨髄再構成の6分析
- 部2ステインにマスターミックスのためのステップ3.3から3.1に詳述さ一般的なプロトコルを使用してフローサイトメトリー分析のための細胞と以下の抗体を詳述したように骨髄細胞を収集:リネージュカクテル、のSca1、CD117、CD135、CD150、CD45.1 、CD45.2。 LINを検出ステップ3.4で説明したように蛍光色素結合ストレプトアビジンを使用してEAGEカクテル抗体。
- 少なくとも8の検出器9とフローサイトメーターを用いて細胞サンプルを取得します。のみ6が利用可能な場合はCD135 +細胞が除外されるように、系統パネルと同じチャンネルにCD135を追加します。 図4に、10が公開され提供される分析テンプレートを使用して、各サンプル中のCD150 +のHSC -のSca1 + CD117 + CD135 -ドナー由来林の周波数を決定します。
結果
二次移植(さらに後述)を含む競争力の移植設定の一般的な説明は、 図1に見出すことができる。移植前の骨髄のHSCのための代表的な分析は、図2に記載されています。ダブレットの除外に関するより詳細な情報と死んだ細胞は、他の場所9見つけることができます。
図3及び図 4はそれぞれ、末梢血および骨髄の分析テンプレートフローサイトメトリーの例を提供します。いくつかのホストのTリンパ球を検出するために正常である(すべてのT細胞の20%まで; 図3B)、T細胞がより放射線抵抗性であるように。競合他社由来細胞はすべての3つの系統で存在すべきです。検出限界は内2万セルの合計を分析するために獲得した総細胞の数に大きく依存するが、我々の経験で単一白血球ゲートは通常は十分です。 ( 図3に示すように、Bリンパ球、Tリンパ球、または骨髄)ドナー細胞は、任意の系統にカットオフより低い割合を表す場合、1%または0.5%の任意の閾値を用いて、マウスは多再構成のために陽性であるとみなされていません。競合的移植が議論で説明したように、ドナーHSCを定量化するために、限界希釈アッセイと組み合わされる場合に、この概念が重要になります。例えば、ドナー由来のTおよびBリンパ球が、通常は一過性の再構築を示唆している骨髄細胞の漸進的な損失を持っていることは確かに可能です。リンパ球は骨髄細胞(特にGr1hi SSChi顆粒球/好中球)よりも長い半減期を有する、さらには骨髄のHSC 10の不在下で存続することができます。
図5は、様々 なその場の下で末梢血キメラ化のための代表的な結果を示していますations。ドナーHSCは競合細胞と機能的に同等である場合には、ドナー(CD45.2 +)と競合他社(CD45.1 +)をの割合由来の細胞は、同等( 図5A)です。彼らはより多くの放射線耐性であるため、図5(a)及び(b)の残留宿主細胞(CD45.1 + CD45.2 +)は、ほぼ独占的にTリンパ球です。ドナー細胞は、末梢血白血球( 図5B)の非常に低い割合を提示するときに、HSCの機能のいくつかの局面は、欠陥可能性があると考察に記載されるように、さらなる研究が必要です。競合細胞の存在は、アッセイがうまく働いたが、ドナーの骨髄は単にあまり効果的であったことを確認します。これは、両方のドナーおよび競合細胞が少数と、宿主細胞中に存在する、図5(c)に示された結果とは対照的である末梢血細胞の大部分を表します。この場合、移植は失敗と私でしたtは競合細胞に対するドナーの相対的な機能にどのような結論を引き出すことはできません。別の解決策は、以下でさらに議論されます。

。ドナーマウスから図1. 実験計画競争移植のために(A)、骨髄細胞(CD45.2 +;のC57BL6背景;対照および試験)およびコンジェニック競合他社マウス(CD45.1 +; B6.SJLは)で混合され、 1:1の比、照射レシピエントマウスの尾静脈に注入し(CD45.1 + CD45.2 +;のC57Bl6のF1子孫は、B6.SJL繁殖ペアをX)。骨髄再構成の効果は、4、8、12および16週間後、移植時及び16週での骨髄移植後以降に末梢血(PB)において決定されます。 (B)さらに、移植細胞の自己再生を評価するために、ボン16週間後に、移植レシピエントから回収した電子の骨髄細胞を照射し、二次レシピエントマウスに導入することができます。 HSC、造血幹細胞。 MPP、多能性前駆細胞; LMPP、リンパプライミングMPPが。 この図の拡大版をご覧になるにはこちらをクリックしてください。
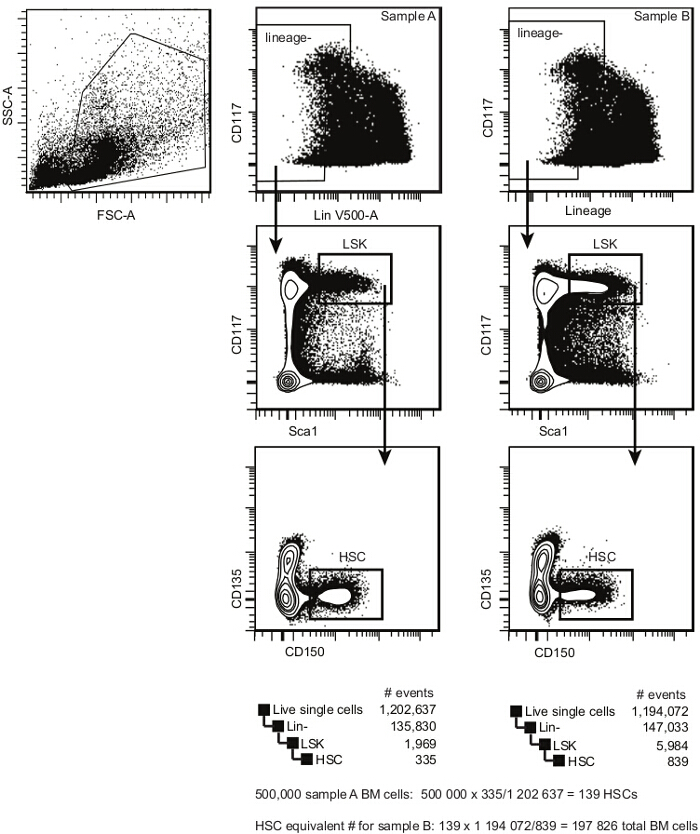
図2. 移植前の骨髄HSC分析テンプレート。単一細胞内では、CKIT(CD117)とリネージュの式に従ってHSPCsを選択します。林薄暗い/内-細胞集団、CKIT 明るいのSca1 +集団(LSK)を選択します。造血幹細胞-のLSKの中で、CD150 + CD135を選択します。この集団は、(この集団内の再増殖細胞の頻度があることが長期および短期再増殖のHSCの両方を含みますトゥイーン1/3と1/5)。骨髄HSCの推定周波数は単一細胞ゲート内のイベントの数でHSCゲート内のイベント数を割ることによって計算される。 この図の拡大版をご覧になるにはこちらをクリックしてください。
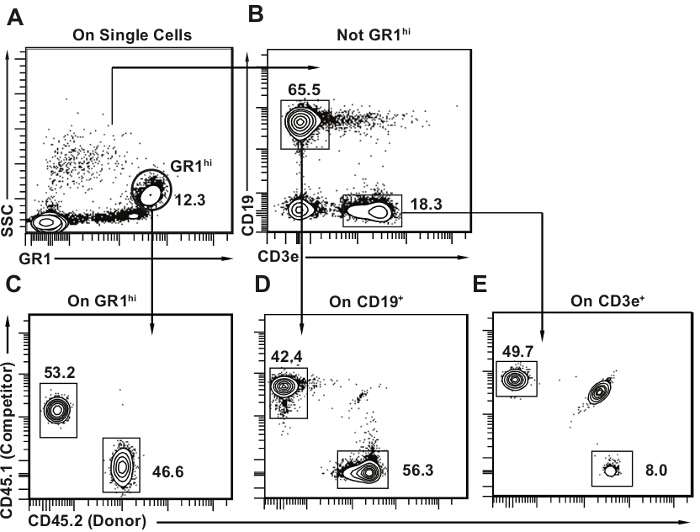
図3.移植後末梢血液分析テンプレート。(A)単一の細胞内では、最初のGR1 明るい SSC ハイ顆粒球を選択します。 Bリンパ球およびCD3e + CD19 - - Tリンパ球(B)次に、CD19 + CD3eを選択します。マウス末梢血は、Bリンパ球は、主要な細胞型(約50%のすべての末梢血液細胞)であることと、リンパ球の大部分が含まれています。 CE)CD4との各サブセットのための2Dフローサイトメトリープロットを描きます他の上の1つの軸とCD45.1 5.2。示すように、各系統のためのドナー(CD45.2 +)を、ホスト(CD45.1 + CD45.2 +)と競合細胞(CD45.1 +)を特定します。パネルEに見られるように、特にTリンパ球集団では、いくつかの残りの宿主細胞を持つようにするのが普通です。この図の拡大版をご覧になるにはこちらをクリックしてください。
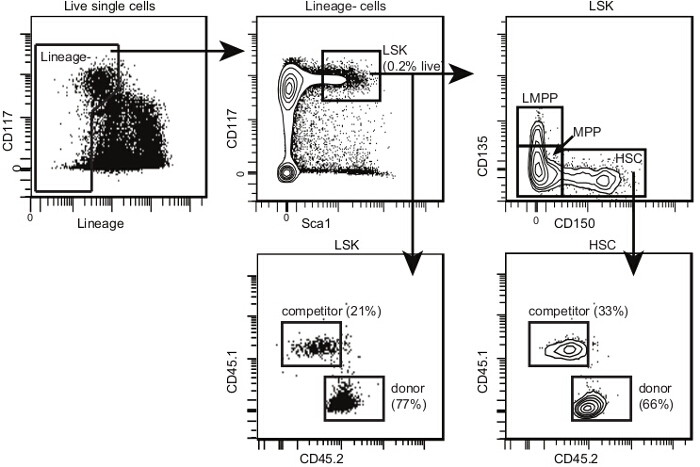
図4. 移植後の骨髄HSC分析テンプレート。のLSK内で図2について示されるように、単一の細胞内では、HSPCsとのLSKを選択し、CD150 + CD135- HSCは、CD150- CD135-多能性前駆細胞(またはのMPP)およびCD150- CD135 +リンパを選択-primedのMPP(またはLMPPs)。 LMPPsの割合は、非照射マウスより移植後低いです。 2D流れcを描きます他の上の1つの軸とCD45.1上のCD45.2と各サブセットのためのプロットをytometry。示すように、各亜集団のためのドナー、ホストと競合細胞を識別します。照射と移植が成功した場合、非常に少数の残りのホストHSPCsがあるはずです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
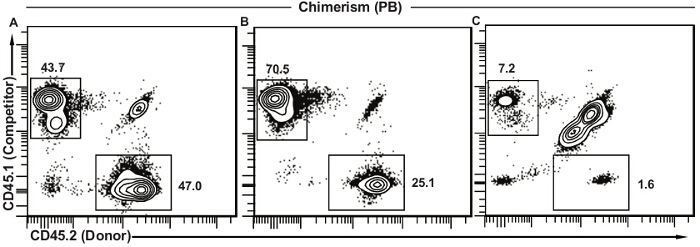
末梢血キメラ図5.代表的な結果。(A)の成功移植ドナーHSCは機能的に競合細胞と同等です。残りの宿主細胞(CD45.1 + CD45.2 +)の大部分は、通常はTリンパ球です。 (B)ドナーのHSCのショーは競合細胞と比較して機能が低下し成功移植。この減少の寄与は、に起因することができますいくつかの異なる要因とさらなる分析は、(議論を参照)必要になります。 (C)競技者とドナー細胞と残りの宿主細胞の大部分の両方の低周波数で失敗移植。このタイプの結果は、失敗した注射(尾静脈の外に、注射を、細胞生存率を低下させ、注射の量を減少させた)照射の予想される用量よりも低い示唆している、またはこれらの組み合わせ。 この図の拡大版をご覧になるにはこちらをクリックしてください。 。
ディスカッション
ここで説明するプロトコルは、既知の競合他社のHSCに対するドナー(テスト)HSCの相対的な適合性を評価するために設計されています。競争の状況は(幹細胞のフィットネスの緩やかな減少を検出する可能性が高い)アッセイの相対感度を向上させ、照射し、注射の有効性のための内部の技術的な制御を提供します。しかし、それはHSCのフィットネスの絶対的な尺度として使用されるべきではありません。競争力の再構築の減少は、自動的にHSCが競争の不存在下でうまく機能しないことを意味するものではありません。それは競争力の設定がより良い出発点であることを主張することができますが、競合細胞が不良HSC機能を救出され、すべてのレシピエントマウスは生存するように、1は、結果の解釈には注意すべきです。非競争的環境の中で結果を確認するとの結論を固めるます。
ここで紹介する実験計画は、HSC等価クを使用しています総骨髄細胞のantitiesの代わりに-sorted HSCを、フローサイトメトリーの純粋な集団。異なるドナー間の変動を排除し、表現型HSC周波数の変動がHSC機能14の変化として解釈されないことを確実にするための研究(異なるドナー、競合他社)の下にあるすべての集団でのHSCの数を等しくすることが重要です。精製されたHSCの上に、ここで説明されたアプローチの利点は、次のとおり改善された細胞の生存率短縮による処理時間やソート中に外部圧力の不足のために。そして、受信者の骨髄への改善ホーミングは(選別された細胞に対する抗体の存在は、骨髄15での生着に干渉する場合があります)。逆に、主な欠点は、移植転帰非HSC集団の寄与、移植後の早期の時点で短命前駆細胞の特に役割があります。さらに、治療または遺伝的修飾は、surfacの発現を変化させる場合HSCは16の選択のために使用する電子マーカーは、結果にバイアスをかけるであろう、一つのサンプルではなく、別の"変装して「HSCのかなりの数があるかもしれません。精製されたHSCを使用し、移植アッセイに固有のものであるときしかし、同じ問題が発生することがあります。
現在のプロトコルを使用して得られた結果は、集団レベルでのみ定性的です。言い換えれば、移植後のドナー細胞の減少の寄与がが原因である可能性があり、出発集団における機能的HSCの低い番号。骨髄に落ち着くと、移植後の最初の数日から数週間に拡大する個々のHSCの能力低下。または周辺部での検出のために使用されている成熟細胞への分化や成長に伴う問題。単独で競争力のある移植からの結果を使用しないことではなく、Hから、細胞増殖、生存、および分化を測定するアッセイでそれらを補完することが重要です血液細胞を循環するSC。分化ブロックを示すようになり、末梢血中のドナー細胞の不在と組み合わせた骨髄中のドナー由来HSCの末梢血の間のドナー細胞の寄与( 図3)および骨髄( 図4)プレゼンスを比較することも重要です。例には示されていないが、GPI1 17の異なるアイソフォームに基づいて、赤血球の再構成を評価することも可能です。血液中に存在する赤血球の大規模な数を考えると、彼らはHSCの低い数字を移植するか、長期間にわたって、それらの出力を以下の場合に特に有用であることができるドナー由来細胞、の検出の高感度な方法を表します。スペクトルの他端に、骨髄細胞は、しばしば、それらの短い半減期の末梢血中の一部は、それらの低周波の一部に、検出された失敗した最初のものです。
目に適合させることが可能です限界希釈アッセイ(またはLDA)を使用して、HSCの定量化を可能にする電子競争力の再増殖アッセイ。上記のようにドナー細胞、ソートされたまたは未ソートのいずれか:これは、各グループは競技者の異なる比率を受け取るいくつかのグループに分かれ、レシピエントマウスのはるかに大きな数が必要になります。ドナー細胞の数が減少するにつれて、ドナー由来の細胞の割合は、1つ又は複数の系統に予め設定された閾値に到達しないでより多くのマウスが存在することになります。移植されたドナー細胞の数に対してグループごとに「負」のマウスの頻度をプロットし、その後、グラフ18,19からのHSCの頻度を決定することが可能です。
移植後のフォローアップの推奨期間は、文献中に変化します。 16週間の期間は、移植は、長期HSCの出力を反映するのに十分であると考えられた後の特定のコンセンサスがありました。 「私のしかし、最近の報告その機能は16週間が必要性を強調してきた直後に低下ntermediate「HSCは、HSC機能17の一層厳格な評価のための。これらの懸念を満たすために16週の時点を過ぎて移植レシピエントのフォローアップを拡張することは確かに可能である。アンもう一度間違いなくより高感度の代替オプションは、骨髄細胞を照射し、二次レシピエントに注入された第1の移植レシピエントから回収した二次移植( 図1B)、である。第二 の移植は、その出口を強制的に、造血幹細胞の追加の増殖圧力をかけます休眠から堅牢な自己複製と細胞のみがそれらの出力を維持することを可能にする。時にはより良い二次移植のための異なるサンプル間でのHSCの数を調整するためにソートドナー細胞を使用することが好ましい。あるいは、ドナーの推定比を確立することが可能です:一次骨髄から競合のHSC( 例えば、 次に、図4)とは、その割合に二次移植でドナー細胞の出力を比較します。移植後の骨髄における機能HSCの頻度は非照射マウスで見られる数に達することがないように、移植の総骨髄細胞の数を増加させることも重要です。これは、複数のプライマリ受信者からの骨髄をプールし、二次レシピエント10あたり5から10000000までの全細胞を注入するのが最善です。
上述したように、ドナーHSCの所与の集団は、長期の再構成のための低下能力を示すことが理由のために多くの理由があります。その一つの理由は、(また、ホーミングと呼ばれる)移植後の骨髄に移行し、骨髄ニッチで自分自身を解決するHSCの能力です。骨髄ホーミングおよび短期拡大を調査するためにここに提示プロトコルを適合させることが可能です。移植された細胞の数(5,000〜10,000 HSCの同等のために大きくする必要があります)移植後の最初の週以内に分析のためのアッセイおよび1,000〜2,000 HSCをホーミング。ホーミングアッセイでは、レシピエントマウスは、移植後の最初の16〜24時間以内に安楽死させ、現在のプロトコルで説明したように、骨髄に達したドナーHSCの数が決定されます。 図1Bで説明したように、さらにその機能を評価するために、短期的なレシピエントから回収した骨髄細胞は、二次レシピエントに移植することができます。二次レシピエントにおけるドナー由来の細胞の割合は、その後、移動し、受信者の骨髄に落ち着くためにドナーHSCの能力を評価するために使用することができます。
競争力のある骨髄移植との主要な問題は、照射し、注射から生じ、どちらかが移植後の死亡率を増加または再構成効率を低下として自分自身を提示します。ここに提示される分割線量照射が、通常、より効率的な骨髄破壊と関連していると単回投与20に比べて低い毒性。用量ここで(2回450ラド)を推奨して、骨髄性およびBリンパ集団が効率的に削除されますが、残留Tリンパ球が( 図3)のままで行います。移植片拒絶反応(異なる遺伝的背景から、ドナーとレシピエントマウス)、照射の高用量(550〜600ラドの2回投与)と2つの用量間の短い遅延(4時間の代わりに次の日を疑ういかなる理由がある場合)残留Tリンパ球を排除するため、拒否に起因する移植片不全の可能性を減少させるはずです。不適切な注射、または代わりに尾静脈の血管周囲空間への注入、試料調製時のドナー細胞の生存率、またはケアの欠如に起因するドナー細胞の混入の問題がまた移植の失敗と移植後の死亡率が増加します。 (例えば、技術的な問題に起因する)非効率的な照射が減少し再構成効率になりますが、MOを増やすべきではありませんrtality。競合細胞は、常に照射受信者を再構築することができるはずとして、ドナーHSC機能で善意の減少から(ここでは詳述したように)これらの状況のすべてにおいて、アッセイにおける競合細胞の存在は、技術的な問題を解離するのに役立ちます。免疫不全宿主はまた、照射および/ または移植片拒絶の危険性の必要性を減少させるために、およびヒトHSC 21〜23の機能を評価するために、例えば、使用することができます。
結論として、我々は、ここでの議論で詳述するように、いくつかの異なる用途に適合させることができる競争力のある移植プロトコルを提示します。我々のアプローチは、処理時間を減少させると同時に、細胞選別と比較した場合、移植片に細胞生存率を向上させる、HSC当量を使用します。これは、細胞ソーターへのアクセスが制限されている場合にも実用的な解決策であり、HSC機能の分析のための魅力的な出発点となって、定量的なLDAアッセイと比較した場合、より少ないマウスを必要とします。
開示事項
The authors declare that they have no competing financial interests.
謝辞
私たちは、手続きのフィギュアデザインとデモの支援のためにRoxannエテュ-アーバーに感謝しています。ラボでの研究が発見はありません付与、コール財団からの移行賞によってサポートされていました。自然科学とカナダの工学研究評議会(NSERC)とイノベーションのためのカナダ基金(CFIリーダーファンドはありません。31377を付与)419226から2012。サンテ(FRQS) - KMHは、フォンデRECHERCHEケベックためChercheur-Boursierジュニアです。
資料
| Name | Company | Catalog Number | Comments |
| Microtainer tubes with K2EDTA | BD Biosciences | 365974 | |
| 20 G needle | BD Syringe | For blood sampling from the mandibular vein | |
| LabQuake Shaker rotisserie | Thermo Scientific | C415110 | |
| Purified anti-mouse CD16/CD32 (clone 2.4G2, Fc Block) | BD Biosciences | 553142 | 2.50 μg/ml |
| Pe-Cy7-conjugated anti-mouse CD3e (clone 145-2C11) | eBioscience | 25-0031 | 0.25 μg/ml |
| PE-conjugated anti-mouse CD19 (clone 1D3) | eBioscience | 12-0193 | 0.25 μg/ml |
| APC-eFluor780 (APC-Cy7 equivalent)-conjugated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 47-5931 | 0.25 μg/ml |
| FITC-conjugate anti-mouse CD45.1 (clone A20) | eBioscience | 11-0453 | 2.50 μg/ml |
| eFluor450-conjugated anti-mouse CD45.2 (clone 104) | eBioscience | 48-0454 | 1.00 μg/ml |
| Biotinylated anti-human/mouse CD45R (B220) (clone RA3-6B2) | eBioscience | 13-0452 | 1.25 μg/ml |
| Biotinylated anti-mouse CD3e (clone 145-2C11) | eBioscience | 13-0031 | 1.25 μg/ml |
| Biotinylated anti-mouse CD11b (clone M1/70) | eBioscience | 13-0112 | 1.25 μg/ml |
| Biotinylated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 13-5931 | 1.25 μg/ml |
| Biotinylated anti-mouse TER119 (clone TER119) | eBioscience | 13-5921 | 0.625 μg/ml |
| V500 streptavidin | BD Biosciences | 56149 | 0.5 μg/ml |
| PE-conjugated anti-mouse CD117 (clone 2B8) | BD Biosciences | 553355 | 0.25 μg/ml |
| PE-Cy7-conjugated anti-mouse Ly6A/E (Sca1) (clone D7) | BD Biosciences | 558162 | 0.25 μg/ml |
| PerCP-eFluor710-conjugated anti-mouse CD135 (clone A2F10) | eBioscience | 46-1351 | 0.5 μg/ml |
| Alexa fluor 647-conjugated anti-mouse CD150 (clone TC15-12F12.2) | Biolegend | 115918 | 0.625 μg/ml BD Biosciences and eBioscience do not carry the same clone |
| 1 ml tuberculin syringe with 27 G needle | BD Syringe | 309623 | |
| 1 ml tuberculin syringe with 25 G needle | BD Syringe | 309626 | |
| 70 μm cell strainer | BD Falcon | 352350 |
参考文献
- Li, H. W., Sykes, M. Emerging concepts in haematopoietic cell transplantation. Nat Rev Immunol. 12 (6), 403-416 (2012).
- Kiel, M. J., Yilmaz, O. H., Iwashita, T., Terhorst, C., Morrison, S. J. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Kim, I., He, S., Yilmaz, O. H., Kiel, M. J., Morrison, S. J. Enhanced purification of fetal liver hematopoietic stem cells using SLAM family receptors. Blood. 108 (2), 737-744 (2006).
- Mayle, A., Luo, M., Jeong, M., Goodell, M. A. Flow cytometry analysis of murine hematopoietic stem cells. Cytometry A. 83 (1), 27-37 (2013).
- Rossi, L., et al. Less Is More: Unveiling the Functional Core of Hematopoietic Stem Cells through Knockout Mice. Cell Stem Cell. 11 (3), 302-317 (2012).
- Till, J. E., McCulloch, E. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat Res. 14, 213-222 (1961).
- Shen, F. W., et al. Cloning of Ly-5 cDNA. Proc Natl Acad Sci U S A. 82 (21), 7360-7363 (1985).
- Identification of GM mice. Laboratory Animals. 37 (suppl 1), 33-35 (2003).
- Rundberg Nilsson, A., Bryder, D., Pronk, C. J. H. Frequency determination of rare populations by flow cytometry: A hematopoietic stem cell perspective. Cytometry Part A. 83A (8), 721-727 (2013).
- Abidin, B. M., Owusu Kwarteng, E., Heinonen, K. M. Frizzled-6 Regulates Hematopoietic Stem/Progenitor Cell Survival and Self-Renewal. J Immunol. 195 (5), 2168-2176 (2015).
- Heinonen, K. M., Vanegas, J. R., Lew, D., Krosl, J., Perreault, C. Wnt4 enhances murine hematopoietic progenitor cell expansion through a planar cell polarity-like pathway. PLoS One. 6 (4), e19279(2011).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34 (9), 39-43 (2005).
- Santaguida, M., et al. JunB protects against myeloid malignancies by limiting hematopoietic stem cell proliferation and differentiation without affecting self-renewal. Cancer Cell. 15 (4), 341-352 (2009).
- Czechowicz, A., Kraft, D., Weissman, I. L., Bhattacharya, D. Efficient transplantation via antibody-based clearance of hematopoietic stem cell niches. Science. 318 (5854), 1296-1299 (2007).
- Zhang, C. C., Lodish, H. F. Murine hematopoietic stem cells change their surface phenotype during ex vivo expansion. Blood. 105 (11), 4314-4320 (2005).
- Benveniste, P., et al. Intermediate-Term Hematopoietic Stem Cells with Extended but Time-Limited Reconstitution Potential. Cell Stem Cell. 6 (1), 48-58 (2010).
- Fazekasde St Groth, B. The evaluation of limiting dilution assays. J Immunol Methods. 49 (2), R11-R23 (1982).
- Louis, I., Heinonen, K. M., Chagraoui, J., Vainio, S., Sauvageau, G., Perreault, C. The signaling protein Wnt4 enhances thymopoiesis and expands multipotent hematopoietic progenitors through beta-catenin-independent signaling. Immunity. 29 (1), 57-67 (2008).
- Cui, Y. Z., et al. Optimal protocol for total body irradiation for allogeneic bone marrow transplantation in mice. Bone Marrow Transplant. 30 (12), 843-849 (2002).
- Benz, C., et al. Hematopoietic Stem Cell Subtypes Expand Differentially during Development and Display Distinct Lymphopoietic Programs. Cell Stem Cell. 10 (3), 273-283 (2012).
- Eppert, K., et al. Stem cell gene expression programs influence clinical outcome in human leukemia. Nat Med. 17 (9), 1086-1093 (2011).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rgamma-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved