Method Article
竞争性移植评价造血干细胞健身
摘要
This protocol provides step-by-step guidelines for setting up competitive mouse bone marrow transplant experiments to study hematopoietic stem/progenitor cell function without prior purification of stem cells by cell sorting.
摘要
The gold standard definition of a hematopoietic stem cell (HSC) is a cell that when transferred into an irradiated recipient will have the ability to reestablish blood cell production for the lifespan of the recipient. This protocol explains how to set up a functional assay to compare the HSC capacities of two different populations of cells, such as bone marrow from mice of two different genotypes, and how to analyze the recipient mice by flow cytometry. The protocol uses HSC equivalents rather than cell sorting for standardization and discusses the advantages and disadvantages of both approaches. We further discuss different variations to the basic protocol, including serial transplants, limiting dilution assays, homing assays and non-competitive transplants, including the advantages and preferred uses of these varied approaches. These assays are central for the study of HSC function and could be used not only for the investigation of fundamental HSC intrinsic aspects of biology but also for the development of preclinical assays for bone marrow transplant and HSC expansion in culture.
引言
造血是一个再生过程,确保已经通过损伤,辐射和细胞死亡丢失血细胞的补充。这个过程是由造血干细胞(HSC)在很大程度上驻留在成人骨髓确保。此外,造血干细胞可用于在自体免疫疾病,血液恶性肿瘤和免疫缺陷1治疗目的。因此,有必要更好地理解,调节造血干细胞的功能,包括其增殖扩张和它们到达和移植后嫁接接受者的骨髓能力的机制。虽然最近有研究报道一些细胞表面标志物,包括SLAM家族成员CD150和CD48,前瞻性地充实成人造血干细胞和胎儿造血干细胞约50%的纯度2-4,为造血干细胞功能的黄金标准衡量仍然是一个在体内再植测定法确定他们重新建立血液ç能力ELL生产在辐照主机5。
体内克隆再植法最初是由免耕和麦卡洛克6开发,并一直完善和扩大。按照最初的定义,保证造血干细胞通过自我更新和分化终身血细胞生成。造血干细胞的转移到照射受体从而使我们能够评估:其通过不同的血细胞谱系的分析来区分(T淋巴细胞,B淋巴细胞,粒细胞,单核细胞)和它们的通过串行移植自我更新的能力的能力。该试验通常将涉及的造血干细胞的两个群体的功能性和/或数量的比较, 如 ,细胞来自不同基因型或细胞的两只小鼠已经被处理或未处理的与可能影响造血干细胞的维持或膨胀不同的因素来在文化。供者嵌合,或转供体造血干细胞T中的贡献O型血细胞的生产然后可以通过在外周血流式细胞分析和骨髓使用细胞表面标志物或其他方法,将区分供体细胞来自接受者,或主机来确定。最广泛使用的标记物是肯定为此,我们已选择为下面提供的实施例的基因PTPRC或CD45白细胞抗原7的两个等位基因。
克隆再增殖测定法可以是竞争性或非竞争性。在非竞争性设置,控制和测试造血干细胞被转移到单独的受体小鼠和每个细胞类型的结果将是独立于其它的。在竞争激烈的环境,测试和控制的造血干细胞的功能是对竞争者的造血干细胞群体测定。这里所描述的协议使用的竞争的设置,但也可以适用于非竞争的情况。这两种方法都有其优点和局限性,我们将在详细比较他们讨论。我们还描述了不同的方法,以确保在移植造血干细胞的数目权益,解释如何通过有限稀释测定法(LDA),以适应对造血干细胞的定量测定,并同时提供对结果的解释成功和不成功的移植的例子。
研究方案
在此协议中描述的所有程序已经批准制度动物伦理委员会,并按照加拿大议会关于动物保护的准则。
注:为了保持无菌/无特定病原体的住房条件,进行涉及生物安全柜或层流罩内的活体小鼠的直接处理所有过程。清洁或消毒笼子,约束装置,外壳材料,食物和水提供给适当的动物。只使用无菌,一次性针头注射和采血。无菌技术是准备移植的过程中是至关重要的。
1.受体小鼠制备方法
- 识别耳谷(或由当地动物伦理委员会批准8其他方式)受体小鼠,使一段时间外周血和骨髓重建的个别跟进。权衡移植后的后续老鼠。我们Ë受体小鼠是周7和12岁之间(低于25克)。
注:在提供的示例,CD45.1 + CD45.2 +受体小鼠在内部通过杂交C57BL / 6小鼠与同类B6.SJL小鼠繁殖。 - 照射受体小鼠与两种剂量450拉德的摧毁造血活性。给首次剂量移植前一天和移植前第二1-2小时。
注:X射线或γ射线既可以根据适当的设施的可用性使用。
2.捐助者和竞争对手骨髓细胞的制备
- 安乐死供体(测试和控制; CD45.2 +)和竞争对手(CD45.1 +; B6.SJL)用CO 2窒息颈椎脱位或使用由当地动物伦理委员会批准的方法老鼠。
- 将老鼠在他们的后面,双腿大开,在一个空的培养皿或者在无菌纱布(保持工作表面清洁)我nside生物安全柜。湿润的皮肤和毛皮用70%乙醇/ 30%H 2 O(V / V)。
- 切断脚用手术刀片或锋利的剪刀。切开沿腿部皮肤,并使用锯齿钳抽离皮肤。切掉多余的肌肉。
- 通过拉动腿骨和使用针对骨盆作为反力剪刀片脱臼股骨。胫骨分离,并从膝盖骨和股骨肌肉去除和肌腱的其余位。放置在2-3毫升无菌磷酸盐缓冲盐水(PBS)的骨头在6孔组织培养板。
- 通过用5ml冲洗骨头无菌PBS收集骨髓细胞。
- 用镊子轻轻握住骨和插入附连到填充1ml注射器到骨的一端的地下25针。按下柱塞和收集细胞在15ml锥形管中。根据需要,直到骨的中心是白色的重复。
- 通过反复穿过针以解离细胞得到单细胞悬浮液。避免气泡和多余的力量。注意:使用一个稍大针(22 G)的在此步骤,以改善细胞生存力。
- 通过细胞通过70微米尼龙过滤器,以保证均匀细胞悬液,以消除碎片和团块。
- 对于使用血球细胞计数移除等分试样。离心剩余的细胞悬浮液在200×g离心在4℃下5分钟。调整细胞密度为在无菌PBS(10 8个细胞/ ml)所需的。置于冰上细胞。
(三)建立供体细胞HSC当量
- 转移3×10 6个细胞(30微升)的等效到5ml的圆进行流式细胞染色底聚苯乙烯管。加未标记的抗体的等体积的抗CD16 / CD32的阻断非特异性染色(在染色缓冲液中稀释(PBS补充有0.1%牛血清白蛋白(BSA)和1mM EDTA)中进行2.5微克/毫升的最终浓度)。孵育在RT 5分钟。
- 在添加染色缓冲液90微升荧光标记的抗体预混:生物素天堂鸡尾酒(B220,CD3e,CD11b的,GR1,TER119),SCA1,CD117,CD135,CD150。在冰上孵育30分钟,避光。
注意:适当的稀释应该每批抗体来确定。见材料的表在本研究中使用的稀释液。 - 加2ml染色缓冲液至细胞,涡旋并离心,在200×g离心5分钟,在4℃以除去未结合的抗体。轻弹倒出上清,重新悬浮颗粒。
- 在添加染色缓冲液稀释10微升荧光标记的链霉(见材料表 )。在冰上孵育20分钟,避光。在步骤3.3冲洗,以除去未结合的链霉。
- 获得使用流式细胞仪具有至少六个检测器9中的细胞样品。确定林的频率- SCA1 + CD117 + CD135 - CD150 +细胞(估计的HSCs)使用分析模板每个样本在图2中所示和如先前报道10,11。
注意:功能的造血干细胞群体内的频率可以1/3和1/5 2,12之间进行估计。 - 建立估计的HSC当量所有样品11,使用一个样本(通常为竞争者,B6.SJL CD45.1 +在本实施例),为基线,如下,并在图2详细说明。
- 计算使用下列公式所需的细胞数目:
#transplanted造血干细胞/收件人= 5×10 5个单元×估计的HSC频(作为确定基线样品;该数通常为125之间75和野生型C57BL / 6小鼠)10-12。
注意:在图2中,对于样品A,结果是139的HSC。
总#移植细胞(对于其它样品;在图2中如样品B)=#反种植造血干细胞/ HSC频率。
注意:在图2中,对于样品B,结果是197826(或约2×10 5)的总的骨髓细胞。
- 计算使用下列公式所需的细胞数目:
- 计算每个移植受体需要使用上述获得的结果各样品的细胞的总数。
注意:该数量应该是5×10 5的基线样品(竞争者)。- 乘以受体小鼠的数量从步骤3.7中得到的数,并添加足够的细胞对于至少两个额外的小鼠,以补偿在注射器中的死体积。
- 混合竞争者( 例如 ,CD45.1 +)和试验细胞(CD45.2 +)的1:1的HSC当量比在步骤3.6计算并调整为每次注射200μl的用无菌PBS的终体积。
注意:对于一个五组的受体小鼠的建议的容积将因此是至少为1.4毫升,含有3.5×10 6个竞争者的骨髓细胞(或973估计的HSC用于图2样品A),和测试电池的当量数(在图2中 ,相当于样品B将是197826×7 = 1384782骨髓细胞)。
4.骨髓移植
- 预热在步骤1.2照射红色热灯的受体小鼠以确保扩张血管和使侧面尾静脉更加明显。
- 制备配有27克针(或更小)1毫升结核菌素注射器。抽吸约750微升制备的细胞悬浮液(3受体小鼠)。确保有注射器没有气泡。
- 将鼠标变成束缚设备。检查尾部并查找侧面尾静脉中,应该是在尾部两侧清晰可见。擦拭注射部位用乙醇。将针头斜面向上,平行于皮肤,轻轻按压活塞。注射应该很容易。如果力量再quired,针是不是在静脉内。
注:年纪较大的老鼠有皮肤较厚,这可能使寻找静脉更加困难。如果针不处于静脉,重新插入针近端到初始注射部位。 - 取出针并按下注射部位用无菌纱布数秒止血。转移鼠标到一个干净的笼子里。
注意:使用相同的注射器和针头注射三次,在这之后将针可能会变得过于迟钝。 - 对移植后的随访中,注射1毫升无菌PBS皮下再水合的小鼠的前五天。添加抗生素饮水,以防止感染(如果需要的话;可选)。称重小鼠每两至三天的第三周安乐死已经失去多于15%-20%的移植前体重(或由当地动物伦理委员会确定的)的小鼠。
5.外周血分析
- 收集一滴血(一pprox。 50-100微升)到EDTA管。
- 从下颌静脉采集血液,使用柳叶刀或22克针头刺破附近位于颌骨下的无毛斑面部皮肤,然后将收集管接收的血液13下降。移植后4,8,12和16周收集血液遵循多谱系重建。
- 加入1ml新鲜制备的RT红细胞裂解缓冲液(9份的0.16M 氯化铵 + 1份为0.17μm的Tris-HCl pH值7.65),以血液中步骤5.1.1收集到的下降。混合和转移样品5ml的适合流式细胞仪圆底聚苯乙烯管。静置在RT 4分钟。
- 加入4倍体积的冰冷的PBS。通过转动端到端混合,并立即在冰上转移。在4℃下200 XG离心10分钟。
- 轻弹倒出上清,重新悬浮颗粒。上清应明确和红色。加2ml染色缓冲液,涡旋简要介绍。在200 XGA离心5分钟ŧ4℃。
- 轻弹倒出上清,重新悬浮颗粒。
- CD45.1,CD45.2,CD3e,CD19,GR1:流式细胞仪使用步骤3.1至3.3详述的通用协议染色和在主结构下面的抗体进行。
- 获得使用流式细胞仪具有至少六个检测器9中的细胞样品。确定用于使用图3中所提供的分析模板每个样品中每个谱系(CD19 + B淋巴细胞,CD3e + T淋巴细胞,GR1 光亮粒细胞)和公布10,11-供体来源的细胞的频率。
6.骨髓重建分析
- 采集骨髓细胞作为第2节中详细染色流式细胞仪分析,利用在步骤3.1至3.3的详细协议一般为预混细胞和抗体如下:天堂鸡尾酒,SCA1,CD117,CD135,CD150,CD45.1 ,CD45.2。检测林使用荧光标记的链霉亲和如在步骤3.4中所述EAGE鸡尾酒抗体。
- 获得使用流式细胞仪具有至少八个检测器9细胞样品。如果只有六个可用,添加CD135到相同的信道作为谱系面板CD135 +细胞将被排除。确定供体衍生的林的频率- SCA1 + CD117 + CD135 - CD150 +造血干细胞使用图4和公布10所提供的分析模板的每个样本。
结果
竞争移植设置,包括继发性移植(下面进一步讨论)的一般说明可以在图1中找到。用于移植前的骨髓造血干细胞的代表性分析可以在图2中可以找到更详细的信息,双峰的排斥和死细胞可以在其他地方找到9。
图3和4为外周血和骨髓分别提供流式细胞分析的模板的示例,。这是正常的,以检测某些主机T淋巴细胞(直至所有T细胞的20%; 图3B),如T细胞是更无线电抗性。竞争者来源的细胞应该是存在于所有三个谱系。检测极限取决于分析获得的总细胞的数量很多,但根据我们的经验,总内20个细胞的单白细胞门通常就足够了。使用1%或0.5%的任意的阈值,如果供体细胞表示(如在图3所示的B淋巴,T淋巴或骨髓)高于在任何特定谱系的截止比例较低,鼠标不被认为是阳性的多向重构。当竞争移植用有限稀释测定法组合如在讨论中说明的量化施主的HSCs这一概念就变得很重要。这当然是可能的有,例如,供体来源的T和B淋巴细胞,但骨髓细胞,这通常会建议仅短暂重构的逐渐丧失。淋巴细胞有较长的半衰期比骨髓细胞(特别是Gr1hi SSChi粒/嗜中性粒细胞),并且可以甚至在不存在骨髓的造血干细胞10持续存在。
图5描绘了对于不同的原位下外周血嵌合代表性结果ations。当供体造血干细胞在功能上等同于竞争者的细胞,给体(CD45.2 +)和竞争剂(CD45.1 +)的比例衍生细胞是当量( 图5A)。在图5A和5B中的残留宿主细胞(CD45.1 + CD45.2 +)几乎完全的T淋巴细胞,因为它们是更无线电抗性。当供体细胞呈现外周血白细胞( 图5B)低得多的比例,HSC功能的某些方面可能出现故障并在讨论中描述的还需要进一步研究。竞争者细胞的存在证实了该测定的工作很好,但供体骨髓只是不太有效。这是相对于在图5C中 ,其中两个供体和竞争对手细胞存在于低数量和宿主细胞代表了大多数外周血细胞的呈现的结果。在这种情况下,移植失败和我t是不可能得出任何结论,供体与竞细胞的相对功能。不同的解决方案将在下面进一步讨论。

图 1. 实验设计 ( 一 )具有竞争力的移植,供体小鼠骨髓细胞(CD45.2 +; C57BL6背景,控制和测试)和同类竞争对手的小鼠(CD45.1 +; B6.SJL)的混合以1:1的比例,并注入照射受体小鼠的尾静脉中(CD45.1 + CD45.2 +; C57BL6的F1代点¯xB6.SJL育种对)。骨髓重建的效力外周血(PB)4,8,12和16周,移植后,并在16周后移植或更高的骨髓来确定。 (B)为了进一步评价移植细胞的自我更新,盂兰盆16周后,从移植回收ë骨髓细胞可以转移到照射辅助受体小鼠。 HSC,造血干细胞; MPP,多能祖细胞; LMPP,淋巴引MPP。 请点击此处查看该图的放大版本。
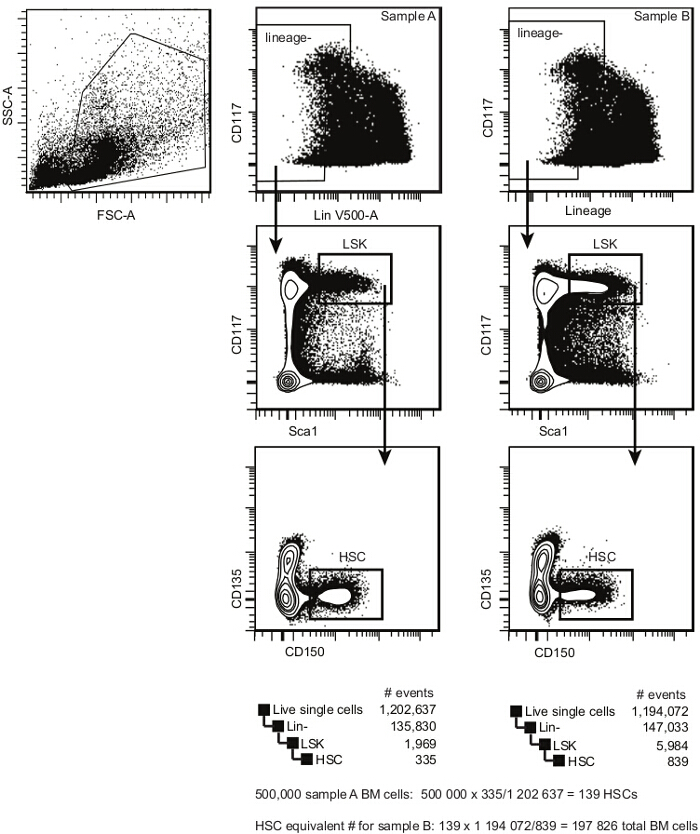
图2. 预移植骨髓造血干细胞的分析模板。在单细胞,根据CKIT(CD117)和世袭表达选择骨髓干细胞。在林暗淡/ -细胞群中,选择CKIT 明亮 SCA1 +人口(LSK)。在LSKs,选择CD150 + CD135 -造血干细胞。这一人群包含长期和短期再植的HSC(一个再植细胞的频率范围内这一人群是是吐温1/3和1/5)。骨髓造血干细胞的估计频率是由单个细胞中的门事件的数量除以在HSC门事件的数量计算。 请点击此处查看该图的放大版本。
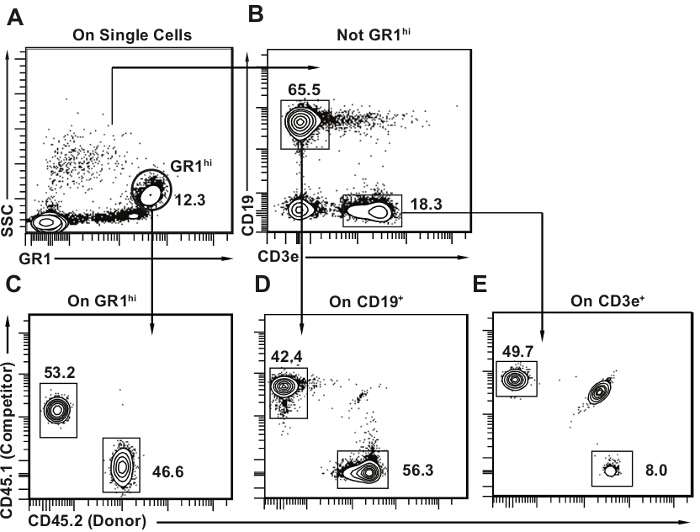
图3.移植后外周血分析模板。(A)在单细胞,首先选择GR1 明亮 SSC 喜粒细胞。 (B),然后选择CD19 + CD3e - B淋巴细胞和CD3e + CD19 - T淋巴细胞。小鼠外周血中含有淋巴细胞的相当大的比例,与B淋巴细胞是主要的细胞类型(约50%的所有的外周血细胞)。 CE)绘制2D流式细胞仪地块与CD4每个子集5.2一轴CD45.1另一方。确定供体(CD45.2 +),主机(CD45.1 + CD45.2 +)和竞争对手的细胞(CD45.1 +)每个谱系,如图所示。这是正常的,有一些剩余的宿主细胞,尤其是T淋巴细胞人口看到面板E. 请点击此处查看该图的放大版本。
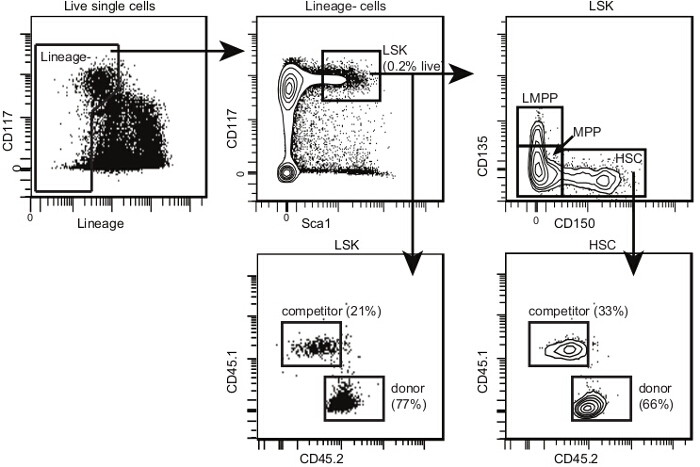
图4. 移植后的骨髓造血干细胞的分析模板。在单细胞,选择和骨髓干细胞作为LSKs所示图2.在LSKs,选择CD150 + CD135-造血干细胞,CD150- CD135-多能祖细胞(或边际产量)和CD150- CD135 +淋巴-primed的MPP(或LMPPs)。 LMPPs的比例比在非照射小鼠移植后更低。绘制2D流Çytometry地皮上的其他一轴CD45.1与CD45.2每个子集。确定捐助,主机和竞争对手的细胞亚群的每个如图所示。如果照射和移植是成功的,应该有极少数剩余的主机骨髓干细胞。 请点击此处查看该图的放大版本。
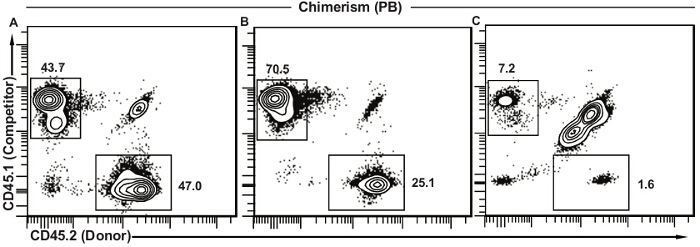
图5.代表性的成果外周血嵌合体。(A)成功移植,其中造血干细胞供者在功能上等同于竞争对手的细胞。绝大多数剩余的宿主细胞(CD45.1 + CD45.2 +)一般是T淋巴细胞。 (B)成功移植,其中造血干细胞捐赠者秀相比竞争对手的细胞功能下降。这种贡献下降可能是由于将需要几个不同的因素,并进一步分析(见讨论)。 (C)移植不成功既竞争和供体细胞和剩余的宿主细胞有很大一部分的低频。这种类型的搜索结果显示比照射预期剂量低,不成功注射液(尾静脉以外的细胞活力下降,减少注射量,注射),或它们的组合。 请点击此处查看该图的放大版本。
讨论
这里所描述的协议被设计来评估针对已知竞争对手的HSCs给体(试验)造血干细胞的相对健康。竞争的情况增加了测定的相对灵敏度(更可能检测到在干细胞的健身中度减少),并提供了照射和喷射的功效的内部技术控制。然而,它不应该被用作HSC健身的绝对值衡量在竞争性重建的下降并不意味着,在没有竞争的造血干细胞不会表现良好。虽然可以说,有竞争力的设置是更好的起点,作为竞争对手的细胞会拯救缺陷的HSC功能,所有受体小鼠会生存,人们应该小心与结果的解释。确认在非竞争性设置结果将固化的结论。
这里介绍的实验设计采用HSC相当于曲总骨髓细胞antities代替流式细胞-sorted HSC的纯群体。它以均衡的造血干细胞的数目在所有群体进行研究(不同供体,竞争者),以消除不同供体之间的变异性,并确保在表型HSC的频率变化不会在HSC功能14被解释为改变是重要的。这里描述过的纯化的HSCs该方法的优点是:改善细胞存活率由于缩短处理时间和排序期间缺乏外部压力;和改进的归巢到收件人骨髓(抗体对分选的细胞的存在可与它们在骨髓15植入干扰)。相反,主要的缺点是非HSC种群的贡献给移植的结果,特别是短命的祖细胞在早期时间点移植后的作用。此外,如果在治疗或遗传修饰改变面传热的表达用于造血干细胞16的选择ë标记,有可能是造血干细胞的一个显著数"的化身"一个样品中,但不是在另一个,这将偏压的结果。然而,也可以使用纯化的HSCs,是固有的移植试验时发生同样的问题。
使用本协议所得到的结果是只有在群体水平上的定性。换句话说,移植后供体细胞的降低的贡献可能是由于;在起动人口官能HSC的一个较小的数字;个体HSC的一个能力减弱沉降进入骨髓,并在移植后的第几天和几周扩大;或具有分化和生长成在外围用于检测的成熟细胞的问题。以不从孤立一个竞争移植使用的结果,但将它们与将测量细胞增殖,存活和分化选自H测定补充它是重要的SC到循环血细胞。同样重要的是要比较的外周血( 图3)和骨髓( 图4)之间供体细胞贡献于骨髓与缺少外周血供体细胞的结合供体来源的造血干细胞的存在将指示一个分化块的。虽然在实施例中未示出,但也可以根据GPI1 17的不同同种型,以评估红细胞重构。鉴于大量存在于血液中的红细胞,它们代表检测的供体来源的细胞,移植造血干细胞的数目低或过长时间以下它们的输出时,它可以是特别有用的一高度敏感的方法。在光谱的另一端,骨髓细胞往往首先向其失败被检测,这部分是因为外周血,部分是因为它们的短半衰期的其低频率的。
能够适应第È竞争的再增殖测定中使用的有限稀释测定法(或LDA),以允许造血干细胞的定量。这将需要的受体小鼠分成其中每一个组接收竞争者的一个不同比率的几个不同的基团的数量大得多:要么排序或未排序如上所述供体细胞。作为供体细胞的数量减少,将有更多的小鼠,其中供体来源的细胞的比例不在一个或几个谱系达到预先建立的阈值。然后可以绘制每组的"负"小鼠对抗移植供体细胞的数目的频率,并确定从随后图形18,19 HSC的频率。
移植后的后续的建议的持续时间在文献中有所不同。过去有一定的共识,其中16周移植后的期间被认为是足够的,以反映长期造血干细胞的输出。但是,"我最近的报告ntermediate"造血干细胞的功能下降后不久16周都强调需要对HSC功能17,甚至更严格的评估。这当然是可以延长移植受者的随访过去16周的时间点,以满足这些问题。一个替代方案,具有可以说是高灵敏度一次以上,是次级移植( 图1B),其中,从第一移植回收被注入到照射次级接受者的骨髓细胞,第二移植提出对造血干细胞的其他增殖性压力,迫使它们的出口从休眠和只允许具有强大的自我更新的细胞以保持它们的输出。有时优选使用排序供体细胞,以更好地调整不同样品之间的HSC数字为次级移植。可替代地,有可能建立供体的估计的比率:从主骨髓造血干细胞的竞争对手( 例如, 图4),然后比较次要移植到比供体细胞的输出。此外,还必须增加移植总骨髓细胞的数量,如在移植后的骨髓功能的造血干细胞的频率永远不会到达在非照射小鼠看到的数字。最好是从多个主收件人汇集骨髓注入每总收件人二次一十月5日至10日百万个细胞。
如上所述,存在用于为什么施主HSC的一个给定的群体可能显示许多原因长期重建能力下降。一个这样的原因是造血干细胞迁移到骨髓移植(也称为归巢)之后和定居本身在骨髓龛的能力。能够适应这里提出来调查骨髓归巢和短期扩张的协议。有必要提高移植细胞(5,000-10,000造血干细胞的当量数归巢测定和移植后的第一个星期内1000-2000造血干细胞以进行分析)。在归巢测定中,接受者小鼠移植后的第16-24小时,并已达到骨髓如在本协议解释确定供体造血干细胞的数量内安乐死。为了进一步评估它们的功能,从短期收件人回收骨髓细胞可以如在图1B中说明的被移植到次要接收者。在二次收件人供体来源的细胞的比例可以被用来评价施主造血干细胞的迁移和沉降到受体骨髓的能力。
与竞争性骨髓移植的主要问题来自照射和注射产生和提出自己作为提高移植后的死亡率要么或降低重建效率。分散剂量的照射下,如这里提出,通常与更高效myeloablation相关联,并且相比单剂量20更少的毒性。与剂量这里推荐(两次450拉德),髓系和B系种群被有效地删除,但剩余的T淋巴细胞做保持( 图3)。如果有任何理由怀疑移植排斥(从不同的遗传背景供体和受体小鼠),较高剂量的照射(两种剂量的550-600拉德)和两种剂量之间的较短的延迟(4小时,而不是在第二天)应该有助于消除残余T淋巴细胞和减少因排斥移植失败的可能性。不正确注射或注射到血管周围空间,而不是的尾静脉,样品制备过程中,由于缺乏护理问题施主细胞活力,或供体细胞污染也将增加移植物衰竭和移植后的死亡率。低效照射(由于技术问题,例如),将导致降低重建效率,但不应该增加莫rtality。在所有的这些情况下,竞争者细胞在测定中存在有助于解离技术问题从供体HSC功能善意减少(如这里详细说明)作为竞争者细胞应该总是能够重建照射收件人。免疫缺陷宿主也可使用,例如,以减少对照射和/或移植物排斥的风险的需要,并且评估人类造血干细胞21-23的功能。
总之,我们在这里提出有竞争力的移植协议可以适于多种不同的用途如在讨论中详细说明。我们的方法采用HSC等同物,可减少处理时间相比,细胞分选时,在移植同时改善细胞活力。它也是一个实际的解决方案时,获得了细胞分选仪是有限的,并与定量的LDA测定时,使之成为有吸引力的起点HSC功能的分析需要更少的小鼠。
披露声明
The authors declare that they have no competing financial interests.
致谢
我们感谢Roxann河图洛书,阿尔布尔与手续的人物设计和演示服务。研究实验室是由从科尔基金会转型奖的支持下,发现不授予。 419226-2012从加拿大自然科学和(NSERC)工程研究理事会和加拿大创新基金会(CFI领袖基金批准号:31377)。 KMH是Chercheur-布西尔少年的全宗德RECHERCHE魁北克 - 桑特(FRQS)。
材料
| Name | Company | Catalog Number | Comments |
| Microtainer tubes with K2EDTA | BD Biosciences | 365974 | |
| 20 G needle | BD Syringe | For blood sampling from the mandibular vein | |
| LabQuake Shaker rotisserie | Thermo Scientific | C415110 | |
| Purified anti-mouse CD16/CD32 (clone 2.4G2, Fc Block) | BD Biosciences | 553142 | 2.50 μg/ml |
| Pe-Cy7-conjugated anti-mouse CD3e (clone 145-2C11) | eBioscience | 25-0031 | 0.25 μg/ml |
| PE-conjugated anti-mouse CD19 (clone 1D3) | eBioscience | 12-0193 | 0.25 μg/ml |
| APC-eFluor780 (APC-Cy7 equivalent)-conjugated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 47-5931 | 0.25 μg/ml |
| FITC-conjugate anti-mouse CD45.1 (clone A20) | eBioscience | 11-0453 | 2.50 μg/ml |
| eFluor450-conjugated anti-mouse CD45.2 (clone 104) | eBioscience | 48-0454 | 1.00 μg/ml |
| Biotinylated anti-human/mouse CD45R (B220) (clone RA3-6B2) | eBioscience | 13-0452 | 1.25 μg/ml |
| Biotinylated anti-mouse CD3e (clone 145-2C11) | eBioscience | 13-0031 | 1.25 μg/ml |
| Biotinylated anti-mouse CD11b (clone M1/70) | eBioscience | 13-0112 | 1.25 μg/ml |
| Biotinylated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 13-5931 | 1.25 μg/ml |
| Biotinylated anti-mouse TER119 (clone TER119) | eBioscience | 13-5921 | 0.625 μg/ml |
| V500 streptavidin | BD Biosciences | 56149 | 0.5 μg/ml |
| PE-conjugated anti-mouse CD117 (clone 2B8) | BD Biosciences | 553355 | 0.25 μg/ml |
| PE-Cy7-conjugated anti-mouse Ly6A/E (Sca1) (clone D7) | BD Biosciences | 558162 | 0.25 μg/ml |
| PerCP-eFluor710-conjugated anti-mouse CD135 (clone A2F10) | eBioscience | 46-1351 | 0.5 μg/ml |
| Alexa fluor 647-conjugated anti-mouse CD150 (clone TC15-12F12.2) | Biolegend | 115918 | 0.625 μg/ml BD Biosciences and eBioscience do not carry the same clone |
| 1 ml tuberculin syringe with 27 G needle | BD Syringe | 309623 | |
| 1 ml tuberculin syringe with 25 G needle | BD Syringe | 309626 | |
| 70 μm cell strainer | BD Falcon | 352350 |
参考文献
- Li, H. W., Sykes, M. Emerging concepts in haematopoietic cell transplantation. Nat Rev Immunol. 12 (6), 403-416 (2012).
- Kiel, M. J., Yilmaz, O. H., Iwashita, T., Terhorst, C., Morrison, S. J. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Kim, I., He, S., Yilmaz, O. H., Kiel, M. J., Morrison, S. J. Enhanced purification of fetal liver hematopoietic stem cells using SLAM family receptors. Blood. 108 (2), 737-744 (2006).
- Mayle, A., Luo, M., Jeong, M., Goodell, M. A. Flow cytometry analysis of murine hematopoietic stem cells. Cytometry A. 83 (1), 27-37 (2013).
- Rossi, L., et al. Less Is More: Unveiling the Functional Core of Hematopoietic Stem Cells through Knockout Mice. Cell Stem Cell. 11 (3), 302-317 (2012).
- Till, J. E., McCulloch, E. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat Res. 14, 213-222 (1961).
- Shen, F. W., et al. Cloning of Ly-5 cDNA. Proc Natl Acad Sci U S A. 82 (21), 7360-7363 (1985).
- Identification of GM mice. Laboratory Animals. 37 (suppl 1), 33-35 (2003).
- Rundberg Nilsson, A., Bryder, D., Pronk, C. J. H. Frequency determination of rare populations by flow cytometry: A hematopoietic stem cell perspective. Cytometry Part A. 83A (8), 721-727 (2013).
- Abidin, B. M., Owusu Kwarteng, E., Heinonen, K. M. Frizzled-6 Regulates Hematopoietic Stem/Progenitor Cell Survival and Self-Renewal. J Immunol. 195 (5), 2168-2176 (2015).
- Heinonen, K. M., Vanegas, J. R., Lew, D., Krosl, J., Perreault, C. Wnt4 enhances murine hematopoietic progenitor cell expansion through a planar cell polarity-like pathway. PLoS One. 6 (4), e19279(2011).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34 (9), 39-43 (2005).
- Santaguida, M., et al. JunB protects against myeloid malignancies by limiting hematopoietic stem cell proliferation and differentiation without affecting self-renewal. Cancer Cell. 15 (4), 341-352 (2009).
- Czechowicz, A., Kraft, D., Weissman, I. L., Bhattacharya, D. Efficient transplantation via antibody-based clearance of hematopoietic stem cell niches. Science. 318 (5854), 1296-1299 (2007).
- Zhang, C. C., Lodish, H. F. Murine hematopoietic stem cells change their surface phenotype during ex vivo expansion. Blood. 105 (11), 4314-4320 (2005).
- Benveniste, P., et al. Intermediate-Term Hematopoietic Stem Cells with Extended but Time-Limited Reconstitution Potential. Cell Stem Cell. 6 (1), 48-58 (2010).
- Fazekasde St Groth, B. The evaluation of limiting dilution assays. J Immunol Methods. 49 (2), R11-R23 (1982).
- Louis, I., Heinonen, K. M., Chagraoui, J., Vainio, S., Sauvageau, G., Perreault, C. The signaling protein Wnt4 enhances thymopoiesis and expands multipotent hematopoietic progenitors through beta-catenin-independent signaling. Immunity. 29 (1), 57-67 (2008).
- Cui, Y. Z., et al. Optimal protocol for total body irradiation for allogeneic bone marrow transplantation in mice. Bone Marrow Transplant. 30 (12), 843-849 (2002).
- Benz, C., et al. Hematopoietic Stem Cell Subtypes Expand Differentially during Development and Display Distinct Lymphopoietic Programs. Cell Stem Cell. 10 (3), 273-283 (2012).
- Eppert, K., et al. Stem cell gene expression programs influence clinical outcome in human leukemia. Nat Med. 17 (9), 1086-1093 (2011).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rgamma-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。