Method Article
Transplants concurrentiels pour l'évaluation des cellules souches hématopoïétiques de remise en forme
Dans cet article
Résumé
This protocol provides step-by-step guidelines for setting up competitive mouse bone marrow transplant experiments to study hematopoietic stem/progenitor cell function without prior purification of stem cells by cell sorting.
Résumé
The gold standard definition of a hematopoietic stem cell (HSC) is a cell that when transferred into an irradiated recipient will have the ability to reestablish blood cell production for the lifespan of the recipient. This protocol explains how to set up a functional assay to compare the HSC capacities of two different populations of cells, such as bone marrow from mice of two different genotypes, and how to analyze the recipient mice by flow cytometry. The protocol uses HSC equivalents rather than cell sorting for standardization and discusses the advantages and disadvantages of both approaches. We further discuss different variations to the basic protocol, including serial transplants, limiting dilution assays, homing assays and non-competitive transplants, including the advantages and preferred uses of these varied approaches. These assays are central for the study of HSC function and could be used not only for the investigation of fundamental HSC intrinsic aspects of biology but also for the development of preclinical assays for bone marrow transplant and HSC expansion in culture.
Introduction
Hématopoïèse est un processus de régénération qui assure la reconstitution des cellules sanguines qui ont été perdus à cause de blessures, le rayonnement et la mort cellulaire. Ce procédé est assurée par des cellules souches hématopoïétiques (HSC) qui résident en grande partie dans la moelle osseuse adulte. En outre, les cellules souches hématopoïétiques peuvent être utilisées à des fins thérapeutiques dans les maladies auto - immunes, des affections malignes hématologiques et de déficiences immunitaires 1. Il est donc nécessaire de mieux comprendre les mécanismes qui régulent la fonction HSC, y compris leur expansion proliférative et leur capacité à atteindre et engraft l'os receveur après la greffe osseuse. Bien que des études récentes ont rapporté plusieurs marqueurs de surface cellulaire, y compris les membres de la famille SLAM CD150 et CD48, pour enrichir prospectivement CSH adultes et CSH fœtales à environ 50% de pureté 2-4, la mesure standard d'or pour CSH fonctionnelle reste un test repeupler in vivo déterminer leur capacité à rétablir le sang cproduction ell dans un hôte irradié 5.
L'essai de repopulation clonale in vivo a été initialement développé par Till et McCulloch 6 et a depuis été affiné et étendu. Comme défini à l'origine, les CSH assurer la production de cellules sanguines à vie grâce à l'auto-renouvellement et la différenciation. Le transfert de CSH dans un destinataire irradié nous permet donc d'évaluer: leur capacité à se différencier grâce à l'analyse des différentes lignées de cellules sanguines (lymphocytes T, les lymphocytes B, les granulocytes, les monocytes) et leur capacité d'auto-renouvellement par la transplantation de série. L'essai devrait normalement impliquer la comparaison de la fonctionnalité et / ou de la quantité de deux populations de CSH, par exemple, les cellules provenant de deux souris de différents génotypes ou des cellules qui ont été traitées ou non traitées avec différents facteurs qui pourraient influer sur le maintien ou l' expansion de CSH en culture. chimérisme du donneur, ou la contribution des donateurs transférés CSH to la production de cellules sanguines peut alors être déterminée par analyse par cytométrie de flux dans le sang périphérique et la moelle osseuse en utilisant des marqueurs de surface cellulaire ou d'autres méthodes qui permet de distinguer les cellules du donneur dans le receveur, ou l'hôte. Les marqueurs les plus utilisés sont certainement les deux allèles du gène PTPRC ou de l' antigène CD45 leucocytaire 7 que nous avons choisi pour les exemples fournis ci - dessous.
L'essai de repopulation clonale peut être soit concurrentiel ou non concurrentiel. Dans un contexte non compétitif, CQH de contrôle et de test sont transférés dans des souris receveuses distinctes et les résultats pour chaque type de cellule est indépendant de l'autre. Dans un contexte concurrentiel, la fonction des deux essais et de contrôle CSH est mesuré par rapport à une population de concurrent CSH. Le protocole décrit ici utilise le paramètre concurrentiel, mais peut également être adapté pour les situations non concurrentielles. Les deux approches ont leurs avantages et leurs limites, et nous allons les comparer en détail dans lediscussion. Nous décrivons également des approches différentes pour assurer l'équité dans le nombre de transplantés CSH, expliquer comment adapter le dosage pour la quantification des CSH en limitant essai de dilution (LDA), et de fournir des exemples des deux greffes réussies ou non pour l'interprétation des résultats.
Protocole
Toutes les procédures décrites dans le présent protocole ont été approuvés par le comité institutionnel de l'éthique animale et de suivre le Conseil canadien sur les lignes directrices de protection des animaux.
Note: Pour maintenir des conditions stériles / spécifiques exempts d'agents pathogènes logement, effectuer toutes les procédures impliquant la manipulation directe des souris vivantes à l'intérieur d'une enceinte de sécurité biologique ou une hotte à flux laminaire. Nettoyer ou stériliser les cages, les dispositifs de retenue, matériaux de construction, chow et de l'eau fournie aux animaux de manière appropriée. Utilisez, aiguilles jetables seulement stériles pour les injections et pour le prélèvement sanguin. La technique aseptique est crucial lors de la préparation de la greffe.
1. Préparation des souris receveuses
- Identifier les souris receveuses avec des encoches de l' oreille (ou toute autre méthode approuvée par le comité d'éthique animale locale 8) pour permettre suivi individuel de sang et de moelle osseuse reconstitution périphérique au fil du temps. Peser la souris pour le post-transplantation suivi. Nousbénéficiaires souris e qui sont âgés entre 7 et 12 semaines (moins de 25 g).
Remarque: Dans l'exemple fourni, les souris receveuses CD45.1 + CD45.2 + ont été élevés dans la maison en traversant C57BL / 6 souris avec des souris B6.SJL congéniques. - Irradiation souris receveuses avec deux doses de 450 rad pour détruire l'activité hématopoïétique. Donner la première dose le jour avant la transplantation et la seconde 1-2 heures avant la transplantation.
Remarque: les rayons X ou gamma-ray peuvent tous deux être utilisés en fonction de la disponibilité des installations appropriées.
2. Préparation des donateurs et des concurrents des cellules de moelle osseuse
- Euthanasier donneur (test et de contrôle; CD45.2 +) et concurrent (CD45.1 +; B6.SJL) souris par asphyxie au CO2 suivie par dislocation cervicale ou à l' aide de méthodes approuvées par le comité d'éthique animale locale.
- Placez la souris sur leur dos, les jambes grandes ouvertes, dans une boîte de Pétri vide ou sur une gaze stérile (pour garder la surface de travail propre) iNside une enceinte de sécurité biologique. Mouiller la peau et de la fourrure avec 70% d' éthanol / 30% H 2 O (v / v).
- Coupez le pied avec une lame chirurgicale ou des ciseaux pointus. Découper la peau le long de la jambe et se détacher de la peau à l'aide de pinces dentelées. Coupez l'excès de muscle.
- Disloquer fémur en tirant sur l'os de la jambe et à l'aide lames de ciseaux contre les os du bassin comme une force contre. Détachez tibia et du fémur de la rotule et retirer bits restants du muscle et les tendons. Placez les os dans 2-3 ml stérile tampon phosphate salin (PBS) dans une plaque de culture de tissus à 6 puits.
- Recueillir les cellules de la moelle osseuse en rinçant les os avec 5 ml de PBS stérile.
- Maintenir l'os doucement avec des forceps et insérer une aiguille de 25 G attachée à une seringue de 1 ml rempli à une extrémité de l'os. Appuyez sur le piston et recueillir les cellules dans un tube de 15 ml conique. Répéter au besoin jusqu'à ce que le centre de l'os est blanc.
- Dissocier les cellules par passage répété à travers l'aiguille àobtenir une suspension cellulaire unique. Éviter les bulles et une force excessive. Remarque: Utilisez une aiguille légèrement plus grand (22 G) pour améliorer la viabilité des cellules à cette étape.
- Passez les cellules à travers un tamis en nylon de 70 pm pour assurer la suspension cellulaire uniforme et pour éliminer les débris et les grumeaux.
- Retirer une aliquote pour le comptage des cellules en utilisant un hémocytomètre. Centrifuger la suspension cellulaire restante à 200 xg pendant 5 min à 4 ° C. Réajuster la densité cellulaire comme requis dans du PBS stérile (10 8 cellules / ml). Gardez les cellules sur la glace.
3. L'établissement d'équivalents HSC cellulaires des donateurs
- Transférer l'équivalent de 3 x 10 6 cellules (30 ul) dans 5 ml tube rond en polystyrène de fond pour la coloration par cytométrie en flux. Ajouter un volume égal d'anticorps non marqué contre le CD16 / CD32 pour bloquer la coloration non spécifique (dilué dans du tampon de coloration (PBS additionné de 0,1% d'albumine de sérum bovin (BSA) et 1 mM d'EDTA) pour obtenir une concentration finale de 2,5 pg / ml). Incuber 5 min à température ambiante.
- Ajouter 90 ul mélange maître d'anticorps conjugué à un fluorochrome préparé dans un tampon de coloration: cocktail Lineage biotinylé (B220, CD3e, CD11b, GR1, Ter119), Sca1, CD117, CD135, CD150. Incuber sur la glace pendant 30 min, à l'abri de la lumière.
Note: Des dilutions appropriées doivent être déterminées pour chaque lot d'anticorps. Voir le tableau des matériaux pour les dilutions utilisées dans cette étude. - Ajouter 2 ml tampon de coloration à cellules, vortex et centrifuger à 200 g pendant 5 min à 4 ° C pour éliminer l'anticorps non lié. Décanter le surnageant et remettre le culot en tapotant.
- Ajouter 10 ul fluorochrome conjugué streptavidine dilué dans du tampon de coloration (voir tableau des matériaux). Incuber sur la glace pendant 20 min, à l'abri de la lumière. Laver comme à l'étape 3.3 pour éliminer la streptavidine non liée.
- Acquérir des échantillons de cellules en utilisant un cytomètre de flux comportant au moins six détecteurs 9. Déterminer la fréquence de Lin - Sca1 + CD117 + CD135 - CD150 + cellules (estimation CSH) dans chaque échantillon en utilisant le modèle d'analyse présentés dans la figure 2 et comme précédemment rapporté 10,11.
Note: La fréquence des CSH fonctionnelles au sein de cette population peut être estimée entre 1/3 et 1/5 2,12. - Établir des équivalents HSC estimées pour tous les 11 échantillons, en utilisant un échantillon (typiquement, le compétiteur B6.SJL CD45.1 + dans cet exemple) sous forme de base comme indiqué ci - dessous et sur la figure 2.
- Calculer le nombre de cellules nécessaires en utilisant les formules suivantes:
#transplanted CSH / recipient = 5 x 10 5 cellules x fréquence HSC estimée (tel que déterminé pour l' échantillon de référence; ce nombre est généralement comprise entre 75 et 125 pour type sauvage C57BL / 6) 10-12.
Note: Dans la figure 2, pour l' échantillon A, le résultat est de 139 CQH.
cellules au total (n transplanté pour les autres échantillons, par exemple , l' échantillon B de la figure 2) = # transplanté fréquence CSH / HSC.
Note: Dans la figure 2, pour l' échantillon B, le résultat est 197826 (soit environ 2 x 10 5) des cellules totales de la moelle osseuse.
- Calculer le nombre de cellules nécessaires en utilisant les formules suivantes:
- Calculer les nombres totaux de cellules requises pour receveur de greffe pour chaque échantillon en utilisant les résultats obtenus ci-dessus.
Remarque: Ce nombre devrait être de 5 x 10 5 pour l'échantillon de référence (concurrent).- Multiplier le nombre obtenu à l'étape 3.7 par le nombre de souris receveuses et ajouter suffisamment de cellules pour au moins deux souris supplémentaires pour compenser le volume mort dans la seringue.
- Mélanger concurrent (par exemple, CD45.1 +) et les cellules de test (CD45.2 de +) en rapport 1: 1 équivalent HSC tel que calculé à l' étape 3.6 et ajuster le volume final de 200 pi par injection à l' aide de PBS stérile.
Remarque: Pour un groupe de cinq souris receveuses le volume proposé serait donc au moins 1,4 ml, contenant 3,5 x 10 cellules de moelle osseuse 6 concurrents (ou973 CQH estimés pour l' échantillon A de la figure 2), et le nombre équivalent de cellules de test (figure 2, l'équivalent pour l' échantillon B , il est 197,826 x 7 = 1,384,782 cellules de moelle osseuse).
4. Greffes de moelle osseuse
- Réchauffez les souris receveuses irradiées à l'étape 1.2 avec une lampe chauffante rouge pour assurer la dilatation des vaisseaux sanguins et de faire la queue latérale veines plus visibles.
- Préparer une seringue à tuberculine de 1 ml munie d'une aiguille 27 G (ou plus petit). Aspirer environ 750 ul de la suspension cellulaire préparée (pour les souris receveuses 3). Assurez-vous qu'il n'y a pas de bulles d'air dans la seringue.
- Insérez la souris dans un dispositif de retenue. Examinez la queue et chercher les veines caudales latérales qui doivent être clairement visibles sur les deux côtés de la queue. Essuyez le site d'injection avec de l'éthanol. Insérez l'aiguille biseau vers le haut, parallèlement à la peau et appuyez doucement sur le piston. L'injection doit être facile. Si la force est recessaires, l'aiguille se trouve pas dans la veine.
Remarque: les souris âgées ont une peau plus épaisse, ce qui peut permettre de trouver la veine plus difficile. Si l'aiguille est dans la veine, réinsérer l'extrémité proximale de l'aiguille au site d'injection. - Retirez l'aiguille et appuyez sur le site d'injection avec de la gaze stérile pendant quelques secondes pour arrêter le saignement. Transférer la souris dans une cage propre.
Remarque: Utilisez la même seringue et une aiguille pour trois injections, après quoi l'aiguille peut devenir trop terne. - Pour la post-transplantation suivi, injecter 1 ml sous-cutanée PBS stérile pour réhydrater la souris pour les cinq premiers jours. Ajouter des antibiotiques dans l'eau potable pour prévenir les infections (si nécessaire, en option). Peser les souris tous les deux à trois jours pour les trois premières semaines et euthanasier les souris qui ont perdu plus de 15-20% de leur poids corporel pré-transplantation (ou tel que déterminé par le comité d'éthique animale locale).
5. Analyse du sang périphérique
- Récupérer une goutte de sang (unpprox. 50-100 ul) dans des tubes EDTA.
- Pour recueillir le sang de la veine mandibulaire, utilisez une lancette ou une aiguille de 22 G pour percer la peau du visage près de l'endroit glabre situé sous la mâchoire et placer le tube collecteur pour recevoir la goutte de sang 13. Recueillir le sang à 4, 8, 12 et 16 semaines après la transplantation à suivre multi-lignée reconstitution.
- Ajouter 1 ml fraîchement préparée RT lyse des globules rouges tampon (9 parties 0,16 M NH4CI + 1 partie de 0,17 M de Tris-HCl , pH 7,65) à la goutte de sang recueilli dans l' étape 5.1.1. Mélanger l'échantillon et de transfert vers un 5 ml tube en polystyrène à fond rond adapté pour cytométrie en flux. Laisser reposer pendant 4 min à température ambiante.
- Ajouter 4 volumes de PBS glacé. Mélanger en mettant bout à bout et transférer immédiatement sur de la glace. Centrifugeuse 10 min à 200 xg à 4 ° C.
- Décanter le surnageant et remettre le culot en tapotant. Surnageant doit être clair et rouge. Ajouter 2 ml de coloration tampon et vortex brièvement. Centrifugeuse 5 min à 200 xgat 4 ° C.
- Décanter le surnageant et remettre le culot en tapotant.
- Procéder à la coloration de cytométrie de flux en utilisant le protocole général décrit dans les étapes 3.1 à 3.3 et les anticorps suivants pour le mélange maître: CD45.1, CD45.2, CD3e, CD19, GR1.
- Acquérir des échantillons de cellules en utilisant un cytomètre de flux comportant au moins six détecteurs 9. Déterminer la fréquence des cellules dérivées du donneur pour chaque lignée (lymphocytes B CD19 +, les lymphocytes T CD3e +, GR1 granulocytes lumineux) dans chaque échantillon en utilisant le modèle d'analyse présentée dans la figure 3 et que publiée 10,11.
6. Analyse de la moelle osseuse Reconstitution
- Recueillir les cellules de moelle osseuse comme décrit dans la section 2. Colorer les cellules pour cytométrie de flux utilisant le protocole général décrit dans les étapes 3.1 à 3.3 et les anticorps suivants pour le mélange maître: Lineage cocktail, Sca1, CD117, CD135, CD150, CD45.1 , CD45.2. Détecter linEAGE anticorps cocktail en utilisant fluorochrome conjugué streptavidine comme décrit à l'étape 3.4.
- Acquérir des échantillons de cellules en utilisant un cytomètre de flux comportant au moins huit détecteurs 9. Si seulement six sont disponibles, ajoutez CD135 sur le même canal que le panneau de la lignée que CD135 + cellules seront exclues. Déterminer la fréquence de Lin donateurs dérivés - Sca1 + CD117 + CD135 - CD150 + CSH dans chaque échantillon en utilisant le modèle d'analyse présentée dans la figure 4 et tel que publié 10.
Résultats
Une description générale de la mise en transplantation concurrentielle, y compris les greffes secondaires (voir plus loin) peut être trouvée dans la figure 1. Une analyse représentative pour l' os pré-greffe osseuse CSH peut être trouvée dans la figure 2. Des informations plus détaillées sur l'exclusion des doublets et les cellules mortes peuvent être trouvées ailleurs 9.
Les figures 3 et 4 donnent des exemples de cytométrie en flux des modèles d'analyse de sang périphérique et de moelle osseuse, respectivement. Il est normal de détecter certains lymphocytes T hôte (jusqu'à 20% des lymphocytes T; figure 3B), comme les lymphocytes T sont plus résistants à la radio. cellules des concurrents dérivés doivent être présents dans les trois lignées. La limite de détection dépend beaucoup du nombre de cellules totales acquises pour l'analyse, mais dans notre expérience un total de 20 mille cellules dans leporte leucocytaire unique est généralement suffisant. L' utilisation d' un seuil arbitraire de 1% ou 0,5% si les cellules du donneur représentent une proportion inférieure à la valeur seuil dans une quelconque lignée donnée (B lymphoïde T lymphoïde ou myéloïde comme représenté sur la figure 3), la souris n'a pas été considéré comme positif pour la reconstitution multilignée . Ce concept devient important lorsque les greffes compétitifs sont combinés avec un essai de dilution limite pour quantifier les CSH donateurs comme expliqué dans la discussion. Il est certainement possible d'avoir, par exemple, lymphocytes T et B dérivées du donneur, mais la perte progressive des cellules myéloïdes, qui serait habituellement suggérer la reconstitution que transitoire. Lymphocytes ont de plus longues demi-vies que les cellules myéloïdes ( en particulier Gr1hi SSChi granulocytes / neutrophiles) et peuvent persister même en l'absence de moelle osseuse CSH 10.
La figure 5 représente des résultats représentatifs pour chimérisme de sang périphérique sous situ différentations. Lorsque CSH donateurs sont fonctionnellement équivalentes aux cellules concurrents, les proportions de donneur (CD45.2 +) et concurrent (CD45.1 +) cellules -derived sont équivalentes (figure 5A). Les cellules hôtes résiduelles (+ CD45.1 CD45.2 +) sur la figure 5A et 5B sont presque exclusivement des lymphocytes T car ils sont plus résistants à la radio. Lorsque les cellules du donneur présentent une proportion beaucoup plus faible de leucocytes du sang périphérique (figure 5B), certains aspects de la fonction HSC sont susceptibles défectueux et d' autres études sont nécessaires , comme décrit dans la discussion. La présence de cellules concurrentes confirme que le test a bien fonctionné, mais moelle osseuse du donneur était simplement moins efficace. Ceci est en contraste avec les résultats présentés à la figure 5C, où les cellules du donneur et des concurrents sont présents en nombre et des cellules hôtes faible représentent la majorité des cellules du sang périphérique. Dans ce cas, la greffe a échoué et it est pas possible de tirer des conclusions quant à la fonctionnalité relative des donateurs par rapport aux cellules concurrents. Différentes solutions sont discutées ci-après.

. Figure 1. Modèle expérimental (A) Pour une greffe compétitive, les cellules de la moelle osseuse de souris donneuses (+ CD45.2; C57BL6 fond; contrôle et de test) des souris et des concurrents congenic (CD45.1 +; B6.SJL) sont mélangés dans un rapport 1: 1 et injecté dans la veine de la queue des souris receveuses irradiées (CD45.1 + CD45.2 +; F1 progéniture de C57BL6 x couples reproducteurs B6.SJL). L'efficacité de la reconstitution de la moelle osseuse est déterminée dans le sang périphérique (PB), 4, 8, 12 et 16 semaines après la transplantation et de la moelle osseuse à 16 semaines après la transplantation ou plus tard. (B) Pour mieux évaluer l'auto-renouvellement des cellules transplantées, bonDes cellules de moelle e récupérés dans les receveurs de greffe après 16 semaines peuvent être transférées dans des souris receveuses secondaires irradiés. HSC, cellules souches hématopoïétiques; MPP, cellules progénitrices multipotentes; PPSP, MPP lymphoïde-apprêtée. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
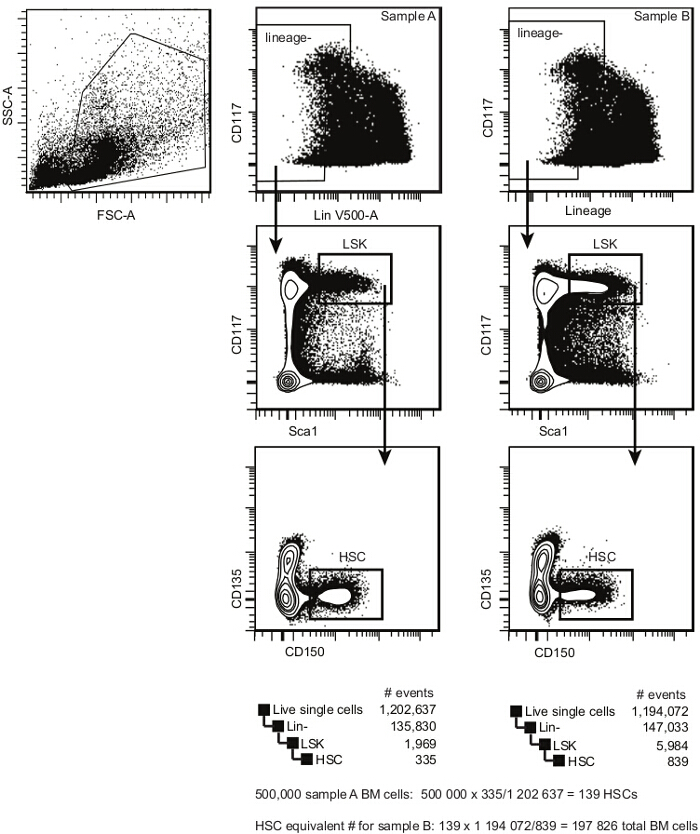
Figure 2. Pré-greffe de moelle osseuse HSC modèle d'analyse. Dans des cellules individuelles, sélectionnez HSPCs selon cKit (CD117) et l' expression de Lineage. Dans le dim / Lin - population de cellules, sélectionnez le cKit de Sca1 lumineux + population (LSK). Dans LSKs, sélectionnez CD150 + CD135 - CSH. Cette population contient à la fois à long terme et à court terme repeupler CSH (la fréquence d'une cellule de repopulation au sein de cette population est d'êtreentre 1/3 et 1/5). La fréquence estimée de la moelle osseuse CSH est calculé en divisant le nombre d'événements dans la porte HSC par le nombre d'événements dans la porte de la cellule unique. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
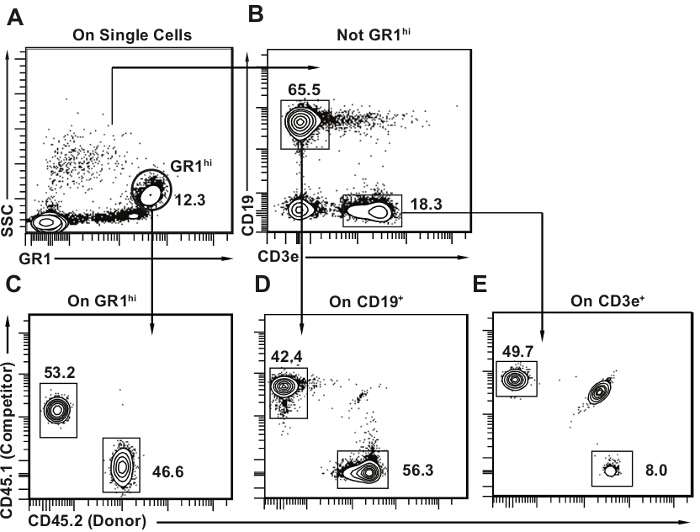
Figure 3. Post-transplantation modèle d'analyse de sang périphérique. (A) Dans des cellules individuelles, sélectionnez d' abord granulocytes hi SSC GR1 lumineux. (B) Ensuite , sélectionnez CD19 + CD3e - lymphocytes B et CD3e + CD19 - lymphocytes T. le sang périphérique de souris contient une grande proportion de lymphocytes avec des lymphocytes B étant le principal type cellulaire (environ 50% de toutes les cellules du sang périphérique). CE) Dessinez flux 2D cytométrie parcelles pour chaque sous-ensemble avec CD45.2 sur un axe et CD45.1 l'autre. Identifier les donateurs (CD45.2 +), hôte (CD45.1 + CD45.2 +) et les cellules concurrentes (CD45.1 de +) pour chaque lignée comme indiqué. Il est normal d'avoir des cellules hôtes qui restent, en particulier dans la population de lymphocytes T comme on le voit dans le panneau E. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
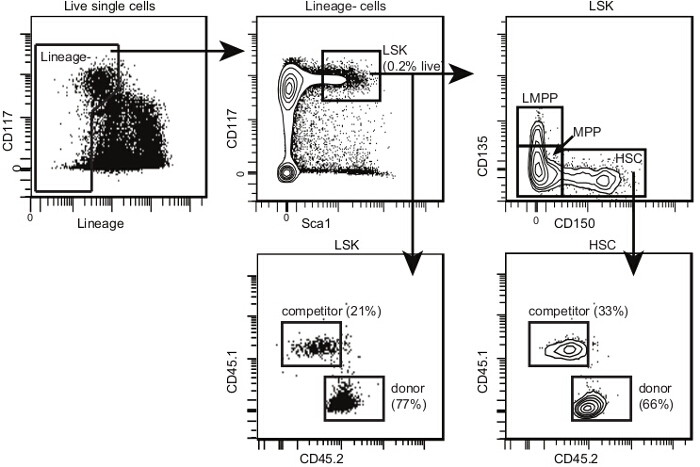
Figure 4. Post-transplantation modèle d'analyse de HSC de moelle osseuse. Dans des cellules individuelles, sélectionnez HSPCs et LSKs comme indiqué pour la figure 2. Dans LSKs, sélectionnez CD150 + CD135- CSH, CD150- CD135- progéniteurs multipotentes (ou députés) et CD150- CD135 + lymphoïde Députés -primed (ou LMPPs). La proportion de LMPPs est plus faible après la transplantation que chez les souris non irradiés. Dessinez 2D flux cytometry emplacements pour chaque sous-ensemble de CD45.2 sur un axe et CD45.1 l'autre. Identifier les donateurs, l'hôte et les cellules des concurrents pour chaque sous-population comme indiqué. Si l'irradiation et la greffe sont couronnées de succès, il devrait y avoir très peu de HSPCs hôtes restants. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
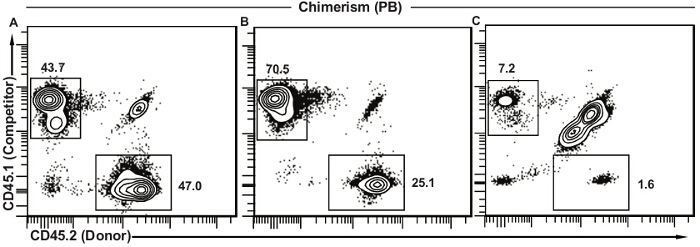
Figure 5. Les résultats représentatifs pour périphérique chimérisme de sang. (A) de transplantation réussie où les donateurs CSH sont fonctionnellement équivalentes aux cellules concurrents. La grande majorité des cellules hôtes restantes (CD45.1 + CD45.2 +) est généralement lymphocytes T. (B) de greffe réussie où les donateurs CSH fonction show a diminué par rapport aux cellules concurrents. Cette diminution de la contribution peut être due àplusieurs facteurs différents et d'autres analyses seront nécessaires (voir la discussion). (C) de greffe non réussie avec les basses fréquences des deux concurrents et les cellules du donneur et une grande proportion de cellules hôtes restantes. Ce type de résultat suggère une plus faible que la dose prévue de l' irradiation, l' injection infructueuse (diminution de la viabilité cellulaire, une diminution du volume de l' injection, l' injection en dehors de la veine de la queue), ou une combinaison de ceux - ci. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure .
Discussion
Le protocole décrit ici est conçu pour évaluer l'aptitude relative des donateurs (test) CSH contre concurrent connu CSH. La situation de la concurrence augmente la sensibilité relative de l'essai (plus susceptibles de détecter des baisses modérées dans la condition physique des cellules souches) et fournit un contrôle technique interne pour l'efficacité de l'irradiation et de l'injection. Cependant, il ne doit pas être utilisé comme une mesure absolue de HSC remise en forme; une diminution de la reconstitution compétitive ne signifie pas automatiquement que le CSH ne serait pas bien performer en l'absence de concurrence. Bien que l'on peut soutenir qu'un contexte concurrentiel est le meilleur point de départ, comme les cellules concurrents vont sauver la fonction défectueuse HSC et toutes les souris receveuses va survivre, il faut être prudent avec l'interprétation des résultats. Confirmant les résultats dans un contexte non concurrentiel se solidifiera les conclusions.
La conception expérimentale présentée ici utilise HSC équivalent quantities de cellules totales de la moelle osseuse au lieu des populations pures de cytométrie CSH -sorted. Il est important d'égaliser le nombre de CSH dans toutes les populations à l'étude (différents bailleurs de fonds, concurrent) pour éliminer la variabilité entre les différents bailleurs de fonds et de veiller à ce que les variations de fréquence phénotypique HSC ne seront pas interprétées comme des altérations de la fonction HSC 14. Les avantages de l'approche décrite ici sur CSH purifiées sont: l'amélioration de la viabilité des cellules en raison de raccourcissement des délais de traitement et l'absence de pression externe pendant le tri; et l' amélioration de la prise d' origine de l'os receveur de moelle (la présence d'anticorps sur les cellules triées peut interférer avec leur greffe dans la moelle osseuse 15). A l'inverse, le principal inconvénient est la contribution des populations non-HSC à l'issue de la transplantation, en particulier le rôle des cellules progénitrices de courte durée à des moments précoces après la transplantation. Par ailleurs, si le traitement ou la modification génétique modifient l'expression de surfacmarqueurs e utilisés pour la sélection des CSH 16, il peut y avoir un nombre important de CSH "déguisé" dans un échantillon , mais pas dans un autre, ce qui biaiser les résultats. Cependant, le même problème peut également survenir lors de l'utilisation CQH purifié et est inhérente à l'essai de transplantation.
Les résultats obtenus en utilisant le présent protocole ne sont que qualitative au niveau de la population. En d'autres termes, une diminution de la contribution des cellules du donneur après la transplantation pourrait être due à; un nombre inférieur de CSH fonctionnelles dans la population de départ; une diminution de la capacité des CSH individuels à régler dans la moelle osseuse et se développer dans les premiers jours et semaines après la transplantation; ou des problèmes de différenciation et de croissance dans des cellules matures qui sont utilisés pour la détection de la périphérie. Il est donc important de ne pas utiliser les résultats d'une greffe compétitive dans l'isolement, mais à les compléter avec des tests qui permettront de mesurer la prolifération cellulaire, la survie et la différenciation de HSC à la circulation des globules. Il est également important de comparer la contribution de la cellule donneuse entre le sang périphérique (Figure 3) et la moelle osseuse (Figure 4) Présence de CSH dérivées du donneur dans la moelle osseuse associée à l'absence de cellules du donneur dans le sang périphérique serait indicative d'un bloc de différenciation . Bien que non représenté dans l'exemple, il est également possible d'évaluer la reconstitution érythroïdes sur la base de différentes isoformes de 17 GPI1. Étant donné le grand nombre d'érythrocytes présents dans le sang, ils représentent une méthode très sensible de détection de cellules dérivées du donneur, qui peut être particulièrement utile lors de la transplantation faible nombre de CSH ou après leur sortie sur de longues périodes de temps. A l'autre extrémité du spectre, les cellules myéloïdes sont souvent les premiers à manquer d'être détecté, en partie à cause de leur faible fréquence dans le sang périphérique et en partie à cause de leur demi-vie courte.
Il est possible d'adapter ee repopulation compétitive essai afin de permettre la quantification des cellules souches hématopoïétiques en utilisant le test de dilution limitante (ou LDA). Cela exigera un plus grand nombre de souris receveuses divisés en plusieurs groupes où chaque groupe reçoit un rapport différent du concurrent: les cellules du donneur, soit triés ou non comme décrit ci-dessus. Comme le nombre de cellules du donneur diminue, il y aura plus de souris dans lesquelles la proportion de cellules dérivées du donneur ne dépasse pas le seuil pré-établi dans une ou plusieurs lignées. Il est alors possible de tracer la fréquence des souris «négative» par groupe contre le nombre de cellules du donneur transplantées et de déterminer la fréquence des CSH à partir du graphique qui a suivi 18,19.
La durée suggérée du post-transplantation suivi varie dans la littérature. Il y avait certain consensus lorsque la période de 16 semaines après la greffe a été considérée comme suffisante pour refléter la sortie du long terme CSH. Cependant, les récents rapports de "intermediate "CSH dont la fonction diminue peu après 16 semaines ont souligné la nécessité d' une évaluation encore plus rigoureuse de la fonction HSC 17. Il est certainement possible d'étendre le suivi des bénéficiaires de transplantation passé le point de temps de 16 semaines pour répondre à ces préoccupations. Une option alternative, une fois de plus avec une sensibilité sans doute plus élevé, est la greffe secondaire (figure 1B), où les cellules de moelle osseuse récupérées auprès des bénéficiaires premiers transplantés sont injectés dans les bénéficiaires secondaires irradiés. la deuxième greffe exerce une pression proliférative supplémentaire sur le CSH, forçant leur sortie de la dormance et ne permettant que des cellules avec robuste auto-renouvellement pour maintenir leur production. il est parfois préférable d'utiliser des cellules de donneurs triés pour mieux ajuster les numéros HSC entre les différents échantillons pour les greffes secondaires. Alternativement, il est possible d'établir un ratio estimé de donateurs : CSH concurrents de la moelle osseuse primaire (par exemple, Figure 4), puis comparer la sortie de cellule donneuse dans les greffes secondaires à ce rapport. Il est également essentiel d'augmenter le nombre de cellules de moelle osseuse transplantées totales, comme la fréquence des CSH fonctionnelles en post-greffe de moelle osseuse ne parvient jamais les chiffres observés chez les souris non irradiées. Il est préférable de mettre en commun la moelle osseuse à partir de plus d'un destinataire primaire et injecter un total de 5-10 millions de cellules par destinataire secondaire 10.
Comme mentionné ci-dessus, il y a un certain nombre de raisons pour lesquelles une population donnée de donateurs CSH peut montrer diminution de la capacité de reconstitution à long terme. Une de ces raisons est la capacité des CSH à migrer vers la moelle osseuse après la transplantation (aussi appelé homing) et se régler dans la niche de la moelle osseuse. Il est possible d'adapter le protocole présenté ici pour enquêter sur la prise d'origine de la moelle osseuse et l'expansion à court terme. Il est nécessaire d'augmenter le nombre de cellules transplantées (l'équivalent de 5.000-10.000 pour CQHessais homing et 1000-2000 CSH pour l'analyse dans la première semaine après la greffe). Dans le test de ralliement, les souris receveuses sont euthanasiés dans le 16-24 premières heures après la transplantation et le nombre de donateurs CSH qui ont atteint la moelle osseuse est déterminée comme expliqué dans le présent protocole. Pour mieux évaluer leur fonction, les cellules de la moelle osseuse récupérées auprès des bénéficiaires à court terme peuvent être transplantés sur des receveurs secondaires comme expliqué à la figure 1B. La proportion de cellules dérivées du donneur dans les destinataires secondaires peut alors être utilisé pour évaluer la capacité des donateurs CSH à migrer et à installer dans l'os receveur de moelle.
Les principaux problèmes avec les greffes de moelle osseuse concurrentielles proviennent de l'irradiation et de l'injection et se présentent comme la mortalité post-transplantation soit augmenté ou diminué l'efficacité de reconstitution. irradiation Split-dose, tel que présenté ici, est généralement associée à myéloablation plus efficace etmoins de toxicité par rapport à dose unique 20. Avec la dose recommandée ici (deux fois 450 rads), les populations de lymphoïdes myéloïdes et B sont efficacement supprimées , mais les lymphocytes T résiduels ne restent (Figure 3). S'il n'y a aucune raison de soupçonner le rejet du greffon (donneur et du receveur des souris de différentes origines génétiques), une dose plus élevée d'irradiation (deux doses de 550-600 rads) et un délai plus court entre les deux doses (4 heures au lieu de le lendemain ) devrait aider à éliminer les lymphocytes T résiduels et de réduire la possibilité d'échec de la greffe en raison du rejet. injection incorrecte, ou une injection dans l'espace périvasculaire au lieu de la veine de la queue, des problèmes avec la viabilité des cellules du donneur, ou la contamination de cellules du donneur en raison du manque de soins pendant la préparation de l'échantillon permettra également d'augmenter l'échec de la greffe et de la mortalité post-transplantation. irradiation Inefficace (en raison de problèmes techniques, par exemple) se traduira par l'efficacité de reconstitution diminué, mais ne devrait pas augmenter mortality. Dans toutes ces situations, la présence de cellules concurrents dans le test permet de dissocier les problèmes techniques (comme indiqué ici) d'une diminution de bonne foi dans les pays donateurs fonction HSC que les cellules concurrents doivent toujours être en mesure de reconstituer le destinataire irradié. Les hôtes immunodéprimés peuvent également être utilisés, par exemple, pour réduire la nécessité d' une irradiation et / ou un risque de rejet du greffon, et pour évaluer la fonction des cellules souches hématopoïétiques humaines 21-23.
En conclusion, nous présentons ici un protocole de greffe concurrentiel qui peut être adapté pour plusieurs utilisations différentes comme indiqué dans la discussion. Notre approche utilise les équivalents HSC, ce qui diminue le temps de traitement et d'améliorer simultanément la viabilité des cellules dans la greffe par rapport à un tri cellulaire. Il est également une solution pratique lorsque l'accès à un trieur de cellules est limitée, et nécessite moins de souris par rapport au dosage quantitatif LDA, ce qui en fait un point de départ intéressant pour l'analyse de la fonction HSC.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Nous sommes reconnaissants à Roxann Hétu-Arbour pour l'aide à la conception de la figure et la démonstration des procédures. La recherche dans le laboratoire a été soutenu par une bourse de transition de la Fondation Cole, Découverte accorde pas. 419226-2012 du Conseil de recherches en génie du Canada (CRSNG) en sciences naturelles et la Fondation canadienne pour l'innovation (FCI Leaders Fund accorde. 31377 pas). KMH est un junior chercheur-boursier du Fonds de recherche du Québec - Santé (FRQS).
matériels
| Name | Company | Catalog Number | Comments |
| Microtainer tubes with K2EDTA | BD Biosciences | 365974 | |
| 20 G needle | BD Syringe | For blood sampling from the mandibular vein | |
| LabQuake Shaker rotisserie | Thermo Scientific | C415110 | |
| Purified anti-mouse CD16/CD32 (clone 2.4G2, Fc Block) | BD Biosciences | 553142 | 2.50 μg/ml |
| Pe-Cy7-conjugated anti-mouse CD3e (clone 145-2C11) | eBioscience | 25-0031 | 0.25 μg/ml |
| PE-conjugated anti-mouse CD19 (clone 1D3) | eBioscience | 12-0193 | 0.25 μg/ml |
| APC-eFluor780 (APC-Cy7 equivalent)-conjugated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 47-5931 | 0.25 μg/ml |
| FITC-conjugate anti-mouse CD45.1 (clone A20) | eBioscience | 11-0453 | 2.50 μg/ml |
| eFluor450-conjugated anti-mouse CD45.2 (clone 104) | eBioscience | 48-0454 | 1.00 μg/ml |
| Biotinylated anti-human/mouse CD45R (B220) (clone RA3-6B2) | eBioscience | 13-0452 | 1.25 μg/ml |
| Biotinylated anti-mouse CD3e (clone 145-2C11) | eBioscience | 13-0031 | 1.25 μg/ml |
| Biotinylated anti-mouse CD11b (clone M1/70) | eBioscience | 13-0112 | 1.25 μg/ml |
| Biotinylated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 13-5931 | 1.25 μg/ml |
| Biotinylated anti-mouse TER119 (clone TER119) | eBioscience | 13-5921 | 0.625 μg/ml |
| V500 streptavidin | BD Biosciences | 56149 | 0.5 μg/ml |
| PE-conjugated anti-mouse CD117 (clone 2B8) | BD Biosciences | 553355 | 0.25 μg/ml |
| PE-Cy7-conjugated anti-mouse Ly6A/E (Sca1) (clone D7) | BD Biosciences | 558162 | 0.25 μg/ml |
| PerCP-eFluor710-conjugated anti-mouse CD135 (clone A2F10) | eBioscience | 46-1351 | 0.5 μg/ml |
| Alexa fluor 647-conjugated anti-mouse CD150 (clone TC15-12F12.2) | Biolegend | 115918 | 0.625 μg/ml BD Biosciences and eBioscience do not carry the same clone |
| 1 ml tuberculin syringe with 27 G needle | BD Syringe | 309623 | |
| 1 ml tuberculin syringe with 25 G needle | BD Syringe | 309626 | |
| 70 μm cell strainer | BD Falcon | 352350 |
Références
- Li, H. W., Sykes, M. Emerging concepts in haematopoietic cell transplantation. Nat Rev Immunol. 12 (6), 403-416 (2012).
- Kiel, M. J., Yilmaz, O. H., Iwashita, T., Terhorst, C., Morrison, S. J. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Kim, I., He, S., Yilmaz, O. H., Kiel, M. J., Morrison, S. J. Enhanced purification of fetal liver hematopoietic stem cells using SLAM family receptors. Blood. 108 (2), 737-744 (2006).
- Mayle, A., Luo, M., Jeong, M., Goodell, M. A. Flow cytometry analysis of murine hematopoietic stem cells. Cytometry A. 83 (1), 27-37 (2013).
- Rossi, L., et al. Less Is More: Unveiling the Functional Core of Hematopoietic Stem Cells through Knockout Mice. Cell Stem Cell. 11 (3), 302-317 (2012).
- Till, J. E., McCulloch, E. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat Res. 14, 213-222 (1961).
- Shen, F. W., et al. Cloning of Ly-5 cDNA. Proc Natl Acad Sci U S A. 82 (21), 7360-7363 (1985).
- Identification of GM mice. Laboratory Animals. 37 (suppl 1), 33-35 (2003).
- Rundberg Nilsson, A., Bryder, D., Pronk, C. J. H. Frequency determination of rare populations by flow cytometry: A hematopoietic stem cell perspective. Cytometry Part A. 83A (8), 721-727 (2013).
- Abidin, B. M., Owusu Kwarteng, E., Heinonen, K. M. Frizzled-6 Regulates Hematopoietic Stem/Progenitor Cell Survival and Self-Renewal. J Immunol. 195 (5), 2168-2176 (2015).
- Heinonen, K. M., Vanegas, J. R., Lew, D., Krosl, J., Perreault, C. Wnt4 enhances murine hematopoietic progenitor cell expansion through a planar cell polarity-like pathway. PLoS One. 6 (4), e19279(2011).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34 (9), 39-43 (2005).
- Santaguida, M., et al. JunB protects against myeloid malignancies by limiting hematopoietic stem cell proliferation and differentiation without affecting self-renewal. Cancer Cell. 15 (4), 341-352 (2009).
- Czechowicz, A., Kraft, D., Weissman, I. L., Bhattacharya, D. Efficient transplantation via antibody-based clearance of hematopoietic stem cell niches. Science. 318 (5854), 1296-1299 (2007).
- Zhang, C. C., Lodish, H. F. Murine hematopoietic stem cells change their surface phenotype during ex vivo expansion. Blood. 105 (11), 4314-4320 (2005).
- Benveniste, P., et al. Intermediate-Term Hematopoietic Stem Cells with Extended but Time-Limited Reconstitution Potential. Cell Stem Cell. 6 (1), 48-58 (2010).
- Fazekasde St Groth, B. The evaluation of limiting dilution assays. J Immunol Methods. 49 (2), R11-R23 (1982).
- Louis, I., Heinonen, K. M., Chagraoui, J., Vainio, S., Sauvageau, G., Perreault, C. The signaling protein Wnt4 enhances thymopoiesis and expands multipotent hematopoietic progenitors through beta-catenin-independent signaling. Immunity. 29 (1), 57-67 (2008).
- Cui, Y. Z., et al. Optimal protocol for total body irradiation for allogeneic bone marrow transplantation in mice. Bone Marrow Transplant. 30 (12), 843-849 (2002).
- Benz, C., et al. Hematopoietic Stem Cell Subtypes Expand Differentially during Development and Display Distinct Lymphopoietic Programs. Cell Stem Cell. 10 (3), 273-283 (2012).
- Eppert, K., et al. Stem cell gene expression programs influence clinical outcome in human leukemia. Nat Med. 17 (9), 1086-1093 (2011).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rgamma-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon