Method Article
Competitive Transplantationen Blutstammzell-Fitness zur Bewertung
In diesem Artikel
Zusammenfassung
This protocol provides step-by-step guidelines for setting up competitive mouse bone marrow transplant experiments to study hematopoietic stem/progenitor cell function without prior purification of stem cells by cell sorting.
Zusammenfassung
The gold standard definition of a hematopoietic stem cell (HSC) is a cell that when transferred into an irradiated recipient will have the ability to reestablish blood cell production for the lifespan of the recipient. This protocol explains how to set up a functional assay to compare the HSC capacities of two different populations of cells, such as bone marrow from mice of two different genotypes, and how to analyze the recipient mice by flow cytometry. The protocol uses HSC equivalents rather than cell sorting for standardization and discusses the advantages and disadvantages of both approaches. We further discuss different variations to the basic protocol, including serial transplants, limiting dilution assays, homing assays and non-competitive transplants, including the advantages and preferred uses of these varied approaches. These assays are central for the study of HSC function and could be used not only for the investigation of fundamental HSC intrinsic aspects of biology but also for the development of preclinical assays for bone marrow transplant and HSC expansion in culture.
Einleitung
Hämatopoese ist ein regenerativer Prozess, der das Auffüllen von Blutzellen gewährleistet, dass durch Verletzungen, Strahlung und Zelltod verloren. Dieser Prozess wird von hämatopoetischen Stammzellen (HSC) gewährleistet, die im erwachsenen Knochenmark weitgehend befinden. Zusätzlich können hämatopoetische Stammzellen für therapeutische Zwecke in Autoimmunerkrankungen, hämatologischen Malignitäten und Immundefizienz 1 verwendet werden. Es besteht somit ein Bedarf nach besser, die Mechanismen zu verstehen, die HSC-Funktion regulieren, einschließlich ihrer proliferative Expansion und ihre Fähigkeit, den Empfängerknochenmark nach der Transplantation zu erreichen und engraft. Obwohl neuere Studien mehrere Zelloberflächenmarker berichtet haben, einschließlich der SLAM Familienmitglieder CD150 und CD48, prospektiv erwachsenen HSZ und fetale HSZ auf ca. 50% Reinheit 2-4, der Goldstandard Maß für die funktionelle HSZ bleibt ein in vivo repopulating Test bereichern bestimmen ihre Fähigkeit, den Blut c wieder herzustellenell Produktion in einem bestrahlten Host 5.
Die in vivo klonalen repopulating Test wurde zunächst von Till und McCulloch 6 entwickelt und verfeinert und erweitert seitdem. Wie ursprünglich definiert, sorgen HSZ lebenslangen Blutkörperchen durch Selbsterneuerung und Differenzierung. Die Übertragung von HSCs in eine bestrahlte Empfänger ermöglicht uns so beurteilen zu: ihre Fähigkeit, durch die Analyse der verschiedenen Blutzelllinien (T-Lymphozyten, B-Lymphozyten, Granulozyten, Monozyten) und ihre Fähigkeit zur Selbsterneuerung durch serielle Transplantation zu differenzieren. Der Assay würde beinhalten in der Regel den Vergleich der Funktionalität und / oder der Menge der zwei Populationen von HSCs, beispielsweise Zellen von zwei Mäusen verschiedener Genotypen oder Zellen kommen , die mit verschiedenen Faktoren behandelt oder unbehandelt sind, die die Wartung oder Expansion von HSCs beeinflussen könnten in Kultur. Spenderchimerismus oder der Beitrag der übertragenen Spender HSZ to Blutzellproduktion kann dann mittels Durchflusszytometrie Analyse im peripheren Blut und Knochenmark unter Verwendung von Zelloberflächenmarker oder andere Verfahren bestimmt werden, die Spenderzellen des Empfängers wird zu unterscheiden, oder Host. Die am häufigsten verwendeten Marker sind sicherlich die beiden Allele des Gens oder Protein-Tyrosinphosphatase CD45 Leukozyten - Antigen 7 , die wir für die Beispiele unten angegeben gewählt.
Die klonalen Neubesiedlung Test kann entweder kompetitiv oder nicht-kompetitiv sein. In einer nicht-kompetitiven Einstellung, Kontrolle und Prüfung HSCs werden in getrennte Empfängermäuse übertragen und das Ergebnis für jeden Zelltyp wird von der anderen unabhängig sein. In einem kompetitiven Einstellung wird die Funktion sowohl Test- und Kontroll HSCs gegen eine Population von Kompetitor HSCs gemessen. Das hier beschriebene Protokoll verwendet die Wettbewerbs Einstellung kann aber auch für nicht-kompetitiven Situationen angepasst werden. Beide Ansätze haben ihre Vor- und Nachteile, und wir werden sie im Detail in der VergleichsDiskussion. Wir beschreiben auch verschiedene Ansätze Eigenkapital in der Zahl der transplantierten HSZ, um sicherzustellen, erklären, wie der Test für die Quantifizierung von HSZ anzupassen, indem Verdünnungsanalyse Begrenzung (LDA), und beide Beispiele für die Interpretation der Ergebnisse erfolgreichen und nicht erfolgreichen Transplantationen zur Verfügung stellen.
Protokoll
Alle in diesem Protokoll beschriebenen Verfahren wurden von der institutionellen Tierethikkommission und folgen dem Canadian Council on Animal Care-Richtlinien zugelassen.
Hinweis: Um steril / specific pathogen freien Gehäuse Bedingungen aufrechtzuerhalten, führen alle Verfahren im Zusammenhang mit Direkt Umgang mit lebenden Mäusen in einem biologischen Sicherheitsschrank oder einem Laminar-Flow-Haube. Reinigen oder sterilisieren Käfige, Haltevorrichtungen, Gehäusematerialien, Futter und Wasser zu den in geeigneter Tiere zur Verfügung gestellt. Verwenden Sie nur sterile Einweg-Nadeln für die Injektionen und zur Blutentnahme. Aseptische Technik ist bei der Herstellung des Transplantats von entscheidender Bedeutung.
1. Herstellung der Empfängermäuse
- Identifizieren Empfängermäuse mit Ohr Kerben (oder einer anderen von der örtlichen Tierethikkommission genehmigten Methode 8) individuelle Follow - up von Rekonstitution peripheren Blut und Knochenmark im Laufe der Zeit zu ermöglichen. Wiegen Sie die Mäuse für die Zeit nach der Transplantation Follow-up. Unse Empfängermäuse, die zwischen 7 und 12 Wochen alt (weniger als 25 g) sind.
Hinweis: In der mitgelieferten Beispiel CD45.1 + CD45.2 + Empfängermäuse wurden im Haus gezüchtet von C57Bl / 6 - Mäuse mit congenic B6.SJL Mäusen kreuzen. - Empfängermäuse mit zwei Dosen von 450 rad bestrahlen hämatopoetischen Aktivität zu zerstören. Geben Sie die erste Dosis am Tag vor der Transplantation und die zweite 1-2 Stunden vor der Transplantation.
Hinweis: Röntgen- oder Gammastrahlen beide verwendet, abhängig von der Verfügbarkeit von geeigneten Einrichtungen werden kann.
2. Herstellung von Donor und Competitor Knochenmarkzellen
- Euthanize Spender (Test und Kontrolle; CD45.2 +) und Wettbewerber (CD45.1 +; B6.SJL) Mäuse durch CO 2 Ersticken gefolgt durch Genickbruch oder unter Verwendung von Methoden , die von der lokalen Tierethikkommission genehmigt.
- Legen Mäuse auf dem Rücken, die Beine weit geöffnet, in eine leere Petrischale oder auf einer sterilen Gaze (zu halten die Arbeitsfläche sauber) inside einem biologischen Sicherheitsschrank. Befeuchten Sie die Haut und das Fell mit 70% Ethanol / 30% H 2 O (v / v).
- Schneiden Sie den Fuß mit einem Skalpell oder einer scharfen Schere ab. Schneiden Sie öffnen die Haut am Bein und ziehen weg, die Haut mit gezackten Pinzette. Schneiden Sie überschüssige Muskel weg.
- Verrenken Femur auf dem Beinknochen ziehen und mit Scherenblätter gegen den Beckenknochen als Gegenkraft. Nehmen Sie Tibia und Femur von der Kniescheibe und entfernen verbleibenden Bits von Muskeln und Sehnen. Platzieren Sie die Knochen in 2-3 ml steriler phosphatgepufferter Salzlösung (PBS) in einer 6-Well-Gewebekulturplatte.
- Sammeln Knochenmarkszellen durch die Knochen mit 5 ml sterilem PBS gespült.
- Halten Sie die Knochen vorsichtig mit einer Pinzette und legen Sie eine 25 G-Nadel zu einem gefüllten 1-ml-Spritze an einem Ende des Knochens. Drücken Sie den Kolben und sammeln Sie die Zellen in einem 15 ml konischen Röhrchen. Bei Bedarf wiederholen, bis die Mitte des Knochen weiß ist.
- Distanzieren Sie die Zellen durch wiederholtes durch die Nadel vorbei aneine Einzelzellsuspension zu erhalten. Vermeiden Sie Blasen und überschüssige Kraft. Hinweis: Verwenden Sie eine etwas größere Nadel (22 G) die Lebensfähigkeit der Zellen in diesem Schritt zu verbessern.
- Führen Sie die Zellen durch ein 70 & mgr; m Nylon-Sieb einheitliche Zellsuspension, um sicherzustellen, und Ablagerungen und Klumpen zu entfernen.
- Entfernen eines aliquoten zur Zellzählung unter Verwendung eines Hämozytometers. Zentrifugieren Sie die verbleibende Zellsuspension bei 200 × g für 5 Minuten bei 4 ° C. Nachjustieren Zelldichte erforderlich , wie in sterile PBS (10 & sup8 ; Zellen / ml). Halten Sie die Zellen auf Eis.
3. Aufbau Spenderzelle HSC Equivalents
- Übertragen , das Äquivalent von 3 x 10 6 Zellen (30 & mgr; l) werden in einen 5 ml Rundbodenpolystyrolröhrchen für die Durchflusszytometrie Färbung. Ein gleiches Volumen an nicht-markiertem Antikörper gegen CD16 / CD32 unspezifische Färbung zu blockieren (verdünnt in Färbepuffer (PBS, ergänzt mit 0,1% Rinderserumalbumin (BSA) und 1 mM EDTA) für eine Endkonzentration von 2,5 & mgr; g / ml). Inkubiere 5 min bei RT.
- In 90 ul Fluorochrom konjugierte Antikörper Master-Mix hergestellt in Färbepuffers: biotinylierten Lineage-Cocktail (B220, CD3e, CD11b, GR1, Ter119), Sca1, CD117, CD135, CD150. Inkubieren auf Eis für 30 min, vor Licht geschützt.
Hinweis: Geeignete Verdünnungen sollte für jede Charge von Antikörper bestimmt werden. Siehe Tabelle der Materialien für Verdünnungen in dieser Studie verwendet. - 2 ml Färbepuffer zu den Zellen, Vortexen und Zentrifugieren bei 200 xg für 5 min bei 4 ° C um ungebundenen Antikörper zu entfernen. Dekantieren Überstand und Pellet durch schnippen.
- In 10 ul fluorochromkonjugierten Streptavidin in Färbepuffers verdünnt (siehe Materialien Tabelle). Inkubieren auf Eis für 20 min, vor Licht geschützt. Waschen wie in Schritt 3.3, um ungebundene Streptavidin entfernen.
- Erwerben Sie die Zellproben ein Durchflusszytometer mit mindestens sechs Detektoren 9. Bestimmen Sie die Häufigkeit der Lin - Sca1 + CD117 + CD135 - CD150 + Zellen (geschätzt HSCs) in jeder Probe die Analyse Vorlage in 2 dargestellt und wie zuvor 10,11 gemeldet.
Hinweis: Die Häufigkeit funktioneller HSCs innerhalb dieser Population kann zwischen 1/3 und 1/5 2,12 geschätzt werden. - Stellen geschätzten HSC - Äquivalente für alle Proben 11, unter Verwendung einer Probe ( in der Regel der Wettbewerber, B6.SJL CD45.1 + in diesem Beispiel) als Basislinie wie unten und in Abbildung 2.
- Berechnen Sie die Anzahl von Zellen unter Verwendung der folgenden Formeln erforderlich:
#transplanted HSCs / Empfänger = 5 x 10 5 Zellen x geschätzten HSC Frequenz (wie für Ausgangsprobe bestimmt; diese Zahl ist in der Regel zwischen 75 und 125 für den Wildtyp C57BL / 6 - Mäuse) 10-12.
Anmerkung: In 2 für Probe A, das Ergebnis 139 HSCs ist.
Gesamt # Zellen transplantiert (für andere Proben, zB Probe B in Abbildung 2) = # transgepflanzt HSZ / HSC-Frequenz.
Anmerkung: In 2 für Probe B ist das Ergebnis 197.826 (oder etwa 2 x 10 5) Gesamtknochenmarkszellen.
- Berechnen Sie die Anzahl von Zellen unter Verwendung der folgenden Formeln erforderlich:
- Berechne die Gesamtzahl der pro Transplantatempfänger für jede Probe benötigt Zellen unter Verwendung der oben erhaltenen Ergebnisse.
Hinweis: Diese Zahl sollte 5 x 10 5 für die Basisprobe sein (Wettbewerber).- Multiplizieren Sie die aus Schritt Nummer 3.7 durch die Anzahl der Empfängermäuse und fügen Sie genügend Zellen für mindestens zwei weitere Mäuse für das Totvolumen in der Spritze zu kompensieren.
- Mischungs Kompetitor (zB CD45.1 +) und die Testzellen (CD45.2 +) in 1: 1 - HSC - Äquivalentverhältnis, berechnet in Schritt 3.6 und stellen das Endvolumen 200 & mgr; l pro Injektion mit steriler PBS.
Hinweis: Eine Gruppe von fünf Empfängermäuse die vorgeschlagene Volumen wäre also mindestens 1,4 ml, enthaltend 3,5 x 10 6 Kompetitor Knochenmarkszellen (bzw.973 geschätzt HSCs für Probe A in 2), und die entsprechende Anzahl von Testzellen (in Figur 2 würde das Äquivalent für Probe B 197.826 x 7 = 1.384.782 Knochenmarkzellen) sein.
4. Knochenmarktransplantationen
- Warm up die Empfängermäuse bestrahlt in Schritt 1.2 mit einem roten Wärmelampe Erweiterung der Blutgefäße, um sicherzustellen, und die seitlichen Schwanzvenen besser sichtbar zu machen.
- Bereiten Sie eine 1 ml Tuberculinspritze ausgestattet mit einer 27 G-Nadel (oder kleiner). Absaugen etwa 750 & mgr; l der hergestellten Zellsuspension (für 3 Empfängermäuse). Stellen Sie sicher, dass es keine Luftblasen in der Spritze sind.
- Legen Sie die Maus in eine Haltevorrichtung. Untersuchen Sie den Schwanz und suchen Sie nach den seitlichen Schwanzvenen, die auf beiden Seiten des Schwanzes deutlich sichtbar sein sollte. Wischen Sie die Injektionsstelle mit Ethanol. Führen Sie die Nadel Schräge nach oben, parallel zur Haut und den Kolben vorsichtig drücken. Die Injektion sollte einfach sein. Wenn Kraft rebenötigt, ist die Nadel nicht in die Vene.
Hinweis: Ältere Mäuse dickere Haut haben, die die Vene erschweren kann zu finden. Wenn die Nadel nicht in der Vene ist, legen die Nadel proximal der anfänglichen Injektionsstelle. - Entfernen Sie die Nadel und drücken Sie die Injektionsstelle mit steriler Gaze für einige Sekunden die Blutung zu stoppen. Übertragen Sie die Maus in einen sauberen Käfig.
Hinweis: Verwenden Sie die gleiche Spritze und Nadel für drei Injektionen, wonach die Nadel zu langweilig werden kann. - Für nach der Transplantation, Follow-up, injizieren 1 ml sterile PBS subkutan die Mäuse für die ersten fünf Tagen zu rehydrieren. Fügen Sie Antibiotika im Trinkwasser Infektionen zu verhindern (falls erforderlich; optional). Wiegen Mäuse alle zwei bis drei Tage für die ersten drei Wochen und einschläfern Mäuse, die mehr als 15-20% ihrer vor der Transplantation Körpergewicht verloren haben (oder wie von der örtlichen Tierethikkommission bestimmt).
5. Analyse von peripherem Blut
- Sammeln Sie einen Tropfen Blut (approx. 50-100 & mgr; l) in EDTA-Röhrchen.
- Um Blut aus der Vene des Unterkiefers zu sammeln, verwenden Sie eine Lanzette oder eine 22 - G - Nadel die Gesichtshaut in der Nähe der haarlos Stelle zu stechen unter den Kieferknochen befindet und legen Sie das Sammelrohr den Blutstropfen 13 zu empfangen. Sammeln Blut bei 4, 8, 12 und 16 Wochen nach der Transplantation Mehr lineage Rekonstitution zu folgen.
- 1 ml frisch hergestellt RT roten Blutkörperchen Lysepuffer (9 Teile 0,16 M NH 4 Cl + 1 Teil 0,17 M Tris-HCl pH 7,65) mit dem Blutstropfen in Schritt 5.1.1 gesammelt. Mix and Transfer Probe auf eine 5-ml-Rundboden-Polystyrolrohr geeignet für die Durchflusszytometrie. Lassen Sie für 4 min bei RT stehen.
- In 4 Volumina eiskaltem PBS. Mischen Sie durch Drehen End-to-End-und Transfer sofort auf Eis. Zentrifuge 10 min bei 200 × g bei 4 ° C.
- Dekantieren Überstand und Pellet durch schnippen. Der Überstand sollte klar und rot sein. 2 ml Färbepuffers und Wirbel kurz. Zentrifuge 5 min bei 200 xgat 4 ° C.
- Dekantieren Überstand und Pellet durch schnippen.
- Fahren Sie mit der Durchflusszytometrie Färbung der allgemeinen Protokoll in den Schritten 3.1 bis 3.3 und den folgenden Antikörpern für den Master-Mix detailliert mit: CD45.1, CD45.2, CD3e, CD19, GR1.
- Erwerben Sie die Zellproben ein Durchflusszytometer mit mindestens sechs Detektoren 9. Bestimmung der Häufigkeit der Spender abgeleiteten Zellen für jede Linie (CD19 + B - Lymphozyten, CD3e + T - Lymphozyten, Granulozyten GR1 hell) in jeder Probe die Analyse Vorlage bereitgestellt in Figur 3 und als 10,11 veröffentlicht.
6. Analyse der Knochenmark-Rekonstitution
- Sammeln Knochenmarkzellen wie in Abschnitt 2. Färben der Zellen für die Durchflusszytometrie-Analyse die allgemeine Protokoll detailliert in den Schritten 3.1 bis 3.3 und die folgenden Antikörper für den Master-Mix: Lineage-Cocktail, Sca1, CD117, CD135, CD150, CD45.1 , CD45.2. Detect lineage Cocktail unter Verwendung von Antikörpern fluorochromkonjugierten Streptavidin als 3,4 in Schritt beschrieben.
- Erwerben Zellproben ein Durchflusszytometer mit mindestens acht Detektoren 9. Wenn nur sechs zur Verfügung stehen, fügen Sie CD135 auf den gleichen Kanal wie Lineage - Panel als CD135 + Zellen werden ausgeschlossen. Bestimmen Sie die Häufigkeit der Spender abgeleiteten Lin - Sca1 + CD117 + CD135 - CD150 + HSZ in jeder Probe die Analyse Vorlage zur Verfügung gestellt in Abbildung 4 und als 10 veröffentlicht.
Ergebnisse
Eine allgemeine Beschreibung der Wettbewerbs Transplantation Einstellung, einschließlich der sekundären Transplantationen (weiter unten erörtert) in Abbildung 1 zu entnehmen. Eine repräsentative Analyse vor der Transplantation des Knochenmarks HSZ in 2 zu . Nähere Informationen über den Ausschluss von Dubletten zu finden und tote Zellen können an anderer Stelle 9.
Figuren 3 und 4 Beispiele der Durchflusszytometrie - Analyse templates für peripherem Blut und Knochenmark bereitzustellen, respectively. Es ist normal , einige Host - T - Lymphozyten zu detektieren (bis zu 20% aller T - Zellen; 3B), wie T - Zellen radio resistent sind. Mitbewerber-abgeleiteten Zellen sollten in allen drei Linien vorhanden sein. Die Nachweisgrenze hängt stark von der Anzahl der gesamten Zellen für die Analyse erworben, aber in unserer Erfahrung insgesamt 20 Tausend Zellen innerhalb dereinzelne Leukozyten-Gate ist in der Regel ausreichend. Unter Verwendung einer willkürlichen Schwellenwert von 1% oder 0,5%, wenn Spenderzellen einen geringeren Anteil als die Grenz in jedem gegebenen Linie repräsentieren (B lymphatischen, T lymphoiden oder myeloiden wie in 3 gezeigt), wird die Maus nicht positiv für multilineage Rekonstitution . Dieses Konzept wird wichtig, wenn die Wettbewerbs Transplantate mit einem Grenzverdünnungs Assay kombiniert werden Donator HSCs zu quantifizieren, wie in der Diskussion erläutert. Es ist sicherlich möglich zu haben, beispielsweise Donor abstammenden T und B-Lymphozyten, aber allmähliche Verlust der myeloiden Zellen, die nur transient Rekonstitution Regel vorschlagen würde. Lymphocyten haben längere Halbwertzeiten als myeloide Zellen (insbesondere Gr1hi SSChi Granulozyten / Neutrophile) und 10 auch in Abwesenheit von Knochenmark HSCs persistieren.
Abbildung 5 zeigt repräsentative Ergebnisse für die periphere Blut Chimärismus unter verschiedenen situtionen. Wenn Spender HSCs funktionell äquivalent sind zu Konkurrenz Zellen sind die Anteile von Spender (CD45.2 +) und Kompetitor (CD45.1 +) abgeleitete Zellen äquivalent (5A). Die Restwirtszellen (CD45.1 + CD45.2 +) in 5A und 5B sind fast ausschließlich T - Lymphozyten , wie sie mehr Funkbeständig sind. Wenn Spenderzellen einen viel geringeren Anteil an Leukozyten des peripheren Blutes (5B) darstellen, sind einige Aspekte der HSC - Funktion wahrscheinlich defekt und weitere Studien erforderlich sind , wie in der Diskussion beschrieben. Die Anwesenheit von Konkurrenten Zellen bestätigt, dass der Test funktionierte gut, aber Spenderknochenmark war einfach weniger wirksam. Dies steht im Gegensatz zu dem Ergebnis in 5C dargestellt, wo beide Donor- und Kompetitor Zellen vorhanden sind in geringer Zahl und Wirtszellen , stellen die Mehrheit der peripheren Blutzellen. In diesem Fall war das Transplantat nicht erfolgreich und it können keine Rückschlüsse auf die relative Funktionalität von Spender im Vergleich zu Konkurrenz Zellen zu ziehen. Verschiedene Lösungen werden weiter unten diskutiert.

. Abbildung 1 : Experimentelles Design (A) Für eine wettbewerbsfähige Transplantation, Knochenmarkzellen von Spendermäusen (CD45.2 +; C57Bl6 Hintergrund, Kontrolle und Test) und congenic Wettbewerber Mäuse (CD45.1 +; B6.SJL) gemischt in ein Verhältnis 1: 1 und in die Schwanzvene von bestrahlten Empfängermäuse injiziert (CD45.1 + CD45.2 +; F1 - Nachkommen von C57Bl6 x B6.SJL Brutpaare). Die Wirksamkeit von Knochenmark Rekonstitution 8, bei 4, 12 in dem peripheren Blut (PB) ermittelt und 16 Wochen nach der Transplantation, und im Knochenmark bei 16 Wochen nach der Transplantation oder höher. (B) Um die Selbsterneuerung von transplantierten Zellen zu bewerten, bone Mark-Transplantation Empfänger nach 16 Wochen gewonnenen Zellen können in bestrahlten sekundären Empfängermäuse übertragen werden. HSC, hämatopoetischen Stammzellen; MPP, multipotente Vorläuferzellen; LMPP, lymphatischen grundierten MPP. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
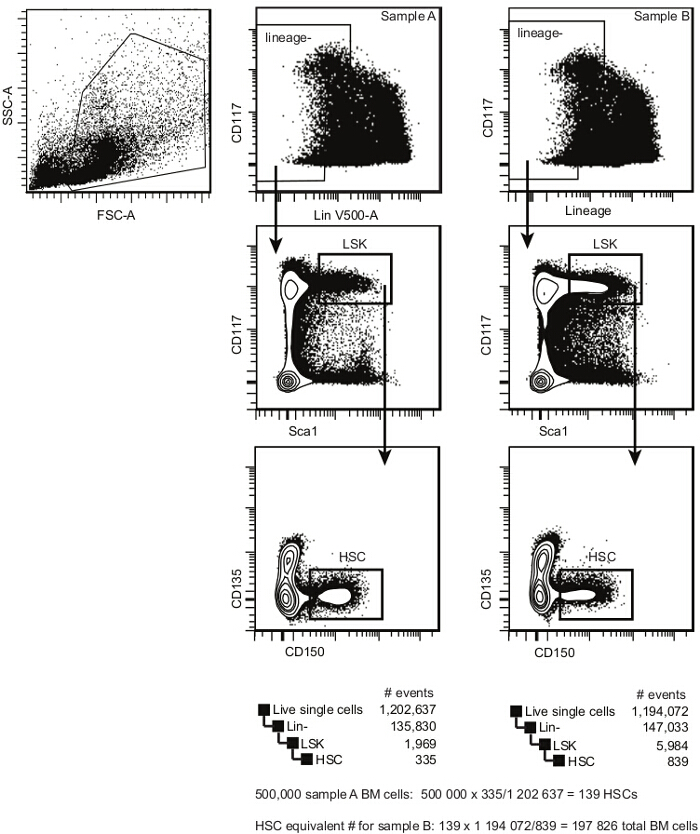
Abbildung 2. Pre-Knochenmarktransplantation HSC Analyse Vorlage. Innerhalb von einzelnen Zellen, wählen HSPCs nach ckit (CD117) und Lineage Ausdruck. Im Lin dim / - Zellpopulation, wählen Sie die ckit helle Sca1 + Bevölkerung (LSK). Innerhalb LSKS, wählen CD150 + CD135 - HSZ. Diese Population enthält sowohl langfristige und kurzfristige repopulating HSZ (die Frequenz eines repopulating Zelle innerhalb dieser Population sein istzwischen 1/3 und 1/5). Die geschätzte Häufigkeit von HSCs Knochenmark , indem die Anzahl der Ereignisse in der HSC - Tor durch die Anzahl der Ereignisse in der einzelnen Zelle Gatter berechnet wird. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
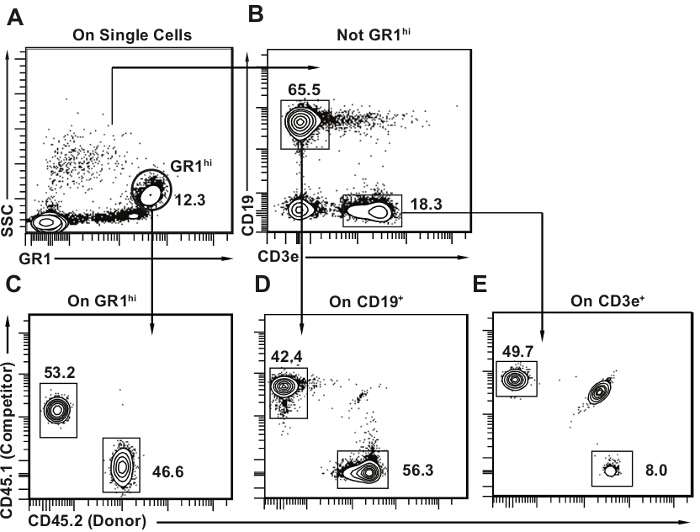
Abbildung 3. Post-Transplantation peripherer Blutanalyse - Vorlage. (A) innerhalb der einzelnen Zellen, wählen Sie zunächst GR1 helle SSC hallo Granulozyten. (B) Wählen Sie dann CD19 + CD3e - B - Lymphozyten und CD3e + CD19 - T - Lymphozyten. Maus peripherem Blut enthält einen großen Anteil an Lymphozyten, B-Lymphozyten mit den Hauptzelltyp ist (etwa 50% alle peripheren Blutzellen). CE) 2D-Zeichnen Durchflusszytometrie Plots für jede Teilmenge mit CD45.2 auf einer Achse und CD45.1 auf der anderen. Identifizieren Spender (CD45.2 +), Host (CD45.1 + CD45.2 +) und Wettbewerber - Zellen (CD45.1 +) für jede Linie , wie dargestellt. Es ist normal , ein paar verbleibenden Wirtszellen zu haben, vor allem in der Population von T - Lymphozyten wie in Feld E. gesehen klicken Sie hier Bitte um eine größere Version dieser Figur zu sehen.
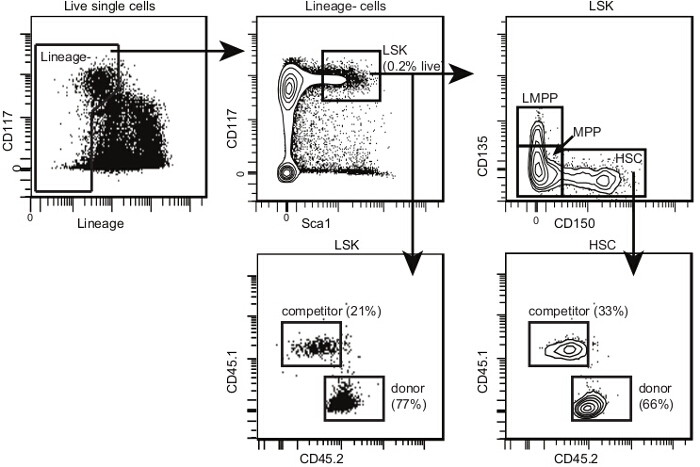
Abbildung 4. Post-Knochenmarktransplantation HSC Analyse Vorlage. Innerhalb von einzelnen Zellen, wählen Sie HSPCs und LSKS wie für Abbildung 2. Innerhalb von LSKS gezeigt, wählen Sie CD150 + CD135- HSZ, CD150- CD135- multi- Vorläufern (oder MPPs) und CD150- CD135 + lymphatischen -geprimte MPPs (oder LMPPs). Der Anteil der LMPPs niedriger nach der Transplantation als in nicht-bestrahlten Mäusen. Zeichnen 2D-Flow cytometry Plots für jede Untergruppe mit CD45.2 auf einer Achse und CD45.1 auf der anderen. Identifizieren Spender, dem Wirt und Wettbewerber Zellen für jede Subpopulation, wie dargestellt. Wenn die Bestrahlung und Transplantation erfolgreich sind, sollte es nur sehr wenige Rest Host HSPCs sein. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
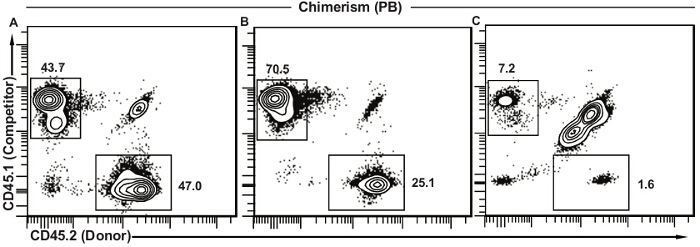
Abbildung 5. Repräsentative Ergebnisse für periphere Blut Chimärismus. (A) Erfolgreiche Transplantation , wo Spender HSZ sind funktional äquivalent zu den Wettbewerber - Zellen. Die überwiegende Mehrheit der verbleibenden Wirtszellen (CD45.1 + CD45.2 +) ist in der Regel T - Lymphozyten. (B) Erfolgreiche Transplantation , wo Spender HSZ - Show - Funktion verringert , wie zum Wettbewerber Zellen verglichen. Diese verringerte Beitrag kann darauf zurückzuführen sein,verschiedene Faktoren und weitere Analysen sind erforderlich, um (siehe Diskussion). (C) Nicht erfolgreiche Transplantation bei niedrigen Frequenzen sowohl Kompetitor und Spenderzellen und einen großen Teil der verbleibenden Wirtszellen. Diese Art von Ergebnis legt nahe , eine niedrigere als Erwartete Dosis der Bestrahlung nicht erfolgreich Injektion ( die Lebensfähigkeit der Zellen verringert wird , verringerte Volumen der Einspritzung, Injektion außerhalb der Schwanzvene) oder eine Kombination aus diesen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen .
Diskussion
Das hier beschriebene Protokoll wurde entwickelt, um die relative Eignung der Spender (Test) HSZ gegen bekannte Wettbewerber HSZ zu bewerten. Die Konkurrenzsituation erhöht die relative Empfindlichkeit des Assays (eher moderate Abnahme der Stammzell Fitness zu erkennen), und stellt eine interne technischen Kontrolle für die Wirksamkeit der Bestrahlung und Injektion. Es sollte jedoch nicht als absolutes Maß für HSC Fitness verwendet werden; nicht gut in der Abwesenheit von Konkurrenz eine Abnahme der Wettbewerbs Rekonstitution bedeutet nicht automatisch, dass die HSZ würde. Obwohl es, dass eine wettbewerbsfähige Einstellung der besseren Ausgangspunkt argumentiert werden kann, ist, da die Wettbewerber Zellen defekt HSC-Funktion und alle Empfängermäuse werden überleben zu retten wird, sollte man sich mit der Interpretation der Ergebnisse vorsichtig sein. Bestätigen die Ergebnisse in einer nicht-kompetitiven Einstellung wird die Schlussfolgerungen zu verfestigen.
Das experimentelle Design präsentiert hier verwendet HSC Äquivalent quantities der gesamten Knochenmarkzellen anstelle von reinen Populationen von Durchflusszytometrie -sortierte HSZ. Es ist wichtig , die Zahl der HSCs in allen Populationen untersucht (verschiedenen Spendern, Wettbewerber) zu beseitigen Variabilität zwischen verschiedenen Spendern zu entzerren und sicherzustellen , dass Variationen in phänotypischen HSC Frequenz nicht als Veränderungen in HSC - Funktion 14 interpretiert werden. Die Vorteile des Ansatzes hier über gereinigten HSZ beschrieben sind: verbesserte Lebensfähigkeit der Zellen durch verkürzte Bearbeitungszeiten und das Fehlen von Außendruck während des Sortierens; und verbesserte homing dem Empfänger Knochenmark (das Vorhandensein von Antikörpern auf sortierten Zellen können mit ihren engraftment in dem Knochenmark 15 interferieren). Im Gegensatz dazu ist der größte Nachteil der Beitrag von Nicht-HSC-Populationen auf die Transplantationsergebnisse, insbesondere die Rolle der kurzlebigen Vorläuferzellen zu frühen Zeitpunkten nach der Transplantation. Wenn darüber hinaus die Behandlung oder genetische Modifikation verändert die Expression von surface Marker für die Auswahl von 16 HSZ verwendet wird , kann es eine beträchtliche Anzahl von HSCs "in disguise" in einer Probe sein , aber in einem anderen nicht, das wird Bias die Ergebnisse. Jedoch kann das gleiche Problem auch auftreten, wenn gereinigter HSCs verwenden und ist inhärent Transplantat-Assay.
Die Ergebnisse der vorliegenden Protokoll sind nur qualitative auf Bevölkerungsebene. In anderen Worten könnte eine verminderte Beitrag der Donorzellen nach Transplantation sein aufgrund; eine geringere Anzahl von funktionellen HSCs in der Ausgangspopulation; eine verminderte Fähigkeit der einzelnen HSZ in das Knochenmark zu regeln und in den ersten Tagen und Wochen nach der Transplantation zu erweitern; oder Probleme mit der Differenzierung und das Wachstum in reifen Zellen, die für die Erfassung in der Peripherie verwendet werden. Es ist daher wichtig, nicht die Ergebnisse aus einem kompetitiven Transplantation isoliert verwenden, aber sie mit Assays zu ergänzen, die die Zellproliferation messen wird, Überleben und Differenzierung von HSC zu Blutzellen zirkulieren. Es ist auch wichtig Donorzelle Beitrag zwischen peripherem Blut (Figur 3) und im Knochenmark (4) Anwesenheit von Donor abstammenden HSCs im Knochenmark in Verbindung mit dem Fehlen von Spenderzellen im peripheren Blut , welches eine Differenzierungsblock wäre zu vergleichen . Obwohl es nicht in dem Beispiel gezeigt, ist es auch möglich , erythroiden Rekonstitution auf der Basis verschiedener Isoformen von GPI1 17 zu beurteilen. Angesichts der großen Zahl von Erythrozyten im Blut stellen sie ein hochempfindliches Nachweisverfahren für Spender-abgeleitete Zellen, die besonders nützlich sein können, wenn geringe Anzahl von HSCs Umpflanzen oder nach deren Ausgang über lange Zeiträume. Am anderen Ende des Spektrums sind myeloischen Zellen oft die ersten, die erkannt wird, zum Scheitern verurteilt, teilweise wegen ihrer niedrigen Frequenz im peripheren Blut und teilweise wegen ihrer kurzen Halbwertszeit.
Es ist möglich, th anzupassene Wettbewerbs Neubesiedlung Assay Quantifizierung von HSCs mit dem Grenzverdünnungstest (oder LDA) zu ermöglichen. Dadurch wird eine viel größere Anzahl von Empfängermäusen erfordern in mehrere Gruppen eingeteilt, wobei jede Gruppe ein anderes Verhältnis der Teilnehmer erhält: Donorzellen, sortiert oder unsortiert, wie oben beschrieben. Da die Zahl der Spenderzellen verringert, wird es mehr Mäuse, in denen der Anteil der Spender-abgeleiteten Zellen nicht den vorher festgelegten Schwellwert in einer oder mehreren Linien zu erreichen. Es ist dann möglich , die Häufigkeit von "negative" Mäuse pro Gruppe gegen die Zahl der transplantierten Donorzellen zu plotten und die Häufigkeit von HSCs aus der nachfolgenden Diagramm 18,19 bestimmen.
Die vorgeschlagene Dauer der nach der Transplantation, Follow-up variiert in der Literatur. Es verwendet, um bestimmte Konsens zu sein, wo die Dauer von 16 Wochen nach der Transplantation in Betracht gezogen wurde, ausreichend zu sein, um die Ausgabe von langfristigen HSZ reflektieren. Die jüngsten Berichte von "intermediate "HSZ , deren Funktion übernimmt kurz nach 16 Wochen die Notwendigkeit unterstrichen haben noch strengere Bewertung der HSC - Funktion 17. Es ist sicherlich möglich , das Follow-up der Transplantatempfänger vergangenen 16 Wochen - Zeitpunkt zu verlängern , diese Bedenken zu befriedigen. Ein alternative Option, ein weiteres Mal mit einer wohl höhere Empfindlichkeit, die sekundäre Transplantation (1B) ist, bei der Zellen aus der ersten Transplantation Empfänger gewonnen Knochenmark werden in bestrahlte sekundären Empfänger injiziert. die zweite Transplantation bringt zusätzliche proliferative Druck auf die HSZ, deren Ausgang zwingen Dormanz und nur Zellen mit robusten Selbsterneuerung ermöglicht, ihre Produktion zu erhalten. es ist manchmal bevorzugt, sortierter Donorzellen zu verwenden, um eine bessere HSC Zahlen zwischen verschiedenen Proben für die sekundären Transplantate einzustellen. Alternativ ist es möglich, eine geschätzte Verhältnis von Donor zu etablieren : Konkurrent HSZ aus dem primären Knochenmark (zB Abbildung 4) und vergleichen dann die Spenderzelle Ausgabe in sekundären Transplantationen in diesem Verhältnis. Es ist auch wichtig, die Zahl der transplantierten Gesamtknochenmarkszellen zu erhöhen, wie die Häufigkeit funktioneller HSCs in post-Transplantation des Knochenmarks nie die Zahlen in nicht-bestrahlten Mäusen gesehen erreicht. Am besten ist es Knochenmark zu bündeln von mehr als einem primären Empfänger und insgesamt von 5-10 Millionen Zellen pro sekundären Empfänger 10 zu injizieren.
Wie oben erwähnt, gibt es eine Reihe von Gründen dafür, warum Fähigkeit zur Langzeit-Rekonstitution verringert eine gegebene Population von Spender HSCs zeigen. Ein solcher Grund ist die Fähigkeit des HSZ auf das Knochenmark nach der Transplantation (auch genannt Homing) zu migrieren und sich selbst im Knochenmark Nische. Es ist möglich, das Protokoll hier vorgestellten anzupassen Knochenmark Homing und kurzfristigen Ausbau zu untersuchen. Es ist notwendig, die Zahl der transplantierten Zellen (das Äquivalent von 5.000-10.000 HSZ zu erhöhen fürHoming-Assays und 1000-2000 HSZ für die Analyse innerhalb der ersten Woche nach der Transplantation). Im Homing Assay Empfängermäuse werden innerhalb der ersten 16-24 Stunden nach der Transplantation und die Anzahl der Spender HSZ eingeschläfert, die das Knochenmark erreicht haben, wird im vorliegenden Protokoll wie erläutert bestimmt. Um ihre Funktion, Knochenmarkzellen zu bewerten von den kurzfristigen Begünstigten zurückzufordern kann in sekundäre Empfänger transplantiert werden , wie in 1B erläutert. Der Anteil der Donor abstammenden Zellen in den sekundären Empfänger kann dann verwendet werden, um die Fähigkeit des Spenders HSCs zu bewerten in den Empfängerknochenmark wandern und absetzen.
Die größten Probleme mit den Wettbewerbsknochenmarktransplantationen ergeben sich aus Bestrahlung und Injektion und präsentieren sich als entweder erhöht nach der Transplantation Mortalität oder Rekonstitution Effizienz verringert. Split-Dosis der Bestrahlung, wie hier dargestellt, wird in der Regel mit einer effizienteren Myeloablation zugeordnet ist, undweniger Toxizität bei 20 bis Verabreichung einer Einzeldosis. Mit der Dosis hier empfohlen (zweimal 450 rads) werden die myeloischen und B lymphatischen Populationen effizient gelöscht , sondern Rest T - Lymphozyten zu tun bleiben (Abbildung 3). Wenn es irgendeinen Grund, Transplantatabstoßung (Spender und Empfänger Mäuse aus verschiedenen genetischen Hintergründen) zu vermuten, eine höhere Dosis der Bestrahlung (zwei Dosen von 550-600 rad) und eine kürzere Verzögerung zwischen den beiden Dosen (4 Stunden, statt am nächsten Tag ) sollten Rest T-Lymphozyten zu eliminieren und die Möglichkeit einer Transplantatversagen aufgrund von Abstoßungs verringern helfen. Falsche Injektion oder Injektion in den perivaskulären Raum anstelle der Schwanzvene, Probleme mit der Lebensfähigkeit Spenderzelle oder Spenderzelle Kontamination durch während der Probenvorbereitung auf mangelnde Sorgfalt wird auch ein Transplantatversagen und nach der Transplantation die Sterblichkeit erhöhen. Ineffiziente Bestrahlung (aufgrund von technischen Problemen, zum Beispiel) führen zu einer verringerten Rekonstitution Effizienz führen, sollte aber nicht mo erhöhenrtality. In all diesen Situationen hilft die Anwesenheit des Kompetitors Zellen in dem Assay technischen Probleme zu dissoziieren (wie hier beschrieben) von einer bona fide Abnahme der Donor-HSC-Funktion als Kompetitor Zellen immer in der Lage sein sollte, die bestrahlte Empfänger zu rekonstituieren. Immundefizienten Wirten können auch verwendet werden, beispielsweise die Notwendigkeit einer Bestrahlung zu verringern und / oder das Risiko einer Transplantatabstoßung, und die Funktion des menschlichen HSCs 21-23 zu bewerten.
Zusammenfassend stellen wir hier einen Wettbewerbstransplantationsprotokoll, das für verschiedene Anwendungen angepasst werden kann, wie in der Diskussion beschrieben. Unser Ansatz nutzt HSC-Äquivalente, die Bearbeitungszeiten verringert und verbessert gleichzeitig die Lebensfähigkeit der Zellen im Transplantat, wenn sie Zellsortierung verglichen. Es ist auch eine praktische Lösung, wenn der Zugang zu einem Zellsortierer begrenzt ist, und weniger Mäuse erfordert, wenn die quantitative LDA-Assay verglichen, es einen attraktiven Ausgangspunkt für die Analyse von HSC-Funktion macht.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Wir sind dankbar, dass Roxann Hétu-Arbour für die Unterstützung bei der Abbildung Design und Demonstration der Verfahren. Die Forschung im Labor durch eine Transition Award von der Cole-Stiftung unterstützt wurde, gewähren Discovery-Nr. 419226-2012 aus den Natur- und Ingenieurwissenschaften Research Council of Canada (NSERC) und der Canada Foundation for Innovation (CFI Leaders Fund nicht gewähren. 31377). KMH ist ein Chercheur-Boursier Junior für den Fonds de recherche du Québec - Santé (FRQS).
Materialien
| Name | Company | Catalog Number | Comments |
| Microtainer tubes with K2EDTA | BD Biosciences | 365974 | |
| 20 G needle | BD Syringe | For blood sampling from the mandibular vein | |
| LabQuake Shaker rotisserie | Thermo Scientific | C415110 | |
| Purified anti-mouse CD16/CD32 (clone 2.4G2, Fc Block) | BD Biosciences | 553142 | 2.50 μg/ml |
| Pe-Cy7-conjugated anti-mouse CD3e (clone 145-2C11) | eBioscience | 25-0031 | 0.25 μg/ml |
| PE-conjugated anti-mouse CD19 (clone 1D3) | eBioscience | 12-0193 | 0.25 μg/ml |
| APC-eFluor780 (APC-Cy7 equivalent)-conjugated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 47-5931 | 0.25 μg/ml |
| FITC-conjugate anti-mouse CD45.1 (clone A20) | eBioscience | 11-0453 | 2.50 μg/ml |
| eFluor450-conjugated anti-mouse CD45.2 (clone 104) | eBioscience | 48-0454 | 1.00 μg/ml |
| Biotinylated anti-human/mouse CD45R (B220) (clone RA3-6B2) | eBioscience | 13-0452 | 1.25 μg/ml |
| Biotinylated anti-mouse CD3e (clone 145-2C11) | eBioscience | 13-0031 | 1.25 μg/ml |
| Biotinylated anti-mouse CD11b (clone M1/70) | eBioscience | 13-0112 | 1.25 μg/ml |
| Biotinylated anti-mouse GR1 (clone RB6-8C5) | eBioscience | 13-5931 | 1.25 μg/ml |
| Biotinylated anti-mouse TER119 (clone TER119) | eBioscience | 13-5921 | 0.625 μg/ml |
| V500 streptavidin | BD Biosciences | 56149 | 0.5 μg/ml |
| PE-conjugated anti-mouse CD117 (clone 2B8) | BD Biosciences | 553355 | 0.25 μg/ml |
| PE-Cy7-conjugated anti-mouse Ly6A/E (Sca1) (clone D7) | BD Biosciences | 558162 | 0.25 μg/ml |
| PerCP-eFluor710-conjugated anti-mouse CD135 (clone A2F10) | eBioscience | 46-1351 | 0.5 μg/ml |
| Alexa fluor 647-conjugated anti-mouse CD150 (clone TC15-12F12.2) | Biolegend | 115918 | 0.625 μg/ml BD Biosciences and eBioscience do not carry the same clone |
| 1 ml tuberculin syringe with 27 G needle | BD Syringe | 309623 | |
| 1 ml tuberculin syringe with 25 G needle | BD Syringe | 309626 | |
| 70 μm cell strainer | BD Falcon | 352350 |
Referenzen
- Li, H. W., Sykes, M. Emerging concepts in haematopoietic cell transplantation. Nat Rev Immunol. 12 (6), 403-416 (2012).
- Kiel, M. J., Yilmaz, O. H., Iwashita, T., Terhorst, C., Morrison, S. J. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Kim, I., He, S., Yilmaz, O. H., Kiel, M. J., Morrison, S. J. Enhanced purification of fetal liver hematopoietic stem cells using SLAM family receptors. Blood. 108 (2), 737-744 (2006).
- Mayle, A., Luo, M., Jeong, M., Goodell, M. A. Flow cytometry analysis of murine hematopoietic stem cells. Cytometry A. 83 (1), 27-37 (2013).
- Rossi, L., et al. Less Is More: Unveiling the Functional Core of Hematopoietic Stem Cells through Knockout Mice. Cell Stem Cell. 11 (3), 302-317 (2012).
- Till, J. E., McCulloch, E. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat Res. 14, 213-222 (1961).
- Shen, F. W., et al. Cloning of Ly-5 cDNA. Proc Natl Acad Sci U S A. 82 (21), 7360-7363 (1985).
- Identification of GM mice. Laboratory Animals. 37 (suppl 1), 33-35 (2003).
- Rundberg Nilsson, A., Bryder, D., Pronk, C. J. H. Frequency determination of rare populations by flow cytometry: A hematopoietic stem cell perspective. Cytometry Part A. 83A (8), 721-727 (2013).
- Abidin, B. M., Owusu Kwarteng, E., Heinonen, K. M. Frizzled-6 Regulates Hematopoietic Stem/Progenitor Cell Survival and Self-Renewal. J Immunol. 195 (5), 2168-2176 (2015).
- Heinonen, K. M., Vanegas, J. R., Lew, D., Krosl, J., Perreault, C. Wnt4 enhances murine hematopoietic progenitor cell expansion through a planar cell polarity-like pathway. PLoS One. 6 (4), e19279(2011).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34 (9), 39-43 (2005).
- Santaguida, M., et al. JunB protects against myeloid malignancies by limiting hematopoietic stem cell proliferation and differentiation without affecting self-renewal. Cancer Cell. 15 (4), 341-352 (2009).
- Czechowicz, A., Kraft, D., Weissman, I. L., Bhattacharya, D. Efficient transplantation via antibody-based clearance of hematopoietic stem cell niches. Science. 318 (5854), 1296-1299 (2007).
- Zhang, C. C., Lodish, H. F. Murine hematopoietic stem cells change their surface phenotype during ex vivo expansion. Blood. 105 (11), 4314-4320 (2005).
- Benveniste, P., et al. Intermediate-Term Hematopoietic Stem Cells with Extended but Time-Limited Reconstitution Potential. Cell Stem Cell. 6 (1), 48-58 (2010).
- Fazekasde St Groth, B. The evaluation of limiting dilution assays. J Immunol Methods. 49 (2), R11-R23 (1982).
- Louis, I., Heinonen, K. M., Chagraoui, J., Vainio, S., Sauvageau, G., Perreault, C. The signaling protein Wnt4 enhances thymopoiesis and expands multipotent hematopoietic progenitors through beta-catenin-independent signaling. Immunity. 29 (1), 57-67 (2008).
- Cui, Y. Z., et al. Optimal protocol for total body irradiation for allogeneic bone marrow transplantation in mice. Bone Marrow Transplant. 30 (12), 843-849 (2002).
- Benz, C., et al. Hematopoietic Stem Cell Subtypes Expand Differentially during Development and Display Distinct Lymphopoietic Programs. Cell Stem Cell. 10 (3), 273-283 (2012).
- Eppert, K., et al. Stem cell gene expression programs influence clinical outcome in human leukemia. Nat Med. 17 (9), 1086-1093 (2011).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rgamma-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten