Method Article
指向進化方法で
要約
We present a detailed protocol to construct and screen mutant libraries for directed evolution campaigns in Saccharomyces cerevisiae.
要約
生物工学的適用のための酵素を設計する際、サッカロマイセス・セレビシエにおける指向進化は、 生体内での高頻度の相同DNA組換えに結合された、突然変異体ライブラリーの構築、クローニングおよび発現を含むプロセスを多くの魅力的な利点を提供しています。ここでは、その総活性を高めるために、真菌のアリールアルコールオキシダーゼ(AAO)の例に基づいて酵母に変異ライブラリを作成し、画面ためのプロトコルを提示します。 2つのタンパク質セグメントは、ランダム突然変異誘発によっておよびin vivo DNA組換えに焦点を当てた、指向性進化に供しました。各セグメントに隣接〜50塩基対のオーバーハングは、完全な自己複製プラスミドを生じさせる線状化ベクターでAAO-融合遺伝子の正しい再組み立てを可能にしました。機能性AAO変種で強化された変異体のライブラリーは、Sでスクリーニングしましたフェントン反応に基づいて敏感なハイスループットアッセイとセレビシエ上清。の一般的なプロセスS.でライブラリー構築セレビシエは、余分なPCR反応を、 インビトロでの DNA組換え及びライゲーション手順を回避する、ここに記載さ容易に多くの他の真核生物の遺伝子を進化させるために適用することができます。
概要
監督分子進化は、酵素1、2を設計するため、堅牢な高速かつ信頼性の高い方法である。ランダム変異、組換えおよびスクリーニングの反復ラウンドを通じて、酵素の改良されたバージョンは、非天然で、小説の反応で、新しい基板に作用を生成することができます環境は、さらに新たな代謝目標3-5を達成するために、細胞を支援します。指向性進化に使用されたホストのうち、ビール酵母サッカロマイセス・セレビシエは、原核生物のカウンターパート6,7でそうでなければ利用できない複雑な真核生物タンパク質の機能発現のためのソリューションのレパートリーを提供しています。
細胞生物学研究で徹底的用い、この小さな真核生物のモデルは、指向進化8によって酵素を設計するための重要な特徴であるその全ての翻訳後修飾、操作および形質転換効率の容易さの点で多くの利点を有します。また、高周波S.における相同DNA組換えのその効率的なプルーフリーディング装置に結合されたセレビシエは、複雑な人工的な経路9-12への単一の酵素とは 異なるシステムの進化を促進する、 生体内でのライブラリの作成 および遺伝子アセンブリのための可能性の広い配列を開きます。私たちの研究室では、酵母における異なるリグニナーゼの分子進化(天然木の崩壊の際にリグニンの分解に関与する酸化還元酵素)13-14のためのツールと戦略を設計する過去十年間を費やしてきました。この通信では、我々は準備するための詳細なプロトコルとS.の画面変異体ライブラリーを提示します、簡単に他の多くの酵素に変換することができます-モデルflavooxidase、 -アリール-アルコールオキシダーゼ(AAO 15)のためセレビシエ 。酵母細胞装置16、によって支援:(相同in vivo でグループ化することによって、変異原性組織再結合過程モーフィング)プロトコルは、集束指向進化の方法を含みます培養液17中に分泌AAO活性を検出するために、フェントン反応に基づいて、ダ非常に敏感なスクリーニングアッセイ。
プロトコル
1.変異体ライブラリーの構築
- 選択領域は、利用できる結晶構造または相同性モデル18に基づいて計算アルゴリズムの助けを借りて、モーフィングに供されます。
- ここでは、ランダム突然変異誘発および組み換え(メット[α1] -Val109、Phe392-Gln566)、高忠実度PCRによる遺伝子(844塩基対)の残りの部分を増幅しながら( 図1)のためのエリンギからAAOの2つの領域をターゲットにしています。
注:いくつかのセグメントは独立に、または組み合わせた方法16にモーフィングによって研究することができます。
- ここでは、ランダム突然変異誘発および組み換え(メット[α1] -Val109、Phe392-Gln566)、高忠実度PCRによる遺伝子(844塩基対)の残りの部分を増幅しながら( 図1)のためのエリンギからAAOの2つの領域をターゲットにしています。
- 突然変異誘発PCRによって標的領域を増幅します。定義された領域のPCR反応を重畳することにより、セグメント間の領域(約50塩基対ずつ)のオーバーラップを作成します。
- DNAテンプレート(0.92 ngの/μl)を含む50μlの最終容量中の標的セグメントの変異原性PCRを準備し、90 nMのオリゴセンス(セグメントM-IIのためのセグメントMIとAAO-BP用RMLN)、90 nMのAntisenseプライマー(セグメントM-IIのためのセグメントMIとRMLCためのAAO-92C)、0.3mMのdNTP類(0.075 mMの各)、3%(v / v)ジメチルスルホキシド(DMSO)、1.5のMgCl 2、0.05ミリモルのMnCl 2および0.05 U /μlのTaq DNA ポリメラーゼ 。プライマー配列は、図1に詳述されています。
- 以下のPCRプログラムを使用してください:2分(1サイクル)、95℃を。 45秒、45秒、50℃、45秒間74℃(28サイクル)95℃、そして10分(1サイクル)74°C。
- 超高忠実度ポリメラーゼで非変異領域を増幅し、変異原性セグメントおよび/または線状化ベクターのオーバーハングを重ね、対応する領域を含みます。
- 含む50μlの最終容量で反応混合物を準備します。DNA鋳型(0.2 ngの/μl)を、250 nMのオリゴセンスHFF、250 nMのオリゴアンチセンスHFR、0.8mMのdNTP類(0.2 mMの各)を、3%(v / v)ジメチルスルホキシド(DMSO)およびDNAポリメラーゼではiProof 0.02 U /μlの。プライマー配列は、中に詳述されています<強い>図1。
- 以下のPCRプログラムを使用してください:30秒(1サイクル)98℃を。 10秒間、98℃、55℃45秒(28サイクル)のための25秒、72℃;そして10分(1サイクル)72℃。
注:43 bpの(プラスミド-M1領域)の1.2と1.3の重なりに記載された条件では、 46塩基対(M1地域-HF領域)。 47塩基対(HF地域-M2領域)および61塩基対(M2 region-プラスミド)は酵母においてインビボスプライシングに有利になるように( 図1)に設計されています。 - 製造業者のプロトコルに従って、商業用ゲル抽出キットを用いて、すべてのPCR断片(変異原性および非変異)を精製します。
- 約50塩基対のフランキング領域は、標的遺伝子の5 '末端および3'末端に相同であるが作成されるように、ベクターを線状化。
- 2μgのDNA、7.5 U のBam HI、7.5 U のXhoI、バッファBaの 20μgのBSAおよび2μLを含む線形化反応混合物を準備します20μlの最終容量中メートルHI 10倍。
- 2時間40分間37℃で反応混合物をインキュベートします。その後、80℃で20分間不活性化を進めます。
- 残留環状プラスミド( 図2)の混入を避けるために、アガロースゲル抽出により線状化ベクターを精製します。
- 同様に隣接するだけでなく、レポーターで反応混合物のアリコート(5μl)を:セミ分取低融点アガロースゲル(V 0.75%、ワット)のメガウェルに消化反応ミックスをロードします。
- ランDNA電気泳動(電極間の5 V / cmで、4ᵒC)とは、メガウェルに対応したアガロースゲルを分離し、1×TAE中4ᵒCでそれを保存します。
- 分子量ラダーと記者とのレーンを染色。 UV光の下でバンドを可視化。ニック線状化ベクターの場所の位置。
注:精製線形化ベクターの品質がcritiであるよう酵母で成功組換えおよびアセンブリのための校正係数、セミ分取のDNA電気泳動用ゲル染色を避けます。ゲル抽出用染料およびUV照射の使用は、 インビボ組換えの効率を損なう、DNAベクターの安定性に影響を及ぼし得ます。毒性EtBrを染料の代わりに、ゲルレッドおよびSYBR染料は、一般に、ゲル染色のために使用されます。 - それを単離することができるように、UV光の不存在下で、染色されたレポーターレーンにニックのガイダンスを使用して、メガウェル断片で線状化ベクターを識別する。
- アガロースから線状化ベクターを抽出し、製造業者のプロトコルに従って、商業用ゲル抽出キットを用いて、それを精製します。
注:抗生物質や栄養要求性マーカーと使用高コピーエピソームシャトルベクター:この例では、酵母GAL1プロモーターの制御下で、ウラシル独立し、アンピシリン耐性pJRoC30ベクトルを採用。
- 等モルマイルを準備PCR断片の固定装置および2で線状化ベクターと混ぜる:線状化プラスミドの無未満100 ngので、1の比(等モルのライブラリ/オープンベクトルのテスト異なる比率は、良好な変換収率を達成するために)。
- それらの濃度および純度を決定するために、260 nmおよび280 nmでのPCRフラグメントの吸光度および線状化ベクターを測定します。
- 商業酵母形質転換キットを用いてDNA混合物で酵母コンピテント細胞を形質転換製造業者の指示に従って(供給するための表を参照のこと )。
- ここでは、欠損およびURA3プロテアーゼを使用-依存S.セレビシエ株、BJ5465。 (下記参照)スクリーニング時に内部標準として親の環状ベクターで細胞を形質転換します。また、PCR断片の不存在下で線状化ベクターを形質転換することにより、背景をチェックしてください。
注:最初の低分泌レベルを検出する場合には、Sを使用しBJ5465のようなセレビシエプロテアーゼ欠損株は、培養上清中の活性タンパク質の蓄積を促進します。標的酵素は、高グリコシルを受ける場合は、グリコシル化欠損株(小さ いマンノースオリゴマーを装着することができるだけである例えば、ΔのKRE2)の使用が適切なオプションである可能性があります。
- ここでは、欠損およびURA3プロテアーゼを使用-依存S.セレビシエ株、BJ5465。 (下記参照)スクリーニング時に内部標準として親の環状ベクターで細胞を形質転換します。また、PCR断片の不存在下で線状化ベクターを形質転換することにより、背景をチェックしてください。
- プレートは、SCドロップアウトプレート上の細胞を形質転換し、3日間30℃でそれらをインキュベートします。プレート(ウラシルを補充したSCドロップアウトプレート上)URA3 - S.スクリーニングのための陰性対照として、プラスミドを欠くセレビシエ細胞(下記参照)。
スクリーニングアッセイ2.ハイスループット(図3)
- ピペットロボットの助けを借りて、ウェルあたり50μlの最少培地で(2,000クローンのライブラリーを分析するために23プレート)を滅菌96ウェルプレートの適切な数を埋めます。
- プレートアウトSC-dropから個々のコロニーを選択し、96ウェルプレートに転送。
- S. -各プレートには、URA3でH1内部標準と同様に親のタイプと列番号6に接種陰性対照としてプラスミドなしでセレビシエ細胞(SC培地にウラシルを補いました)。
注意:まあH1はウラシルを補充し、ドロップアウトメディアと特異的に充填されています。ウェル細胞を含まない培地を含むブランクもまた、追加の無菌対照として調製することができます。
- S. -各プレートには、URA3でH1内部標準と同様に親のタイプと列番号6に接種陰性対照としてプラスミドなしでセレビシエ細胞(SC培地にウラシルを補いました)。
- 彼らのふたでプレートをカバーし、パラフィルムでラップ。 30°C、湿度の高いシェーカーで225rpmで、80%の相対湿度で48時間プレートをインキュベートします。
- パラフィルムを外し、分注ロボットの助けを借りて、各ウェルに発現培地160μlを添加、プレートを再密封し、さらに24時間のためにそれらをインキュベートします。
注:他の場所で19報告されているように最小培地および発現培地を調製します。分泌レベルは、T、およびそれに応じて研究中の遺伝子に応じて変えることができます彼インキュベーション時間は、すべてのウェルにおける細胞増殖を同期させるために、それぞれの場合に最適化されなければなりません。 - 4℃で10分間、2,800×gで遠心分離プレート(マスタープレート)。
- 転送ロボットマルチステーションを処理液を用いてレプリカプレートにマスタープレート中のウェルから20μlの上清。
一般的に酵母中での異種発現のために使用されるシグナルペプチドによって標的タンパク質の天然のシグナルペプチドを交換することをお勧めし酵素の分泌を有利にする( 例えば、α因子プレプロリーダー、SからK 1キラートキシンの指導者注: セレビシエ 、または両方のペプチド13)のさえキメラバージョン。代替的に、天然のシグナルペプチドは、排他的に、酵母での分泌のために進化することができます。 - ピペッティングロボットの助けを借りて、100 mMリン酸ナトリウム緩衝液pH6.0中の2mM のp -methoxybenzylalcohol20μlのを追加します。 96私たちと簡単にプレートをかき混ぜますLLプレートミキサー、室温で30分間、それらをインキュベートします。
- 2(SO 4)2、100μMキシレノールオレンジ、250μMのFe(NH 4):ウェル中のFOX混合物の最終濃度(分注ロボットでは、それぞれのレプリカプレートにFOX試薬の160μlを添加し、ミキサーで簡単にかき混ぜますおよび25mM H 2 SO 4)。
- このような有機共溶媒(DMSO、エタノール、メタノール)またはソルビトール17としての感度を向上させる試薬には、いくつかの添加剤を加えます。ここでは、100 mMの( 図4)の最終濃度になるようにソルビトールを添加することにより反応を増幅します。
- プレートリーダーで560 nmでプレート(エンドポイントモード、T 0)を読みます。
- 色が発症するまで室温でプレートをインキュベートし、再び(トン1)吸収を測定します。
- インキュベーション後のABS値との差から相対活性を計算し、最初の測定のそれはパレに正規化各プレートについてNTALタイプ(Δtの1 -トン0)。
- 偽陽性を排除するために、2つの連続した再上映に最高の変異ヒットを施します。
注:典型的には、再上映プラスミド19を新鮮な酵母細胞の形質転換に続いて、大腸菌における酵母、増幅および精製からのプラスミドの単離を含みます。選択された各クローンはpentaplicateで再スクリーニングされます。
結果
PからAAO エリンギは、リグニンを攻撃開始するために、H 2 O 2との真菌のペルオキシダーゼを供給する外flavooxidaseです。 AAOの2つのセグメントがその活性およびSにおけるその発現を高めるためにモーフィングにより集束指向性進化に供しましたセレビシエ 19。 S.によって抱い外国酵素のにかかわらずセレビシエ 、酵母に変異ライブラリーを構築する最も重要な問題は、断片と線状化ベクターへのそれらのクローニングの間のスプライシングを優先するように、特定の重複領域のエンジニアリングに関するものです。現在の例では、各PCR反応のために、すべてのフラグメントは、酵母in vivoでのスプライシングを促進するために、約50塩基対のオーバーハングを有していました。セグメント数が組み立てられ、線状化ベクターにクローン化する上での組換え事象の数が依存している( すなわち、2つの交差事象は、との間で行われました図1); 3 PCRセグメントは、非変異誘発segment-に隣接する2つの変異原性のセグメントに加えて線状化ベクターを持つ2つの追加のクロスオーバーを-THE。彼らは形質転換効率は向上しませんが我々の経験によると、50塩基対より長い重複配列は、内部の組換えの可能性を減少させます。
突然変異荷重は、異なる風景を有する変異体のライブラリーをサンプリングし、親酵素活性の<10%を有するクローンの数を算出し、さらに、アクティブおよび非アクティブな変異体( 図5A)のランダムサンプルを配列決定することによって、それらをチェックすることにより調整しました。分散S.係数の決意するためセレビシエ細胞は、親AAOで形質転換し、プレートアウトSC-ドロップ上にプレーティングしました。個々のコロニーを96ウェルプレートおよびクローンの活動に採取し、接種した新鮮な調製物から評価しました。変異原性サンプル2( のTaq /のMnCl 2 0.05 mm)をライブラリー構築およびスクリーニングのための出発点として選ば れました。
AAOの生物学的活性は、反応媒体中のH 2 O 2濃度を増加させるように、我々は、H 2 O 2の小さな変化を定量化するために高感度かつ正確なアッセイの検索しました。 FOXは、フェントン反応20、に基づいて、化学的な方法となるHによる酸化2 O 2ドライブの青紫色の複合体を形成するキシレノールオレンジと鉄の反応3+(O -cresolsulfone-フタ3 '、3' ' -ビス(メチルイミノ)二酢酸ε560 = 1.5×10 4 M -1 cm -1 で )。鉄酸化工程は明らかεとラジカルの増殖を増加させる、アッセイの感度を高めるためにソルビトールを添加することにより増幅された560 = 2.25×10 5 M -1 cm -1で(FIグレ4)。
(μMの範囲で)、このアッセイの検出限界(0、0.5、1、1.5、2、2.5、3、4μMH 2 O 2トリプリケートで標準96ウェルプレート中でブランク決意法により算出しました。 )及びSからいくつかの上清を使用してプラスミド( 図5B) - セレビシエは、URA3を欠いています。アッセイは、(H 2 O 2の8μMまで)ソルビトールの存在下では直線的であった、と直線性は、応答が弱かった(少なくとも、H 2 O 2の30μMまで)この砂糖の不在下でより持続的であったが( 例えば、H 2 O 2の6μMで、4倍の増強は、( 図5B) -ダーク橙その不在で0.24の吸光度から、ソルビトール-deep紫の存在下で得られました)。 ABSおよびAAO濃度との関係は、電子の増加量で評価しました。(酵母菌上清から)nzyme及び線形応答が観察されました。 R 2 = 0.997( 図5C)。
FOX信号は培養液中の異なる要素によって明らかな干渉なしに数時間安定であったことは注目に値します。 FOXの予想感度は上清中AAOによって産H 2 O 2〜0.4μMでした ソルビトールの存在、およびその不在中〜2μMインチ
2000クローンの変異体ライブラリーを構築し、このアッセイでスクリーニングしました。いくつかのAAO変異体は、pの -methoxybenzylアルコールに対する顕著に改善された分泌および活性( 図5D)19で同定されました。

図1。AAO進化のためのプロトコルをモーフィングAAOの2つの異なる領域がランダム突然変異誘発および組換えのために標的された:シグナルペプチド(SP)を含むM1(青、590塩基対)。 M2(イエロー、528塩基対)。 (灰色、844 bp)のHF領域は、高忠実度ポリメラーゼを用いて増幅しました。変異原性領域はAAO(PDB ID:3FIM)の結晶構造にマッピングした。 この図の拡大版をご覧になるにはこちらをクリックしてください。
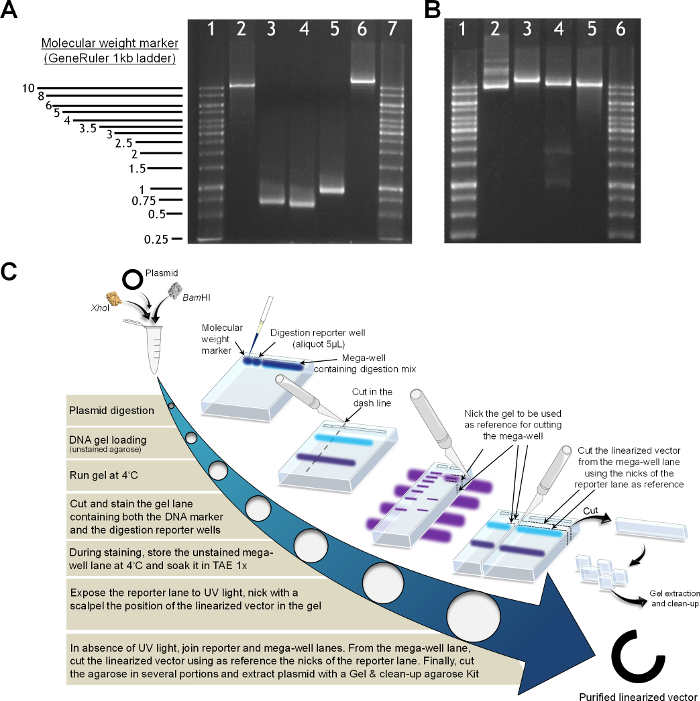
PCR産物および線状化ベクターの図2の製造 (A)分析用アガロースゲル(1%W:V)。レーン1および7、分子量マーカー(1kbのラダー)を含みます。 BamHIおよびXho I線状化ベクター、レーン2; PCRセグメントM1、レーン3; PCRセグメントM2、レーン4; PCRセグメントHF、レーン5; V INNheI(地域MI、HF及びM-IIでフルAAO遺伝子を含む)、レーン6(B)のベクトル線形化、レーン1および6分子の規格、1 KBラダーで線状に再組み立てベクトルをIVO。プラスミドミニプレップ、レーン2。 NheI、レーン3で線状化プラスミド; BamHIおよびXho I、レーン4で線状化プラスミド;プラスミド精製の ための消化後ゲル抽出とクリーンアップによって得られた線状化プラスミド、レーン5(C)プロトコル。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3.ハイスループットスクリーニングプロトコル。プロセスの概要。 大きい輸出自主規制を表示するには、こちらをクリックしてください。この図のイオン。

図4. FOX方法。白色腐朽菌は、•OHヒドロキシルラジカルを生成するフェントン反応により木材の細胞壁を攻撃します。 FOX方法カップルこの反応はオレンジ(XO)をキシレノールし、XO-のFe 3+錯体の吸光度を560nmで測定します。鉄の酸化は、試薬混合物にソルビトールを添加することにより増幅される。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5.変異原風景とは異なるエラープローンPCR条件およびスクリーニングアッセイの検証を使用してライブラリをモーフィングするため。(A NG>)モーフィング風景。破線はアッセイの変動係数を示しながら、水平の実線は、アッセイにおける親のタイプの活性を示します。パーセンテージは、親酵素活性の10%未満を有するクローンの数を示します。活動は、降順にプロットされています。 (B)FOXの検出限界は、ソルビトールの存在下(黒丸)でH 2 O 2の漸増濃度下および非存在下(白四角)で評価しました。 (C)AAO濃度(形質転換体の上清)とABS 560nmの間の線形相関。各点は、8回の実験の平均値に対応し、標準偏差を含みます。 (D)変異体ライブラリーの風景。他の場所で19報告されているように選択された変異体(影付きの正方形)を再スクリーニングしました。実線はAAO親のタイプの活性を示します。>この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
この記事では、我々はSに指向進化により酵素を設計するために我々の研究室で使用されるヒントやトリックのほとんどをまとめていますセレビシエ (例としてAAOを使用して)、彼らは単にここに記載の一般的な方法に従って、多くの他の真核生物の酵素系との使用に適合させることができるようになっています。
ライブラリの作成 の面では、モーフィングが変化していないタンパク質16の残りの領域を残しながら、小さなタンパク質のストレッチにランダム突然変異を導入し、再結合するための高速ワンポット法です。いくつかの突然変異負荷を有するライブラリーは容易に完全な自律的に複製するベクターを生成するために、線状化プラスミドと一緒に、調製され、 生体内で再結合することができます。重複配列は、余分なPCR反応を回避し、完全な遺伝子の断片は、 インビボ組換えを介して再組み立てすることを可能にするために、各ストレッチに隣接し、in vitroライゲーションステップにすることが重要です。このP INこれは、形質転換効率を損なうことがあるrotocol、PCR断片との間の交差事象の頻度は、重複領域の大きさを減少させることによって増加させることができます。かかわらず、突然変異誘発PCRに使用されるDNAポリメラーゼの、突然変異荷重を予め構築し、小さな変異体ライブラリーの風景を( 図5A)を分析することによって調整することができます。製GeneMorph IIキットを使用する場合は、 インビボで DNA組換えので、このアプローチに従うことが依然として賢明である、特に、製造業者によって推定突然変異負荷を変更することができます。一般的に言えば、35れた変異風景 - この番号は、標的タンパク質とその活性の機能に変化がスクリーニング合計クローンの50%は、親の活性の10%未満を有するが、指向進化のキャンペーンのために適しています。典型的には、変異体ライブラリーの風景の分析はさらに、変異体のランダムサンプルのDNA配列決定により確認されています。現在の例では、TaqポリメラーゼDNAポリメラーゼによる3 '→5'proofリーディングエキソヌクレアーゼ活性の欠如にリンクされ、その高い誤り率を使用しました。 Taqポリメラーゼライブラリーにおける変異負荷はのMnCl 2の異なる濃度を添加することによって変更されたが、不平衡dNTPおよび/ または遺伝子の鋳型濃度の減少の使用はまた、適切な選択肢です。モーフィングの固有の限界が再結合するセグメントの数から来ます。我々の経験によると、4タンパク質ブロック(線状化ベクターとの組換え領域をカウント5の交差事象)までの良好な変換収率(転換反応当たり〜10 5個のクローン)でスプライスされることができます。この方法は、簡単に大幅にスクリーニング努力21,22を削減しながら、同時にいくつかの位置を探索する( 例えば、NDTに縮重プライマーを用いて、または22ユニークコドンのための縮重を作成)を行い、複数の部位飽和突然変異誘発に変更することができます。
AAOのための直接的な「 ブラインド 」スクリーニングプロトコルは、(関係なく酵素によって使用される基板のH 2 O 2の直接検出に基づいて)非常に敏感で信頼性の高い、十分に間接的に確立します過酸化物(主に比色基質とペルオキシダーゼを結合する)を検出するためのプロトコル。実際、FOXアッセイは日常的に生物学的流体中のH 2 O 2を測定するために使用され、簡単AAOを進化させたプロトコルに変換され、他のH 2 O 2産生酵素( 例えば、グルコースオキシダーゼ、セロビオースデヒドロゲナーゼ、グリオキサールできますオキシダーゼ、特に応答が別の方法で検出することが困難な非天然基質に対する活性のためのメタノールオキシダーゼ)、。
それは高い変換効率を提供していますので、S.セレビシエは、1×10まで(真核生物の遺伝子の指向性進化のための最も適切なホストです6形質転換体/μgのDNAが)、それは、N末端 およびC末端の処理、およびグリコシル化を含む複雑な翻訳後プロセシングおよび修飾を(実行)、それが分泌経路を介して、培養液中に外来タンパク質をエクスポートします。加えて、十分に確立された分子生物学的ツールは、異なる強度のプロモーターの制御下で、ユニまたは双方向エピソーム(非統合)シャトルベクターを含む、この酵母、で動作するように用意されています。少なくとも最後のではなく、相同DNA組換えの高い頻度は、現在、単一のタンパク質、ならびにより複雑な酵素経路8、12、13、23を進化させるために使用されているDNAの多様性を得るために開発される方法の範囲を許可しています。 in vivoでのギャップ修復し、この酵母のプルーフリーディング装置は、(DNAの配列同一性の約60%で)異なる遺伝子を再結合する際キメラを作成するだけでなく、directeから最高の子孫/突然変異をシャッフルするために使用することができますD進化キャンペーン、またはそれによって折り畳みや機能の面での変異体のライブラリを豊かに、in vitroおよび進化の1ラウンドのインビボ組換え方法で一緒に持って来ます。
開示事項
著者らは、開示することは何もありません。
謝辞
This work was supported by the European Commission project Indox-FP7-KBBE-2013-7-613549; a Cost-Action CM1303-Systems Biocatalysis; and the National Projects Dewry [BIO201343407-R] and Cambios [RTC-2014-1777-3].
資料
| Name | Company | Catalog Number | Comments |
| 1. Culture media | |||
| Ampicillin sodium salt | Sigma-Aldrich | A0166 | CAS Nº 69-52-3 M.W. 371.39 |
| Bacto Agar | Difco | 214010 | |
| Cloramphenicol | Sigma-Aldrich | C0378 | CAS Nº 56-75-7 M.W. 323.13 |
| D-(+)-Galactose | Sigma-Aldrich | G0750 | CAS Nº 59-23-4 M.W. 180.16 |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | CAS Nº 50-99-7 M.W. 180.16 |
| D-(+)-Raffinose pentahydrate | Sigma-Aldrich | 83400 | CAS Nº 17629-30-0 M.W. 594.51 |
| Peptone | Difco | 211677 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P0662 | CAS Nº 7778-77-0 M.W. 136.09 |
| Uracil | Sigma Aldrich | U1128 | |
| Yeast Extract | Difco | 212750 | |
| Yeast Nitrogen Base without Amino Acids | Difco | 291940 | |
| Yeast Synthetic Drop-out Medium Supplements without uracil | Sigma-Aldrich | Y1501 | |
| Name | Company | Catalog Number | Comments |
| 2. PCR Reactions | |||
| dNTP Mix | Agilent genomics | 200415-51 | 25 mM each |
| iProof High-Fidelity DNA polymerase | Bio-rad | 172-5301 | |
| Manganese(II) chloride tetrahydrate | Sigma-Aldrich | M8054 | CAS Nº 13446-34-9 M.W. 197.91 |
| Taq DNA Polymerase | Sigma-Aldrich | D4545 | For error prone PCR |
| Name | Company | Catalog Number | Comments |
| 3. Plasmid linearization | |||
| BamHI restriction enzyme | New England Biolabs | R0136S | |
| Bovine Serum Albumin | New England Biolabs | B9001S | |
| XhoI restriction enzyme | New England Biolabs | R0146S | |
| Not I restriction enzyme | New England Biolabs | R0189S | |
| Gel Red | Biotium | 41003 | For staining DNA |
| Name | Company | Catalog Number | Comments |
| 4. FOX assays | |||
| Ammonium iron(II) sulfate hexahydrate | Sigma-Aldrich | F3754 | CAS Nº 7783-85-9 M.W. 392.14 |
| Anysil Alcohol | Sigma Aldrich | W209902 | CAS Nº 105-13-5 M.W. 138.16 |
| D-Sorbitol | Sigma-Aldrich | S1876 | CAS Nº 50-70-4 M.W. 182.17 |
| Hydrogen peroxide 30% | Merck Millipore | 1072090250 | FOX standard curve |
| Xylenol Orange disodium salt | Sigma-Aldrich | 52097 | CAS Nº 1611-35-4 M.W. 716.62 |
| Name | Company | Catalog Number | Comments |
| 5. Agarose gel stuff | |||
| Agarose | Norgen | 28035 | CAS Nº 9012-36-6 |
| Gel Red | Biotium | 41003 | DNA analysis dye |
| GeneRuler 1kb Ladder | Thermo Scientific | SM0311 | DNA M.W. standard |
| Loading Dye 6x | Thermo Scientific | R0611 | |
| Low-melting temperature agarose | Bio-rad | 161-3112 | CAS Nº 39346-81-1 |
| Name | Company | Catalog Number | Comments |
| 6. Kits and cells | |||
| S. cerevisiae strain BJ5465 | LGC Promochem | ATTC 208289 | Protease deficient strain with genotype: MATα ura3-52 trp1 leu2-delta1 his3-delta200 pep4::HIS3 prb1-delta1.6R can1 GAL |
| E. coli XL2-Blue competent cells | Agilent genomics | 200150 | For plasmid purification and amplification |
| NucleoSpin Gel and PCR Clean-up Kit | Macherey-Nagel | 740,609,250 | DNA gel extraction |
| NucleoSpin Plasmid Kit | Macherey-Nagel | 740,588,250 | Column miniprep Kit |
| Yeast Transformation Kit | Sigma-Aldrich | YEAST1-1KT | Included DNA carrier (Salmon testes) |
| Zymoprep yeast plasmid miniprep I | Zymo research | D2001 | Plasmid extraction from yeast |
| Name | Company | Catalog Number | Comments |
| 7. Plates | |||
| 96-well plates | Greiner Bio-One | 655101 | Clear, non-sterile, polystyrene (for activity measurements) |
| 96-well plates | Greiner Bio-One | 655161 | Clear, sterile, polystyrene (for microfermentations) |
| 96-well plate lid | Greiner Bio-One | 656171 | Clear, sterile, polystyrene (for microfermentations) |
参考文献
- Jäckel, C., Hilvert, D. Biocatalysts by evolution. Curr. Opin. Biotechnol. 21 (6), 753-759 (2010).
- Bornscheuer, U. T. Engineering the third wave of biocatalysis. Nature. 485 (7397), 185-194 (2012).
- Renata, H., Wang, Z. W., Arnold, F. H. Expanding the enzyme universe: accessing non-natural reactions by mechanism-guided directed evolution. Angew. Chem. Int. Ed. 54 (11), 3351-3367 (2015).
- Cobb, R. E., Chao, R., Zhao, H. Directed evolution: past, present and future. AIChE J. 59 (5), 1432-1440 (2013).
- Abatemarco, J., Hill, A., Alper, H. S. Expanding the metabolic engineering toolbox with directed evolution. Biotechnol. J. 8 (12), 1397-1410 (2013).
- Pourmir, A., Johannes, T. W. Directed evolution: selection of the host organism. Comput Struct Biotechnol J. 2 (3), e201209012(2012).
- Krivoruchko, A., Siewers, V., Nielsen, J. Opportunities for yeast metabolic engineering: lessons from synthetic biology. Biotechnol J. 6 (3), 262-276 (2011).
- Gonzalez-Perez, D., Garcia-Ruiz, E., Alcalde, M. Saccharomyces cerevisiae in directed evolution: an efficient tool to improve enzymes. Bioeng Bugs. 3, 172-177 (2012).
- Alcalde, M. Mutagenesis protocols in Saccharomyces cerevisiae by In Vivo Overlap Extension. Methods Mol. Biol. 634, 3-14 (2010).
- Bulter, T., Alcalde, M. Preparing libraries in Saccharomyces cerevisiae. Methods. Mol. Biol. 231, 17-22 (2003).
- Ostrov, N., Wingler, L. M., Cornish, W. Gene assembly and combinatorial libraries in S. cerevisiae via reiterative recombination. Methods. Mol. Biol. 978, 187-203 (2013).
- Shao, Z., Zhao, H., Zhao, H. DNA assembler, an in vivo genetic method for rapid construction of biochemical pathways. Nucleic Acids Res. 37 (2), e16(2009).
- Alcalde, M. Engineering the ligninolytic enzyme consortium. Trends Biotechnol. 33 (3), 155-162 (2015).
- Garcia-Ruiz, E. Directed evolution of ligninolytic oxidoreductases: from functional expression to stabilization and beyond. Cascade Biocatalysis: integrating stereoselective and environmentally friendly reactions. , Wiley-VCH. 1-22 (2014).
- Hernandez-Ortega, A., Ferreira, P., Martinez, A. T. Fungal aryl-alcohol oxidase: a peroxide-producing flavoenzyme involved in lignin degradation. Appl. Microbiol. Biotechnol. 93 (4), 1395-1410 (2012).
- Gonzalez-Perez, D., Molina-Espeja, P., Garcia-Ruiz, E., Alcalde, M. Mutagenic organized recombination process by homologous in vivo grouping (MORPHING) for directed enzyme evolution. PLoS One. 9, e90919(2014).
- Rhee, S. G., Chang, T., Jeong, W., Kang, D. Methods for Detection and Measurement of Hydrogen Peroxide Inside and Outside of Cells. Mol. Cells. 29 (6), 539-549 (2010).
- Sebestova, E., Bendl, J., Brezovsky, J., Damborsky, J. Computational tools for designing smart libraries. Methods. Mol. Biol. 1179, 291-314 (2014).
- Viña-Gonzalez, J., Gonzalez-Perez, D., Ferreira, P., Martinez, A. T., Alcalde, M. Focused directed evolution of aryl-alcohol oxidase in yeast using chimeric signal peptides. Appl. Environ. Microbiol. , (2015).
- Gay, C., Collins, J., Gebicki, J. M. Hydroperoxide Assay with the Ferric-Xylenol orange Complex. Anal. Biochem. 273 (2), 149-155 (1999).
- Reetz, M. T. Biocatalysis in organic chemistry and biotechnology: Past, present, and future. J. Am. Chem. Soc. 135 (34), 12480-12496 (2013).
- Mate, D. M., Gonzalez-Perez, D., Mateljak, I., Gomez de Santos, P., Vicente, A. I., Alcalde, M. The pocket manual of directed evolution: Tips and tricks. Biotechnology of Microbial Enzymes: Production, Biocatalysis and Industrial Applications. , Elsevier. Forthcoming Forthcoming.
- Chao, R., Yuan, Y., Zhao, H. Recent advances in DNA assembly technologies. FEMS Yeast Res. 15, 1-9 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved