Method Article
בימוי שיטת אבולוציה
In This Article
Summary
We present a detailed protocol to construct and screen mutant libraries for directed evolution campaigns in Saccharomyces cerevisiae.
Abstract
אבולוציה מכוונת ב שמר אפייה מציעה יתרונות רבים אטרקטיביים בעת תכנון אנזימים עבור יישומים ביוטכנולוגיים, תהליך כרוך בבנייה, שיבוט וביטוי של ספריות מוטציה, מצמיד את רקומבינציה DNA בתדר גבוה ההומולוגית in vivo. כאן, אנו מציגים פרוטוקול ליצור ספריות מוטציה מסך בשמרים המבוססת על הדוגמא של מונואמין aryl-אלכוהול פטרייתי (AAO) כדי לשפר את הפעילות הכוללת שלה. שני מקטעי חלבון היו נתונים האבולוציה ממוקד בבימויו של mutagenesis אקראי וב רקומבינציה DNA vivo. מסוכך של ~ 50 נ"ב איגוף בכל מגזר אפשר וההרכבה הנכונה של גן AAO-פיוז'ן וקטור לינארית והוליד פלסמיד משכפלים מלא באופן אוטונומי. ספריות Mutant מועשרות גרסות פונקציונליות AAO הוקרנו ס supernatants cerevisiae עם assay תפוקה גבוהה רגיש המבוססת על התגובה פנטון. התהליך הכללי שלבניית ספרייה ב ס cerevisiae המתואר כאן יכול בקלות להיות מיושם להתפתח גני האיקריוטים רבים אחרים, הימנעות PCR תגובות נוספות, ב- DNA במבחנת צעדי רקומבינציה קשירה.
Introduction
אבולוציה מולקולרית בימוי היא שיטה חזקה, מהירה ואמינה לעצב אנזימים 1, 2. דרך סיבובים איטרטיבי של מוטציות אקראיות, רקומבינציה הקרנה, הגירסות משופרות של אנזימים יכולות להיוצר שפועלים על מצעים חדשים, בתגובות רומן, ב שאינו טבעי סביבות, או אפילו כדי לסייע התא כדי להשיג את המטרות מטבוליות חדשות 3-5. בין המארחים המשמשים אבולוציה מכוונת, את cerevisiae Saccharomyces שמרי בירה מציע רפרטואר של פתרונות עבור הביטוי הפונקציונלי של חלבונים איקריוטיים מורכבים שאינם זמינים אחרת עמיתיהם פרוקריוטים 6,7.
משומשים ממצה מחקרים בביולוגיה של התא, מודל אוקריוטים הקטן הזה יש יתרונות רבים מבחינת שלאחר translational שינויים, קלות ויעילות מניפולציה וטרנספורמציה, שכולן הן התכונות החשובות להנדס אנזימים על ידי אבולוציה מכוונת 8. יתר על כן, תדירות גבוההשל רקומבינציה DNA ההומולוגית ס cerevisiae מצמיד את מנגנון הוכחת הקריאה היעיל בה פותח מגוון רחב של אפשרויות ליצירת ספרייה והרכבת גני in vivo, טיפוח האבולוציה של מערכות שונות אנזימים יחידים מסלולים מלאכותיים מורכבים 9-12. המעבדה שלנו בילתה את העשור האחרון בעיצוב כלים ואסטראטגי עבור האבולוציה המולקולרית של ligninases השונה בשמרים (oxidoreductases מעורב השפלה של ליגנין במהלך דעיכת עץ טבעית) 13-14. בתקשורת זו, אנו מציגים פרוטוקול מפורט להכין וספריות מוטצית מסך ס cerevisiae עבור מודל flavooxidase, מונואמין -aryl-אלכוהול (AAO 15) -, כי יכול להיות מתורגם בקלות אנזימים רבים אחרים. הפרוטוקול כרוך שיטת אבולוציה ממוקדת מכוון (Morphing: תהליך רקומבינציה מוטגנים מאורגן על ידי הומולוגי in vivo קיבוץ) נעזרה במנגנון שמרים תא 16, גידולassay ההקרנה מאוד רגיש דה המבוססת על התגובה פנטון על מנת לזהות פעילות AAO מופרש לתוך המרק תרבות 17.
Protocol
1. בניית ספריית Mutant
- בחרו את האזורים להיות חשופים Morphing בעזרת אלגוריתמים חישוביים המבוססים על מודלי הומולוגית מבנה או קריסטל הזמין 18.
- כאן, למקד שני אזורים של AAO מ Pleurotus eryngii עבור mutagenesis ו רקומבינציה אקראית (Met [α1] -Val109, Phe392-Gln566), תוך הגברה והשאר של הגן (844 נ"ב) על ידי באיכות גבוהה PCR (איור 1).
הערה: מקטעים אחדים ניתן ללמוד על ידי Morphing באופן עצמאי או בשילוב 16.
- כאן, למקד שני אזורים של AAO מ Pleurotus eryngii עבור mutagenesis ו רקומבינציה אקראית (Met [α1] -Val109, Phe392-Gln566), תוך הגברה והשאר של הגן (844 נ"ב) על ידי באיכות גבוהה PCR (איור 1).
- הגבר את האזורים שהותקפו על ידי מוטגנים PCR. צור חפיפה בין אזורים ובין מגזרים (~ 50 נ"ב כל אחד) על ידי superimposing PCR תגובות של האזורים המוגדרים.
- כן PCR מוטגנים של מגזרים ממוקדים נפח סופי של 50 μl המכילים תבנית ה- DNA (0.92 ng / μl), 90 תחושת אוליגו ננומטר (RMLN עבור המגזר אמ"ן AAO-BP עבור המגזר M-II), 90 ננומטרפריימר ntisense (AAO-92C עבור מגזר אמ"ן RMLC עבור מגזר M-II), 0.3 מ"מ dNTPs (0.075 מ"מ כל אחד), 3% (v / v) dimethylsulfoxide (DMSO), 1.5 מ"מ 2 MgCl, 0.05 מ"מ MnCl 2 ו 0.05 U / μl פולימראז תקי DNA. רצפי Primers מפורטים באיור 1.
- השתמש תוכנית ה- PCR הבאה: 95 מעלות צלזיוס למשך 2 דקות (1 מחזור); 95 מעלות צלזיוס למשך 45 שניות, 50 מעלות צלזיוס למשך 45 שניות, 74 מעלות צלזיוס למשך 45 שניות (28 מחזורים); ו -74 מעלות צלזיוס במשך 10 דקות (1 מחזור).
- הגבר את האזורים שאינם מוטגנים עם פולימראז נאמנות הגבוהה במיוחד וכולל אזורים המקבילים חופפי המגזרים מוטגנים / או סככות וקטור הוא לינארית.
- הכן תערובת התגובה בנפח סופי של 50 μl המכיל: תבנית ה- DNA (0.2 ng / μl), 250 ננומטר תחושה אוליגו HFF, 250 HFR antisense אוליגו ננומטר, 0.8 מ"מ dNTPs (0.2 מ"מ כל אחד), 3% (v / v) dimethylsulfoxide (DMSO) ו 0.02 U / μl iproof DNA פולימרז. רצפי Primers מפורטים איור 1.
- השתמש תוכנית ה- PCR הבאה: 98 מעלות צלזיוס למשך 30 שניות (1 מחזור); 98 מעלות צלזיוס למשך 10 שניות, 55 מעלות צלזיוס למשך 25 שניות, 72 מעלות צלזיוס למשך 45 שניות (28 מחזורים); ו -72 מעלות צלזיוס במשך 10 דקות (1 מחזור).
הערה: עם התנאים המתוארים 1.2 ו -1.3 חפיפות של 43 נ"ב (אזור פלסמיד-M1); 46 נ"ב (אזור לאזור HF M1); 47 נ"ב (אזור-M2 HF באזור) ו -61 נ"ב (פלסמיד אזור- M2) נועדו (איור 1) להעדיף ב שחבור vivo בשמרים. - לטהר את כל שברי PCR (מוטגנים הלא מוטגנים) עם ערכת חילוץ ג'ל מסחרית על פי הפרוטוקול של היצרן.
- Linearize וקטור כך איגוף אזורים של כ -50 נ"ב נוצרים כי הם הומולוגיים אל 5'- ו 3'-הקצוות של גן המטרה.
- הכינו תערובת התגובה לינאריזציה המכיל 2 מיקרוגרם DNA, 7.5 U בם HI, 7.5 U Xho לי, 20 מיקרוגרם BSA ו -2 μl של הצפת Baמ HI 10x בנפח סופי של 20 μl.
- דגירת תערובת התגובה על 37 מעלות צלזיוס למשך 2 שעות ו -40 דקות. לאחר מכן, להמשיך עם איון על 80 מעלות צלזיוס למשך 20 דקות.
- לטהר את הווקטור לינארית על ידי מיצוי ג'ל agarose כדי למנוע זיהום עם הפלסמיד העגול שיורית (איור 2).
- טען את תערובת התגובה העיכול אל-היטב מגה של ג'ל agarose נקודת התכה נמוכה חצי preparative (0.75%, w: נ) וכן aliquot (5 μl) של תערובת התגובה ב הסמוך גם ככתב.
- הפעלה אלקטרופורזה DNA (5 V / ס"מ בין האלקטרודות, 4 ᵒC) ולהפריד את הג'ל agarose המתאים היטב מגה ולאחסן אותו ב 4 ᵒC ב 1x טה.
- כתם השביל עם סולם המשקל המולקולרי ואת הכתב. דמיינו את הלהקות תחת אור UV. ניק במצב שבו מקומות הווקטור לינארית.
הערה: ככל איכות הווקטור לינארית המטוהר היא critiגורם cal עבור רקומבינציה והרכבה מוצלחת בשמרים, להימנע מכתים ג'ל אלקטרופורזה DNA חצי preparative. השימוש של צבעים וחשיפת UV להפקת ג'ל עשוי להשפיע על היציבות של וקטור DNA, להתפשר על יעילות רקומבינציה vivo. כפי אלטרנטיבת צבעי EtBr רעילים, ג'ל אדום וצבעי SYBR משמשים עבור מכתים ג'ל. - בהיעדר אור UV, לזהות את הווקטור לינארית ב שהבר מגה-גם באמצעות הדרכתו של ניקס בנתיב הכתב המוכתם כך שהוא יכול להיות מבודד.
- חלץ את הווקטור לינארית מ agarose ולטהר אותו עם ערכת חילוץ ג'ל מסחרית על פי הפרוטוקול של היצרן.
הערה: וקטורים הסעות episomal גבוהה עותק השתמש בטושים אנטיביוטיקה auxotrophy: בדוגמה זו שיישמנו אורציל עצמאית אמפיצילין התנגדות וקטור pJRoC30, תחת שליטה של האמרגן שמרים GAL1.
- הכן מיל equimolarxture של שברי PCR ומערבב אותו עם הווקטור לינארית ב יחס של 2: 1, עם לא פחות מ -100 ננוגרם של פלסמיד לינארית (יחסים שונים במבחן וקטור equimolar ספרייה / פתוח להשיג תשואות טרנספורמציה טובות).
- מדוד את הספיגה של שברי PCR ו הווקטור לינארית ב 260 ננומטר ו -280 ננומטר כדי לקבוע הריכוז והטוהר שלהם.
- Transform בתאי שמרים מוסמך בתערובת DNA באמצעות ערכת טרנספורמציה שמרים מסחרית (ראה טבלה עבור אספקה) על פי הוראות היצרן.
- הנה, להשתמש פרוטאז לקוי URA3 - תלוי ס זן cerevisiae, BJ5465. להפוך את התאים עם וקטור circularized הורית כסטנדרט פנימי במהלך ההקרנה (ראה להלן). בנוסף, לבדוק את הרקע על ידי הפיכת הווקטור לינארית בהעדר שבר PCR.
הערה: במקרה של התגלה רמות הפרשה נמוכות ראשוניות, השתמש סcerevisiae פרוטאז זנים לקוי כמו BJ5465 לטפח הצטברות של חלבון פעיל supernatants תרבות. אם אנזים היעד עובר hyperglycosylation, שימוש זני glycosylation מחסר (למשל, Δ kre2 כי הוא מסוגל רק הצמדת oligomers מנוז הקטן) יכול להיות אופציה מתאימה.
- הנה, להשתמש פרוטאז לקוי URA3 - תלוי ס זן cerevisiae, BJ5465. להפוך את התאים עם וקטור circularized הורית כסטנדרט פנימי במהלך ההקרנה (ראה להלן). בנוסף, לבדוק את הרקע על ידי הפיכת הווקטור לינארית בהעדר שבר PCR.
- פלייט תאי טרנספורמציה על צלחות נשירת SC הדגירה אותם ב 30 מעלות צלזיוס למשך שלושה ימים. פלייט (על צלחות הנשירה SC בתוספת אורציל) URA3 - ס תאי cerevisiae חסרי פלסמיד כביקורת שלילית להקרנה (ראה להלן).
2. תפוקה גבוהה הקרנת Assay (איור 3)
- מלאו מספר מתאים של 96-גם צלחות סטרילי (23 צלחות לנתח ספרייה של 2,000 שיבוטים) עם 50 μl בינוניים מינימאלי לכל טוב בעזרת רובוט pipetting.
- פיק מושבות בודדות מתוך SC-נושרים צלחות ולהעבירם צלחות 96-היטב.
- בכל צלחת, לחסן מספר העמודה 6 עם סוג הורית כסטנדרט פנימי היטב H1 עם URA3 - ס תאים cerevisiae (במדיום SC בתוספת אורציל) ללא פלסמיד כביקורת שלילית.
הערה: ובכן H1 מלא במיוחד עם התקשורת הנשירה בתוספת אורציל. מדיה ריק היטב המכיל ללא תאים ניתן להכין גם כפקד עקרות נוספים.
- בכל צלחת, לחסן מספר העמודה 6 עם סוג הורית כסטנדרט פנימי היטב H1 עם URA3 - ס תאים cerevisiae (במדיום SC בתוספת אורציל) ללא פלסמיד כביקורת שלילית.
- מכסים את הצלחות עם העפעפיים שלהם ועוטפים אותם Parafilm. דגירת צלחות עבור 48 שעות ב 30 מעלות צלזיוס, 225 סל"ד ולחות יחסית 80% שייקרו ולח.
- הסר את Parafilm, להוסיף 160 μl של מדיום ביטוי היטב כל בעזרת רובוט pipetting, לאטום את צלחות דגירה אותם במשך שעות 24 נוספות.
הערה: בינוני מינימל ובינוני ביטוי ערוך כפי שדווחו במקומות אחרים 19. רמות ההפרשה עשויות להשתנות תלויים הגן נחקר ובהתאם, tהוא הדגירה פעמים חייבות להיות מותאמות בכל מקרה לסנכרן את צמיחת תאים בכל הבארות. - צנטריפוגה צלחות (צלחות אב) ב 2,800 x ז במשך 10 דקות ב 4 ° C.
- העברת 20 μl של supernatant מבארות בצלחת המאסטר לצלחת העתק באמצעות נוזל טיפול multistation רובוטית.
הערה: כדי להעדיף הפרשת אנזים רצוי להחליף את הפפטיד אות יליד חלבון המטרה על ידי פפטידים אות נפוצים ביטוי Heterologous בשמרים (למשל, גורם α prepro-המנהיג, המנהיג של הרעלן Killer 1 K מ ס cerevisiae, או גרסאות כימרי אפילו של שני פפטידים 13). לחלופין, הפפטיד אות היליד ניתן התפתח באופן בלעדי עבור הפרשה בשמרים. - הוסף 20 μl של 2 מ"מ p -methoxybenzylalcohol ב- pH חיץ פוספט נתרן 100 מ"מ 6.0 בעזרת הרובוט pipetting. מערבבים את צלחות בקצרה עם 96-אנחנוll מערבל צלחת דגירה אותם במשך 30 דקות ב RT.
- עם רובוט pipetting, להוסיף 160 μl של מגיב FOX על כל צלחת העתק ומערבבים בקצרה עם מערבל (הריכוז הסופי של תערובת FOX בבאר: 100 מיקרומטר xylenol כתום, 250 מיקרומטר Fe (NH 4) 2 (SO 4) 2 ו 25 מ"מ H 2 SO 4).
- הוסף מספר ותוספות מגיבים כדי לשפר את הרגישות, כגון ממסי שיתוף אורגניים (DMSO, אתנול, מתנול) או סורביטול 17. הנה, להגביר את התגובה על ידי הוספת סורביטול לריכוז סופי של 100 מ"מ (איור 4).
- קראו את הצלחות (מצב נקודת סיום, t0) ב 560 ננומטר על קורא צלחת.
- דגירת הצלחות ב RT עד שצבע מפתחת מדידת הבליעה שוב (t 1).
- חשבתי את הפעילות היחסית מהפער בין שווי Abs לאחר דגירה וכי המדידה הראשונית מנורמל פאךקסוג פתיחות opening סגירות closures עבור כל צלחת (Δt 1 - t0).
- נושא להיטי המוטציה הטובים ביותר לשני מחדש הקרנות רצופות כדי לשלול תוצאות חיוביות שגויות.
הערה: בדרך כלל, מחדש הקרנות כוללות בידוד פלסמיד מן השמרים, הגברה וטיהור Escherichia coli, ואחריו טרנספורמציה של תאי שמרים טריים עם הפלסמיד 19. כל כפיל שנבחר מחדש הוקרן pentaplicate.
תוצאות
AAO מ פ eryngii הוא flavooxidase תאי המספק peroxidases פטרייתי עם H 2 O 2 כדי להתחיל לתקוף ליגנין. שני קטעים של AAO היו נתוני אבולוציה ממוקדת בבימויו של Morphing כדי לשפר את פעילותה וביטויו ס cerevisiae 19. בלא קשר עם אנזימים חוץ שטיפחו ס cerevisiae, הנושא הקריטי ביותר בעת בניית ספריות מוטציה בשמרים נוגעת ההנדסה של אזורים חופפים ספציפיים להעדיף את השחבור בין שברי השיבוט שלהם לתוך הווקטור לינארית. בדוגמה הנוכחית, עבור כל תגובה PCR, כל שברי היה המסוכך של כ -50 נ"ב לקדם שחבור vivo בשמרים. מספר אירועי רקומבינציה תלוי במספר המגזרים צריך להרכיב את הציוד משובט עם הווקטור לינארית (כלומר, שני אירועים מוצלבים התקיימו ביןבשלושה מגזרים PCR -The בשני מגזרי מוטגנים איגוף segment- הלא mutagenized בתוספת שני צמתים נוספים עם וקטור לינארית; איור 1). על פי הניסיון שלנו, רצפים חופפים יותר מ -50 נ"ב להקטין את הסבירות של רקומבינציה פנימית בזמן שהם לא לשפר את היעילות הטרנספורמציה.
המון מוטציוני הותאמו באמצעות דגימת ספריות מוטציה עם נופים שונים, בחישוב מספר שיבוטים עם <10% של פעילות האנזים הורית, ובהמשך לבדוק אותם על ידי רצף מדגם אקראי של וריאנטים הפעיל והלא פעיל (איור 5 א). לקביעת המקדם השונה ס תאי cerevisiae שהוסבו עם AAO ההורים מצופים על ושחרר SC צלחות. מושבות בודדות היו נקטפים מחוסנים בתוך צלחת גם 96 ואת הפעילות של השיבוטים הוערכה מן ההכנות טריות. מדגם מוטגנים2 (תקי / MnCl 2 0.05 מ"מ) נבחר כנקודת היציאה לבניית הקרנת ספרייה.
היות והפעילות הביולוגית של AAO מגביר את הריכוז H 2 O 2 במדיום התגובה, חיפשנו assay רגיש ומדויק לכמת שינויים קלים H 2 O 2. FOX היא שיטה כימית המבוססת על התגובה פנטון 20, לפיה חמצון על ידי H 2 O 2 כוננים התגובה של Fe 3+ עם כתום xylenol לגבש כחול-סגול מורכבים (o -cresolsulfone-phthalein 3 ', 3' '- bis (methylimino) diacetate ε 560 = 1.5 x 10 4 M -1 cm -1). צעד חמצון הברזל היה מוגבר על ידי הוספת סורביטול כדי לשפר את הרגישות של assay, הגדלת ההתפשטות של רדיקלים עם ε לכאורה 560 = 2.25 x 10 5 M -1 cm -1 (אלחוטיאיור 4).
את גבול הגילוי של assay זה (בטווח מיקרומטר) חושב לפי שיטת קביעת בלנק בצלחת 96-היטב עם סטנדרטים בשלושה עותקים (0, 0.5, 1, 1.5, 2, 2.5, 3 ו -4 מיקרומטר H 2 O 2 ) ושימוש כמה supernatants מ ס cerevisiae חסר URA3 - פלסמיד (איור 5). את הבחינה כמו ליניארי בנוכחות סורביטול (עד 8 מיקרומטר של H 2 O 2), ולמרות ליניאריות היה יותר מתמיד בהיעדר סוכר זה (לפחות עד 30 מיקרומטר של H 2 O 2), התגובה הייתה חלשה (למשל, ב -6 מיקרומטר של H 2 O 2, שיפור של פי 4 הושג בנוכחות סורביטול -deep בסגול מתוך ספיגה של 0.24 בהעדרה -dark הכתום (איור 5 ב)). הקשר בין שרירי בטן ואת ריכוז AAO הוערך עם כמויות גדלות והולכות של דוארnzyme (מן supernatants שמרים) ו תגובה ליניארי נצפה; R 2 = 0.997 (איור 5 ג).
ראוי לציין כי אות FOX הייתה יציבה במשך כמה שעות ללא כל הפרעה נראית לעין על ידי הגורמים השונים במרק התרבות. הרגישות המוערכת של FOX הייתה ~ 0.4 מיקרומטר של H 2 O 2 המיוצר על ידי AAO ב supernatant בנוכחות סורביטול, ו ~ 2 מיקרומטר בהעדרה.
ספריית מוטציה של 2,000 שיבוטים נבנתה והוקרנה עם assay זה. מוטנטים כמה AAO זוהו עם הפרשה השתפרה בעיקר ופעילות נגד אלכוהול p -methoxybenzyl (5D איור) 19.

איור 1.. Morphing פרוטוקול אבולוציה AAO שני אזורים שונים של AAO היו מטרה mutagenesis ו רקומבינציה אקראית: M1 (כחול, 590 נ"ב) הכוללת את הפפטיד האות (SP); M2 (צהוב, 528 נ"ב). אזור HF (האפור, 844 נ"ב) היה מוגבר עם polymerases איכות גבוהה. אזורים מוטגנים מופו במבנה הגבישי של AAO (PDB מזהה: 3FIM). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
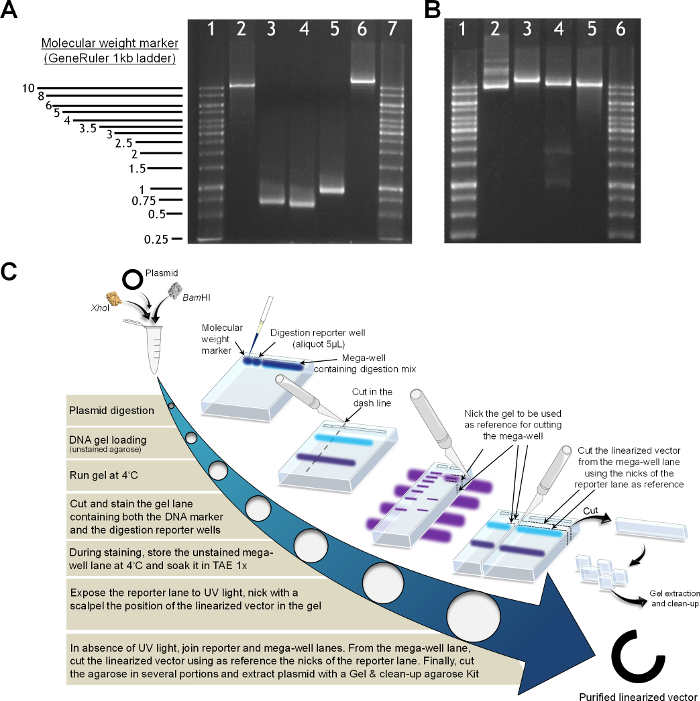
הכנה איור 2. של מוצרים PCR ואת לינארית וקטור (א) ג'ל agarose אנליטית (1% w: נ). המכיל סמן משקל מולקולרי (1 סולם kb) במסלולים 1 ו -7; בם HI ו Xho וקטור לינארית לי, מסלול 2; PCR קטע M1, מסלול 3; PCR קטע M2, מסלול 4; HF קטע PCR, מסלול 5; נאיבו מחדש וקטור לינארית עם Nhe אני (המכיל את גן AAO המלא עם אזורי MI, HF ו- M-II), ליין 6. (ב) לינאריזציה וקטור, מסלולי 1 ו -6 סטנדרטים מולקולריים, סולם Kb 1; פלסמיד miniprep, מסלול 2; פלסמיד לינארית עם Nhe אני, מסלול 3; פלסמיד לינארית עם Bam HI ו Xho לי, מסלול 4; הפלסמיד לינארית מתקבל על ידי מיצוי ג'ל לניקוי לאחר עיכול, ליין 5. (ג) פרוטוקול טיהור פלסמיד. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. פרוטוקול הקרנת תפוקה גבוהה. סקירה כללית של התהליך. אנא לחץ כאן כדי להציג vers גדוליון של נתון זה.

איור 4. שיטת FOX. פטריות לבנות-ריקבון לתקוף את דופן התא של עץ באמצעות תגובה פנטון שמייצרת הידרוקסיל רדיקלי OH •. זוגות שיטת FOX שתגובה זו xylenol הכתום (XO), ואת הספיגה של מתחם 3+ XO-Fe נמדדה ב 560 ננומטר. חמצון שחור מוגבר על ידי התוספת של סורביטול לתערובת המגיבה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5. מוטגנים נופי הדרכה לספריות Morphing שימוש שגיאה שונה נוטה PCR תנאים ותיקוף של Assay ההקרנה. (א ng>) נופים Morphing. קו אופקי מוצק מציגה את פעילות מן הסוג ההורים ב assay ואילו קווים מקווקווים מציינים את מקדם ההשתנות של assay. האחוזים מציינים את מספר שיבוטים עם פחות מ -10% של פעילות האנזים ההורית. פעילויות נרשמות בסדר יורד. (ב) גבול גילוי FOX הוערך עם ריכוז גדל והולך של H 2 O 2 (העיגולים השחורים) הנוכחות והיעדרות (ריבועים לבנים) של סורביטול. (C) קשר לינארי בין ריכוז AAO (supernatants transformant) ו- ABS 560nm. כל נקודה תואמת את הממוצע של 8 ניסויים וכולל את סטיית התקן. (ד) נוף הספרייה Mutant. וריאנטים הנבחרים (המרובע מוצל) היו rescreened כפי שדווחו במקומות אחרים 19. קו מוצק מציג את הפעילות מסוג הורי AAO.> אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
במאמר זה, יש לנו סכמתי רוב הטיפים והטריקים המועסקים במעבדה שלנו להנדס אנזימים על ידי אבולוציה מכוונת ס cerevisiae (באמצעות AAO כדוגמא), כך שהם יכולים להיות מותאמים לשימוש עם מערכות אנזימים האיקריוטים רבות אחרות על ידי ביצוע הגישה הנפוצה פשוט המתואר כאן.
במונחים של יצירת ספרייה, Morphing היא שיטה בסיר אחד מהר כדי להציג ולשלב מחדש מוטציות אקראיות בתוך רצועות חלבון קטנות תוך השארת האזורים הנותרים של החלבון 16 ללא שינוי. ספריות עם כמה המון מוטציוני ניתן להכין בקלות recombined in vivo, יחד עם הפלסמיד לינארית, כדי ליצור וקטור מלא משכפלים באופן אוטונומי. זה קריטי, כי רצפים חופפים אגף כל מתיחה לאפשר שברי הגן המלא להיות מחדש באמצעות רקומבינציה in vivo, הימנעות PCR תגובות נוספות בצעדי קשירה במבחנה. ב p זהrotocol, תדירות אירועים מוצלבים בין שברי PCR יכול להיות מוגברת על ידי הקטנת הגודל של האזורים החופפים, אם כי זה עשוי לסכן את יעילות השינוי. לא משנה של polymerases DNA המשמש PCR מוטגנים, נטען מוטציוני יכול להיות מותאם על ידי בנייה בעבר וניתוח נופי ספריית מוטציה קטנה (איור 5 א). אם ערכת GeneMorph השנייה משמשת, זה עדיין מומלץ לעקוב גישה זו מאז רקומבינציה DNA vivo ב יכולה לשנות את עומסי מוטציוני בעיקר מוערכים על ידי היצרן. באופן כללי, נופים מוטנטית, 35 - 50% של שיבוטים הכולל הוקרנו יש פחות מ -10% מפעילות ההורים מתאימים קמפייני אבולוציה מכוונים, אם כי מספר זה משתנה כפונקציה של חלבון המטרה ופעילותה. בדרך כלל, הניתוח של נופי ספריות מוטציה מאומת נוסף על ידי רצפי DNA של מדגם אקראי של מוטציות. בדוגמה הנוכחית, תקי DNA פולימרז שמש בשל השיעור הגבוה של הטעות שלה, אשר קשור לחוסר 3'→ 5'proof-קריאת פעילות exonuclease. נטען מוטציוני בספריות תקי שונו על ידי תוספת של ריכוזים שונים של MnCl 2, אך השימוש dNTPs מאוזן ו / או הפחתה בריכוזי תבנית הגן הם גם אפשרויות מתאימות. ולמגבלות של Morphing נובעת ממספר מגזרים להיות recombined. על פי הניסיון שלנו, עד ארבעה בלוקי חלבון (חמישה אירועים מוצלבים ספירה באזורים רקומבינציה עם הווקטור לינארית) ניתן שחבור עם תשואות טרנספורמציה טובות (~ 10 5 שיבוטים לכל תגובת טרנספורמציה). שיטה זו יכולה בקלות להיות שונה כדי mutagenesis באתר-רוויה מרובה בצע (למשל, באמצעות NDT פריימרים מנוונים או יצירת ניוון עבור 22 קודונים ייחודיים) לחקור מספר תפקידים בו זמנית תוך צמצום מאמצי ההקרנה באופן משמעותי 21,22.
ss = "jove_content"> פרוטוקול ההקרנה "העיוור" הישיר AAO הוא מאוד רגיש ואמין (מבוסס על זיהוי הישיר של H 2 O 2 תלות המצע בשימוש על ידי האנזים), מייצג assay משלים אחר ותיק עקיף פרוטוקולים לזהות חמצניים (peroxidases צימוד בעיקר עם מצעים colorimetric). ואכן, assay FOX הועסק באופן שגרתי כדי למדוד H 2 O 2 ב נוזלים ביולוגיים, וזה יכול עכשיו להיות מתורגם בקלות לתוך פרוטוקולים להתפתח AAO וכל אחרים H 2 O 2 בייצור אנזימים (למשל, oxidases גלוקוז, דהידרוגנאז cellobiose, Glyoxal oxidases, oxidases מתנול), במיוחד עבור פעילות על מצעים שאינם טבעיים שבו תגובות קשות אחרת כדי לזהות.
ס cerevisiae הוא המארח הנאות ביותר אבולוציה מכוונת של גנים אוקריוטים שכן הוא מציע יעילויות הטרנספורמציה גבוהות (עד 1 x 106 transformants / מיקרוגרם DNA), הוא מבצע עיבוד שלאחר translational מורכב ושינויים (כולל N- ועיבוד C- מסוף, ו glycosylation) וזה מייצא חלבונים זרים לתוך מרק התרבות באמצעות מסלול הפרשה. בנוסף, כלי ביולוגיה מולקולרית ומבוססים זמינים לעבודה עם שמרים זה, כולל וקטורי הסעות חַד או דו-כיוונית episomal (בלתי משתלב) בשליטת היזמים של עוצמות שונות. ואחרון חביב, תדירות הגבוהה של רקומבינציה DNA ההומולוגית אפשרה מגוון של שיטות כדי להתפתח להשיג גיוון DNA כי נמצאים בשימוש כיום להתפתח חלבונים יחידים, כמו גם מסלולי אנזימים מורכבים יותר 8, 12, 13, 23. תיקון פער vivo ב ואת מכשיר קורא ההוכחה שמרים זה יכול גם להיות מועסק כדי ליצור מפלצות כאשר recombining גנים שונים (הכולל כ. 60% של זהות רצף ה- DNA), כמו גם דשדוש טובת צאצאים / מוטציות מתוך ישירה"ד קמפיין האבולוציה, או להפגיש במבחנה בשיטות רקומבינציה vivo בסיבוב אחד של האבולוציה, ובכך להעשיר ספריות מוטציה מבחינת foldability ותפקוד.
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
This work was supported by the European Commission project Indox-FP7-KBBE-2013-7-613549; a Cost-Action CM1303-Systems Biocatalysis; and the National Projects Dewry [BIO201343407-R] and Cambios [RTC-2014-1777-3].
Materials
| Name | Company | Catalog Number | Comments |
| 1. Culture media | |||
| Ampicillin sodium salt | Sigma-Aldrich | A0166 | CAS Nº 69-52-3 M.W. 371.39 |
| Bacto Agar | Difco | 214010 | |
| Cloramphenicol | Sigma-Aldrich | C0378 | CAS Nº 56-75-7 M.W. 323.13 |
| D-(+)-Galactose | Sigma-Aldrich | G0750 | CAS Nº 59-23-4 M.W. 180.16 |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | CAS Nº 50-99-7 M.W. 180.16 |
| D-(+)-Raffinose pentahydrate | Sigma-Aldrich | 83400 | CAS Nº 17629-30-0 M.W. 594.51 |
| Peptone | Difco | 211677 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P0662 | CAS Nº 7778-77-0 M.W. 136.09 |
| Uracil | Sigma Aldrich | U1128 | |
| Yeast Extract | Difco | 212750 | |
| Yeast Nitrogen Base without Amino Acids | Difco | 291940 | |
| Yeast Synthetic Drop-out Medium Supplements without uracil | Sigma-Aldrich | Y1501 | |
| Name | Company | Catalog Number | Comments |
| 2. PCR Reactions | |||
| dNTP Mix | Agilent genomics | 200415-51 | 25 mM each |
| iProof High-Fidelity DNA polymerase | Bio-rad | 172-5301 | |
| Manganese(II) chloride tetrahydrate | Sigma-Aldrich | M8054 | CAS Nº 13446-34-9 M.W. 197.91 |
| Taq DNA Polymerase | Sigma-Aldrich | D4545 | For error prone PCR |
| Name | Company | Catalog Number | Comments |
| 3. Plasmid linearization | |||
| BamHI restriction enzyme | New England Biolabs | R0136S | |
| Bovine Serum Albumin | New England Biolabs | B9001S | |
| XhoI restriction enzyme | New England Biolabs | R0146S | |
| Not I restriction enzyme | New England Biolabs | R0189S | |
| Gel Red | Biotium | 41003 | For staining DNA |
| Name | Company | Catalog Number | Comments |
| 4. FOX assays | |||
| Ammonium iron(II) sulfate hexahydrate | Sigma-Aldrich | F3754 | CAS Nº 7783-85-9 M.W. 392.14 |
| Anysil Alcohol | Sigma Aldrich | W209902 | CAS Nº 105-13-5 M.W. 138.16 |
| D-Sorbitol | Sigma-Aldrich | S1876 | CAS Nº 50-70-4 M.W. 182.17 |
| Hydrogen peroxide 30% | Merck Millipore | 1072090250 | FOX standard curve |
| Xylenol Orange disodium salt | Sigma-Aldrich | 52097 | CAS Nº 1611-35-4 M.W. 716.62 |
| Name | Company | Catalog Number | Comments |
| 5. Agarose gel stuff | |||
| Agarose | Norgen | 28035 | CAS Nº 9012-36-6 |
| Gel Red | Biotium | 41003 | DNA analysis dye |
| GeneRuler 1kb Ladder | Thermo Scientific | SM0311 | DNA M.W. standard |
| Loading Dye 6x | Thermo Scientific | R0611 | |
| Low-melting temperature agarose | Bio-rad | 161-3112 | CAS Nº 39346-81-1 |
| Name | Company | Catalog Number | Comments |
| 6. Kits and cells | |||
| S. cerevisiae strain BJ5465 | LGC Promochem | ATTC 208289 | Protease deficient strain with genotype: MATα ura3-52 trp1 leu2-delta1 his3-delta200 pep4::HIS3 prb1-delta1.6R can1 GAL |
| E. coli XL2-Blue competent cells | Agilent genomics | 200150 | For plasmid purification and amplification |
| NucleoSpin Gel and PCR Clean-up Kit | Macherey-Nagel | 740,609,250 | DNA gel extraction |
| NucleoSpin Plasmid Kit | Macherey-Nagel | 740,588,250 | Column miniprep Kit |
| Yeast Transformation Kit | Sigma-Aldrich | YEAST1-1KT | Included DNA carrier (Salmon testes) |
| Zymoprep yeast plasmid miniprep I | Zymo research | D2001 | Plasmid extraction from yeast |
| Name | Company | Catalog Number | Comments |
| 7. Plates | |||
| 96-well plates | Greiner Bio-One | 655101 | Clear, non-sterile, polystyrene (for activity measurements) |
| 96-well plates | Greiner Bio-One | 655161 | Clear, sterile, polystyrene (for microfermentations) |
| 96-well plate lid | Greiner Bio-One | 656171 | Clear, sterile, polystyrene (for microfermentations) |
References
- Jäckel, C., Hilvert, D. Biocatalysts by evolution. Curr. Opin. Biotechnol. 21 (6), 753-759 (2010).
- Bornscheuer, U. T. Engineering the third wave of biocatalysis. Nature. 485 (7397), 185-194 (2012).
- Renata, H., Wang, Z. W., Arnold, F. H. Expanding the enzyme universe: accessing non-natural reactions by mechanism-guided directed evolution. Angew. Chem. Int. Ed. 54 (11), 3351-3367 (2015).
- Cobb, R. E., Chao, R., Zhao, H. Directed evolution: past, present and future. AIChE J. 59 (5), 1432-1440 (2013).
- Abatemarco, J., Hill, A., Alper, H. S. Expanding the metabolic engineering toolbox with directed evolution. Biotechnol. J. 8 (12), 1397-1410 (2013).
- Pourmir, A., Johannes, T. W. Directed evolution: selection of the host organism. Comput Struct Biotechnol J. 2 (3), e201209012(2012).
- Krivoruchko, A., Siewers, V., Nielsen, J. Opportunities for yeast metabolic engineering: lessons from synthetic biology. Biotechnol J. 6 (3), 262-276 (2011).
- Gonzalez-Perez, D., Garcia-Ruiz, E., Alcalde, M. Saccharomyces cerevisiae in directed evolution: an efficient tool to improve enzymes. Bioeng Bugs. 3, 172-177 (2012).
- Alcalde, M. Mutagenesis protocols in Saccharomyces cerevisiae by In Vivo Overlap Extension. Methods Mol. Biol. 634, 3-14 (2010).
- Bulter, T., Alcalde, M. Preparing libraries in Saccharomyces cerevisiae. Methods. Mol. Biol. 231, 17-22 (2003).
- Ostrov, N., Wingler, L. M., Cornish, W. Gene assembly and combinatorial libraries in S. cerevisiae via reiterative recombination. Methods. Mol. Biol. 978, 187-203 (2013).
- Shao, Z., Zhao, H., Zhao, H. DNA assembler, an in vivo genetic method for rapid construction of biochemical pathways. Nucleic Acids Res. 37 (2), e16(2009).
- Alcalde, M. Engineering the ligninolytic enzyme consortium. Trends Biotechnol. 33 (3), 155-162 (2015).
- Garcia-Ruiz, E. Directed evolution of ligninolytic oxidoreductases: from functional expression to stabilization and beyond. Cascade Biocatalysis: integrating stereoselective and environmentally friendly reactions. , Wiley-VCH. 1-22 (2014).
- Hernandez-Ortega, A., Ferreira, P., Martinez, A. T. Fungal aryl-alcohol oxidase: a peroxide-producing flavoenzyme involved in lignin degradation. Appl. Microbiol. Biotechnol. 93 (4), 1395-1410 (2012).
- Gonzalez-Perez, D., Molina-Espeja, P., Garcia-Ruiz, E., Alcalde, M. Mutagenic organized recombination process by homologous in vivo grouping (MORPHING) for directed enzyme evolution. PLoS One. 9, e90919(2014).
- Rhee, S. G., Chang, T., Jeong, W., Kang, D. Methods for Detection and Measurement of Hydrogen Peroxide Inside and Outside of Cells. Mol. Cells. 29 (6), 539-549 (2010).
- Sebestova, E., Bendl, J., Brezovsky, J., Damborsky, J. Computational tools for designing smart libraries. Methods. Mol. Biol. 1179, 291-314 (2014).
- Viña-Gonzalez, J., Gonzalez-Perez, D., Ferreira, P., Martinez, A. T., Alcalde, M. Focused directed evolution of aryl-alcohol oxidase in yeast using chimeric signal peptides. Appl. Environ. Microbiol. , (2015).
- Gay, C., Collins, J., Gebicki, J. M. Hydroperoxide Assay with the Ferric-Xylenol orange Complex. Anal. Biochem. 273 (2), 149-155 (1999).
- Reetz, M. T. Biocatalysis in organic chemistry and biotechnology: Past, present, and future. J. Am. Chem. Soc. 135 (34), 12480-12496 (2013).
- Mate, D. M., Gonzalez-Perez, D., Mateljak, I., Gomez de Santos, P., Vicente, A. I., Alcalde, M. The pocket manual of directed evolution: Tips and tricks. Biotechnology of Microbial Enzymes: Production, Biocatalysis and Industrial Applications. , Elsevier. Forthcoming Forthcoming.
- Chao, R., Yuan, Y., Zhao, H. Recent advances in DNA assembly technologies. FEMS Yeast Res. 15, 1-9 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved