Method Article
マイクロ波照射を用いて潜在的な抗寄生虫治療薬としてのバックボーン環状ペプチドライブラリの開発
要約
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
要約
タンパク質 - タンパク質相互作用薬(PPI)は、ほぼすべての生物学的プロセスに密接に関与しており、多くのヒト疾患にリンクされています。そのため、基礎研究、製薬業界でのPPIを対象とする大規模な努力があります。タンパク質 - タンパク質界面は平坦、通常は大きく、多くの場合、そのような部位を標的とする小分子の発見を複雑に、ポケットを欠いています。抗体を用いた代替的な標的アプローチは乏しい経口バイオアベイラビリティ、低い細胞透過性、及び生産効率の悪さに起因する制限があります。
PPIインターフェースを標的にするペプチドを使用すると、いくつかの利点を有します。ペプチドは、より高いコンホメーションの柔軟性、高い選択性を有し、一般に安価です。しかし、ペプチドは、細胞膜を横切る乏しい安定性と非効率性などの独自の制限があります。このような限界を克服するために、ペプチドの環化を行うことができます。環化は、ペプチドの選択性を改善することが実証されています、代謝安定性、および生物学的利用能。しかし、環状ペプチドの生理活性立体構造を予測することは容易ではありません。この課題を克服するために、1つの魅力的なアプローチは、すべてのバックボーン環状ペプチドは、同じ一次配列を持っているが、そのような環の大きさや位置など、その立体構造に影響を与えるパラメータが異なるた画面に集中ライブラリーをスクリーニングします。
私たちは、特定の寄生虫のPPIをターゲットバックボーン環状ペプチドのライブラリーを合成するための詳細なプロトコルを記述します。合理的な設計アプローチを使用して、我々は、活性化Cキナーゼ(LACK)のための足場タンパク質のL eishmania受容体に由来するペプチドを開発しました。我々はではなく、哺乳動物宿主ホモログで、寄生虫に保存されているLACK中の配列は、寄生虫「生存のために重要であるタンパク質のための相互作用部位を表すことができるという仮説を立てました。環状ペプチドは、反応時間を短縮し、高めるためにマイクロ波照射を用いて合成しました。効率。別のリングサイズとバックボーン環状ペプチドのライブラリーを開発することは、ほとんどの生物学的活性コンホメーションのための体系的な画面を容易にします。この方法は、環状ペプチドを合成するための一般的で、速く、容易な方法を提供します。
概要
タンパク質-タンパク質相互作用薬(PPI)は、細胞内シグナル伝達の細胞死1に、ほとんどの生物学的プロセスにおいて重要な役割を果たしています。したがって、のPPIを標的とする基礎研究および治療用途に基本的に重要です。 PPIは、具体的かつ安定的な抗体によって調節することができるが、抗体が低いバイオアベイラビリティを製造し、持っている高価では困難です。代替的に、のPPIは、小分子によって標的とすることができます。小分子は、抗体に比べて合成が容易、安価です。しかし、彼らは比較的柔軟で、大きなタンパク質-タンパク質インターフェース2,3に比べて小さな空洞へのより良いフィット。多様な研究が単純で安価抗体よりも、小さな分子よりも柔軟であるペプチドは、タンパク質のインターフェースをバインドし、PPIは4,5を調節することができることを実証しました。グローバル治療用ペプチドの市場は2013年に150億ドルの周りに評価され、10.5%のスズメノカタビラを成長していますLLY 6。また、50以上の販売ペプチド、臨床試験の異なる段階で約270ペプチド、および高度な前臨床段階7で約400ペプチドがあります。多数のペプチドは薬として使用されているが、ペプチドがまだ乏しい生物学的利用能および安定性、細胞膜を横断中の非効率性、およびコンホメーションの柔軟性8,9を含め、広範なアプリケーションを制限するいくつかの課題を提起します。これらの欠点を克服するための一つの代替は、ローカル(D-アミノ酸およびN-アルキル化)及びグローバル(環化)制約8,10-12として異なる修飾を適用することです。これらの変更はまた、自然に発生します。例えば、シクロスポリンA、免疫抑制環状天然ペプチドは、単一のD-アミノ酸を含み、N-アルキル化修飾13,14を受けます 。
天然アミノ酸の改変は、多くの場合、ペプチドに影響を与える、例えば、D-及びN-アルキル化のようなローカルな制約を誘導します9;の生物活性。しかし、目的の配列は同じまま可能な環化は、生物学的活性を保存する可能性が高いです。環化は、異なるコンホメーションの間の平衡を低減することにより、ペプチド立体配座空間を制限するための非常に魅力的な方法です。これは通常、一つだけの機能を仲介する活性コンホメーションにペプチドを制限することにより、生物学的活性および選択性を向上させます。環化はまた、より少ない分解酵素により認識されるコンフォメーションにペプチドを保持することによってペプチドの安定性を向上させます。確かに、環状ペプチドは、それらの線形対応15-17に比べて代謝安定性、バイオアベイラビリティ、および選択性を改善していることが示されました。
いくつかのケースでは制限が生理活性コンフォメーションを達成することからペプチドを防止することができるので、環化は両刃の剣であることができます。このハードルを克服するために、集中ライブラリーは、全てのペプチドが同じプライマリsequencを持っていますEその結果、一定のファーマコフォアを合成することができます。ライブラリ内のペプチドは、その後、ほとんどの生物活性コンフォメーション9,18をスクリーニングするために、このような環の大きさと位置と、その構造に影響を与えるパラメータが異なります。
ペプチドは、溶液中で、現在より一般的ペプチド合成法であり、さらに説明される固相ペプチド合成(SPPS)アプローチの両方によって合成することができます。 SPPSは、化学変換は、合成化合物19の広い範囲を調製するためにリンカーを介して固体支持体上で実施されるプロセスです。 SPPSは、N末端に、固体支持体に結合しているC末端から段階的にアミノ酸の連続的カップリングにより集合ペプチドを可能にします。 N-αアミノ酸の側鎖は、STごとに一つのアミノ酸の付加を確実にするために、ペプチド伸長の間に使用される反応条件に安定である保護基でマスクされなければなりませんEP。最後のステップでは、ペプチドを樹脂から放出され、側鎖保護基が同時に除去されます。ペプチドが合成されている間、すべての可溶性試薬は濾過によって、ペプチド固体支持体マトリックスから除去し、それぞれのカップリング工程の終了時に洗い流すことができます。そのようなシステムでは、高濃度での試薬 の大過剰が完了するまで、カップリング反応を駆動することができ、全ての合成工程は、材料20の任意の転送せずに、同じ容器内で行うことができます。
SPPSは、不完全な反応、副反応、不純な試薬、ならびに反応21を監視する困難の生産など、いくつかの制限がありますが、SPPSの利点は、ペプチド合成のための「ゴールドスタンダード」行いました。これらの利点は、その結果、非天然アミノ酸を組み込むためのオプション、自動化、容易な精製、物理的損失を最小化し、過剰な試薬の使用を含みます高収率。 SPPSは難しいシーケンス21,22、蛍光修正23、及びペプチドライブラリー24,25の合成において非常に有用であることが示されています。 SPPSはまた、このようなオリゴヌクレオチド26,27、オリゴ糖28,29、およびペプチド核酸30,31などの他のポリチェーンアセンブリのための非常に便利です。興味深いことに、いくつかの場合において、SPPSは、伝統的に、溶液32,33に形成されている小分子を合成するのに有利で あることが示されました。 SPPSは、研究と教育34,35のための小規模なだけでなく、大規模で業界36〜38の両方で使用されています。
主にペプチドの合成のためのSPPS法で使用される2つの合成戦略は、ブチルオキシカルボニル(BOC)および9-フルオレニルメトキシカルボニル(Fmoc)です。 SPPSのために導入された元の戦略は、rからのペプチドの側鎖保護基を除去し、切断するために強い酸性条件を必要とするBocでしたESIN。 Fmocベースのペプチド合成は、しかしながら、適度な塩基条件を利用し、酸に不安定なBocでプロトコル39に穏やかな代替手段です。 Fmocストラテジーは、酸性条件下で樹脂からペプチドを切断しながら、合成の最後の工程で除去され、直交t-ブチル(tBuで)側鎖保護を利用します。
固体支持体上のペプチド合成のための一般的な原理は、図1に示されている。N-α末端の一時的な保護基でマスクされ、最初のアミノ酸は、C末端から樹脂上にロードされます。 ( 図1、工程1)必要に応じて側鎖をマスクする半永久的保護基も使用されます。標的ペプチドの合成は、N-α-一時的保護基( 図1、工程2)及び次の保護アミノ酸のカップリング( 図1の脱保護の反復サイクルにより、N末端 にC末端から組み立てられますオング>、ステップ3)。最後のアミノ酸は、( 図1、ステップ4)にロードされた後、ペプチドを樹脂支持体から切断され、半永久的保護基は、( 図1、ステップ5)を除去します。

固相ペプチド合成を 、図1 の一般的なスキームは、N-α保護アミノ酸を、樹脂(ステップ1)にリンカーを介してカルボキシル基を用いて固定されます。所望のペプチドは、N-α(ステップ2)およびアミノ酸のカップリング(工程3)からの一時的な保護基(TPG)の脱保護の反復サイクルによりN末端にC末端から直線的に組み立てられます。合成(ステップ4)を達成した後、半永久的保護基(SPG)は、ペプチド切断(ステップ5)の間に脱保護されます。= "_空白"を取得>この図の拡大版をご覧になるにはこちらをクリックしてください。
完全なペプチド鎖を組み立てた後、環化は、いくつかの選択肢によって達成することができる:(A)頭-尾環化-これは便利な方法ですが、それは環化のための唯一の選択肢( 図2A)、(B)環化を提供するので、限られ生物活性官能基を含む、目的の配列からのアミノ酸を使用する-しかし、これらのアミノ酸の使用を妨げることなく、アミノ酸(またはその他のビルディングブロック)を添加することにより、生物学的活性( 図2B)、及び(C)の環化に影響を与え得ます生理活性シーケンス。それは興味( 図2C)の配列を変更することなく、集束ライブラリーを製造することができるように、これらの分子を導入することは広く行われています。
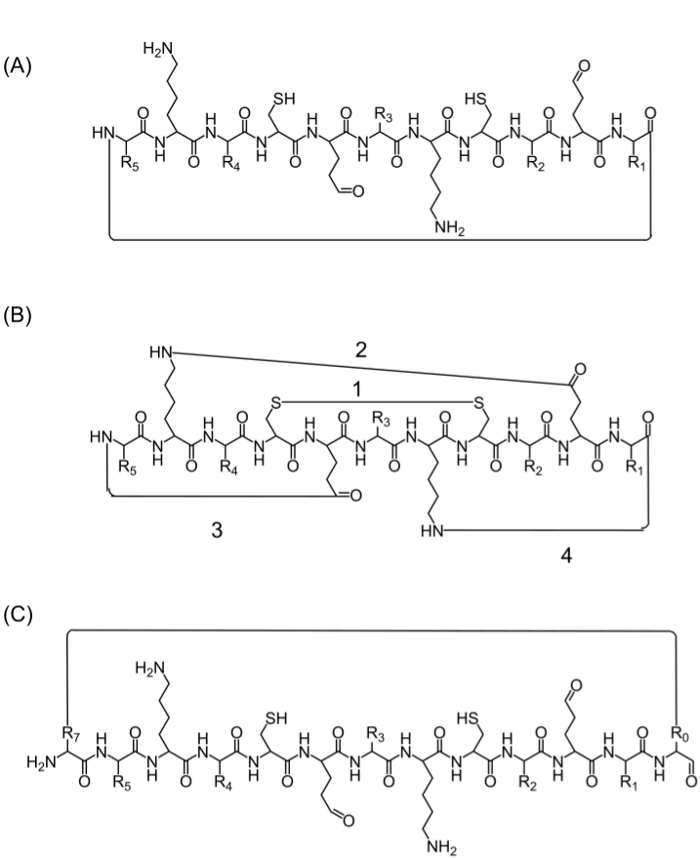
Figure 2. 代替ペプチド環化戦略尾環化(A)のヘッド、C末端およびN末端 の間のペプチド結合を介して。 (B)N-するグルタミン酸/アスパラギン酸(2)、または側鎖に官能性システイン残基間のジスルフィド結合などの基(1)、又はリジンの側鎖間のアミド結合の間の環化またはC末端(3 -4); (R0)の前と(R7)の生物活性シーケンスの後、たとえば、余分なアミノ酸またはアミノ酸誘導体または小分子を添加することにより、(C)環化。 この図の拡大版をご覧になるにはこちらをクリックしてください。
マイクロ波支援合成は、このように有機化学変換に40,41を加速 、反応を加熱するためにマイクロ波照射を使用しています。マイクロ波化学は吸収する溶剤試薬/の能力に基づいていますマイクロ波エネルギーと42を熱に変換します。技術が広まったの前に、主要な欠点は、合成プロトコルと適切な温度と圧力のコントロール43,44のために利用可能なシステムの欠如の制御性と再現性を含めて、克服しなければなりませんでした。マイクロ波支援ペプチド合成の最初の報告は、カップリング効率および純度45の有意な改善を有するいくつかの短いペプチドを合成するための台所のマイクロ波(7-10アミノ酸)を用いて行きました。また、マイクロ波エネルギーは、鎖の凝集を減少させる副反応を減少させる、ラセミ化を制限し、すべての困難および長いシーケンス46-53に重要な結合率を改善することが示されました。
現在、固体支持体上のペプチドまたは関連化合物の合成のためのマイクロ波照射の使用は、有機溶剤54の代わりに、水(A)合成を含む、広範です。 (B)ペプチドの合成とこのような合成により、立体障害されたアミノ酸誘導体のカップリング効率が低い、典型的には困難である糖ペプチド55-58または59-61ホスホペプチドなどの一般的な翻訳後修飾、。 (C)側鎖に接続されている窒素原子62、またはペプトイドでのアミノ酸残基のC(α)の置換によって形成することができ、このようなアザペプチドなどの主鎖中に修飾を有するペプチドの合成むしろCα原子63,64よりアミド窒素; (D)環状ペプチド65-71の合成;コンビナトリアルライブラリー51,72のと(E)の合成。多数の例では、著者らは、より高い効率が報告され、従来の手順と比較して、マイクロ波照射を使用して合成時間を減少させました。
合理的な設計73-75を使用して、我々は、foを足場のL eishmaniaの受容体から誘導された抗寄生虫性ペプチドを開発Rは、Cキナーゼ(LACK)を活性化しました。 LACKは、リーシュマニア感染76の初期段階において重要な役割を果たしています。 LACKの低いレベルで発現する寄生虫はLACKが不可欠寄生虫シグナル伝達過程およびタンパク質合成78に関与しているようであっても、免疫不全マウスに77に寄生することができません。そのため、不足は重要な足場タンパク質79、貴重な薬剤標的です。ではなく、ホストの哺乳類ホモログのラックに、寄生虫に保存されている欠如配列に着目し、8アミノ酸ペプチド文化にリーシュマニア属の生存率を減少させた(RNGQCQRK)を同定しました。
ここでは、上述のLACKタンパク質配列に由来する骨格環状ペプチドの合成のためのプロトコールを記載します。ペプチドは、Fmocの/にtBuプロトコルSPPS法によってマイクロ波加熱を用いて固体支持体上で合成しました。ペプチドは、アミド結合などを介してTAT 47-57(YGRKKRRQRRR)キャリアペプチドに結合させましたSPPSの一部。細胞内への貨物の様々なTATベースのトランスポートは、15年以上にわたって使用されており、細胞内小器官への貨物の配送には80を確認されています。四つの異なるリンカー、コハク酸およびグルタル酸無水物、ならびにアジピン酸およびピメリンは、2〜5個の炭素原子のカルボン酸リンカーを生成するための環化を行うために使用されました。環化は、マイクロ波エネルギーを使用して行った、最終的な切断および側鎖脱保護工程は、マイクロ波エネルギーなしで手動で行われました。自動化されたマイクロ波シンセサイザーの使用は、生成物の純度を改善し、製品の収率が増加し、合成の持続時間を減少させました。この一般的なプロトコールは、in vitroおよびin vivoでの重要な分子機構を理解し、さらにヒト疾患のための潜在的な薬物を開発するためにペプチドを使用する他の研究に適用することができます。
プロトコル
1.機器および試薬の準備
- 準備設備
- 適切な個人用保護具を使用して、ヒュームフード内のすべての手順を実行します。
- 化学的にテフロン(登録商標)反応器(ガラスフリットと30 mlの)または使い捨てのポリプロピレンマイクロ波電力供給を制御するための光ファイバ温度プローブを装備した発見の追加のモジュールをマイクロ波ペプチド合成機を用いて固体支持体上のペプチドを合成しますカートリッジ(粗いフリットと12ミリリットル)。
- 適切な混合のために、反応容器に窒素供給を接続し、あるいはポリプロピレンカートリッジの両端を密封し、ロータリーシェーカー上に置き。
- 反応混合物または洗浄液を排出するために、廃棄物のトラップを経由してハウスバキュームに接続します。
- 反応容器内に光ファイバープローブを配置します。
- 試薬の準備
- スケートリンクアミドAM樹脂100〜200メッシュを秤量することによって樹脂を準備し(0.204 mg)を適切に膨張し、そして排出するために2-4時間振る、ダウン樹脂を洗浄するために、反応容器/ポリプロピレンカートリッジにN 1の混合物、N-ジメチルホルムアミド (DMF)/ジクロロメタン(DCM):1の5ミリリットルを追加します。
- DMF中の対応するFmoc-アミノ酸を溶解することにより酸性溶液アミノ0.2Mの9-フルオレニルメトキシカルボニル(Fmoc)を調製し、アミノ酸が溶解するまで混合物をボルテックスした(表1)。
- 100 mlのDMF中でN、N、N '、N' -tetramethyluroniumヘキサフルオロホスフェート(HBTU)および固体が溶解するまで混合物をボルテックス( 表 - (ベンゾトリアゾール-1-イル) - 18.96グラムOに溶解し0.45 M活性剤溶液ミックスを調製します1)。
- 65.2 mlの1-メチル-2-ピロリジノン(NMP)( 表1)と34.8 mlのN、N-ジイソプロピルエチルアミン (DIEA)を組み合わせることにより、2 M活性剤ベース液ミックスを調製します。
- 1-ヒドロキシベンゾトリアゾール水和物(HOBt)3.37グラムを溶解して、0.1M脱保護溶液ミックスを調製しますDMF中のピペリジンの20%(v / v)の溶液250mlで、固体が溶解するまで混合物をボルテックスした (表1)。
2. Fmoc保護アミノ酸のカップリング
- アミノ酸カップリング
- アミノ酸(2.5 ml)を/活性剤(1 ml)を/活性剤ベース(0.5ml)を反応容器/ポリプロピレンカートリッジに添加し、反応を300秒(25 W、75°C、 表2)を進行させ。ソリューションを排出します。
- DMFで樹脂を洗浄します。 120秒(7ミリリットル、W 0、RT)用の樹脂に、DMFを追加して、解決策をドレイン。 5回繰り返します。
- Fmocの脱保護
- 反応容器/ポリプロピレンカートリッジに、0.1MのHOBtとDMF中の20%ピペリジンの7ミリリットルを追加し、30秒(45 W、75°C、 表2)インキュベートします。
- 反応混合物を排出します。
- 反応容器/ポリプロピレンカートリッジに、0.1MのHOBtとDMF中の20%ピペリジンの7ミリリットルを加え、180秒間インキュベート(45 W、75°C、 表2)。
- 反応混合物を排出します。
- DMFで樹脂を洗浄します。 120秒(7ミリリットル0 W、RT)用樹脂に、DMFを追加して、解決策をドレイン。 5回繰り返します。
注:必要に応じて、ここでの手順を一時停止し、後日再開。
- アミノ酸のカップリング工程の後に、( - 20℃で長期間記憶するための樹脂)を、4℃で少なくとも数日間DCMとストアで樹脂を洗浄します。
- ポリプロピレンカートリッジに反応容器から樹脂を移動します。
- DCMで樹脂を洗ってください。 (7ミリリットル0 W、RT)120秒間樹脂に、DCMを追加して、解決策をドレイン。 3回繰り返します。
- トップキャップとコックでしっかりとポリプロピレンカートリッジをシール。
- 新しい合成を開始する前に、DMF中の3-4時間(7ミリリットル)用の樹脂を膨潤させます。
- 合成の監視
- 迅速の進行を決定するために、カイザー(ニンヒドリン)テストまたはクロラニル試験に使用合成。必要に応じて、合成されたペプチドの純度および質量を決定するために、小規模な開裂反応を行います。セクション9を参照してください。
注意:以上のトラブルシューティングについては、表3を参照してください 。
- 迅速の進行を決定するために、カイザー(ニンヒドリン)テストまたはクロラニル試験に使用合成。必要に応じて、合成されたペプチドの純度および質量を決定するために、小規模な開裂反応を行います。セクション9を参照してください。
- ターゲットを絞ったペプチドを合成するために、必要に応じて繰り返して、2.1と2.2のステップ: Arg(Pbf)-Asn(Trt)-Gly-Gln(Trt)-Cys(Trt)-Gln(Trt)-Arg(Pbf)-Lys(Boc)-Lys(Mtt)-Gly-Gly-Tyr(But)-Gly-Arg(Pbf)-Lys(Boc)-Lys(Boc)-Arg(Pbf)-Arg(Pbf)-Gln(Trt)-Arg(Pbf)-Arg(Pbf)-Arg(Pbf).
3.無水物/酸カップリング
- 無水カップリング
- NMPで樹脂を洗浄します。 120秒間樹脂に(7ミリリットル、W 0、RT)を、NMPを追加して、解決策をドレイン。 3回繰り返します。
- NMP中の対応する酸無水物の10当量(5ml)に溶解し、溶液( 表1)に1当量の4-ジメチルアミノピリジン(DMAP)および10当量のDIEAを加えます。
- (25 / DIEA樹脂に無水物/ DMAPの混合物10と300秒間インキュベート:1:10を追加W、75°C、 表2)。ソリューションを排出します。
- NMPで樹脂を洗浄します。 120秒間樹脂に(7ミリリットル、W 0、RT)を、NMPを追加して、解決策をドレイン。 3回繰り返します。
- 酸結合
- DMFで樹脂を洗浄します。 (7ミリリットル0 W、RT)120秒間樹脂に、DMFを追加して、解決策をドレイン。 3回繰り返します。
- DMF中の対応するジカルボン酸の10当量(5ml)に溶解します。溶液( 表1)に1当量のDMAPおよび10当量のN、N '-Diisopropylcarbodiimide(DIC)を追加します。
- 30分間混合して混合物を予備活性化します。
- 樹脂に混合物を追加し、300秒(25 W、75°C、 表2)インキュベートし、溶液を排出します。
- DMFで樹脂を洗浄します。 120秒間樹脂に(7ミリリットル、W 0、RT)およびドレインソリューションを、DMFを追加します。手順を繰り返し3回。
グループ脱保護の保護4. N-メチルトリチル(MTT)イオン
注:リジン側鎖は、N -メチルトリチル(MTT)81、酸に不安定な条件の下で82,83を選択的に脱保護することができる保護基で保護しました。マイクロ波エネルギーなしでシェーカー上で手動で保護基を脱保護のMtt。
- キャッププラグとコックを備えたポリプロピレンカートリッジに樹脂を転送します。
- DCMで樹脂を洗ってください。 (7ミリリットル0 W、RT)120秒間樹脂に、DCMを追加して、解決策をドレイン。 3回繰り返します。
- 樹脂1グラム当たりのポリプロピレンカートリッジに、DCM、1%トリフルオロ酢酸(TFA)の混合物15〜25 mlを加え、5%トリイソプロピルシラン(TIS)、および94%。
注意:TFAは強酸であり、腐食性及び皮膚、眼、および肺組織に非常に刺激します。- すべての回で、フード中のTFAの濃縮溶液を保管してください。
- よく換気フード内で適切な個人用保護具(眼の保護、白衣と手袋)と作業を使用します。速やかに手袋を変更彼らは、TFAとすぐにクリーンアップ任意の流出に触れた場合。皮膚や目が酸に触れた場合は、すぐに水で患部をフラッシュし、さらに15分間洗います。
- シェーカー上ポリプロピレンカートリッジを置き、室温で5分間振とうします。
- 真空を適用することにより、ポリプロピレンカートリッジからソリューションを排出します。
- 繰り返しは4.3から4.5、3回繰り返します。
- DCMで樹脂を洗ってください。 (7ミリリットル0 W、RT)120秒間樹脂に、DCMを追加して、解決策をドレイン。 5回繰り返します。
線状ペプチドの環化5.
- DCMで樹脂を洗ってください。 (7ミリリットル0 W、RT)120秒間樹脂に、DCMを追加して、解決策をドレイン。 5回繰り返します。
- 50ミリリットルポリプロピレンチューブでは、ジブロモメタン中の5当量のベンゾトリアゾール-1- LY-オキシ-トリス-ピロリのヘキサフルオロホスフェート(PyBOPの)(DBM、5 ml)に溶解し、溶液( 表1)に10当量のDIEAを追加します。
- は、樹脂に混合物を追加し、300秒(25 W、75°C、 表2)インキュベートします。ソリューションを排出します。
- DCMで樹脂を洗ってください。 (7ミリリットル0 W、RT)120秒間樹脂に、DCMを追加して、解決策をドレイン。 3回繰り返します。
側鎖グループの6切断および脱保護
- DCMおよびジエチルエーテルで樹脂を洗浄します。
- (7ミリリットル0 W、RT)120秒間樹脂に、DCMを追加して、解決策をドレイン。 2回繰り返します。
- (7 mlの、0 W、RT)120秒間樹脂にジエチルエーテルを加え、溶液を排出します。 2回繰り返します。
- 水酸化カリウム(KOH 1〜10 g)を超える少なくとも3時間、室温で真空デシケーター中で樹脂を乾燥させます。
- 乾燥した樹脂を計量し、ポリプロピレンカートリッジに転送します。
- 樹脂の一つ一つグラムに予備冷却トリフルオロ酢酸(TFA)開裂カクテル(例えば、90%TFA、2.5%水、2.5%TIS、5%フェノール)を10mlを加えます。
- 3時間シェイクRTで。
- 50ミリリットルのポリプロピレンチューブに樹脂をフィルタリングすることにより、TFA切断ソリューションを収集します。ろ過のために、12ミリリットルのポリプロピレンカートリッジであるフリットを使用しています。
- チューブに冷ジエチルエーテル(35ミリリットル)を追加します。
- 4℃で1207×gで5分間遠心。
- エーテル層をデカント。
- 繰り返しステップ6.7から6.9まで、5回。
7.バックボーン環状ペプチドを乾燥
- 同じチューブに沈殿したペプチドを維持し、30分間フード内でそれを乾燥させてください。
- 水とアセトニトリル(ACN)の1:1混合物中のペプチドを溶解します。
- 液体窒素中での最終生成物溶液をフリーズします。
- 最終製品を凍結乾燥。
8.バックボーン環状ペプチドの特徴付け
- 水(400μL)中の生成物の少量サンプル(1 mg)を溶解します。
- 逆相高速液体chromatograpに溶解したペプチド(10〜200μl)を注入HY(RP-HPLC)システムは、ペプチド純度34をテストします。
- 質量分析マトリックス支援レーザー脱離イオン化(MALDI-MS)84を用いてペプチドの質量を確認してください。
- アセトニトリルの1(v / v)の混合物:1で1μL(100μM)のペプチドを混ぜた水を、マトリックスの1μL(5 mg / mlの、αシアノ-4-ヒドロキシ桂皮酸)と1:1(Vアセトニトリル/ v)混合物:TFA(0.1%)を含む水。
- MS-MALDIプレート上のスポット1μL。
- サンプルを乾燥し、質量分析計に入れてください。
- ペプチドを計量し、パーセント収率を計算します。
- -20℃で保存してください。
9.合成の監視
- カイザー(ニンヒドリン)テスト85
- 試薬溶液を準備します。
- 25mlの蒸留水にシアン化カリウム(KCN)の16.5 mgの溶解することにより溶液Aを準備します。ピリジン49ミリリットルで上記溶液1mlを希釈します。
- 溶液Bを準備エタノール20ml中のニンヒドリンの1グラムを溶解することもできます。
- 20ミリリットルのエタノールに40gのフェノールを溶解して溶液Cを準備します。
- アミノ酸カップリングや保護基の脱保護が完了したことを確認するにはカイザー試験を使用してください。
- 試験管に樹脂からいくつかのビーズを転送します。
- 各溶液の3滴(〜100μl)を(A、BおよびC)を加え、混合します。
- 5分間、110℃の加熱ブロックに試験管を加熱します。
注:ブルー色のビーズ(陽性の結果)が不完全なカップリング反応またはFmoc保護基の脱保護を示しています。
- 試薬溶液を準備します。
- クロラニル試験86
- 各テストのために新鮮な以下の試薬を準備します。
- DMF、溶液A中2%クロラニル溶液を調製します
- DMF中2%のアセトアルデヒドの溶液を調製し、溶液B.
- アミノ酸カップリング、またはTの完了を確認するためにクロラニル試験を行います彼は、保護基の脱保護。
- 1.5mlチューブに溶液B100μlの溶液Aの100μLを混ぜます。
- ビーズを落とし、ゆっくりと5分間振ります。
注意:ダークブラウン色のビーズ(陽性の結果が)Fmoc保護基の脱保護または不完全なカップリング反応を示しています。
- 各テストのために新鮮な以下の試薬を準備します。
- 小規模開裂反応
- キャッププラグとコックを装備した3ミリリットルのポリプロピレンカートリッジに少量の樹脂を除去します。
- 95%TFA、2.5%水及び2.5%TISの2 mlの混合物を用いて治療します。
- RTで30分間混合物を振ります。
- ポリプロピレンカートリッジのフリットを用いて濾過することにより樹脂を除去し、窒素気流により溶剤を蒸発させます。
- 残渣を水に溶解し、HPLCを用いて、製品および/またはMSを分析します。
文化アッセイで10 ドノバンリーシュマニア前鞭毛生存率
- ドノバンリーシュマニア (L.ドノバン )の成長と処理条件
- 文化L. 26℃で4.5グラム/ Lのグルコース、L-グルタミンおよびピルビン酸ナトリウムを有するイーグル培地(DMEM)のダルベッコ改変でドノバンの前鞭毛期。
- L.トリートドノバンは、26℃で24時間環状ペプチド(100μM)でプロマスチゴート。
- ドノバン・リーシュマニア (L.ドノバン )生存率アッセイ
- 製造業者のプロトコルに従って、アラマーブルー20μlの寄生虫の生存率を評価します。
- (570nmの励起および590nm発光での)蛍光を測定することにより、アラマーブルーの削減を決定します。より高い蛍光値は、より高い代謝活性および増加した寄生虫の生存率を示しています。
結果
ここでは、特にリーシュマニア寄生虫の重要なのPPIを対象とし、(駆虫薬87としてのPPIを対象とするペプチドについてのレビューのために)駆虫剤として作用バックボーン環状ペプチドの集中小さなライブラリの開発について説明します。小説の骨格環状ペプチドの合成により、ファーマコフォアは、拡張可能な大きさの足場に保存されています。ここで提案されている集中ライブラリーの強さは、環化反応を介して、立体配座の自由の制限度を可能にしながら、ペプチド足場の大きさを変化させる能力です。主鎖環状ペプチドの全合成は、のFmoc / tBuでのプロトコルに従って、固体支持体上に自動化されたマイクロ波合成装置を用いて行きました。環化は、リンカー、酸無水物/酸及びリジンの側鎖アミンとの間のアミド結合を作成することによって行いました。最終的な切断および側鎖の脱保護は、合成スキームおよびfのため(マイクロ波エネルギーなしで手動で行われましたinalの製品構造は、 図3)を参照してください 。生成物は、-20℃で保存し、白色粉末25mgを得、分取HPLCにより分析しました。生成物の試料は、MS( 図4)によってチェックし、純度の程度は、分析HPLC( 図5)を用いて決定しました 。各環状ペプチドのサンプルは、生物学的スクリーニングのために送られました。 4環状ペプチド(PL1)の一つは、 ドノバンリーシュマニア (L.ドノバン )、内臓リーシュマニア症、ヒトにおいて最も深刻なリーシュマニア症を引き起こす寄生虫に対して活性でした。ペプチドPL1は、対照処置( 表4)と比較して75%の寄生虫の生存率を減少させました。

図3. 合成スキームと、本研究で合成バックボーン環状ペプチドの構造試薬および条件:(I)アミノ酸のカップリング:300秒、25 W、75°C、1:2.2アミノ酸/活性剤/活性剤ベース1.1を使用。 (ⅱ)のFmoc脱保護:30秒、180秒の両方DMF + 0.1 M HOBtの中の20%ピペリジンを用いて、45 W、75°C、で。 (III)酸無水物のカップリング:10:NMP中の1無水物/ DIEA / DMAP 10を使用して300秒、25 W、75°Cを、。 (IV)のMtt脱保護:3 *(300秒、0 W、RT)1使用して:5:94のTFA / TIS / DCMを。 (v)の環化:300秒、5:10のPyBOPを用いて、25 W、75°C、/ DBMでDIEA。 (VI)の切断および脱保護:90を使用して3時間、0 W、室温、:2.5:2.5:5のTFA / TIS / H 2 O /フェノール。ペプチドは、固相合成の一部としてアミド結合を介してTAT 47-57(のTyr-Glyを-のArg-Lysの-のLys-Argの-Argの-Glnの-Argの-Argの-Argの)キャリアペプチドに結合させた。 こちらをクリックしてください。この図の拡大版を表示します。

図 4. MALDI-TOF質量分析のトレース代表的なバックボーン環状ペプチド。観測された質量、2853.456は、計算された質量、2854.271に近い一致している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
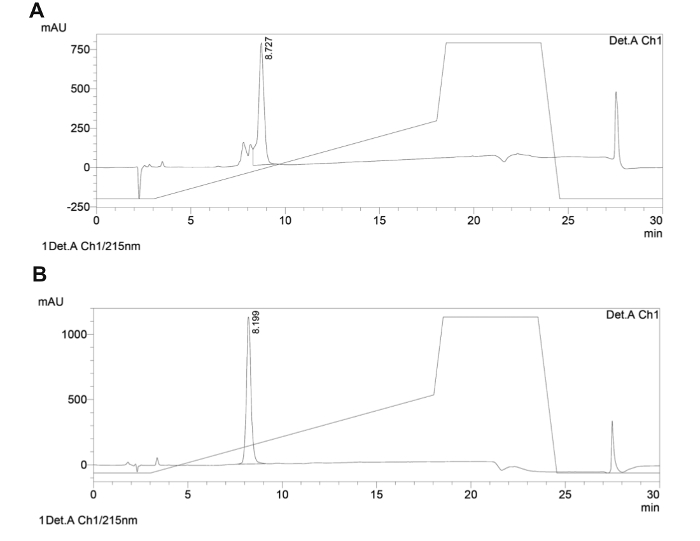
代表的な環状ペプチド骨格の 図5 分析用逆相HPLCトレース。粗製の(A)及び精製した(B)の主鎖環状ペプチドの分析的HPLCトレースを示します。使用される溶媒系は 、(0.1%TFAを含むH 2 O)であり、B(CH 3 0.1%TFAとCN)。 1ミリリットルC18と40℃で15分で/分で5〜50%Bの直線勾配、5ミクロン、150ミリメートルカラムに適用し、検出は215nmであった。 こちらをクリックしてくださいこの図の拡大版を表示します。
| 溶液 | 試薬 | MW(グラム/モル) | D(グラム/ ml)を | 容量(ml) | 濃度(M) | 合計金額 |
| - アミノ酸溶液 - | アラニンアミノ酸 | 311.34 | 0.2 | 6.23グラム | ||
| DMF中のアミノ酸の0.2 M | DMF | 100 | 100ミリリットル | |||
| アラニンアミノ酸が、同じ計算の例では、適切なMWで、各アミノ酸のために行われるべきです。 100 mlのアミノ酸溶液を100 mlのDMF中のアラニンアミノ酸の6.23グラムを溶解し調製しました。 4℃で保存します。 | ||||||
| - 脱保護溶液- | HOBt | 135.1 | 0.1 | 3.37グラム | ||
| 0.1MのHOBtとDMF中のピペリジンの20%(v / v)のソリューション | ピペリジン | 50 | 50ミリリットル | |||
| DMF | 200 | 200ミリリットル | ||||
| 保護基-脱保護は、FmocのNαの除去のために使用されます。 250 mlの脱保護溶液を調製するには、200 mlのDMF中に3.37グラムのHOBtを溶解し、50mlのピペリジンを加えます。 4℃で保存します。 | ||||||
| - 活性剤溶液 - | HBTU | 379.24 | 0.45 | 18.96グラム | ||
| DMF中の0.45 M HBTU | DMF | 100 | 100ミリリットル | |||
| アクティベーターは、カップリング反応の前にアミノ酸を活性化する活性化剤ベースとともに使用。 100 mlの活性化剤溶液を調製し、100 mlのDMF中の18.96グラムのHBTUを溶解します。 4℃で保存します。 | ||||||
| - アクティベーターベース・ソリューション - | DIEA | 129.24 | 0.742 | 2 | 34.80ミリリットル | |
| NMP中2MのDIEA | NMP | 65.20ミリリットル | ||||
| 活性剤ベースは、カップリング反応の前にアミノ酸を活性化するために活性剤と一緒に使用されます。 100ミリリットルの活性剤ベースのソリューションミックスを調製した34.8ミリリットルDIEAおよび65.2ミリリットルのNMP。 4℃で保存します。 | ||||||
| 溶液 | 試薬 | MW(グラム/モル) | D(グラム/ ml)を | 容量(ml) | 式 | 合計金額 |
| 無水ソリューション - 10:1:NMP中の10無水物/ DMAP / DIEA | グルタル/無水コハク酸 | 114.1 / 100.07 | 10 | 0.11 / 0.10グラム | ||
| DMAP | 122.2 | 1 | 0.01グラム | |||
| DIEA | 129.24 | 0.742 | 10 | 0.09ミリリットル | ||
| NMP | 5 | 5ミリリットル | ||||
| 、5ミリリットルのNMPにグルタル/無水コハク酸の0.11 / 0.10グラムを溶かした溶液に0.01グラムのDMAPおよびDIEAの0.09ミリリットルを追加します。新鮮な溶液を調製します。 | ||||||
| 酸溶液 - 10:1:DMF中の10酸/ DMAP / DIC | アジピン/ピメリン酸 | 146.14 / 160.17 | 10 | 0.15 / 0.16グラム | ||
| DMAP | 122.2 | 1 | 0.01グラム | |||
| DIC | 126.2 | 0.806 | 10 | 0.16ミリリットル | ||
| DMF | 5 | 5ミリリットル | ||||
| 、5ミリリットルのDMFにアジピン/ピメリン酸の0.15 / 0.16グラムを溶かした溶液に0.01グラムのDMAPとDICの0.16ミリリットルを追加します。新鮮な溶液を調製します。 | ||||||
| 環化ソリューション - DBMで5:10のPyBOP / DIEA | PyBOP | 520.3 | 5 | 0.26グラム | ||
| DIEA | 129.24 | 0.742 | 10 | 0.09ミリリットル | ||
| DBM | 5ミリリットル | 5ミリリットル | ||||
| DBM 5mlに0.26グラムののPyBOPを溶解し、この溶液にDIEAの0.09ミリリットルを追加します。準備新鮮な溶液。 | ||||||
バックボーン環状ペプチド合成のための表1試薬およびソリューションを提供しています。合成のためのソリューションおよび試薬のリストが提供されます。
| マイクロ波サイクル | 電力(ワット ) | 温度 (℃) | 時間 (秒) | ||
| 1 | アミノ酸をカップリング | 25 | 75 | 300 | |
| 2 | Fmoc保護基の脱保護 | (a)は、初期の脱保護 | 45 | 75 | 30 |
| (B)完全な脱保護 | 45 | 75 | 180 | ||
カップリングおよび脱保護のため、表2のマイクロ波サイクル。マイクロ波サイクルのアミノ酸カップリングおよびFmoc脱保護。アミノ酸の(1)のカップリング。最初の(a)および(b)完全な脱保護:(2)のFmocマスキング基の脱保護は、2ステップで行われます。
| 問題 | 考えられる理由 | 溶液 |
| カイザーまたはクロラニル試験は、アミノ酸のカップリング後に陽性であります | アミノ酸のカップリングが不完全です | カップリング工程を繰り返し |
| ペプチドを効率的に上清から分離されていません | TFAの過剰量 | 窒素流を用いて試料を蒸発 |
| 生成物中の欠失配列の存在 | Fmoc除去は不完全です | Fmoc除去は、手順を繰り返し不完全である場合には、カイザーまたはクロラニル試験および/または小規模切断によって脱保護の監視 |
| アミノ酸couplingが不完全です | 手順を繰り返して、アミノ酸のカップリングが不完全である場合には、カイザーまたはクロラニル試験および/または小規模の切断による結合を監視および/またはより長い反応時間を使用 |
最も一般的な合成の課題に対する解決策の表3.トラブルシューティングのアドバイスリストが提供されます。
| ペプチド | シーケンス | N | ミズ。カル。 | MS OBS。 | HPLC | 産出 | 寄生虫の生存率 | ||
| PL1 | RNGQCQRK-GG-YGRKKRRQRRR | 2 | 2854.321 | 2853.456 | 98% | 86% | 25% | ||
| PL2 | RNGQCQRK-GG-YGRKKRRQRRR | 3 | 2868.348 | 2868.808 | 98% | 87% | 100% | ||
| PL3 | RNGQCQRK-GG-YGRKKRRQRRR | 4 | 2882.375 | 2881.823 | 96% | 89% | 97% | ||
| PL4 | RNGQCQRK-GG-YGRKKRRQRRR | 5 | 2896.402 | 2895.603 | 97% | 85% | 98% | ||
表4.特性と、この研究中のペプチドの生物活性は、Nアルキルスペーサー(構造については図3を参照)におけるメチレンの数を指します。 MSは、MALDI法を用いて行われ、純度を分析用HPLCにより決定しました。ペプチドは、 ドノバンリーシュマニアの前鞭毛期に加え、寄生虫の生存率を評価し、ペプチドの非存在下でインキュベートした培養物を制御するために、生存率として表しました。のみPL1が高いLeishmanicidal活性を有していました。オブザーバー実験条件に知らされていませんでした。データは、3つの独立した実験の代表です。
ディスカッション
完全に自動化されたマイクロ波合成装置を用いてリーシュマニア寄生虫の欠如タンパク質由来の骨格環状ペプチドの集中ライブラリーの合成が記載されています。環状ペプチドの集中ライブラリが保存されたファーマコフォアと様々なリンカーを開発しました。そのような無水グルタル酸、無水コハク酸、アジピン酸、ピメリン酸、リジン、オルニチン、および他のビルディングブロックのような種々のリンカーの付加は、環状ペプチドのコンフォメーション空間の多様性を増加させることができます。フォーカスされた環状ペプチドライブラリーの合成は、研究者が最適な立体配座空間をスクリーニングすることができます。環状ペプチドの立体配座は、環の大きさや位置などのパラメータに依存して変化するので、異なる立体構造を有する多様な類似体は、生物学的構造-活性関係で有用であり得る、生成された88を研究することができます。
SPPSの主な課題は、SYNTを診断されましたhetic進歩と問題解決なし中間体は単離されないからです。したがって、いくつかの比色試験は、カイザーとクロラニル試験により遊離アミンを識別するもののような反応をモニターするために使用され得ます。カイザーまたはクロラニル試験は示していない場合には、小規模な切断反応(そのαアミノ基が5員環の一部であるため、 例えば、プロリンおよびヒドロキシプロリンが他のアミノ酸と同様にニンヒドリンと反応しません)そして質量分析は、合成の進行状況を監視するために適用されてもよいです。
切断時間および切断カクテルは、化学的性質及び使用される保護基の数に基づいて変更することができます。これは、樹脂(1〜10 mg)を、少量を使用して初期トライアル切断は適切な条件を検証するために実行することをお勧めします。キングらは 、様々なペプチドについて異なる切断カクテルをテストして、それらの詳細なガイドラインはreactioを最適化するために使用することができn個の条件89。バックボーン環状ペプチドは、少なくとも3時間のインキュベーションは、完全な切断のためのデフォルトとして推奨されています。しかし、保護基または困難な保護基の数が多い(例えば、t-ブチルエステルまたはペンタ-2,3-ジヒドロベンゾフラン-5-スルホニル)を含むペプチドは、完全な脱保護を確実にするために、より長い時間インキュベートする必要があります。ここで、我々は体系的に最適な切断時間やカクテルを研究していません。それにもかかわらず、我々は短い切断時間(未満2時間)は、いくつかの保護基の不完全な切断が生じたことがわかりました。
標準的なマイクロ波ペプチド合成プロトコールは、ペプチドの種々の合成のための一般的に適用可能な方法です。ほとんどの場合、自動マイクロ波シンセサイザーの使用は、合成時間を低減し、製品の収率および純度を増加させます。また、ラセミ化及びアスパルチミド形成のような副反応を減少させます。我々が行っていないが、私たちや他のラボの経験に基づいて、本研究では、電子レンジ、従来の合成を並べて比較、それはマイクロ波支援合成の使用は、従来のプロトコル61,70よりも優れていることが示されました。ほとんどすべての活性剤及び樹脂は、効果的にマイクロ波SPPSに使用することができ、一般的な方法はまた、改変などのペプチド、糖ペプチド、リンペプチド、アザペプチド、ペプトイド、および環状ペプチド90の種々の合成に適用することができます。
環化は、線形前駆体の効力および安定性を強化するための便利な方法です。環状ペプチドは、結合親和性および選択性の増加に寄与し得ることが望ましい拘束コンフォメーションを得ることができます。また、線状ペプチドは、場合によっては複数の内因性タンパク質の結合インターフェース91を標的とするために 、それらを可能にする、複数の環状のループを含むように修飾することができます。しかし、環化がnecessないことに注意することが重要ですarilyすべて時には、これらのプロパティのいずれかの改善につながります。特定の環状ペプチドが標的受容体によって認識されないのコンフォメーションをもたらすことができる(例えば92,93).Therefore、環状ペプチドの集中ライブラリーは、生物活性をスクリーニングする必要があります。結論として、合成環状ペプチドは、望ましい薬理学的特性を示す細胞膜を通過するのに十分に小さく、高い選択性を有するのに十分な大きさです。高効力、特異性、および安全プロファイルは薬剤候補などの環状ペプチドの約束に貢献しています。
開示事項
著者らは、開示することは何もありません。
謝辞
我々は有用な議論のためにローレンヴァンWassenhove、Sunhee黄、およびダリアMochly・ローゼンに感謝します。資金提供者は、研究デザイン、データ収集と分析、公開することを決定、または原稿の準備で何の役割も持っていないNQする作品は、健康補助金NIH RC4 TW008781-01 C-IDEA(SPARK)の国立研究所によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic. Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. |
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′- tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’-Diisopropylcarbodiimide (DIC) | Sigma | 38370 | Caution Flammable/ Toxic |
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials - micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP | |
| Nitrogen cylinder | |||
| Desiccator | |||
| Analytical RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-20AD solvent delivery unit, SIL-20AC autosampler, DGU-20A5 degasser (Shimadzu, MD, USA). | ||
| Preparative RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-6AD solvent delivery unit and FRC-10A fraction collector (Shimadzu, MD, USA). |
参考文献
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O'Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using 'safety catch' methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based 'building block' approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O'Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis - A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved