Method Article
פיתוח של עמוד השדרה ספריית פפטיד מחזורי כנגד טפילי פוטנציאל Therapeutics שימוש מיקרוגל הקרנה
In This Article
Summary
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Abstract
אינטראקציות חלבון-חלבון (PPIs) מעורבות באופן אינטימי כמעט בכל התהליכים הביולוגיים וצמודות למחלות רבות אנושיות. לכן, יש מאמץ גדול כדי למקד PPIs במחקר בסיסי ובתעשיית התרופות. ממשקי חלבונים הם בדרך כלל גדולים, שטוחים, ולעתים קרובות חוסר כיסים, מסבך את הגילוי של מולקולות קטנות המתמקדות באתרים כאלה. יש גישות אלטרנטיביות מיקוד באמצעות נוגדני מגבלות בשל זמינות ביולוגית ירודה אוראלית, תא-חדירות נמוכות, וחוסר יעילות ייצור.
יש שימוש בפפטידים למקד ממשקי PPI מספר יתרונות. יש לי פפטידים גמישות קונפורמציה גבוהה יותר, הסלקטיביות מוגברת, והם בדרך כלל זולים. עם זאת, יש לי פפטידים מגבלות משלהם, כולל יציבות עניה וקרום תא חוסר יעילות חצייה. כדי להתגבר על מגבלות אלה, ניתן לבצע cyclization פפטיד. Cyclization הודגם לשפר סלקטיביות פפטיד, יציבות מטבולית, וזמינות ביולוגית. עם זאת, ניבוי קונפורמציה ביו של פפטיד מחזורי הוא לא טריוויאלי. כדי להתגבר על האתגר הזה, גישה אטרקטיבית אחד אותו למסך ספרייה ממוקדת למסך שבו יש את כל פפטידים מחזורי עמוד השדרה באותו רצף ראשוני, אך שונות בפרמטרים המשפיעים על קונפורמציה, כגון גודל טבעת ומיקום.
אנו מתארים פרוטוקול מפורט לסינתזה של פפטידים ספרייה מחזוריים עמוד השדרה מיקוד PPIs טפיל הספציפי. שימוש בגישה עיצוב רציונלים, שפיתחנו פפטידים הנגזרים מקולט eishmania L חלבון הפיגום לC-קינאז מופעל (חוסר). חוקרים שערנו כי רצפים בחוסר הנשמרים בטפילים, אבל לא בhomolog מארח היונקים, עשויים לייצג אתרי אינטראקציה לחלבונים שהם קריטיים ליכולת הקיום של הטפילים. פפטידים מחזוריים היו מסונתזים באמצעות קרינת מיקרוגל כדי להפחית את זמני תגובה ולהגדיליְעִילוּת. פיתוח ספרייה של פפטידים מחזוריים עמוד השדרה בגדלים שונים טבעת מאפשר מסך שיטתי לקונפורמציה הפעילה הביולוגית ביותר. שיטה זו מספקת דרך כללית, מהירה, וקלילה לסנתז פפטידים מחזוריים.
Introduction
אינטראקציות חלבון-חלבון (PPIs) לשחק תפקיד מרכזי ברוב התהליכים ביולוגיים, מהעברת אותות תאיות לתא המוות 1. לפיכך, מיקוד PPIs הוא בעל חשיבות עליונה למחקר בסיסי ויישומים טיפוליים. יכול להיות מוסדר על ידי PPIs נוגדנים ספציפיים ויציבים, אבל נוגדנים הם יקרים וקשים לייצר ויש זמינות ביולוגית ירודה. לחלופין, יכול להיות ממוקד PPIs על ידי מולקולות קטנות. מולקולות קטנות קלות יותר לסנתז וזולים בהשוואה לנוגדנים; עם זאת, הם יחסית פחות גמישים ולהתאים טובים יותר לחללים קטנים יותר לממשקי חלבון-חלבון גדול 2,3. מחקרים שונים הראו כי פפטידים, שהם פשוט יותר וזולים יותר מאשר נוגדנים וגמישים יותר ממולקולות קטנות, יכולים להיקשר ממשקי חלבון ולהסדיר PPIs 4,5. שוק פפטיד הטיפולי העולמי מוערך כרבע מליארד דולרים בשינה 2013, והוא גדל annua 10.5%lly 6. יתר על כן, יש יותר מ -50 פפטידים משווקים, סביב 270 פפטידים בשלבים שונים של ניסויים קליניים, ופפטידים כ -400 בשלבים פרה-קליניים מתקדמים 7. למרות פפטידים רבים נמצאים בשימוש כתרופות, פפטידים עדיין מהווים מספר אתגרים המגבילים את היישום הנרחב שלהם, כולל זמינות ביולוגית ירודה ויציבות, חוסר יעילות בקרום תא מעבר, וגמישות קונפורמציה 8,9. חלופה אחת להתגבר על החסרונות אלה היא להחיל שינויים שונים כגון (חומצת אמינו וD-N-אלקילציה) מקומיות והגלובלי (cyclization) אילוצים 8,10-12. שינויים אלה להתרחש גם באופן טבעי. לדוגמא, ציקלוספורין, פפטיד הטבעי מחזורי לדיכוי מערכת חיסון, מכיל חומצת אמינו בודדת D-ועובר שינויי N-אלקילציה 13,14.
שינוי של חומצות אמינו טבעיות כדי לגרום לאילוצים מקומיים, כגון D- וN-אלקילציה, לעתים קרובות משפיע על פפטיד9; של פעילות ביולוגית. עם זאת, cyclization, שבו הרצף של עניין יכול להישאר אותו הדבר, יש יותר סיכוי לשמור על פעילות ביולוגית. Cyclization היא דרך אטרקטיבית מאוד להגביל את מרחב קונפורמציה פפטיד על ידי הפחתת שיווי המשקל בין תצורות שונות. בדרך כלל זה מגביר את הפעילות והסלקטיביות ביולוגיות על ידי הגבלת פפטיד לקונפורמציה הפעילה שמתווכת רק פונקציה אחת. Cyclization גם משפר את יציבות פפטיד על ידי שמירה על פפטיד בקונפורמציה שפחות מוכרת על ידי אנזימים משפילים. ואכן, פפטידים מחזוריים הוצגו השתפרו יציבות מטבולית, זמינות ביולוגית, וסלקטיביות בהשוואה לעמיתיהם ליניארי שלהם 15-17.
עם זאת, cyclization יכולה להיות חרב פיפיות שכן במקרים מסוימים ההגבלה עלולה למנוע פפטידים מהשגת קונפורמציה ביו. כדי להתגבר על מכשול זה, ספרייה ממוקדת שבו יש את כל פפטידים אותו sequenc העיקרייכול להיות מסונתז pharmacophores דואר וכתוצאה מכך קבוע. פפטידים בספרייה שונים בפרמטרים המשפיעים על המבנה שלהם, כגון גודל טבעת ומיקום, על מנת להקרין לאחר מכן לקונפורמציה ביו ביותר 9,18.
יכולים להיות מסונתזים פפטידים הן בפתרון ועל ידי גישת סינתזת פפטיד מוצק שלב (SPPS), שנמצא כעת גישת סינתזת פפטיד הנפוצה יותר ויידון נוסף. SPPS הוא תהליך שבו שינויים כימיים מבוצעים על תמיכה מוצקה באמצעות מקשר להכין מגוון רחב של תרכובות סינתטיות 19. SPPS מאפשר פפטידים הרכבה על ידי צימוד רצוף של חומצות אמינו באופן הדרגתי מC-הסופית, שמצורף לתמיכה מוצקה, לN-הסופית. הצד-השרשרות של חומצות N-α-אמינו חייבים להיות רעול פנים עם הגנה על קבוצות שהם יציבים בתנאי תגובת שימוש במהלך התארכות פפטיד כדי להבטיח את התוספת של חומצת אמינו אחת לרח 'EP. בשלב האחרון, פפטיד הוא שוחרר מהשרף והצד-שרשרת הגנה על קבוצות יוסרו במקביל. בעוד פפטיד הוא להיות מסונתז, ניתן להסיר את כל חומרים כימיים המסיסים ממטריצת תמיכת פפטיד המוצק על ידי סינון ונשטפו בסוף כל שלב צימוד. עם מערכת כזו, עודף גדול של חומרים כימיים בריכוז גבוה יכול לנהוג תגובות צימוד להשלמה וניתן לבצע את כל שלבי הסינתזה באותו הכלי ללא כל העברה של חומר 20.
למרות שיש כמה מגבלות SPPS כגון הייצור של תגובות לא שלמות, תגובות לוואי, חומרים כימיים טמאים, כמו גם קשיי ניטור התגובה 21, את היתרונות של SPPS עשו את זה "תקן הזהב" לסינתזת פפטיד. יתרונות אלה כוללים את האפשרות לשלב חומצות אמינו שאינם טבעיות, אוטומציה, טיהור קלה, הפסדים פיזיים ממוזערים, ושימוש בחומרים כימיים עודפים, וכתוצאה מכךתשואות גבוהות. SPPS הוכח להיות שימושי מאוד בסינתזה של רצפים קשים 21,22, שינויי ניאון 23, וספריות פפטיד 24,25. SPPS הוא גם מאוד שימושי עבור מכלולים מרובה שרשרת אחרות כגון oligonucleotides 26,27, אוליגוסכרידים 28,29, וחומצות גרעין פפטיד 30,31. מעניין לציין, שבמקרים מסוימים, SPPS הוצג להיות יתרון עבור סינתזת מולקולות קטנות שנעשות באופן מסורתי בפתרון 32,33. SPPS משמש הוא בקנה מידה קטנה למחקר והוראה 34,35, כמו גם בקנה מידה גדולה בתעשייה 36-38.
שתי אסטרטגיות סינתזה המשמשות בעיקר במתודולוגיה SPPS לסינתזה של פפטידים הן butyloxycarbonyl (בוק) ו9-fluorenylmethoxycarbonyl (FMOC). האסטרטגיה המקורית הציגה לSPPS הייתה בוק, אשר דורש תנאי חומצה חזקים כדי להסיר צד שרשרת הגנה על קבוצות ולדבוק פפטיד מresin. סינתזת פפטיד מבוססת FMOC, לעומת זאת, מנצלת תנאי בסיס מתונים והיא אלטרנטיבה מתונה יותר לפרוטוקול בוק חומצה יציב 39. אסטרטגית FMOC מנצלת הגנת צד שרשרת המאונכות t-בוטיל (TBU) שהוסרה בשלב האחרון של הסינתזה תוך ביקוע פפטיד מהשרף בתנאי חומצה.
העיקרון הכללי לסינתזת פפטיד על תמיכה מוצקה מוצג באיור 1. חומצת אמינו הראשונית, רעול פנים על ידי קבוצת הגנה זמנית על N-α-הסופית, נטענת על השרף מC-סופית. קבוצת הגנת חצי קבועה כדי להסוות את שרשרת הצד משמשת גם במידת צורך (איור 1, שלב 1). הסינתזה של פפטיד היעד מורכבת מC-הסופית לN-הסופית על ידי מחזורים חוזרים ונשנים של deprotection של קבוצת הגנת N-α-הזמנית (איור 1, שלב 2) וצימוד של חומצת אמינו המוגנת הבאה (איור 1 אונג>, שלב 3). לאחר חומצת אמינו האחרונה נטענת (איור 1, שלב 4), פפטיד הוא ביקע מתמיכת השרף וקבוצות הגנת חצי הקבועה מוסרים (איור 1, שלב 5).

באיור 1. תכנית כללית של סינתזת פפטיד השלב מוצקה. חומצת אמינו המוגנת-N-α מעוגנת באמצעות קבוצת carboxyl באמצעות מקשר לשרף (שלב 1). הפפטיד הרצוי מורכב באופן ליניארי מC-הסופית לN-הסופית על ידי מחזורים חוזרים ונשנים של deprotection של הקבוצה הזמנית הגנה (TPG) מN-α (שלב 2) וצימוד חומצת אמינו (שלב 3). לאחר להשיג הסינתזה (שלב 4), קבוצות חצי קבועות הגנה (SPG) הם deprotected במהלך מחשוף פפטיד (שלב 5).תקבל = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לאחר ההרכבה של שרשרת הפפטיד המלאה, cyclization יכול להיות מושגת על ידי מספר חלופות: (א) ראש אל זנב cyclization - זו דרך נוחה אבל מוגבל שכן הוא מספק רק אפשרות אחת לcyclization (איור 2 א), cyclization (ב) באמצעות חומצות אמינו מהרצף של עניין המכילות קבוצות פונקציונליות ביו - עם זאת, השימוש בחומצות אמינו אלה עשויים להשפיע על הפעילות הביולוגית (איור 2), וcyclization (C) על ידי הוספת חומצות אמינו (אבני בניין או אחר) מבלי להפריע הרצף ביו. היכרות עם מולקולות אלה היא נפוצה שכן היא מאפשרת ייצור של ספריות ממוקדות מבלי לשנות את הרצף של עניין (איור 2 ג).
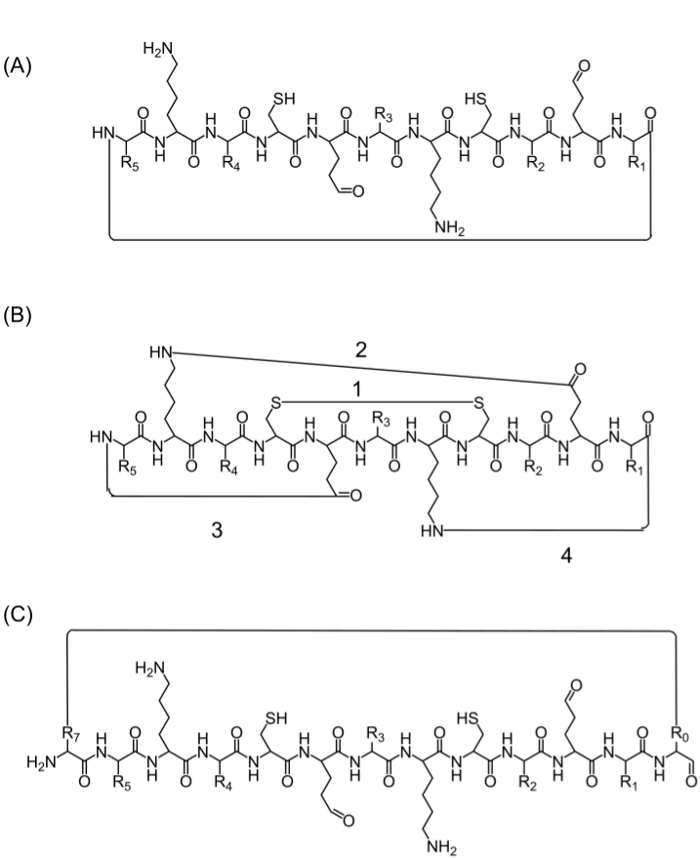
Figure 2. אסטרטגיות cyclization פפטיד האלטרנטיבי ראש () לcyclization זנב, דרך קשר פפטידי בין C-הסופית וN-הסופית.; cyclization (ב ') בין קבוצות הפונקציונליות כגון אג"ח דיסולפיד בין שאריות ציסטאין (1), או קשר בין אמיד הרשתות בצד של ליזין לאספרטית / חומצה גלוטמית (2), או רשת צד לn- או C-סופית (3 -4); cyclization (C) על ידי הוספת חומצות אמינו נוספות או נגזרי חומצת אמינו או מולקולות קטנות, לדוגמא לפני (R0) ואחרי (R7) הרצף ביו. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
סינתזה משתמשת קרינת מיקרוגל לחמם תגובות, ובכך מאיץ כימי אורגנית בסיוע מיקרוגל תמורות 40,41. כימיה מיקרוגל מבוססת על היכולת של המגיב / הממס לספוגמיקרוגל אנרגיה ולהמיר אותו לחום 42. לפני הטכנולוגיה הפכה נפוצה, חסרונות עיקריים היו הצורך להתגבר, כוללים יכולת השליטה והשחזור של פרוטוקולי סינתזה וחוסר מערכות זמינות עבור פקדי טמפרטורה ולחץ נאותים 43,44. הדו"ח הראשון של סינתזת פפטיד בסיוע מיקרוגל נעשה שימוש במיקרוגל מטבח לסנתז כמה פפטידים קצרים (7-10 חומצות אמינו) עם שיפור משמעותי של יעילות הצימוד וטוהר 45. יתר על כן, אנרגיית מיקרוגל הוצגה כדי להקטין הצטברות שרשרת, להפחית תגובות צד, להגביל racemization, ולשפר את שיעורי צימוד, שהם קריטיים לכל רצפים קשים וארוכים 46-53.
כיום השימוש בקרינת מיקרוגל לסינתזה של פפטידים או תרכובות הקשורות בתמיכה מוצקה הוא נרחבת, כולל סינתזה () במים במקום ממס אורגני 54; (ב) סינתזה של פפטידים עםשינויים נפוצים לאחר translational, כגון glycopeptides 55-58 או phosphopeptides 59-61, סינתזה שקשה בדרך כלל עקב יעילות הצימוד הנמוכה של נגזרי חומצת אמינו הפריעו sterically; (ג) סינתזה של פפטידים עם שינוי בעמוד השדרה, כגון azapeptides, אשר יכול להיווצר על ידי ההחלפה של C (α) של שאריות חומצת אמינו עם אטום חנקן 62, או peptoids, הצד שמחובר לשרשרת חנקן אמיד ולא אטום Cα 63,64; סינתזה של פפטידים מחזוריים 65-71 (ד); סינתזה ו( ה) של ספריות קומבינטורית 51,72. במקרים רבים, החוקרים דיווחו יעילות גבוהה יותר וצמצום זמן סינתזה באמצעות קרינת מיקרוגל בהשוואה לפרוטוקול המקובל.
באמצעות עיצוב רציונאלי 73-75, שפיתחנו פפטידים אנטי-טפילים שנגזרו מהקולט של eishmania L הפיגום FOr מופעל C-קינאז (חוסר). חוסר ממלא תפקיד חשוב בשלב המוקדם של זיהום שושנת יריחו 76. טפילים להביע רמות נמוכות יותר של חוסר להיכשל טפילים אפילו עכברים שנפרץ חיסון 77 כמו חוסר מעורב בתהליכי טפיל איתות חיוניים וסינתזת חלבון 78. לכן, חוסר הוא חלבון מפתח פיגום 79 ויעד תרופה יקר. התמקדות ברצפים בחוסר הנשמרים בטפילים, אך לא במעמד homolog היונקים המארח, זיהינו פפטיד חומצת אמינו 8 (RNGQCQRK) שירד שושנת יריחו sp. כדאיות בתרבות.
כאן, אנו מתארים פרוטוקול לסינתזה של פפטידים עמוד השדרה מחזורית הנגזרים מרצף חלבון חוסר שתואר לעיל. פפטידים היו מסונתזים על תמיכה מוצקה באמצעות חימום במיקרוגל על ידי המתודולוגיה SPPS עם פרוטוקול FMOC / TBU. פפטידים היו מצומדת לפפטיד 47-57 מוביל (YGRKKRRQRRR) TAT באמצעות אג"ח אמיד כחלק מSPPS. תחבורה של מגוון רחב של מטענים לתאים מבוססות TAT הייתה בשימוש כבר למעלה מ -15 שנים ומסירת המטען לאברונים subcellular אושרה 80. ארבעה linkers שונה, succinic ואנהידריד glutaric כמו גם adipic והחומצה pimelic, שימש לביצוע cyclization ליצור linkers חומצה קרבוקסילית של שניים עד חמישה פחמנים. Cyclization נעשה שימוש באנרגית מיקרוגל, והצעדים deprotection מחשוף וצד-שרשרת הסופיים נעשו באופן ידני ללא אנרגיית מיקרוגל. השימוש בסינתיסייזר מיקרוגל אוטומטי שיפר את טוהר המוצר, הגדיל את תשואת המוצר, וצמצם את משך הזמן של הסינתזה. פרוטוקול כללי זה יכול להיות מיושם למחקרים אחרים שעושים שימוש בפפטידים להבין מנגנון מולקולרי חשוב במבחנת in vivo ולפתח תרופות פוטנציאליות למחלות בבני אדם.
Protocol
1. ציוד וריאגנטים הכנה
- ציוד הכנה
- לבצע את כל הפעולות בתוך מנדף שימוש בציוד מגן אישי מתאים.
- כימי לסנתז פפטידים על תמיכה מוצקה באמצעות מיקרוגל פפטיד סינתיסייזר עם מודול נוסף של גלה מצויד בבדיקת טמפרטורה של סיבים אופטיים לשליטה כוח משלוח המיקרוגל בכלי תגובת טפלון (30 מיליליטר, עם frit זכוכית) או בפוליפרופילן חד פעמי מחסנית (12 מיליליטר, עם frit גס).
- לערבוב נכון, להתחבר אספקת חנקן לכלי התגובה, או לחלופין לאטום את שני הקצוות של מחסנית פוליפרופילן, ומניח על שייקר סיבובי.
- לניקוז תערובות תגובה או שטיפות, להתחבר לואקום הבית באמצעות מלכודת פסולת.
- מניחים את הבדיקה הסיבים אופטיים לתוך כלי התגובה.
- הכנת ריאגנטים
- הכן את השרף על ידי שקילת רשת 100-200 שרף רינק אמיד בבוקר (0.204 מ"ג), להוסיף 5 מיליליטר של 1: 1 תערובת של N, -dimethylformamide N (DMF) / dichloromethane (DCM) למחסנית הכלי / פוליפרופילן התגובה לשטוף את השרף למטה, לנער במשך 2-4 שעות להתנפח כמו שצריך, ולנקז.
- הכן 0.2 M-9 fluorenylmethoxycarbonyl (FMOC) -amino פתרונות חומצה על ידי המסת חומצת אמינו-FMOC המקבילה בDMF ומערבולת את התערובת עד חומצות אמינו הם מומסים (טבלה 1).
- הכן תערובת פתרון 0.45 M activator ידי המסת 18.96 גרם O - (benzotriazol-1-י.ל) - N, N, N ', N' hexafluorophosphate -tetramethyluronium (HBTU) ב 100 מיליליטר DMF וvortexing את התערובת עד המוצק מומס (טבלה 1).
- הכן תערובת 2 פתרון בסיס activator M על ידי שילוב של 34.8 מיליליטר N, -diisopropylethylamine N (DIEA) עם 65.2 מיליליטר 1-מתיל-2-pyrrolidinone (תמ"א) (טבלת 1).
- הכן תערובת פתרון 0.1 M deprotection ידי המסת מימה 3.37 g 1-hydroxybenzotriazole (HOBt)ב 250 מיליליטר של פתרון 20% / V V של piperidine בDMF וvortexing את התערובת עד המוצק מומסת (טבלה 1).
2. FMOC מוגן חומצת אמין זיווגים
- צימוד חומצת אמינו
- להוסיף חומצת אמינו (2.5 מיליליטר) / activator (1 מיליליטר) / בסיס activator (0.5 מיליליטר) למחסנית הכלי / פוליפרופילן תגובה ולתת את התגובה להמשיך עבור 300 שניות (25 W, 75 ° C, טבלה 2). מסננים את הפתרון.
- לשטוף את השרף עם DMF. להוסיף DMF לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור חמש פעמים.
- deprotection FMOC
- להוסיף 7 מיליליטר של piperidine 20% בDMF עם 0.1 M HOBt מחסנית הכלי / פוליפרופילן לתגובת דגירה במשך 30 שניות (45 W, 75 ° C, טבלה 2).
- מסננים את תערובת התגובה.
- להוסיף 7 מיליליטר של piperidine 20% בDMF עם 0.1 M HOBt מחסנית הכלי / פוליפרופילן לתגובת דגירה במשך 180 שניות (45 W, 75 ° C, טבלת 2).
- מסננים את תערובת התגובה.
- לשטוף את השרף עם DMF. להוסיף DMF לשרף עבור 120 שניות (7 מיליליטר 0 W, RT) ולנקז את הפתרון. חזור חמש פעמים.
הערה: לחלופין, להשהות את ההליך כאן ולחדש במועד מאוחר יותר.
- לאחר שלב צימוד חומצת אמינו, לשטוף את השרף עם DCM וחנות לכמה ימים לפחות על 4 מעלות צלזיוס (עבור חנות תקופה ארוכה יותר השרף ב-- 20 מעלות צלזיוס).
- הזז את השרף מכלי התגובה למחסנית פוליפרופילן.
- לשטוף את השרף עם DCM. להוסיף DCM לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור שלוש פעמים.
- לאטום את מחסנית פוליפרופילן הדוק עם כובע וברזלים עליון.
- לפני שמתחיל סינתזה חדשה, להתנפח השרף במשך 3-4 שעות בDMF (7 מיליליטר).
- ניטור הסינתזה
- השתמש בבדיקת קייזר (ninhydrin) או בדיקת Chloranil כדי לקבוע את ההתקדמות של מהירותסִינתֶזָה. לחלופין, לבצע תגובת מחשוף בקנה מידה קטנה כדי לקבוע את טוהר והמוני של פפטיד מסונתז. ראה סעיף 9.
הערה: בפתרון בעיות נוספות ראה טבלה 3.
- השתמש בבדיקת קייזר (ninhydrin) או בדיקת Chloranil כדי לקבוע את ההתקדמות של מהירותסִינתֶזָה. לחלופין, לבצע תגובת מחשוף בקנה מידה קטנה כדי לקבוע את טוהר והמוני של פפטיד מסונתז. ראה סעיף 9.
- חזור על שלבים 2.1 ו -2.2 כרצויים לסנתז פפטיד ממוקד: Arg(Pbf)-Asn(Trt)-Gly-Gln(Trt)-Cys(Trt)-Gln(Trt)-Arg(Pbf)-Lys(Boc)-Lys(Mtt)-Gly-Gly-Tyr(But)-Gly-Arg(Pbf)-Lys(Boc)-Lys(Boc)-Arg(Pbf)-Arg(Pbf)-Gln(Trt)-Arg(Pbf)-Arg(Pbf)-Arg(Pbf).
3. אנהידריד / חומצת צימוד
- צימוד אנהידריד
- לשטוף את השרף עם תמ"א. להוסיף תמ"א לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור שלוש פעמים.
- ממיסים 10 שווה של אנהידריד המקביל בתמ"א (5 מיליליטר), להוסיף 1 4-Dimethylaminopyridine שווה הערך (DMAP) ו -10 שווה DIEA לפתרון (טבלת 1).
- הוסף 10: 1: 10 תערובת של אנהידריד / DMAP / DIEA לשרף ודגירה של 300 שניות (25W, 75 ° C, טבלה 2). מסננים את הפתרון.
- לשטוף את השרף עם תמ"א. להוסיף תמ"א לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור שלוש פעמים.
- צימוד חומצה
- לשטוף את השרף עם DMF. להוסיף DMF לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור שלוש פעמים.
- ממיסים 10 שווה של חומצת dicarboxylic המקבילה בDMF (5 מיליליטר). הוסף 1 DMAP שווה ושווה 10 N, N '-Diisopropylcarbodiimide (DIC) לפתרון (טבלת 1).
- טרום להפעיל את התערובת על ידי ערבוב במשך 30 דקות.
- מוסיף את התערובת לשרף והדגירה של 300 שניות (25 W, 75 ° C, טבלה 2) ולנקז את הפתרון.
- לשטוף את השרף עם DMF. להוסיף DMF לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז פתרון. חזור על שלב שלוש פעמים.
4. N-methyltrityl (MTT) הגנת הקבוצה Deprotectיוֹן
הערה: שרשרת צד יזין הייתה מוגנת עם N-methyltrityl (MTT) 81, קבוצת הגנה שניתן deprotected סלקטיבי בתנאים יציב חומצה 82,83. Deprotect MTT הגנת קבוצה באופן ידני על שייקר בלי אנרגיית מיקרוגל.
- העבר את השרף למחסנית פוליפרופילן מצויד בתקע כובע וברזלים.
- לשטוף את השרף עם DCM. להוסיף DCM לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור שלוש פעמים.
- להוסיף 15-25 מיליליטר של תערובת של 1% חומצת trifluoroacetic (TFA), 5% Triisopropylsilane (TIS), ו -94% DCM למחסנית פוליפרופילן לגרם אחד של שרף.
הערה: TFA הוא חומצה חזקה ומאכל והוא מאוד ממגר את העור, עיניים, ורקמת ריאה.- שמור תמיסות מרוכזות של TFA בשכונה בכל העת.
- להשתמש בציוד מגן אישי מתאים (הגנה על העין, חלוק מעבדה וכפפות) ועבודה במכסת מנוע מאוורר היטב. כפפות שינוי מיידיאם הם באים במגע עם TFA ומייד לנקות כל נשפך. אם עור או עיניים לבוא במגע עם החומצה, לשטוף את האזור הפגוע באופן מיידי עם מים ולשטוף במשך 15 דקות נוספות.
- הנח את מחסנית פוליפרופילן על שייקר ולנער במשך 5 דקות על RT.
- מסננים את הפתרון ממחסנית פוליפרופילן על ידי יישום ואקום.
- חזור על שלבים 4.3-4.5 פעמים, שלוש.
- לשטוף את השרף עם DCM. להוסיף DCM לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור חמש פעמים.
5. Cyclization של פפטיד לינארי
- לשטוף את השרף עם DCM. להוסיף DCM לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור חמש פעמים.
- בצינור פוליפרופילן 50 מיליליטר, לפזר 5 שווה benzotriazole-1-ly-אצטילן-טריס-pyrrolidinophosphonium hexafluorphosphate (PyBOP) בDibromomethane (DBM, 5 מיליליטר) ולהוסיף 10 שווה DIEA לפתרון (טבלת 1).
- מוסיף את התערובת לשרף והדגירה של 300 שניות (25 W, 75 ° C, טבלה 2). מסננים את הפתרון.
- לשטוף את השרף עם DCM. להוסיף DCM לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור שלוש פעמים.
6. מחשוף וDeprotection של קבוצות צד שרשרת
- לשטוף את השרף עם DCM ואתר diethyl.
- להוסיף DCM לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור על שתי פעמים.
- להוסיף אתר diethyl לשרף עבור 120 שניות (7 מיליליטר, 0 W, RT) ולנקז את הפתרון. חזור על שתי פעמים.
- ייבש את השרף בייבוש ואקום ב RT לפחות 3 שעות על אשלגן הידרוקסידי (KOH, 1-10 ז).
- לשקול את השרף המיובש ולהעביר אותו למחסנית פוליפרופילן.
- להוסיף 10 מיליליטר של קוקטייל מחשוף מקורר מראש trifluoroacetic חומצה (TFA) (לדוגמא, 90% TFA, 2.5% מים, 2.5% פנול TIS ו 5%) לכל גרם אחד של שרף.
- לנער במשך 3 שעותב RT.
- לאסוף את פתרון מחשוף TFA ידי סינון השרף לתוך צינור פוליפרופילן 50 מיליליטר. לסינון, להשתמש frit שהוא במחסנית פוליפרופילן 12 מיליליטר.
- להוסיף אתר קר diethyl (35 מיליליטר) לצינור.
- צנטריפוגה במשך 5 דקות ב1,207 XG ב 4 מעלות צלזיוס.
- למזוג את שכבת האתר.
- חזור על שלב 6.7-6.9, חמש פעמים.
7. ייבוש עמוד השדרה המחזורי פפטיד
- שמור את הפפטיד זירז באותו הצינור ולייבש אותו במכסת מנוע למשך 30 דקות.
- ממיסים את הפפטיד ב1: 1 תערובת של מים ואצטוניטריל (ACN).
- להקפיא את פתרון המוצר הסופי בחנקן נוזלי.
- Lyophilize המוצר הסופי.
8. אפיון עמוד השדרה המחזורי פפטיד
- ממיסים מדגם קטן (1 מ"ג) של המוצר במים (μl 400).
- להזריק את הפפטיד המומס (10-200 μl) לchromatograp נוזל עתירים ביצועים שלב הפוךHY מערכת (RP-HPLC) כדי לבדוק את טוהר פפטיד 34.
- בדוק את המסה של הפפטיד באמצעות יינון ספקטרומטריית מסת desorption הלייזר בסיוע מטריקס (MS-MALDI) 84.
- מערבבים פפטיד μl 1 (100 מיקרומטר) ב1: (V / V) תערובת 1 של אצטוניטריל: מים עם 1 μl של מטריצה (חומצת 5 מ"ג / מיליליטר, α-cyano-4-hydroxycinnamic) ב1: 1 (נ / נ) תערובת של אצטוניטריל: מים עם TFA (0.1%).
- מקום 1 μl על צלחת MS-MALDI.
- ייבש את הדגימה ולמקם אותו בספקטרומטר המסה.
- לשקול את הפפטיד ולחשב את תשואת אחוזים.
- חנות ב -20 מעלות צלזיוס.
9. ניטור הסינתזה
- קייזר מבחן 85 (ninhydrin)
- הכן את הפתרונות מגיב.
- הכן פתרון על ידי המסת 16.5 מ"ג של אשלגן ציאניד (KCN) ב 25 מיליליטר של מים מזוקקים. לדלל 1 מיליליטר של הפתרון מעל 49 מיליליטר של פירידין.
- הכן פתרון Bעל ידי המסת 1 גרם של ninhydrin ב 20 מיליליטר של אתנול.
- הכן פתרון C על ידי המסת פנול 40 גרם ב 20 מיליליטר אתנול.
- השתמש בבדיקת קייזר לבדוק את השלמת צימוד חומצת אמינו או deprotection של קבוצת ההגנה.
- העבר כמה חרוזים מהשרף למבחנה.
- להוסיף שלוש טיפות (~ 100 μl) של כל פתרון (A, B ו- C) ולערבב.
- מחממים את המבחנה על בלוק חימום ב 110 מעלות צלזיוס למשך 5 דקות.
הערה: חרוזים בצבע כחולים (תוצאה חיובית) מצביעות על תגובת צימוד שלמה או deprotection של קבוצת הגנת FMOC.
- הכן את הפתרונות מגיב.
- מבחן Chloranil 86
- הכן את חומרים כימיים טריים עבור כל בדיקה הבאה.
- הכן פתרון של 2% Chloranil בDMF, א פתרון
- הכן פתרון של אצטאלדהיד 2% בDMF, ב 'פתרון
- בצע את בדיקת Chloranil לבדוק את השלמת צימוד חומצת אמינו או לאהוא deprotection של קבוצת ההגנה.
- שילוב של פתרון 100 μl עם הפתרון של B 100 μl בצינור 1.5 מיליליטר.
- זרוק את חרוזים ובעדינות לנער במשך 5 דקות.
הערה: חרוזים חום כהים בצבע (תוצאה חיובית) מצביעים deprotection של קבוצת הגנת FMOC או תגובת צימוד שלמה.
- הכן את חומרים כימיים טריים עבור כל בדיקה הבאה.
- תגובת מחשוף בקנה מידה קטנה
- הסר כמות קטנה של שרף למחסנית פוליפרופילן 3 מיליליטר מצויד בתקע כובע וברזלים.
- פנק עם תערובת 2 מיליליטר של 95% TFA, 2.5% מים וTIS 2.5%.
- לנער את התערובת למשך 30 דקות ב RT.
- הסר את השרף על ידי סינון באמצעות frit של מחסנית פוליפרופילן ולהתאדות הממסים על ידי זרם של חנקן.
- ממיסים את השאריות במים ולנתח את המוצר באמצעות HPLC ו / או MS.
10. שושנת יריחו donovani Promastigote הכדאיות בתרבות Assay
- שושנת יריחו donovani (L. donovani) תנאי גידול וטיפול
- תרבות L. promastigotes donovani בשינוי של Dulbecco של בינוני של הנשר (DMEM) עם 4.5 g / L גלוקוז, L- גלוטמין, ופירובט נתרן ב 26 מעלות צלזיוס.
- פנק את L. donovani promastigotes עם פפטידים מחזוריים (100 מיקרומטר) למשך 24 שעות ב 26 מעלות צלזיוס.
- donovani שושנת יריחו assay כדאיות (L. donovani)
- להעריך את הכדאיות טפיל עם 20 μl alamarBlue פי הפרוטוקול של היצרן.
- לקבוע alamarBlue הפחתה על ידי מדידת הקרינה (ב 570 ננומטר עירור ופליטת 590 ננומטר). ערכי הקרינה גבוהים יותר מצביעים על פעילות המטבולית גדולה יותר ויכולת קיום טפיל מוגברת.
תוצאות
כאן אנו מתארים את הפיתוח של ספרייה קטנה ממוקדת של פפטידים מחזוריים עמוד השדרה שמתמקדת PPIs החיוני של הטפיל שושנת יריחו ולפעול כסוכנים נגד פרזיטים (לסקירה על פפטידים המתמקדים ב- PPI כסוכנים נגד פרזיטים 87). באמצעות הסינתזה של פפטידים מחזוריים עמוד השדרה רומן, pharmacophores נשמר בפיגום של גודל להארכה. הכוח של הספרייה הממוקדת המוצעת כאן הוא היכולת להשתנות גדלי פיגום פפטיד, ובמקביל לאפשר מידה מסוימת של חופש קונפורמציה מוגבלת באמצעות cyclization. הסינתזה שלמה של פפטידים מחזוריים עמוד השדרה נעשתה באמצעות סינתיסייזר מיקרוגל אוטומטי על תמיכה מוצקה, בעקבות פרוטוקול FMOC / TBU. Cyclization בוצע על ידי יצירת קשר אמיד בין מקשר, אנהידריד / חומצה, ואמין בצד השרשרת של ליזין. Deprotection המחשוף וצד-שרשרת הסופית בוצעו באופן ידני ללא אנרגיית מיקרוגל (לערכת סינתזה וFמבנה מוצרי INAL ראה איור 3). המוצר נותח על ידי HPLC preparative להניב 25 מ"ג של אבקה לבנה מאוחסן ב -20 ° C. מדגם של המוצר נבדק על ידי MS (איור 4) ומידת טוהר שלה נקבעה באמצעות HPLC אנליטי (איור 5). מדגם של כל פפטיד המחזורי נשלח להקרנה ביולוגית. אחד מארבעת פפטידים מחזוריים (PL1) היה פעיל נגד שושנת יריחו donovani (L. donovani), טפיל גורם leishmaniasis הקרביים, leishmaniasis החמור ביותר בבני אדם. פפטיד PL1 מופחת כדאיות טפיל על ידי 75% בהשוואה לטיפול השליטה (לוח 4).

איור 3. תכנית סינתזה ומבנה של פפטיד המחזורי עמוד השדרה מסונתז במחקר זה ריאגנטים ותנאים:. (I) אמין צימוד חומצה: 300 שניות, 25 W, 75 ° C,באמצעות 1.1: 1: 2.2 חומצת אמינו / activator / בסיס activator. (Ii) deprotection FMOC: 30 שניות ו -180 שניות שני ב 45 W, 75 ° C, באמצעות 20 piperidine% בDMF 0.1 M HOBt +. (Iii) צימוד אנהידריד: 300 שניות, 25 W, 75 ° C, באמצעות 10: 10: אנהידריד 1 / DIEA / DMAP בתמ"א. (Iv) deprotection MTT: 3 * (300 שניות, 0 W, RT) באמצעות 1: 5: 94 TFA / TIS / DCM. (נ) Cyclization: 300 שניות, 25 W, 75 ° C, באמצעות 05:10 PyBOP / DIEA בDBM. (Vi) מחשוף וdeprotection: 2.5: 5 TFA / TIS / H 2 O / פנול 3 שעות, 0 W, RT, באמצעות 90: 2.5. פפטידים היו מצומדת ל47-57 פפטיד מוביל TAT (Tyr-גלאי-Arg-ליס-יס-Arg-Arg-GLN-Arg-Arg-ARG) באמצעות אג"ח אמיד כחלק מסינתזת השלב המוצק. אנא לחצו כאן ל לצפות בגרסה גדולה יותר של דמות זו.

איור 4. עקבות ספקטרוסקופיה מסת MALDI-TOF שלעמוד השדרה נציג פפטיד המחזורי. המסה שנצפתה, 2853.456 הוא בהסכם קרוב למסה המחושבת, 2,854.271. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
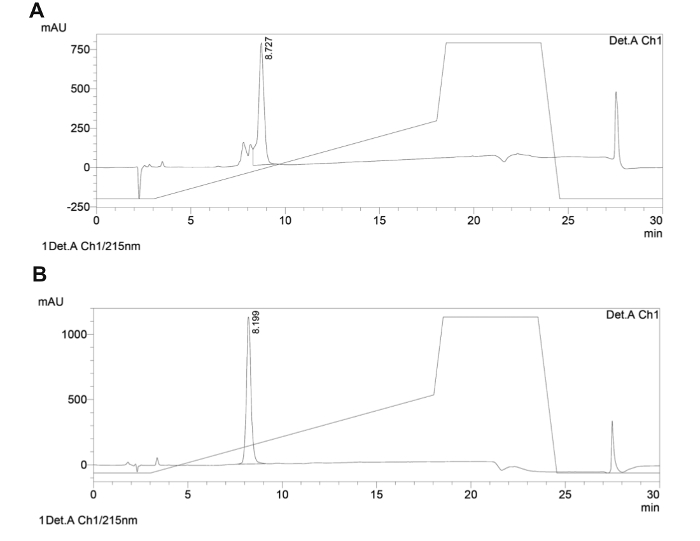
איור 5. עקבות אנליטי HPLC השלב ההפוך של פפטיד המחזורי עמוד השדרה נציג. עקבות HPLC אנליטי של הנפט הגולמי () ופפטיד עמוד השדרה המטוהר (ב) המחזורי מוצגות. מערכות הממס השתמשו היו (H 2 O עם 0.1% TFA) ו- B (CH 3 CN עם 0.1% TFA). שיפוע ליניארי של 5-50% ב 1 מיליליטר / דקה ב -15 דקות ב -40 מעלות צלזיוס עם C18, 5 מיקרומטר, 150 מ"מ הטור יושם והגילוי היה ב215 ננומטר. אנא לחץ כאןכדי לצפות בגרסה גדולה יותר של דמות זו.
| פִּתָרוֹן | מֵגִיב | MW (g / mol) | ד (ג '/ מיליליטר) | נפח (מיליליטר) | ריכוז (M) | הכמות הכוללת |
| - פתרון חומצת אמינו - | חומצת אמינו אלאנין | 311.34 | 0.2 | 6.23 גרם | ||
| 0.2 M של חומצת אמינו בDMF | DMF | 100 | 100 מיליליטר | |||
| דוגמא לחומצת אמינו אלאנין, אבל באותו החישוב צריך להיעשות עבור כל חומצת אמינו, עם MW המתאים. כדי להכין תמיסת חומצת אמינו 100 מיליליטר לפזר 6.23 גרם של חומצת אמינו אלאנין ב100 מיליליטר DMF. חנות ב 4 מעלות צלזיוס. | ||||||
| - פתרון Deprotection- | HOBt | 135.1 | 0.1 | 3.37 גרם | ||
| 20% פתרון V / V של piperidine בDMF עם 0.1M HOBt | Piperidine | 50 | 50 מיליליטר | |||
| DMF | 200 | 200 מיליליטר | ||||
| Deprotection משמש להסרת α FMOC N - הגנת קבוצה. כדי להכין פתרון 250 מיליליטר deprotection לפזר 3.37 גרם HOBt ב200 מיליליטר DMF ולהוסיף 50 מיליליטר piperidine. חנות ב 4 מעלות צלזיוס. | ||||||
| - פתרון Activator - | HBTU | 379.24 | 0.45 | 18.96 גרם | ||
| 0.45 M HBTU בDMF | DMF | 100 | 100 מיליליטר | |||
| Activator הואבשימוש עם בסיס activator כדי להפעיל את חומצת אמינו לפני תגובת הצימוד. כדי להכין פתרון activator 100 מיליליטר לפזר 18.96 HBTU גרם ב 100 מיליליטר DMF. חנות ב 4 מעלות צלזיוס. | ||||||
| - פתרון בסיס Activator - | DIEA | 129.24 | .742 | 2 | 34.80 מיליליטר | |
| 2 M DIEA בתמ"א | תמ"א | 65.20 מיליליטר | ||||
| בסיס Activator משמש עם activator כדי להפעיל את חומצת אמינו לפני תגובת הצימוד. כדי להכין תערובת פתרון בסיס activator 100 מיליליטר 34.8 מיליליטר DIEA ו65.2 מיליליטר תמ"א. חנות ב 4 מעלות צלזיוס. | ||||||
| פִּתָרוֹן | מֵגִיב | MW (g / mol) | ד (ג '/ מיליליטר) | נפח (מיליליטר) | משוואה | הכמות הכוללת |
| פתרון אנהידריד - 10: 1: 10 אנהידריד / DMAP / DIEA בתמ"א | Glutaric / אנהידריד Succinic | 114.1 / 100.07 | 10 | 0.11 / 0.10 גר ' | ||
| DMAP | 122.2 | 1 | 0.01 גרם | |||
| DIEA | 129.24 | .742 | 10 | 0.09 מיליליטר | ||
| תמ"א | 5 | 5 מיליליטר | ||||
| ממיסים 0.11 / 0.10 גרם של glutaric / אנהידריד succinic ב 5 מיליליטר תמ"א, להוסיף 0.01 גר 'DMAP ו0.09 מיליליטר של DIEA לפתרון. הכן פתרון חדש. | ||||||
| פתרון חומצה - 10: 1: 10 חומצה / DMAP / דסק"ש בDMF | Adipic / חומצת Pimelic | 146.14 / 160.17 | 10 | 0.15 / 0.16 גר ' | ||
| DMAP | 122.2 | 1 | 0.01 גרם | |||
| דסק"ש | 126.2 | .806 | 10 | 0.16 מיליליטר | ||
| DMF | 5 | 5 מיליליטר | ||||
| ממיסים 0.15 גר '/ 0.16 של Adipic / Pimelic חומצה ב 5 מיליליטר DMF, להוסיף 0.01 גר' DMAP ו0.16 מיליליטר של דסק"ש לפתרון. הכן פתרון חדש. | ||||||
| פתרון Cyclization - 05:10 PyBOP / DIEA בDBM | PyBOP | 520.3 | 5 | 0.26 גרם | ||
| DIEA | 129.24 | .742 | 10 | 0.09 מיליליטר | ||
| DBM | 5 מיליליטר | 5 מיליליטר | ||||
| ממיסים PyBOP 0.26 גרם ב 5 DBM מיליליטר ולהוסיף 0.09 מיליליטר של DIEA לפתרון. הכןפתרון טרי. | ||||||
ריאגנטים טבלה 1. ופתרונות לסינתזת פפטיד המחזורית עמוד השדרה. רשימה של הפתרונות וריאגנטים לסינתזה מסופקים.
| מחזור מיקרוגל | ספק (ואט) | Temp (° C) | זמן (שניות) | ||
| 1 | צימוד חומצות אמינו | 25 | 75 | 300 | |
| 2 | Deprotection של קבוצת הגנת FMOC | (א) deprotection הראשוני | 45 | 75 | 30 |
| (ב) deprotection מלא | 45 | 75 | 180 | ||
טבלת 2. מחזורי מיקרוגל לצימוד וdeprotection. מחזורי מיקרוגל לצימוד אמינו חומצה וFMOC-deprotection. (1) צימוד של חומצות אמינו. (2) Deprotection של קבוצת מיסוך FMOC נעשה בשני שלבים: (א) ראשוניים ו- (ב) deprotection מלא.
| בְּעָיָה | סיבה אפשרית | פִּתָרוֹן |
| בדיקות קייזר או Chloranil חיוביות לאחר צימוד חומצת אמינו | צימוד חומצת אמינו אינו שלם | חזור על שלב הצימוד |
| פפטידים אינם מופרדים ביעילות מsupernatant | סכום עודף של TFA | להתאדות המדגם באמצעות זרם של חנקן |
| נוכחות של רצפי מחיקה במוצר | הסרת FMOC אינה שלמה | צג deprotection על ידי בדיקות קייזר או Chloranil ו / או מחשוף בקנה מידה קטן, במקרה הסרת FMOC היא חוזרת שלם הצעד |
| coupl חומצת אמינוING אינו שלם | צג הצימוד על ידי בדיקות קייזר או Chloranil ו / או מחשוף בקנה מידה קטן, במקרה צימוד חומצת אמינו אינו שלם לחזור על השלב ו / או להשתמש בזמן תגובה ארוך יותר |
רשימת עצות 3. פתרון בעיות בלוח של פתרונות לאתגרים סינטטיים הנפוצים ביותר מסופקת.
| פפטיד | סדר פעולות | n | גברת. קאל. | MS Obs. | HPLC | תְשׁוּאָה | כדאיות טפיל | ||
| PL1 | RNGQCQRK-GG-YGRKKRRQRRR | 2 | 2854.321 | 2853.456 | 98% | 86% | 25% | ||
| pL2 | RNGQCQRK-GG-YGRKKRRQRRR | 3 | 2868.348 | 2868.808 | 98% | 87% | 100% | ||
| pL3 | RNGQCQRK-GG-YGRKKRRQRRR | 4 | 2882.375 | 2881.823 | 96% | 89% | 97% | ||
| pL4 | RNGQCQRK-GG-YGRKKRRQRRR | 5 | 2896.402 | 2895.603 | 97% | 85% | 98% | ||
שולחן אפיון 4. ופעילות ביולוגית של פפטידים במחקר זה. N מתייחסים למספר methylenes בspacer אלקיל (ראה איור 3 למבנה). MS נעשה שימוש בטכניקת MALDI וטוהר נקבע על ידי HPLC אנליטי. פפטידים נוספו לpromastigotes שושנת יריחו donovani ואת הכדאיות של טפילים הוערכה והביעה כהישרדות אחוזים ביחס לשליטה תרבויות מודגרות בהעדר פפטיד. רק היה לי PL1 פעילות Leishmanicidal גבוהה. המשקיףהתעוור לתנאי ניסוי. הנתונים הם נציג של שלושה ניסויים בלתי תלויים.
Discussion
הסינתזה של ספרייה ממוקדת של פפטידים מחזוריים עמוד השדרה נגזרים מחלבון חוסר הטפיל שושנת יריחו באמצעות סינתיסייזר מיקרוגל אוטומטי לחלוטין מתוארת. ספרייה ממוקדת של פפטידים מחזוריים פותחה עם pharmacophores שימור וlinkers השונים. תוספת של linkers השונים כגון אנהידריד glutaric, אנהידריד succinic, חומצת adipic, חומצת pimelic, ליזין, ornithine, ואובניים בניין אחר יכולה לשמש כדי להגדיל את מגוון חלל קונפורמציה של פפטידים מחזוריים. הסינתזה של ספריית פפטידים מחזוריים ממוקדת מאפשרת לחוקרים למסך למרחב קונפורמציה האופטימלי. מאז קונפורמציה של פפטידים מחזוריים משתנה בהתאם לפרמטרים כגון גודל טבעת ומיקום, תחליפים מגוונים עם תצורות שונות יכולים להיות שנוצרו, אשר עשוי להיות שימושי ביחסי מבנה-פעילות ביולוגיות לומדים 88.
אתגר עיקרי בSPPS הוא אבחון syntהתקדמות hetic ופתרון בעיות שכן אין ביניים מבודדים. לכן, ניתן להשתמש במספר בדיקות colorimetric לעקוב אחר התגובה, כגון אלה המזהים אמינים בחינם על ידי בדיקות קייזר וChloranil. אם בדיקות קייזר או Chloranil אינן אינדיקטיביות (למשל, פרולין והידרוקסי-פרולין לא מגיבים עם ninhydrin באותה הצורה כמו חומצות אמינו האחרות, כי קבוצת אמין אלפא היא חלק מטבעת membered חמש), תגובת מחשוף בקנה מידה קטנה וניתוח ספקטרומטר מסה ניתן להחיל כדי לפקח על התקדמות סינתזה.
זמן מחשוף וקוקטייל המחשוף יכולים להיות שונה המבוססים על התכונות הכימיות ומספר קבוצות ההגנה משמשות. מומלץ מחשוף ניסוי ראשוני תוך שימוש בכמות קטנה של השרף (מ"ג 1-10) יבוצע כדי לוודא את התנאים המתאימים. המלך et al. קוקטיילים מחשוף שונים נבדקו על פפטידים שונים והנחיות המפורטות ניתן להשתמש כדי לייעל reactioתנאי n 89. לפפטידים מחזוריים עמוד השדרה, דגירה של לפחות 3 שעות מומלצת כברירת מחדל עבור מחשוף מלא. עם זאת, פפטידים המכילים מספר גבוה של קבוצות הגנה או קבוצות הגנה קשות (לדוגמא, אסתר לא-בוטיל או pentamethyl-2,3-5-sulfonyl dihydrobenzofuran) יש טופחה במשך זמן רב יותר כדי להבטיח deprotection מלא. במסמך זה, יש לנו לא באופן שיטתי למדו זמן מחשוף האופטימלי או קוקטייל. עם זאת, מצאנו כי זמן קצר מחשוף (פחות משעה 2) הביא מחשוף שלם של כמה קבוצות הגנה.
פרוטוקול סינתזת פפטיד המיקרוגל הסטנדרטי הוא שיטה בדרך כלל ישימה עבור הסינתזה של מגוון רחב של פפטידים. ברוב המקרים, השימוש בסינתיסייזר מיקרוגל אוטומטי מפחית את משך הסינתזה ומגדיל את התשואה וטוהר של המוצרים. יתר על כן, זה מקטין את תגובות לוואי כגון racemization והיווצרות aspartimide. למרות שלא עשוהשוואת Side-by-צד של מיקרוגל וסינתזה קונבנציונלית במחקר זה, המבוסס על הניסיון שלנו ומעבדות אחרות, שהראתה כי השימוש בסינתזה בסיוע מיקרוגל עדיפה על הפרוטוקול הקונבנציונלי 61,70. כמעט כל המפעילים ושרפים ניתן להשתמש ביעילות בSPPS מיקרוגל והשיטה הכללית יכולה להיות מיושמת גם לסינתזה של מגוון רחב של פפטידים שונה, כגון, glycopeptides, phosphopeptides, azapeptides, peptoids, ופפטידים מחזוריים 90.
Cyclization היא דרך נוחה כדי לשפר את העוצמה ויציבות של מבשרים ליניארי. פפטידים מחזוריים יכולים להשיג קונפורמציה רצויה מוגבלת שעשויות לתרום לעלייה בזיקה וסלקטיביות מחייבות. יתר על כן, ניתן לשנות פפטידים יניארי להכיל לולאות מחזוריות מרובות, ומאפשרים להם למקד אולי ממשקי חלבון אנדוגני מרובים מחייבים 91. עם זאת, חשוב לשים לב cyclization שאינו necessarily להוביל לשיפור בלפעמים כל המאפיינים האלה או כל. פפטידים מחזוריים מסוימים יכולים לגרום לתצורות שאינם מוכרות על ידי קולטנים ממוקדים (למשל 92,93) .לכן, ספרייה ממוקדת של פפטידים מחזוריים יש צורך המסך לפעילות ביולוגית. לסיכום, פפטידים סינטטיים מחזוריים להציג מאפיינים תרופתיים רצויים, הם קטנים מספיק כדי לחצות את קרום התא, והם גדולים מספיק כדי להיות סלקטיביות גבוהה. עוצמה גבוהה, סגוליות, ופרופיל בטוח יתרמו להבטחה 'פפטידים מחזוריים כמועמדי סמים.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
אנו מודים לורן ואן Wassenhove, Sunhee הוואנג, ודריה מושלי-רוזן לדיונים מועילים. העבודה נתמכה על ידי המכון הלאומי לבריאות NIH מענק RC4 TW008781-01 C-רעיון (ניצוץ) לNQ היו הממנים לא היה תפקיד בעיצוב מחקר, איסוף נתונים וניתוח, החלטה לפרסם, או הכנה של כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic. Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. |
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′- tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’-Diisopropylcarbodiimide (DIC) | Sigma | 38370 | Caution Flammable/ Toxic |
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials - micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP | |
| Nitrogen cylinder | |||
| Desiccator | |||
| Analytical RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-20AD solvent delivery unit, SIL-20AC autosampler, DGU-20A5 degasser (Shimadzu, MD, USA). | ||
| Preparative RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-6AD solvent delivery unit and FRC-10A fraction collector (Shimadzu, MD, USA). |
References
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, American Chemical Society. 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O'Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using 'safety catch' methodology. J Vis Exp. (63), e4112(2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based 'building block' approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O'Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis - A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710(2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373(2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved