Method Article
Sviluppo di un Backbone ciclico Peptide Biblioteca come potenziale Antiparassitaria Therapeutics Uso Microonde irradiazione
In questo articolo
Riepilogo
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Abstract
Interazioni proteina-proteina (PPI) sono intimamente coinvolti in quasi tutti i processi biologici e sono collegati a molte malattie umane. Pertanto, vi è un grande sforzo per PPI nella ricerca di base e del settore farmaceutico bersaglio. Interfacce proteina-proteina sono di solito grandi, piatti, e spesso non hanno le tasche, complicando la scoperta di piccole molecole che hanno come target tali siti. Approcci di targeting alternativi utilizzando anticorpi hanno delle limitazioni dovute alla scarsa biodisponibilità orale, a bassa permeabilità cellulare, e inefficienza della produzione.
Utilizzo di peptidi per indirizzare le interfacce PPI ha diversi vantaggi. Peptidi hanno una maggiore flessibilità conformazionale, una maggiore selettività, e sono generalmente poco costoso. Tuttavia, i peptidi hanno i loro limiti, tra cui scarsa stabilità e inefficienza attraversare le membrane cellulari. Per superare tali limitazioni, peptide ciclizzazione può essere eseguita. Ciclizzazione ha dimostrato di migliorare la selettività peptide, Stabilità metabolica e biodisponibilità. Tuttavia, prevedere la conformazione bioattiva di un peptide ciclico non è banale. Per superare questa sfida, un attraente approccio a schermo una libreria mirato per schermo in cui tutti i peptidi ciclici backbone hanno la stessa sequenza primaria, ma si differenziano per i parametri che influenzano la loro conformazione, come la dimensione e la posizione dell'anello.
Descriviamo un protocollo dettagliato per la sintesi di una libreria di backbone peptidi ciclici mirati specifici PPI parassita. Utilizzando un approccio progettuale razionale, abbiamo sviluppato peptidi derivati dalla proteina patibolo recettore L eishmania per C attivata-chinasi (mancanza). Abbiamo ipotizzato che le sequenze in MANCANZA che si conservano nei parassiti, ma non nel omologo mammifero ospite, possono rappresentare siti di interazione per le proteine che sono fondamentali per la vitalità dei parassiti. I peptidi ciclici sono stati sintetizzati utilizzando irradiazione a microonde per ridurre i tempi di reazione e aumentareefficienza. Lo sviluppo di una libreria di backbone peptidi ciclici con misure degli anelli diversi facilita una schermata sistematica per la conformazione attiva più biologica. Questo metodo fornisce un modo generale, veloce e facile da sintetizzare peptidi ciclici.
Introduzione
Interazioni proteina-proteina (PPI) svolgono un ruolo fondamentale nella maggior parte dei processi biologici, da intracellulare trasduzione del segnale di morte cellulare 1. Quindi, il targeting PPI è di fondamentale importanza per la ricerca di base e applicazioni terapeutiche. PPI possono essere regolate da anticorpi specifici e stabili, ma anticorpi sono costosi e difficili da produrre e hanno scarsa biodisponibilità. In alternativa, PPI possono essere bersaglio di piccole molecole. Piccole molecole sono più facili da sintetizzare e poco costoso rispetto agli anticorpi; tuttavia, sono relativamente meno flessibili e si adattano meglio piccole cavità di grandi interfacce proteina-proteina 2,3. Diversi studi hanno dimostrato che i peptidi, che sono più semplici e meno costosi rispetto agli anticorpi e più flessibile di piccole molecole, possono legarsi interfacce proteine e regolare PPI 4,5. Il mercato globale peptide terapeutico è stata valutata una quindicina di miliardi di dollari nel 2013 ed è in crescita del 10,5% annually 6. Inoltre, ci sono più di 50 peptidi commercializzati, circa 270 peptidi in diverse fasi di sperimentazione clinica, e circa 400 peptidi in fase preclinica avanzate 7. Sebbene numerosi peptidi vengono utilizzati come farmaci, peptidi pongono ancora diverse sfide che limitano la loro applicazione diffusa tra cui scarsa biodisponibilità e la stabilità, l'inefficienza nelle membrane cellulari di attraversamento, e la flessibilità conformazionale 8,9. Una alternativa per superare questi inconvenienti è applicare diverse modifiche come (D-amminoacido e N-alchilazione) locale e globale (ciclizzazione) vincoli 8,10-12. Queste modifiche si verificano anche in natura. Ad esempio, ciclosporina A, un peptide ciclico naturale immunosoppressore, contiene un singolo D-amminoacido e subisce N-alchilazione modifiche 13,14.
Modifica di aminoacidi naturali per indurre vincoli locali, come D- e N-alchilazione, spesso colpisce il peptide9; s attività biologica. Tuttavia, ciclizzazione, in cui la sequenza di interesse può rimanere lo stesso, è più probabile per preservare l'attività biologica. Ciclizzazione è un modo molto attraente per restringere peptide spazio conformazionale riducendo l'equilibrio tra le diverse conformazioni. Di solito aumenta l'attività biologica e selettività limitando il peptide alla conformazione attiva che media una sola funzione. Ciclizzazione migliora anche la stabilità peptide mantenendo il peptide in una conformazione che è meno riconosciuto da enzimi di degradazione. Infatti, peptidi ciclici hanno dimostrato di aver migliorato la stabilità metabolica, la biodisponibilità, e la selettività rispetto ai loro omologhi lineari 15-17.
Tuttavia, ciclizzazione può essere un'arma a doppio taglio poiché in alcuni casi la restrizione può impedire che i peptidi di raggiungere una conformazione bioattiva. Per superare questo ostacolo, una biblioteca focalizzato in cui tutti i peptidi hanno lo stesso SEQUENC primarioe di conseguenza costanti pharmacophores possono essere sintetizzati. Peptidi nella libreria differiscono parametri che influenzano la loro struttura, come la dimensione e la posizione dell'anello, in modo da schermare successivamente per la conformazione più bioattivo 9,18.
I peptidi possono essere sintetizzati sia in soluzione e da un approccio di sintesi peptidica in fase solida (SPPS), che ora è il metodo più diffuso sintesi peptidica e sarà discusso ulteriormente. SPPS è un processo mediante il quale trasformazioni chimiche vengono eseguite su un supporto solido tramite un linker per preparare una vasta gamma di composti sintetici 19. SPPS consente assemblaggio peptidi di accoppiamento consecutivo di aminoacidi in modo graduale dal C-terminale, che è attaccato ad un supporto solido, al N-terminale. Le catene laterali di acido N-alfa-ammino devono essere mascherati con gruppi protettivi che sono stabili nelle condizioni di reazione utilizzate durante peptide allungamento per garantire l'aggiunta di un amminoacido per step. Nella fase finale, il peptide viene rilasciato dalla resina e la catena laterale gruppi protettori sono contemporaneamente rimossi. Mentre il peptide viene sintetizzato, tutti i reagenti solubili possono essere rimossi dal peptide-solido matrice di supporto per filtrazione e lavato via alla fine di ogni fase di accoppiamento. Con tale sistema, un grande eccesso di reagenti ad alta concentrazione può guidare reazioni di accoppiamento a completamento e tutti i passaggi di sintesi può essere effettuato nello stesso recipiente senza trasferimento di materiale 20.
Sebbene SPPS ha alcune limitazioni, quali la produzione di reazioni incomplete, reazioni collaterali, reagenti impuri, nonché difficoltà di controllo della reazione 21, i vantaggi di SPPS hanno reso il "gold standard" per la sintesi peptidica. Questi vantaggi includono la possibilità di incorporare amminoacidi non naturali, automazione, facile purificazione, perdite fisiche minimizzate, e l'uso di reagenti in eccesso, con conseguentealti rendimenti. SPPS ha dimostrato di essere estremamente utile nella sintesi di sequenze difficili 21,22, modifiche fluorescenti 23, e librerie peptidiche 24,25. SPPS è anche molto utile per altri assembly poli-chain, come oligonucleotidi 26,27, 28,29, oligosaccaridi e peptide acidi nucleici 30,31. È interessante notare che, in alcuni casi, SPPS ha dimostrato di essere vantaggioso per sintetizzare piccole molecole che sono tradizionalmente realizzati in soluzione 32,33. SFF è utilizzato sia in piccola scala per la ricerca e l'insegnamento 34,35, così come su larga scala nel settore industriale 36-38.
Due strategie di sintesi che sono utilizzati principalmente nella metodologia SPPS per la sintesi di peptidi sono butilossicarbonile (Boc) e 9-fluorenilmetossicarbonile (Fmoc). La strategia originale introdotte per SPPS era Boc, che richiede condizioni di acidi forti per rimuovere catena laterale gruppi protettori e fendere il peptide dal rEsin. Sintesi peptidica Fmoc-based utilizza tuttavia moderate condizioni di base ed è un mite alternativa al protocollo Boc acido labile 39. La strategia Fmoc utilizza ortogonale t-butile (tBu) Protezione catena laterale che viene rimosso nell'ultimo passaggio della sintesi mentre fende il peptide dalla resina in condizioni acide.
Il principio generale per la sintesi peptidica su supporto solido è presentato in Figura 1. L'aminoacido iniziale, mascherato da un gruppo di protezione temporanea sul N-α-terminale, viene caricato sulla resina dal C-terminale. Un gruppo protettivo semipermanente per mascherare la catena laterale è anche utilizzato se necessario (Figura 1, Passaggio 1). La sintesi del peptide bersaglio viene assemblato dal C-terminale all'N-terminale da cicli ripetitivi di deprotezione del gruppo protettivo N-α-temporaneo (Figura 1, fase 2) e accoppiamento del successivo amminoacido protetto (Figura 1 ong>, punto 3). Dopo l'ultimo aminoacido viene caricato (Figura 1, fase 4), il peptide viene scissa dal supporto di resina e dei gruppi protettivi semi-permanenti sono rimossi (Figura 1, fase 5).

Figura 1. Schema generale di sintesi in fase solida del peptide. L'amminoacido N-α-protetto viene ancorato con il gruppo carbossilico tramite un linker alla resina (Passaggio 1). Il peptide desiderato viene assemblata in modo lineare dal C-terminale all'N-terminale da cicli ripetitivi di deprotezione del gruppo protettivo temporaneo (TPG) dal N-α (Fase 2) e accoppiamento aminoacido (Passaggio 3). Dopo realizzare la sintesi (passo 4), i gruppi protettori semipermanenti (SPG) sono deprotetto durante peptide clivaggio (Fase 5).ottenere = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.
Dopo il montaggio della catena peptidica completa, ciclizzazione può essere ottenuto mediante diverse alternative: (A) testa-coda ciclizzazione - questo è un modo conveniente ma limitato in quanto fornisce una sola opzione per ciclizzazione (Figura 2A), (B) ciclizzazione utilizzando gli aminoacidi della sequenza di interesse che contengono gruppi funzionali bioattive - tuttavia, l'uso di questi aminoacidi può influenzare l'attività biologica (Figura 2B), e (C) ciclizzazione aggiungendo aminoacidi (o altri blocchi) senza disturbare la sequenza bioattivo. Introducendo queste molecole è diffuso in quanto consente produzione di librerie focalizzate senza modificare la sequenza di interesse (Figura 2C).
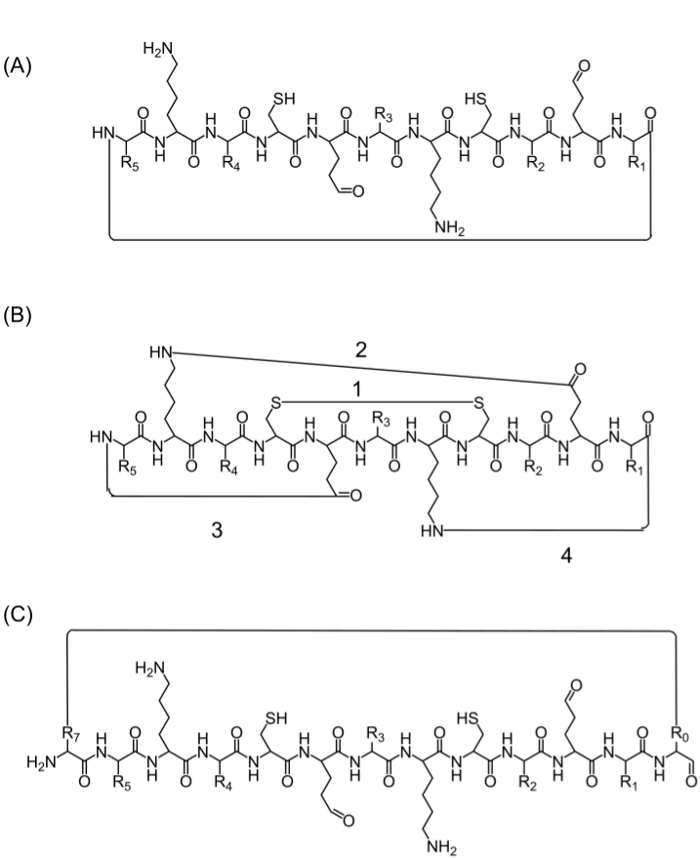
FIGURA 2. strategie peptide Alternativa ciclizzazione (A) testa-coda ciclizzazione, attraverso un legame peptidico tra il C-terminale e N-terminale.; (B) ciclizzazione tra i gruppi funzionali come un legame disolfuro tra i residui di cisteina (1), o un legame ammidico tra le catene laterali di lisina per acido aspartico / glutammico (2), o catena laterale di N- o C-terminale (3 -4); (C) ciclizzazione con l'aggiunta di amminoacidi extra o derivati degli aminoacidi o piccole molecole, ad esempio prima (R0) e dopo (R7) la sequenza bioattivo. Cliccate qui per vedere una versione più grande di questa figura.
Micro-onde sintesi utilizza irradiazione a microonde per riscaldare le reazioni, accelerando così chimico organico trasformazioni 40,41. Microonde chimica è basata sulla capacità del reagente / solvente per assorbire ilforno a microonde di energia e convertirla in calore 42. Prima che la tecnologia è diventata diffusa, grossi inconvenienti dovuti superare, compresa la controllabilità e la riproducibilità dei protocolli di sintesi e la mancanza di sistemi disponibili temperatura e di pressione adeguati controlli 43,44. La prima relazione di micro-onde sintesi peptidica è stato fatto utilizzando un forno a microonde cucina per sintetizzare diversi peptidi brevi (7-10 aminoacidi), con un significativo miglioramento della efficienza di accoppiamento e la purezza 45. Inoltre, l'energia a microonde ha dimostrato di diminuire aggregazione catena, ridurre le reazioni collaterali, limitare racemizzazione, e migliorare i tassi di accoppiamento, che sono tutti critici per difficili e lunghe sequenze 46-53.
Attualmente l'uso di irradiazione con microonde per la sintesi di peptidi o composti correlati su un supporto solido è ampia, tra cui (a) Sintesi di acqua invece di solvente organico 54; (B) sintesi di peptidi concomuni modificazioni post-traduzionali, come glicopeptidi 55-58 o 59-61 phosphopeptides, la cui sintesi è tipicamente difficile a causa della bassa efficienza di accoppiamento di derivati amminoacidici stericamente impediti; (C) sintesi di peptidi con modifica del backbone, come azapeptides, che possono essere costituiti dalla sostituzione del C (α) di un residuo amminoacidico con un atomo di azoto 62, o peptoids, la cui catena laterale è collegato al azoto ammidico piuttosto che l'atomo Cα 63,64; (D) sintesi di peptidi ciclici 65-71; e (E) sintesi di librerie combinatoriali 51,72. In molti casi, gli autori hanno riportato una maggiore efficienza e ridotto tempo di sintesi usando irradiazione a microonde rispetto al protocollo convenzionale.
Utilizzando un design razionale 73-75, abbiamo sviluppato peptidi anti-parassiti che sono stati ottenuti da recettore L del eishmania ponteggio FOattivato r C-chinasi (mancanza). MANCANZA svolge un ruolo importante nella fase precoce dell'infezione Leishmania 76. Parassiti che esprimono bassi livelli di MANCANZA riescono a parassitare anche topi immunocompromessi 77 la mancanza è coinvolta nei processi parassita segnalazione essenziali e sintesi proteica 78. Pertanto, MANCANZA è una proteina impalcatura chiave 79 e un altro obiettivo prezioso. Concentrarsi sulle sequenze in MANCANZA che si conservano nei parassiti, ma non nel mammifero ospite omologo RACK, abbiamo identificato un peptide 8 aminoacidi (RNGQCQRK) che è diminuita di Leishmania sp. Vitalità nella cultura.
Qui, descriviamo un protocollo per la sintesi di peptidi ciclici backbone derivati dalla sequenza proteica LACK sopra descritta. I peptidi sono stati sintetizzati su un supporto solido mediante riscaldamento a microonde dalla metodologia SPPS con protocollo Fmoc / tBu. I peptidi sono stati coniugati ad un TAT 47-57 (YGRKKRRQRRR) carrier peptidico attraverso un legame ammidico comeparte del SPPS. Trasporti con sede a TAT di una varietà di carichi nelle cellule è stato utilizzato da oltre 15 anni e la consegna della merce in organuli subcellulari è stato confermato 80. Quattro differenti linker, succinico e anidride glutarica nonché adipico e acido pimelico, sono stati usati per eseguire la ciclizzazione di generare linkers acidi carbossilici da due a cinque atomi di carbonio. Ciclizzazione è stato fatto utilizzando l'energia a microonde, e la scissione e della catena laterale fasi finali deprotezione sono stati fatti a mano, senza l'energia a microonde. L'uso di un sintetizzatore automatizzato microonde migliorato la purezza del prodotto, aumentato la resa del prodotto, e ha ridotto la durata della sintesi. Questo protocollo generale può essere applicato ad altri studi che utilizzano peptidi comprendere importante meccanismo molecolare in vitro e in vivo e sviluppare ulteriormente potenziali farmaci per malattie umane.
Protocollo
1. Attrezzature e reagenti Preparazione
- Attrezzature Preparazione
- Eseguire tutti i passaggi all'interno di una cappa aspirante con un equipaggiamento di protezione personale.
- Chimicamente sintetizzare peptidi su supporto solido con un microonde Peptide Synthesizer con un modulo aggiuntivo di Discover dotato di una sonda di temperatura a fibre ottiche per il controllo della erogazione microonde alimentazione in un recipiente di reazione Teflon (30 ml, con una fritta di vetro) o in polipropilene monouso Cartuccia (12 ml, con una fritta ruvida).
- Per una corretta miscelazione, collegare l'alimentazione di azoto al recipiente di reazione, oppure sigillare entrambe le estremità della cartuccia polipropilene, e disporre su un agitatore rotante.
- Per scaricare miscele di reazione o lavaggi, collegare alla casa del vuoto attraverso un sifone.
- Posizionare la sonda in fibra ottica nel recipiente di reazione.
- Preparazione reagenti
- Preparare la resina pesando Rink Amide AM resina 100-200 mesh (0.204 mg), Aggiungere 5 ml di miscela 1: 1 di N, N -dimethylformamide (DMF) / diclorometano (DCM) alla cartuccia recipiente / polipropilene reazione per lavare la resina giù, agitare per 2-4 ore a gonfiarsi correttamente, e drenare.
- Preparare 0,2 M 9-fluorenilmetossicarbonile (Fmoc) ammino soluzioni acide sciogliendo il corrispondente acido Fmoc-ammino in DMF e agitare la miscela fino amminoacidi vengono sciolti (Tabella 1).
- Preparare 0,45 M attivatore mix soluzione sciogliendo 18,96 g O - (benzotriazol-1-il) - N, N, N ', N' esafluorofosfato -tetramethyluronium (HBTU) in 100 ml di DMF e vortex la miscela fino a quando il solido è sciolto (Tabella 1).
- Preparare 2 M di base attivatore mix soluzione combinando 34,8 ml N, N -diisopropylethylamine (DIEA) con 65,2 ml 1-metil-2-pirrolidinone (NMP) (Tabella 1).
- Preparare 0,1 M deprotezione mix soluzione sciogliendo idrato 3,37 g 1-idrossibenzotriazolo (HOBt)in 250 ml di una v / v soluzione al 20% di piperidina in DMF e vortex la miscela fino a quando il solido viene disciolto (Tabella 1).
2. Fmoc-protetti Amino Acid Accoppiamento
- Accoppiamento aminoacido
- Aggiungere amminoacido (2,5 ml) / attivatore (1 ml) / base attivatore (0,5 ml) per reazione cartuccia nave / polipropilene e lasciare che la reazione procede per 300 sec (25 W, 75 ° C, tabella 2). Scolare la soluzione.
- Lavare la resina con DMF. Aggiungere DMF alla resina per 120 secondi (7 ml, 0 W, RT) e scaricare la soluzione. Ripetere cinque volte.
- Deprotezione Fmoc
- Aggiungere 7 ml di 20% piperidina in DMF con 0,1 M HOBt reazione cartuccia nave / polipropilene e incubare per 30 sec (45 W, 75 ° C, tabella 2).
- Scolare la miscela di reazione.
- Aggiungere 7 ml di 20% piperidina in DMF con 0,1 M HOBt di reazione cartuccia nave / polipropilene e incubare per 180 secondi (45 W, 75 ° C, tabella 2).
- Scolare la miscela di reazione.
- Lavare la resina con DMF. Aggiungere DMF alla resina per 120 secondi (7 ml 0 W, rt) e scaricare la soluzione. Ripetere cinque volte.
Nota: In alternativa, mettere in pausa la procedura qui e riprendere in un secondo momento.
- Dopo amminoacido fase di accoppiamento, lavare la resina con DCM e conservare per almeno alcuni giorni a 4 ° C (per un periodo più lungo deposito resina a - 20 ° C).
- Spostare la resina dal recipiente di reazione ad una cartuccia polipropilene.
- Lavare la resina con DCM. Aggiungere DCM alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetete per tre volte.
- Sigillare la cartuccia in polipropilene strettamente con un tappo superiore e rubinetto.
- Prima di iniziare una nuova sintesi, gonfiare la resina per 3-4 ore in DMF (7 ml).
- Monitoraggio sintesi
- Utilizzare il test Kaiser (ninidrina) o il test cloranile per determinare rapidamente il progresso dellasintesi. Facoltativamente, eseguire una reazione di scissione piccola scala per determinare la purezza e la massa del peptide sintetizzato. Vedere la sezione 9.
Nota: Per ulteriori guasti vedi tabella 3.
- Utilizzare il test Kaiser (ninidrina) o il test cloranile per determinare rapidamente il progresso dellasintesi. Facoltativamente, eseguire una reazione di scissione piccola scala per determinare la purezza e la massa del peptide sintetizzato. Vedere la sezione 9.
- Ripetere i punti 2.1 e 2.2, se lo desideri di sintetizzare peptidi mirati: Arg(Pbf)-Asn(Trt)-Gly-Gln(Trt)-Cys(Trt)-Gln(Trt)-Arg(Pbf)-Lys(Boc)-Lys(Mtt)-Gly-Gly-Tyr(But)-Gly-Arg(Pbf)-Lys(Boc)-Lys(Boc)-Arg(Pbf)-Arg(Pbf)-Gln(Trt)-Arg(Pbf)-Arg(Pbf)-Arg(Pbf).
3. Anidride / Acid Accoppiamento
- Accoppiamento Anidride
- Lavare la resina con NMP. Aggiungere NMP alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetete per tre volte.
- Sciogliere 10 equivalenti di anidride corrispondente in NMP (5 ml), aggiungere 1 equivalente 4-dimetilamminopiridina (DMAP) e 10 equivalenti DIEA alla soluzione (Tabella 1).
- Aggiungere 10: 1: 10 miscela di anidride / DMAP / DIEA alla resina e incubare per 300 sec (25W, 75 ° C, tabella 2). Scolare la soluzione.
- Lavare la resina con NMP. Aggiungere NMP alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetete per tre volte.
- Accoppiamento acido
- Lavare la resina con DMF. Aggiungere DMF alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetete per tre volte.
- Sciogliere 10 equivalenti del corrispondente acido bicarbossilico in DMF (5 ml). Aggiungere 1 DMAP equivalente e 10 equivalenti N, N '-Diisopropylcarbodiimide (DIC) alla soluzione (Tabella 1).
- Pre-attivare l'impasto mescolando per 30 minuti.
- Aggiungere la miscela alla resina e incubare per 300 sec (25 W, 75 ° C, tabella 2) e scaricare la soluzione.
- Lavare la resina con DMF. Aggiungere DMF alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetere il passaggio tre volte.
4. N-methyltrityl (MTT) Proteggere Gruppo Deprotectione
Nota: La catena laterale lisina è stato protetto con N-methyltrityl (MTT) 81, un gruppo di protezione che può essere deprotetto selettivamente in condizioni acide labili 82,83. Deprotect Mtt gruppo protettivo manualmente su un agitatore senza energia a microonde.
- Trasferire la resina di una cartuccia in polipropilene dotato di spina tappo e rubinetto di arresto.
- Lavare la resina con DCM. Aggiungere DCM alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetete per tre volte.
- Aggiungere 15-25 ml di una miscela di 1% di acido trifluoroacetico (TFA), 5% Triisopropylsilane (TIS), e 94% DCM alla cartuccia polipropilene per grammo di resina.
Nota: TFA è un acido forte e corrosivo ed è estremamente irritante per la pelle, occhi e tessuto polmonare.- Mantenere soluzioni concentrate di TFA nella cappa in ogni momento.
- Usare un equipaggiamento di protezione personale (protezione per gli occhi, un camice da laboratorio e guanti) e lavorare in una cappa ben ventilata. Cambiare i guanti tempestivamentese vengono a contatto con TFA e subito clean-up tutte le cadute. Se la pelle o gli occhi entrano in contatto con l'acido, risciacquare immediatamente la zona interessata con acqua e lavare per altri 15 min.
- Posizionare la cartuccia polipropilene su un agitatore e agitare per 5 minuti a temperatura ambiente.
- Scolare la soluzione dalla cartuccia polipropilene applicando il vuoto.
- Ripetere i passaggi 4,3-4,5, tre volte.
- Lavare la resina con DCM. Aggiungere DCM alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetere cinque volte.
5. La ciclizzazione del peptide lineare
- Lavare la resina con DCM. Aggiungere DCM alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetere cinque volte.
- In una provetta di polipropilene da 50 ml, sciogliere 5 equivalenti benzotriazolo-1-ly-ossi-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) in Dibromomethane (DBM, 5 ml) e aggiungere 10 equivalenti DIEA alla soluzione (Tabella 1).
- Aggiungi la miscela di resina e incubare per 300 sec (25 W, 75 ° C, tabella 2). Scolare la soluzione.
- Lavare la resina con DCM. Aggiungere DCM alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetete per tre volte.
6. fenditura e Deprotezione di Side catena Gruppi
- Lavare la resina con DCM ed etere etilico.
- Aggiungere DCM alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetere due volte.
- Aggiungi etere etilico alla resina per 120 secondi (7 ml, 0 W, rt) e scaricare la soluzione. Ripetere due volte.
- Essiccare la resina in essiccatore sotto vuoto a temperatura ambiente per almeno 3 ore su idrossido di potassio (KOH, 1-10 g).
- Pesare la resina essiccata e trasferirlo ad una cartuccia polipropilene.
- Aggiungere 10 ml di acido trifluoroacetico un (TFA) cleavage cocktail pre-raffreddata (per esempio, 90% TFA, 2,5% di acqua, 2,5% e 5% TIS fenolo) per ogni grammo di resina.
- Agitare per 3 orea RT.
- Raccogliere la soluzione scissione TFA filtrando la resina in un tubo di polipropilene da 50 ml. Per la filtrazione, utilizzare la fritta che è nella cartuccia polipropilene 12 ml.
- Aggiungere dietiletere freddo (35 ml) al tubo.
- Centrifugare per 5 minuti a 1207 xg a 4 ° C.
- Decantare lo strato di etere.
- Ripetere il passaggio 6,7-6,9, cinque volte.
7. Asciugare il Backbone ciclico Peptide
- Mantenere il peptide precipitato nello stesso tubo e asciugare in una cappa per 30 min.
- Sciogliere il peptide in una miscela 1: 1 di acqua e acetonitrile (ACN).
- Congelare la soluzione finale del prodotto in azoto liquido.
- Lyophilize il prodotto finale.
8. Caratterizzazione Backbone ciclico Peptide
- Sciogliere un piccolo campione (1 mg) del prodotto in acqua (400 ml).
- Iniettare il peptide disciolto (10-200 microlitri) ad una fase inversa liquida ad alta prestazione chromatography sistema (RP-HPLC) a verificare la purezza 34 peptide.
- Controllare la massa del peptide usando la spettrometria di massa matrix-assisted laser desorbimento di ionizzazione (MALDI-MS) 84.
- Mescolare 1 ml (100 mM) peptide in un 1: 1 (v / v) di acetonitrile: acqua con 1 ml di matrice (acido 5 mg / ml, α-ciano-4-idrossicinnamico) in rapporto 1: 1 (v / v) di acetonitrile: acqua con TFA (0,1%).
- Spot 1 ml sulla piastra MS-MALDI.
- Asciugare il campione e collocarlo nello spettrometro di massa.
- Pesare il peptide e calcolare la resa per cento.
- Conservare a -20 ° C.
9. Monitoraggio della sintesi
- Kaiser (ninidrina) prova di 85
- Preparare le soluzioni dei reagenti.
- Preparare una soluzione sciogliendo 16,5 mg di cianuro di potassio (KCN) in 25 ml di acqua distillata. Diluire 1 ml della suddetta soluzione con 49 ml di piridina.
- Preparare la Soluzione Bsciogliendo 1 g di ninidrina in 20 ml di etanolo.
- Preparare Soluzione C sciogliendo 40 g di fenolo in 20 ml di etanolo.
- Utilizzare il test Kaiser per controllare il completamento dell'accoppiamento amminoacido o la deprotezione del gruppo protettivo.
- Trasferire alcune perle dalla resina in una provetta.
- Aggiungere tre gocce (~ 100 microlitri) di ciascuna soluzione (A, B e C) e mescolare.
- Riscaldare la provetta su una piastra riscaldante a 110 ° C per 5 min.
Nota: perline colorate blu (risultato positivo) indicano reazione di accoppiamento incompleto o deprotezione Fmoc gruppo protettivo.
- Preparare le soluzioni dei reagenti.
- Test cloranile 86
- Preparare i seguenti reagenti freschi per ogni test.
- Preparare una soluzione di 2% cloranile in DMF, la soluzione A.
- Preparare una soluzione di 2% acetaldeide in DMF, soluzione B.
- Eseguire il test cloranile per verificare il completamento di accoppiamento aminoacido o tha deprotezione del gruppo protettivo.
- Miscelare 100 ml di soluzione A con 100 ml di soluzione B in una provetta da 1,5 ml.
- Cada le perline e agitare delicatamente per 5 minuti.
Nota: perline colorate marrone scuro (risultato positivo) indicano deprotezione del gruppo protettivo Fmoc o una reazione giunto incompleto.
- Preparare i seguenti reagenti freschi per ogni test.
- Reazione scissione piccola scala
- Rimuovere una piccola quantità di resina ad una cartuccia polipropilene 3 ml equipaggiato con spina tappo e rubinetto.
- Trattare con una miscela 2 ml di 95% TFA, 2,5% di acqua e 2,5% TIS.
- Agitare la miscela per 30 minuti a RT.
- Rimuovere la resina per filtrazione usando la fritta della cartuccia polipropilene ed evaporare i solventi da un flusso di azoto.
- Riprendere il residuo con acqua e analizzare il prodotto mediante HPLC e / o MS.
10. Leishmania donovani promastigote vitalità in Cultura Assay
- Leishmania donovani (L. donovani) condizioni di crescita e di trattamento
- Cultura L. promastigoti donovani in Modifica di Dulbecco di Eagle (DMEM) con 4,5 g / L di glucosio, L-glutammina, e piruvato di sodio a 26 ° C.
- Trattare la L. donovani promastigoti con peptidi ciclici (100 micron) per 24 ore a 26 ° C.
- Leishmania donovani (L. donovani) saggio di redditività
- Valutare la vitalità del parassita con 20 microlitri alamarBlue secondo il protocollo del produttore.
- Determinare riduzione alamarBlue la fluorescenza di misura (a 570 nm di eccitazione e 590 nm di emissione). Valori di fluorescenza più alti indicano maggiore attività metabolica e una maggiore vitalità del parassita.
Risultati
Qui si descrive lo sviluppo di una piccola biblioteca mirata di backbone peptidi ciclici che colpiscono specificamente PPI vitali del parassita Leishmania e agiscono come agenti antiparassitari (per opinione su peptidi che colpiscono PPI come agenti antiparassitari 87). Attraverso la sintesi di nuovi backbone peptidi ciclici, farmacofori sono conservati in un ponteggio di dimensioni estensibile. La forza della biblioteca focalizzato qui proposto è la possibilità di variare le dimensioni peptide impalcatura pur consentendo un limitato grado di libertà conformazionale tramite ciclizzazione. L'intera sintesi dei peptidi ciclici backbone è stata effettuata utilizzando un sintetizzatore automatizzato microonde su supporto solido, seguendo il protocollo Fmoc / tBu. La ciclizzazione è stata eseguita creando un legame ammidico tra il linker, anidride / acido, e l'ammina catena laterale di lisina. La scissione e catena laterale deprotezione finale sono state effettuate manualmente senza l'energia a microonde (per schema di sintesi e fprodotti Inal struttura vedi Figura 3). Il prodotto è stato analizzato mediante HPLC preparativa per fornire 25 mg di polvere bianca conservati a -20 ° C. Un campione del prodotto è stato controllato da MS (Figura 4) ed il grado di purezza è stata determinata mediante HPLC analitico (Figura 5). Un campione di ogni peptide ciclico è stato inviato per lo screening biologico. Uno dei quattro peptidi ciclici (PL1) era attivo contro Leishmania donovani (L. donovani), un parassita che causa la leishmaniosi viscerale, il più grave leishmaniosi negli esseri umani. Peptide pl1 ridotta vitalità parassita del 75% rispetto al trattamento di controllo (Tabella 4).

Figura 3. schema e la struttura del backbone peptide ciclico sintetizzato in questo studio Synthesis Reagenti e condizioni:. (I) Amino acid accoppiamento: 300 sec, 25 W, 75 ° C,con 1.1: 1: 2.2 aminoacido / attivatore / base attivatore. (ii) deprotezione Fmoc: 30 sec e 180 sec sia a 45 W, 75 ° C, utilizzando 20% piperidina in DMF + 0,1 M HOBt. (iii) Anidride accoppiamento: 300 sec, 25 W, 75 ° C, utilizzando 10: 10: 1 anidride / DIEA / DMAP in NMP. (iv) Mtt deprotezione: 3 * (300 sec, 0 W, rt) con 1: 5: 94 TFA / TIS / DCM. (v) La ciclizzazione: 300 sec, 25 W, 75 ° C, utilizzando 5:10 PyBOP / DIEA in DBM. (vi) fenditura e deprotezione: 3 h, 0 W, rt, utilizzando 90: 2.5: 2.5: 5 TFA / TIS / H 2 O / fenolo. I peptidi sono stati coniugati ad un TAT 47-57 (Tyr-Gly-Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg) peptide carrier attraverso un legame ammidico come parte della sintesi in fase solida. Fare click qui per visualizzare una versione più grande di questa figura.

Figura 4. MALDI-TOF traccia spettroscopia di massa dibackbone rappresentante peptide ciclico. La massa osservata, 2853.456 è in stretto accordo alla massa calcolata, 2854,271. Clicca qui per vedere una versione più grande di questa figura.
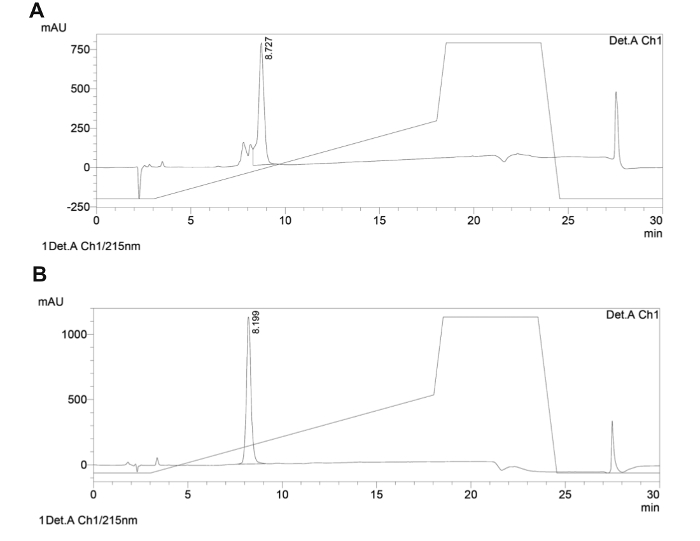
Sono presenti Figura 5. Analytical traccia HPLC in fase inversa di backbone rappresentante peptide ciclico. Le tracce HPLC analitica del grezzo (A) e purificato (B) backbone peptide ciclico. I sistemi di solventi usati erano A (H 2 O con TFA 0,1%) e B (CH 3 CN con 0,1% TFA). Un gradiente lineare di 5-50% B a 1 ml / min in 15 min a 40 ° C con un C18, 5 micron, 150 mm di colonna è stato applicato e la rivelazione era a 215 nm. Cliccate quiper visualizzare una versione più grande di questa figura.
| Soluzione | Reagente | MW (g / mol) | d (g / ml) | Volume (ml) | Concentrazione (M) | Importo totale |
| - Soluzione di aminoacidi - | Aminoacido alanina | 311,34 | 0.2 | 6.23 g | ||
| 0,2 M di amminoacido in DMF | DMF | 100 | 100 ml | |||
| Un esempio per l'acido alanina amino, ma lo stesso calcolo dovrebbe essere fatto per ogni amminoacido, con la MW appropriata. Per preparare una soluzione di acido 100 ml amino sciogliere 6,23 g di amminoacido alanina in 100 ml di DMF. Conservare a 4 ° C. | ||||||
| - Soluzione Deprotezione- | HOBt | 135.1 | 0.1 | 3.37 g | ||
| 20% v / v soluzione di piperidina in DMF con 0,1 M HOBt | Piperidina | 50 | 50 ml | |||
| DMF | 200 | 200 ml | ||||
| Deprotezione viene utilizzato per la rimozione delle α Fmoc N - gruppo protettore. Per preparare una soluzione da 250 ml di deprotezione sciogliere 3,37 g HOBt in 200 ml di DMF e aggiungere 50 ml di piperidina. Conservare a 4 ° C. | ||||||
| - Soluzione Activator - | HBTU | 379,24 | 0.45 | 18.96 g | ||
| 0,45 M HBTU in DMF | DMF | 100 | 100 ml | |||
| Activator èutilizzato con la base attivatore per attivare l'amminoacido prima della reazione di accoppiamento. Per preparare una soluzione attivatore 100 ml sciogliere 18,96 g HBTU in 100 ml di DMF. Conservare a 4 ° C. | ||||||
| - Soluzione di base Activator - | DIEA | 129,24 | 0,742 | 2 | 34,80 ml | |
| 2 M DIEA in NMP | NMP | 65.20 ml | ||||
| Attivatore di base viene utilizzato con l'attivatore per attivare l'amminoacido prima della reazione di accoppiamento. Per preparare una base di 100 ml di attivatore mix soluzione 34,8 ml DIEA e 65,2 ml NMP. Conservare a 4 ° C. | ||||||
| Soluzione | Reagente | MW (g / mol) | d (g / ml) | Volume (ml) | Eq | Importo totale |
| Soluzione Anidride - 10: 1: 10 anidride / DMAP / DIEA in NMP | Glutarico / anidride Succinic | 114.1 / 100.07 | 10 | 0,11 / 0,10 g | ||
| DMAP | 122.2 | 1 | 0,01 g | |||
| DIEA | 129,24 | 0,742 | 10 | 0,09 ml | ||
| NMP | 5 | 5 ml | ||||
| Sciogliere 0,11 / 0,10 g di glutarica / anidride succinica in 5 ml NMP, aggiungere 0,01 g di DMAP e 0,09 ml di DIEA alla soluzione. Preparare una soluzione fresca. | ||||||
| Soluzione acida - 10: 1: 10 / acido DMAP / DIC in DMF | Adipico / acido pimelico | 146,14 / 160,17 | 10 | 0,15 / 0,16 g | ||
| DMAP | 122.2 | 1 | 0,01 g | |||
| DIC | 126,2 | 0,806 | 10 | 0,16 ml | ||
| DMF | 5 | 5 ml | ||||
| Sciogliere 0,15 / 0,16 g di adipico / acido pimelico in 5 ml di DMF, aggiungere 0,01 g di DMAP e 0,16 ml di DIC alla soluzione. Preparare una soluzione fresca. | ||||||
| Soluzione ciclizzazione - 05:10 PyBOP / DIEA in DBM | PyBOP | 520,3 | 5 | 0,26 g | ||
| DIEA | 129,24 | 0,742 | 10 | 0,09 ml | ||
| DBM | 5 ml | 5 ml | ||||
| Sciogliere 0,26 g PyBOP in 5 ml DBM e aggiungere 0,09 ml di DIEA alla soluzione. Preparare unasoluzione fresca. | ||||||
Tabella 1. Reagenti e soluzioni per la spina dorsale ciclica sintesi peptidica. Elenco delle soluzioni e reagenti per la sintesi è fornito.
| Ciclo Microonde | Potenza (W) | Temp (° C) | Tempo (sec) | ||
| 1 | Accoppiamento amminoacidi | 25 | 75 | 300 | |
| 2 | Deprotezione di Fmoc gruppo protettivo | (a) deprotezione iniziale | 45 | 75 | 30 |
| (b) deprotezione completa | 45 | 75 | 180 | ||
Tabella 2. cicli a microonde per l'accoppiamento e deprotezione. Cicli microonde peraccoppiamento aminoacidi e Fmoc-deprotezione. (1) Accoppiamento di amminoacidi. (2) La deprotezione del gruppo Fmoc mascheramento avviene in due fasi: (a) iniziali e (b) deprotezione completa.
| Problema | Possibile ragione | Soluzione |
| Test Kaiser o cloranile sono positivi dopo l'accoppiamento aminoacido | L'accoppiamento amminoacido è incompleta | Ripetere la fase di accoppiamento |
| Peptidi non sono efficacemente separate dal supernatante | Eccesso di TFA | Evaporare il campione con un flusso di azoto |
| Presenza di sequenze delezione nel prodotto | Rimozione Fmoc è incompleta | Monitorare la deprotezione dai test Kaiser o cloranile e / o piccole clivaggio scala, nel caso la rimozione Fmoc è incompleta ripetere il passo |
| Amino acid couplING è incompleta | Monitorare l'accoppiamento mediante test Kaiser o cloranile e / o piccole clivaggio scala, nel caso l'accoppiamento amminoacido è incompleta ripetere il passo e / o utilizzare tempo di reazione più lungo |
È fornito Tabella 3. Risoluzione dei consigli Elenco delle soluzioni per le sfide di sintesi più comuni.
| Peptide | Sequenza | n | SIGNORINA. Cal. | MS Obs. | HPLC | dare la precedenza | Vitalità Parasite | ||
| pl1 | RNGQCQRK-GG-YGRKKRRQRRR | 2 | 2854.321 | 2853.456 | 98% | 86% | 25% | ||
| PL2 | RNGQCQRK-GG-YGRKKRRQRRR | 3 | 2868.348 | 2868.808 | 98% | 87% | 100% | ||
| PL3 | RNGQCQRK-GG-YGRKKRRQRRR | 4 | 2882.375 | 2881.823 | 96% | 89% | 97% | ||
| pL4 | RNGQCQRK-GG-YGRKKRRQRRR | 5 | 2896.402 | 2895.603 | 97% | 85% | 98% | ||
Tabella 4. Caratterizzazione e bioattività dei peptidi in questo studio. N si riferisce al numero di methylenes nel distanziale alchile (vedi Figura 3 per struttura). MS è stato fatto con la tecnica MALDI e la purezza è stato determinato mediante HPLC analitica. I peptidi sono stati aggiunti promastigoti Leishmania donovani e la vitalità dei parassiti è stato valutato ed espressi come percentuale di sopravvivenza rispetto ai controlli culture incubate in assenza di peptide. Solo pl1 aveva elevata attività Leishmanicidal. L'osservatoreè stato accecato alle condizioni sperimentali. I dati sono rappresentativi di tre esperimenti indipendenti.
Discussione
La sintesi di una libreria mirata di backbone peptidi ciclici derivati dalla proteina LACK del parassita Leishmania usando un forno a microonde sintetizzatore automatizzato è descritto. Una libreria concentrato di peptidi ciclici è stato sviluppato con farmacofori conservate e diversi linker. L'aggiunta di vari linker come anidride glutarica, anidride succinica, acido adipico, acido pimelico, lisina, ornitina, e altri blocchi può essere utilizzato per aumentare la varietà dello spazio conformazionale dei peptidi ciclici. La sintesi di una libreria di peptidi ciclici mirato permette ai ricercatori di schermo per lo spazio conformazionale ottimale. Poiché la conformazione di peptidi ciclici varia secondo parametri quali la dimensione e la posizione dell'anello, diversi analoghi con differenti conformazioni possono essere generati, che può essere utile in biologico relazione struttura-attività studies 88.
Una sfida principale SFF è diagnosticare il syntprogresso hetic e di problem-solving in quanto non intermedi sono isolati. Pertanto, alcuni test colorimetrici possono essere utilizzati per monitorare la reazione, come quelli che identificano ammine libere da Kaiser e cloranile test. Se i test Kaiser o cloranile non sono indicativi (ad esempio, prolina e idrossi-prolina non reagiscono con ninidrina allo stesso modo degli altri aminoacidi perché il loro gruppo amminico alfa è parte di un anello membered cinque), una reazione di scissione piccola scala e l'analisi di spettrometria di massa può essere applicato per controllare il progresso sintesi.
Cleavage tempo e il cocktail scissione possono essere modificati in base alle proprietà chimiche e il numero dei gruppi protettivi utilizzati. Si consiglia una scissione prova iniziale utilizzando una piccola quantità di resina (1-10 mg) eseguita per verificare le condizioni appropriate. King et al. Hanno testato diversi cocktail scissione per i vari peptidi e le loro linee guida dettagliate può essere utilizzato per ottimizzare reaction condizioni 89. Per dorsale peptidi ciclici, incubazione per almeno 3 ore è raccomandato come impostazione predefinita per la piena scissione. Tuttavia, peptidi contenenti un elevato numero di gruppi protettivi o difficili gruppi protettivi (ad esempio, estere t-butile o pentametil-2,3-diidrobenzofuranico-5-sulfonil) devono essere incubate per un tempo più lungo per garantire la completa deprotezione. Qui, non abbiamo studiato sistematicamente il tempo di scissione ottimale o un cocktail. Tuttavia, abbiamo scoperto che un breve periodo di tempo scissione (meno di 2 ore) ha determinato scissione incompleta di alcuni gruppi protettori.
Il protocollo di sintesi microonde peptide standard è un metodo generalmente applicabile per la sintesi di una varietà di peptidi. Nella maggior parte dei casi, l'uso di un sintetizzatore automatico microonde riduce la durata sintesi e aumenta la resa e la purezza dei prodotti. Inoltre, diminuisce reazioni collaterali come racemizzazione e formazione aspartimide. Anche se non abbiamo fattoun confronto side-by-side di microonde e sintesi convenzionale in questo studio, basato sulla nostra esperienza e altri laboratori ', è stato dimostrato che l'uso della sintesi assistita da microonde è superiore al protocollo convenzionale 61,70. Quasi tutti attivatori e resine possono essere utilizzati efficacemente in microonde SPPS e il metodo generale possono essere applicati anche alla sintesi di una varietà di peptidi modificati, quali, glicopeptidi, phosphopeptides, azapeptides, peptoids, e peptidi ciclici 90.
Ciclizzazione è un modo conveniente per aumentare la potenza e la stabilità dei precursori lineari. Peptidi ciclici possono ottenere una conformazione vincolato desiderabile che possono contribuire ad una maggiore affinità di legame e selettività. Inoltre, i peptidi lineari possono essere modificati per contenere più cicli ciclici, consentendo loro di rivolgersi a più possibilmente proteina endogena interfacce vincolanti 91. Tuttavia, è importante notare che ciclizzazione non necessprincipalm ente portare a miglioramenti in tutto o talvolta una di queste proprietà. Alcuni peptidi ciclici può provocare conformazioni non riconosciuti dai recettori mirati (ad esempio 92,93) .Pertanto, una biblioteca mirato di peptidi ciclici è necessario schermo per la bioattività. In conclusione, peptidi ciclici sintetici presentano caratteristiche farmacologiche desiderabili, sono abbastanza piccoli da attraversare la membrana cellulare, e sono abbastanza grande per avere elevata selettività. Ad alta potenza, la specificità, e il profilo di sicurezza contribuiscono alla promessa peptidi ciclici 'come farmaci candidati.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Lauren Van Wassenhove, Sunhee Hwang, e Daria Mochly-Rosen per le discussioni utili. Il lavoro è stato sostenuto dal National Institutes of Health di Grant NIH RC4 TW008781-01 C-IDEA (SPARK) per NQ I finanziatori non hanno avuti ruolo nel disegno dello studio, la raccolta e l'analisi dei dati, decisione di pubblicare, o preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic. Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. |
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′- tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’-Diisopropylcarbodiimide (DIC) | Sigma | 38370 | Caution Flammable/ Toxic |
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials - micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP | |
| Nitrogen cylinder | |||
| Desiccator | |||
| Analytical RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-20AD solvent delivery unit, SIL-20AC autosampler, DGU-20A5 degasser (Shimadzu, MD, USA). | ||
| Preparative RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-6AD solvent delivery unit and FRC-10A fraction collector (Shimadzu, MD, USA). |
Riferimenti
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O'Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using 'safety catch' methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based 'building block' approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O'Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis - A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon