Method Article
Desarrollo de un Backbone cíclica Péptido Biblioteca como Potencial Antiparasitarios Terapéutica Utilizando Microondas irradiación
En este artículo
Resumen
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Resumen
Las interacciones proteína-proteína (IBP) son íntimamente involucrado en casi todos los procesos biológicos y están vinculados a muchas enfermedades humanas. Por lo tanto, hay un esfuerzo importante para orientar los IBP en la investigación básica y en la industria farmacéutica. Proteína-proteína interfaces suelen ser grandes, planas, ya menudo carecen de los bolsillos, lo que complica el descubrimiento de pequeñas moléculas que se dirigen a tales sitios. Enfoques alternativos de focalización utilizando anticuerpos tienen limitaciones debido a la mala biodisponibilidad oral, baja permeabilidad celular, y la ineficiencia de la producción.
El uso de péptidos para apuntar interfaces de PPI tiene varias ventajas. Los péptidos tienen una mayor flexibilidad conformacional, el aumento de la selectividad, y son generalmente de bajo costo. Sin embargo, los péptidos tienen sus propias limitaciones incluida la mala estabilidad y la ineficiencia de cruzar las membranas celulares. Para superar estas limitaciones, la ciclación del péptido se puede realizar. La ciclación se ha demostrado para mejorar la selectividad de péptidos, La estabilidad metabólica y biodisponibilidad. Sin embargo, la predicción de la conformación bioactiva de un péptido cíclico no es trivial. Para superar este reto, un enfoque atractivo para cribar una biblioteca enfocada a la pantalla en la que todos los péptidos con esqueleto cíclico tienen la misma secuencia primaria, pero se diferencian en los parámetros que influyen en su conformación, tales como el tamaño del anillo y la posición.
Se describe un protocolo detallado para la síntesis de una biblioteca de péptidos cíclicos de cadena principal de orientación IBP parásitos específicos. Utilizando un enfoque de diseño racional, hemos desarrollado péptidos derivados de la proteína andamio receptor L eishmania para C-quinasa activada (LACK). La hipótesis de que las secuencias en la carencia que se conservan en los parásitos, pero no en el homólogo huésped de mamífero, pueden representar sitios de interacción de las proteínas que son críticos para la viabilidad de los parásitos. Los péptidos cíclicos se sintetizaron utilizando irradiación de microondas para reducir los tiempos de reacción y aumentareficiencia. El desarrollo de una biblioteca de péptidos cíclicos backbone con diferentes tamaños de anillos facilita una pantalla sistemático para la conformación activa más biológica. Este método proporciona un modo general, rápido y fácil para sintetizar péptidos cíclicos.
Introducción
Interacciones proteína-proteína (IBP) desempeñan un papel fundamental en la mayoría de los procesos biológicos, de transducción de señales intracelulares a la muerte celular 1. Por lo tanto, la orientación IBP es de fundamental importancia para la investigación básica y las aplicaciones terapéuticas. IBP pueden ser reguladas por anticuerpos específicos y estables, pero los anticuerpos son caros y difíciles de fabricar y tienen una escasa biodisponibilidad. Alternativamente, los IBP pueden ser dirigidos por pequeñas moléculas. Las moléculas pequeñas son más fáciles de sintetizar y de bajo costo en comparación con los anticuerpos; sin embargo, son relativamente menos flexible y se adaptan mejor a las pequeñas cavidades que a grandes proteína-proteína interfaces 2,3. Diversos estudios han demostrado que los péptidos, que son más simples y más baratos que los anticuerpos y más flexible que las moléculas pequeñas, se pueden unir las interfaces de proteínas y regular los IBP 4,5. El mercado global de péptido terapéutico fue valorada alrededor de quince mil millones de dólares en 2013 y crece un 10,5% annually 6. Además, hay más de 50 péptidos comercializados, alrededor de 270 péptidos en diferentes fases de los ensayos clínicos, y alrededor de 400 péptidos en fases preclínicas avanzadas 7. Aunque numerosos péptidos se utilizan como fármacos, péptidos todavía plantean varios retos que limitan su aplicación generalizada incluyendo escasa biodisponibilidad y estabilidad, la ineficiencia en las membranas celulares de cruce, y la flexibilidad conformacional 8,9. Una alternativa para superar estos inconvenientes es aplicar diferentes modificaciones tales como las limitaciones 8,10-12 (D-aminoácido y N-alquilación) local y global (ciclación). Estas modificaciones también se producen naturalmente. Por ejemplo, la ciclosporina A, un péptido natural cíclico inmunosupresor, contiene un solo D-aminoácido y se somete a modificaciones N-alquilación 13,14.
La modificación de los aminoácidos naturales para inducir limitaciones locales, tales como D- y N-alquilación, a menudo afecta el péptido9; s actividad biológica. Sin embargo, la ciclación, en la que la secuencia de interés puede seguir siendo el mismo, es más probable para preservar la actividad biológica. La ciclación es una forma muy atractiva para restringir el espacio conformacional del péptido mediante la reducción del equilibrio entre diferentes conformaciones. Por lo general, aumenta la actividad biológica y la selectividad al restringir el péptido a la conformación activa que media una sola función. La ciclación también mejora la estabilidad del péptido manteniendo el péptido en una conformación que es menos reconocido por enzimas de degradación. De hecho, se muestran péptidos cíclicos que han mejorado la estabilidad metabólica, biodisponibilidad, y la selectividad en comparación con sus homólogos lineales 15-17.
Sin embargo, la ciclación puede ser una espada de doble filo ya que en algunos casos, la restricción puede evitar que los péptidos de alcanzar una conformación bioactiva. Para superar este obstáculo, una biblioteca centrada en el que todos los péptidos tienen la misma sequenc primariae y, en consecuencia constantes farmacóforos pueden ser sintetizados. Los péptidos de la biblioteca difieren en los parámetros que influyen en su estructura, tales como el tamaño del anillo y la posición, con el fin de detectar posteriormente para la conformación más bioactivo 9,18.
Los péptidos se pueden sintetizar tanto en solución como por un enfoque de síntesis de péptidos en fase sólida (SPPS), que es ahora el enfoque de síntesis de péptidos más prevalente y se tratará más adelante. SPPS es un proceso por el cual las transformaciones químicas se llevan a cabo sobre un soporte sólido mediante un enlazador para preparar una amplia gama de compuestos sintéticos 19. SPPS permite el montaje de péptidos por acoplamiento consecutivo de los aminoácidos en una manera escalonada desde el C-terminal, que está unido a un soporte sólido, a la N-terminal. Las cadenas laterales de ácido N-alfa-amino deben ser enmascarados con grupos protectores que son estables en las condiciones de reacción utilizadas durante la elongación del péptido para garantizar la adición de un aminoácido por step. En el paso final, el péptido se libera de la resina y los grupos protectores de cadena lateral se eliminan de forma concomitante. Mientras se sintetiza el péptido, todos los reactivos solubles se pueden eliminar de la matriz de soporte-péptido sólido por filtración y se lavaron lejos en el final de cada etapa de acoplamiento. Con un sistema de este tipo, un gran exceso de reactivos en una concentración elevada puede conducir reacciones de acoplamiento hasta su finalización y todos los pasos de síntesis se puede realizar en el mismo recipiente sin ninguna transferencia de material 20.
Aunque SPPS tiene algunas limitaciones, tales como la producción de reacciones incompletas, las reacciones secundarias, reactivos impuros, así como las dificultades de seguimiento de la reacción 21, las ventajas de SPPS han convertido en el "estándar de oro" para la síntesis de péptidos. Estas ventajas incluyen la opción de incorporar aminoácidos no naturales, la automatización, la purificación fácil, pérdidas físicas minimizadas, y el uso de reactivos en exceso, resultando enaltos rendimientos. SPPS ha demostrado ser extremadamente útil en la síntesis de secuencias difíciles 21,22, modificaciones fluorescentes 23, y bibliotecas de péptidos 24,25. SPPS también es muy útil para otros conjuntos de poli-cadena tales como oligonucleótidos, oligosacáridos 28,29 26,27, y ácidos nucleicos peptídicos 30,31. Curiosamente, en algunos casos, SPPS ha demostrado ser ventajoso para la síntesis de moléculas pequeñas que se hacen tradicionalmente en solución 32,33. SPPS se utiliza tanto en pequeña escala para la investigación y la enseñanza 34,35, así como a gran escala en la industria 36-38.
Dos estrategias de síntesis que se utilizan principalmente en la metodología de SPPS para la síntesis de péptidos son butiloxicarbonilo (Boc) y 9-fluorenilmetoxicarbonilo (Fmoc). La estrategia original introducido para SPPS era Boc, que requiere condiciones de ácido fuerte para eliminar de la cadena lateral y grupos protectores de escindir el péptido de la rEsin. La síntesis de péptidos basada en Fmoc, sin embargo, utiliza las condiciones de base moderada y es una alternativa más suave para el protocolo Boc lábil al ácido 39. La estrategia Fmoc utiliza ortogonal t-butilo (tBu) la protección de la cadena lateral que se elimina en la última etapa de la síntesis, mientras que la escisión del péptido de la resina en condiciones ácidas.
El principio general para la síntesis de péptidos sobre un soporte sólido se presenta en la Figura 1. El aminoácido inicial, enmascarado por un grupo protector temporal en el N-α-terminal, se carga en la resina de la C-terminal. Un grupo protector semi-permanente para enmascarar la cadena lateral también se utiliza si es necesario (Figura 1, Paso 1). La síntesis del péptido diana se ensambla a partir de la C-terminal a la N-terminal por ciclos repetitivos de desprotección del grupo protector de N-α-temporal (Figura 1, paso 2) y el acoplamiento del siguiente aminoácido protegido (Figura 1 ong>, Paso 3). Después de que el último aminoácido se carga (Figura 1, Etapa 4), el péptido se escinde del soporte de resina y los grupos protectores semipermanentes se eliminan (Figura 1, paso 5).

Figura 1. Esquema general de la síntesis de péptidos en fase sólida. El aminoácido protegido con N-α se ancla mediante el grupo carboxilo a través de un enlazador a la resina (Paso 1). El péptido deseado se ensambla de forma lineal desde el extremo C-terminal a la N-terminal por ciclos repetitivos de desprotección del grupo protector temporal (TPG) de la N-α (Paso 2) y el acoplamiento de aminoácidos (Paso 3). Después de lograr la síntesis (Paso 4), los grupos protectores semi-permanentes (SPG) se desprotegen durante la escisión del péptido (Paso 5).conseguir = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
Después del montaje de la cadena peptídica completa, ciclación se puede lograr mediante varias alternativas: (A) de cabeza a cola ciclación - Esta es una manera conveniente, pero limitado, ya que proporciona una única opción para la ciclación (Figura 2 A), (B) ciclación utilizando los aminoácidos de la secuencia de interés que contienen grupos funcionales bioactivos - sin embargo, el uso de estos aminoácidos puede influir en la actividad biológica (Figura 2B), y (C) ciclación mediante la adición de aminoácidos (u otros bloques de construcción) sin perturbar la secuencia bioactivo. La introducción de estas moléculas está muy extendida, ya que permite la producción de bibliotecas enfocadas sin modificar la secuencia de interés (Figura 2C).
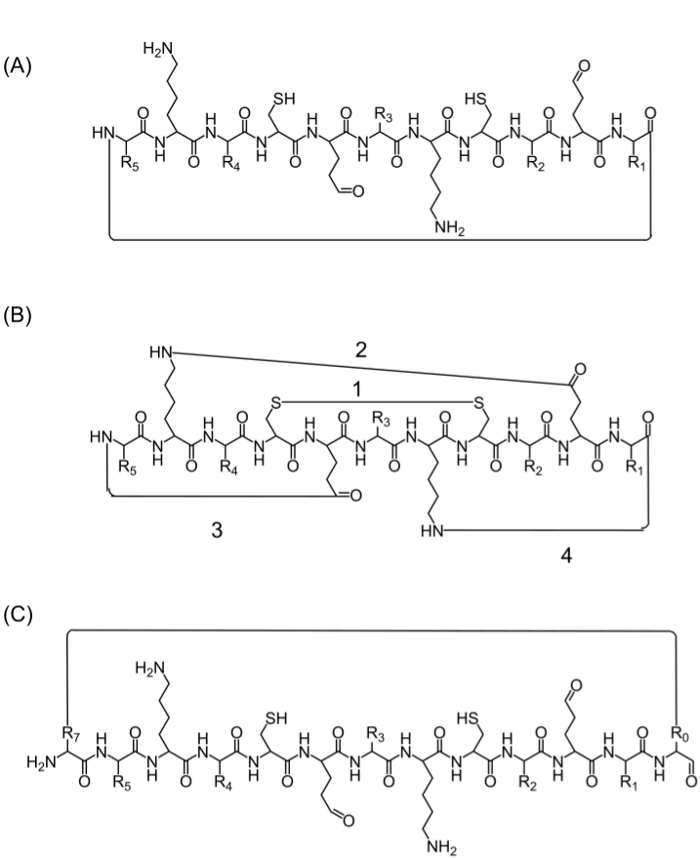
Figura 2. estrategias de ciclación de péptidos Alternativa (A) la cabeza a la cola de ciclación, a través de un enlace peptídico entre el C-terminal y N-terminal.; (B) ciclación entre los grupos funcionales tales como un enlace disulfuro entre residuos de cisteína (1), o un enlace amida entre las cadenas laterales de lisina para aspártico / ácido glutámico (2), o cadena lateral a N- o C-terminal (3 -4); (C) ciclación mediante la adición de aminoácidos adicionales o derivados de aminoácidos o moléculas pequeñas, por ejemplo antes (R0) y después (R7) la secuencia bioactiva. Haga clic aquí para ver una versión más grande de esta figura.
Asistida por microondas síntesis utiliza irradiación de microondas para calentar reacciones, acelerando así química orgánica Transformaciones 40,41. La química de microondas se basa en la capacidad del reactivo / disolvente para absorber elmicroondas energía y convertirla en calor 42. Antes de que la tecnología se generaliza, los principales inconvenientes tuvieron que superar, incluyendo la capacidad de control y reproducibilidad de los protocolos de síntesis y la falta de sistemas disponibles para temperatura y presión adecuados controles 43,44. El primer informe de síntesis de péptidos asistida por microondas se hizo usando un microondas cocina para sintetizar varios péptidos cortos (7-10 aminoácidos) con una mejora significativa de la eficiencia de acoplamiento y pureza 45. Por otra parte, la energía de microondas se demostró que disminuir la agregación de la cadena, reducir las reacciones laterales, limitar la racemización, y mejorar las tasas de acoplamiento, que son todos críticos para las secuencias difíciles y largas 46-53.
Actualmente el uso de irradiación de microondas para la síntesis de péptidos o compuestos relacionados en un soporte sólido es extensa, incluyendo (A) la síntesis en agua en lugar de disolvente orgánico 54; (B) la síntesis de péptidos conmodificaciones post-traduccionales comunes, tales como glicopéptidos 55-58 o 59-61 fosfopéptidos, cuya síntesis es típicamente difícil debido a la baja eficiencia de acoplamiento de derivados de ácido amino estéricamente impedidos; (C) la síntesis de péptidos con modificación en la columna vertebral, tales como azapeptides, que pueden formarse por la sustitución de la C (α) de un residuo de aminoácido con un átomo de nitrógeno 62, o peptoides, cuya cadena lateral está conectada a la nitrógeno de la amida en lugar del átomo de Cα 63,64; (D) la síntesis de péptidos cíclicos 65-71; y (E) la síntesis de bibliotecas combinatorias 51,72. En numerosos casos, los autores informaron una mayor eficiencia y reducido tiempo de síntesis usando irradiación de microondas en comparación con el protocolo convencional.
El uso de un diseño racional 73-75, desarrollamos péptidos anti-parasitarios que se derivaron de los receptores del andamio L de eishmania for activa C-quinasa (FALTA). FALTA juega un papel importante en la fase temprana de la infección por Leishmania 76. Los parásitos que expresan niveles más bajos de FALTA fallan en parasitar incluso ratones inmunocomprometidos 77 como FALTA está involucrado en procesos de parásitos señalización esenciales y la síntesis de proteínas 78. Por lo tanto, FALTA es una proteína andamio clave 79 y una diana farmacológica valioso. Centrándose en las secuencias en la carencia que se conservan en los parásitos, pero no en el huésped mamífero RACK homólogo, hemos identificado un péptido de 8 aminoácidos (RNGQCQRK) que la disminución de Leishmania sp. Viabilidad en cultivo.
Aquí, se describe un protocolo para la síntesis de la cadena principal cíclica péptidos derivados de la secuencia de proteína LACK descrito anteriormente. Los péptidos se sintetizaron en un soporte sólido usando calentamiento por microondas mediante la metodología de SPPS con Fmoc protocolo / tBu. Los péptidos se conjugan con un péptido 47-57 de soporte (YGRKKRRQRRR) TAT a través de un enlace amida comoparte de la SPPS. Transporte basado en TAT de una variedad de cargas en las células ha sido utilizado durante más de 15 años y la entrega de la carga en orgánulos subcelulares se ha confirmado 80. Cuatro enlazadores diferentes, succínico y anhídrido glutárico, así como adípico y ácido pimélico, fueron utilizados para realizar la ciclación para generar enlazadores de ácido carboxílico de dos a cinco carbonos. La ciclación se realizó utilizando energía de microondas, y la división y de la cadena lateral pasos finales de desprotección se realizaron manualmente sin energía de microondas. El uso de un sintetizador automático de microondas mejoró la pureza del producto, aumenta el rendimiento del producto, y redujo la duración de la síntesis. Este protocolo general se puede aplicar a otros estudios que utilizan péptidos de entender importante mecanismo molecular in vitro e in vivo y desarrollar fármacos potenciales para enfermedades humanas.
Protocolo
1. Equipo y Preparación de Reactivos
- Equipos Preparación
- Realice todos los pasos dentro de una campana de extracción usando equipo de protección personal adecuado.
- Químicamente sintetizar péptidos sobre soporte sólido utilizando un microondas Sintetizador de Péptidos con un módulo adicional de Discover equipado con una sonda de temperatura de fibra óptica para controlar el suministro de potencia de microondas en un recipiente de reacción de teflón (30 ml, con una frita de vidrio) o en un polipropileno desechable cartucho (12 ml, con una frita gruesa).
- Para una mezcla adecuada, conecte el suministro de nitrógeno al recipiente de reacción, o bien sellar ambos extremos del cartucho de polipropileno, y coloque en un agitador rotatorio.
- Para drenar mezclas de reacción o lavados, conéctese al vacío de la casa a través de un sifón.
- Coloque la sonda de fibra óptica en el recipiente de reacción.
- Preparación de los reactivos
- Preparar la resina pesando Rink Amide AM resina de malla 100-200 (0.204 mg), Añadir 5 ml de mezcla 1: 1 de N, N-dimetilformamida (DMF) / diclorometano (DCM) para el cartucho recipiente / polipropileno reacción para lavar la resina abajo, agitar durante 2/4 hora a hincharse correctamente, y escurrir.
- Preparar 0,2 M 9-fluorenilmetoxicarbonilo (Fmoc) -amino soluciones de ácido disolviendo el correspondiente ácido Fmoc-amino en DMF y agitar la mezcla hasta que los aminoácidos se disuelven (Tabla 1).
- Preparar mezcla de solución 0,45 M activador disolviendo 18,96 g de O - (benzotriazol-1-il) - N, N, N ', N' se disuelve tetrametiluronio (HBTU) en 100 ml de DMF y la mezcla vórtex hasta que el sólido (tabla 1).
- Preparar 2 M mezcla de solución base de activador mediante la combinación de 34,8 ml de N, N-diisopropiletilamina (DIEA) con 65,2 ml de 1-metil-2-pirrolidinona (NMP) (Tabla 1).
- Preparar mezcla de solución 0,1 M de desprotección mediante la disolución de hidrato de 3,37 g 1-hidroxibenzotriazol (HOBt)en 250 ml de una solución v / v 20% de piperidina en DMF y vórtex la mezcla hasta que el sólido se disuelve (Tabla 1).
2. Fmoc-protegido Amino Acid Coupling
- Acoplamiento de aminoácidos
- Añadir ácido amino (2,5 ml) / activador (1 ml) / base activador (0,5 ml) para cartucho de recipiente / polipropileno de reacción y dejar que la reacción transcurra durante 300 seg (25 W, 75 ° C, Tabla 2). Escurrir la solución.
- Lavar la resina con DMF. Añadir DMF a la resina durante 120 segundos (7 ml, 0 W, RT) y drene la solución. Repita cinco veces.
- Desprotección Fmoc
- Añadir 7 ml de 20% de piperidina en DMF con 0,1 M HOBt cartucho recipiente / polipropileno a la reacción y se incuba durante 30 seg (45 W, 75 ° C, Tabla 2).
- Vacíe la mezcla de reacción.
- Añadir 7 ml de 20% de piperidina en DMF con 0,1 M HOBt cartucho buque / polipropileno a la reacción y se incuba durante 180 segundos (45 W, 75 ° C, Tabla 2).
- Vacíe la mezcla de reacción.
- Lavar la resina con DMF. Añadir DMF a la resina durante 120 segundos (7 ml 0 W, rt) y drene la solución. Repita cinco veces.
Nota: Opcionalmente, hacer una pausa en el procedimiento aquí y reanude en una fecha posterior.
- Después de aminoácido etapa de acoplamiento, lavar la resina con DCM y almacenar durante al menos varios días a 4 ° C (por un período mayor tienda de la resina a - 20 ° C).
- Mover la resina del recipiente de reacción a un cartucho de polipropileno.
- Lavar la resina con DCM. Añadir DCM a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita tres veces.
- Selle el cartucho de polipropileno herméticamente con una tapa superior y la llave de paso.
- Antes de iniciar una nueva síntesis, hinchar la resina durante 3-4 horas en DMF (7 ml).
- Monitoreo de la síntesis
- Utilice la prueba de Kaiser (ninhidrina) o ensayo de cloranilo para determinar rápidamente el progreso de lasíntesis. Opcionalmente, realizar una reacción de escisión a pequeña escala para determinar la pureza y la masa del péptido sintetizado. Vea la sección 9.
Nota: Para la solución de problemas véase la Tabla 3.
- Utilice la prueba de Kaiser (ninhidrina) o ensayo de cloranilo para determinar rápidamente el progreso de lasíntesis. Opcionalmente, realizar una reacción de escisión a pequeña escala para determinar la pureza y la masa del péptido sintetizado. Vea la sección 9.
- Repita los pasos 2.1 y 2.2 como se desee para sintetizar el péptido específico: Arg(Pbf)-Asn(Trt)-Gly-Gln(Trt)-Cys(Trt)-Gln(Trt)-Arg(Pbf)-Lys(Boc)-Lys(Mtt)-Gly-Gly-Tyr(But)-Gly-Arg(Pbf)-Lys(Boc)-Lys(Boc)-Arg(Pbf)-Arg(Pbf)-Gln(Trt)-Arg(Pbf)-Arg(Pbf)-Arg(Pbf).
3. / anhídrido ácido Coupling
- Acoplamiento Anhídrido
- Lavar la resina con NMP. Añadir NMP a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita tres veces.
- Disolver 10 equivalentes de la correspondiente anhídrido en NMP (5 ml), añadir 1 equivalente 4-dimetilaminopiridina (DMAP) y 10 equivalentes de DIEA a la solución (Tabla 1).
- Añadir una mezcla 10: 10 de anhídrido / DMAP / DIEA a la resina y se incuba durante 300 segundos (25: 1W, 75 ° C, Tabla 2). Escurrir la solución.
- Lavar la resina con NMP. Añadir NMP a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita tres veces.
- Acoplamiento ácido
- Lavar la resina con DMF. Añadir DMF a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita tres veces.
- Disolver 10 equivalentes de ácido dicarboxílico correspondiente en DMF (5 ml). Añadir 1 DMAP equivalentes y 10 equivalentes de N, N '-Diisopropylcarbodiimide (DIC) a la solución (Tabla 1).
- Pre-activar la mezcla mezclando durante 30 minutos.
- Añadir la mezcla a la resina y se incuba durante 300 segundos (25 W, 75 ° C, Tabla 2) y drene la solución.
- Lavar la resina con DMF. Añadir DMF a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita el paso tres veces.
4. N-metiltritilo (MTT) Proteger Grupo desprotegeion
Nota: La cadena lateral de lisina se protegió con N-metiltritilo (MTT) 81, un grupo protector que se puede desproteger selectivamente bajo condiciones lábiles en medio ácido 82,83. Se desprotege MTT grupo protector manualmente en un agitador sin la energía de microondas.
- Transferir la resina a un cartucho de polipropileno equipado con enchufe tapa y llave de paso.
- Lavar la resina con DCM. Añadir DCM a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita tres veces.
- Añadir de 15-25 ml de una mezcla de 1% de ácido trifluoroacético (TFA), 5% de triisopropilsilano (TIS), y 94% DCM al cartucho de polipropileno por un gramo de resina.
Nota: TFA es un ácido fuerte y corrosivo y es extremadamente irritante para la piel, los ojos y el tejido pulmonar.- Mantener las soluciones concentradas de TFA en la campana en todo momento.
- Utilice equipo de protección personal (protección para los ojos, una bata de laboratorio y guantes) y el trabajo en una campana bien ventilada. Cambiar los guantes con prontitudsi entran en contacto con TFA y de inmediato la limpieza cualquier derrame. Si la piel o los ojos entran en contacto con el ácido, lave la zona afectada inmediatamente con agua y lavar durante otros 15 min.
- Coloque el cartucho de polipropileno en una coctelera y agitar durante 5 minutos a temperatura ambiente.
- Escurrir la solución desde el cartucho de polipropileno mediante la aplicación de vacío.
- Repita los pasos 4.3-4.5, tres veces.
- Lavar la resina con DCM. Añadir DCM a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita cinco veces.
5. La ciclación del péptido lineal
- Lavar la resina con DCM. Añadir DCM a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita cinco veces.
- En un tubo de polipropileno de 50 ml, se disuelven 5 equivalentes de benzotriazol-1-ly-oxi-tris-pirrolidinofosfonio hexafluorphosphate (PyBOP), en Dibromometano (DBM, 5 ml) y añadir 10 equivalentes de DIEA a la solución (Tabla 1).
- añadir la mezcla a la resina y se incuba durante 300 segundos (25 W, 75 ° C, Tabla 2). Escurrir la solución.
- Lavar la resina con DCM. Añadir DCM a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repita tres veces.
6. La escisión y desprotección de grupos de cadena lateral
- Lavar la resina con DCM y éter dietílico.
- Añadir DCM a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repetir dos veces.
- Añadir éter dietílico a la resina durante 120 segundos (7 ml, 0 W, rt) y drene la solución. Repetir dos veces.
- Se seca la resina en desecador de vacío a temperatura ambiente durante al menos 3 horas sobre hidróxido de potasio (KOH, 1-10 g).
- Pesar la resina seca y la transfiere a un cartucho de polipropileno.
- Añadir 10 ml de un ácido trifluoroacético (TFA) cóctel de escisión pre-enfriado (por ejemplo, 90% de TFA, 2,5% de agua, 2,5% de TIS y 5% de fenol) a cada un gramo de resina.
- Agitar durante 3 horasa TA.
- Recoger la solución de escisión TFA mediante la filtración de la resina en un tubo de polipropileno de 50 ml. Para la filtración, utilizar la frita que se encuentra en el cartucho de polipropileno 12 ml.
- Añadir éter dietílico frío (35 ml) al tubo.
- Centrifugar durante 5 min a 1207 × g a 4 ° C.
- Decantar la capa de éter.
- Repita el paso 6.7 a 6.9, cinco veces.
7. Secar el Backbone cíclica Péptido
- Mantenga el péptido precipitado en el mismo tubo y secar en una campana durante 30 min.
- Se disuelve el péptido en una mezcla 1: 1 de agua y acetonitrilo (ACN).
- Congelar la solución de producto final en nitrógeno líquido.
- Liofilizar el producto final.
8. Caracterizar el Backbone cíclica Péptido
- Disolver una pequeña muestra (1 mg) del producto en agua (400 l).
- Inyectar el péptido disuelto (10-200 l) a un líquido chromatograp de alto rendimiento en fase inversaHY sistema (RP-HPLC) para probar la pureza del péptido 34.
- Compruebe la masa del péptido mediante espectrometría de masas de ionización por desorción láser asistida por matriz (MALDI-MS) 84.
- Mezclar 1 l (100 mM) péptido en un 1: 1 (v / v) mezcla de acetonitrilo: agua con 1 l de matriz (ácido 5 mg / ml, α-ciano-4-hidroxicinámico) en un 1: 1 (v / v) mezcla de acetonitrilo: agua con TFA (0,1%).
- Punto 1 l en la placa de MALDI-MS.
- Secar la muestra y colóquela en el espectrómetro de masas.
- Pesar el péptido y calcular el porcentaje de rendimiento.
- Almacenar a -20 ° C.
9. Control de la Síntesis
- Kaiser (ninhidrina) prueba de 85
- Preparar las soluciones de reactivos.
- Preparar la solución A disolviendo 16,5 mg de cianuro de potasio (KCN) en 25 ml de agua destilada. Diluir 1 ml de la solución anterior con 49 ml de piridina.
- Preparar la solución Bdisolviendo 1 g de ninhidrina en 20 ml de etanol.
- Preparar la solución C disolviendo 40 g de fenol en 20 ml de etanol.
- Utilice la prueba de Kaiser para comprobar la finalización de acoplamiento de aminoácidos o de la desprotección del grupo protector.
- Transferir unos granos de la resina a un tubo de ensayo.
- Añadir tres gotas (~ 100 mu l) de cada solución (A, B y C) y mezclar.
- Calentar el tubo de ensayo en un bloque de calentamiento a 110 ° C durante 5 min.
Nota: cuentas de colores azules (resultado positivo) indican reacción de acoplamiento incompleto o desprotección del grupo protector Fmoc.
- Preparar las soluciones de reactivos.
- Prueba de 86 cloranil
- Prepare los siguientes reactivos frescos para cada prueba.
- Preparar una solución de 2% cloranilo en DMF, la solución A.
- Preparar una solución de 2% de acetaldehído en DMF, la solución B.
- Realice la prueba de cloranilo para comprobar la finalización de acoplamiento de aminoácidos o tque la desprotección del grupo protector.
- Mezclar 100 l de la solución A con 100 l de solución B en un tubo de 1,5 ml.
- La caída de las bolas y agitar suavemente durante 5 minutos.
Nota: Las cuentas de colores marrón oscuro (resultado positivo) indican desprotección del grupo protector Fmoc o una reacción de acoplamiento incompleto.
- Prepare los siguientes reactivos frescos para cada prueba.
- Reacción de escisión pequeña escala
- Retirar una pequeña cantidad de resina a un cartucho de polipropileno 3 ml equipado con enchufe tapa y llave de paso.
- Tratar con una mezcla 2 ml de 95% de TFA, 2,5% de agua y 2,5% de TIS.
- Agitar la mezcla durante 30 min a TA.
- Eliminar la resina por filtración utilizando la frita del cartucho de polipropileno y evaporar los disolventes por una corriente de nitrógeno.
- Disolver el residuo en agua y analizar el producto utilizando HPLC y / o MS.
10. Leishmania donovani Promastigote Viabilidad de Cultura Ensayo
- Leishmania donovani (L. donovani) las condiciones de crecimiento y de tratamiento
- Cultura L. promastigotes donovani en la modificación de Dulbecco del medio de Eagle (DMEM) con 4,5 g / L de glucosa, L-glutamina y piruvato de sodio a 26 ° C.
- Tratar la L. donovani promastigotes con péptidos cíclicos (100 M) durante 24 horas a 26 ° C.
- Leishmania donovani (L. donovani) ensayo de viabilidad
- Evaluar la viabilidad del parásito con 20 l alamarBlue según el protocolo del fabricante.
- Determinar la reducción de alamarBlue midiendo la fluorescencia (excitación a 570 nm y 590 nm de emisión). Valores de fluorescencia más altos indican una mayor actividad metabólica y un aumento de la viabilidad del parásito.
Resultados
Aquí se describe el desarrollo de una pequeña biblioteca enfocada de péptidos cíclicos de cadena principal que se dirigen específicamente IBP vitales del parásito Leishmania y actuar como agentes antiparasitarios (para una revisión acerca de los péptidos que se dirigen a los IBP como agentes antiparasitarios 87). A través de la síntesis de péptidos con esqueleto cíclico novela, farmacóforos se conservan en un andamio de tamaño extensible. La fuerza de la biblioteca enfocada que aquí se propone es la capacidad de variar los tamaños de andamios péptido al tiempo que permite un grado limitado de libertad conformacional a través de ciclación. Toda la síntesis de los péptidos cíclicos de cadena principal se realizó utilizando un sintetizador automático de microondas sobre un soporte sólido, siguiendo el protocolo Fmoc / tBu. La ciclación se llevó a cabo mediante la creación de un enlace amida entre el enlazador, anhídrido / ácido, y la amina de la cadena lateral de la lisina. La escisión y la cadena lateral desprotección final se llevaron a cabo de forma manual, sin la energía de microondas (para el esquema de síntesis y festructura de productos Inal ver Figura 3). El producto se analizó por HPLC preparativa para producir 25 mg de polvo blanco almacenadas a -20 ° C. Una muestra del producto se verificó por MS (Figura 4) y su grado de pureza se determinó usando HPLC analítica (Figura 5). Una muestra de cada péptido cíclico fue enviado para la investigación biológica. Uno de los cuatro péptidos cíclicos (PL1) fue activo frente a Leishmania donovani (L. donovani), un parásito que causa la leishmaniasis visceral, la más severa leishmaniasis en humanos. Péptido pL1 reduce la viabilidad del parásito en un 75% en comparación con el tratamiento de control (Tabla 4).

Figura 3. Esquema y la estructura del péptido con esqueleto cíclico sintetizado en este estudio Síntesis Reactivos y condiciones:. (I) amino ácido de acoplamiento: 300 seg, 25 W, 75 ° C,usando 1,1: 1: 2,2 de ácido amino / activador / base activador. (ii) la desprotección Fmoc: 30 seg y 180 seg tanto a 45 W, 75 ° C, utilizando 20% de piperidina en DMF + 0,1 M HOBt. (iii) acoplamiento de anhídrido: 300 seg, 25 W, 75 ° C, usando 10: 10: 1 de anhídrido / DIEA / DMAP en NMP. (iv) desprotección MTT: 3 * (300 seg, 0 W, rt) usando 1: 5: 94 de TFA / TIS / DCM. (v) La ciclación: 300 seg, 25 W, 75 ° C, utilizando 05:10 PyBOP / DIEA en dBm. (vi) La escisión y desprotección: 3 h, 0 W, rt, utilizando 90: 2,5: 2,5: 5 TFA / TIS / H 2 O / fenol. Los péptidos se conjugaron con un 47 a 57 (Tyr-Gly-Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg) péptido portador TAT a través de un enlace amida como parte de la síntesis en fase sólida. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4. MALDI-TOF espectrometría de masas rastro debackbone representante péptido cíclico. La masa observada, 2853.456 está en estrecho acuerdo con la masa calculada, 2854.271. Por favor haga clic aquí para ver una versión más grande de esta figura.
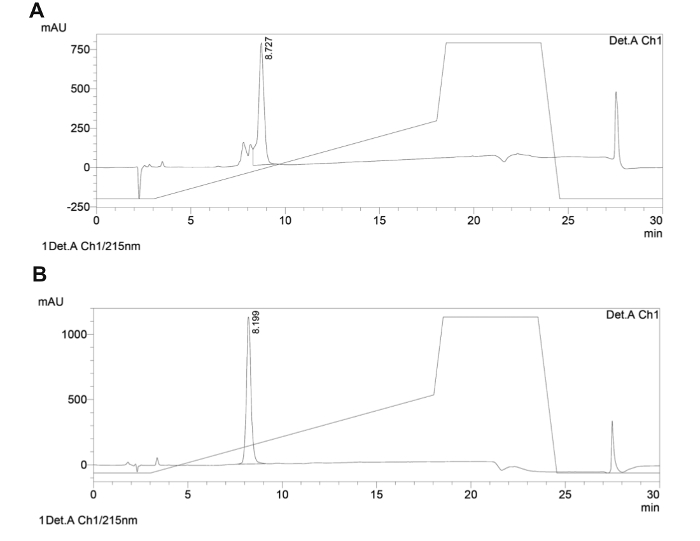
Figura 5. Analytical traza de HPLC de fase inversa de péptido con esqueleto cíclico representativo. Las trazas de HPLC analítico de crudo (A) y (B) péptido cíclico purificado columna vertebral se muestran. Los sistemas de disolventes usados fueron A (H 2 O con 0,1% TFA) y B (CH 3 CN con 0,1% TFA). Un gradiente lineal de 5-50% de B a 1 ml / min en 15 min a 40 ° C con un C18, 5 m, columna 150 mm se aplicó y la detección se realizó a 215 nm. Haga clic aquípara ver una versión más grande de esta figura.
| Solución | Reactivo | MW (g / mol) | d (g / ml) | Volumen (ml) | Concentración (M) | Cantidad total |
| - Solución de ácido Amino - | Aminoácido Alanina | 311,34 | 0.2 | 6,23 g | ||
| 0,2 M de ácido amino en DMF | DMF | 100 | 100 ml | |||
| Un ejemplo para el aminoácido alanina, pero el mismo cálculo debe realizarse para cada aminoácido, con el MW apropiado. Para preparar una solución de ácido 100 ml se disuelven 6,23 g amino del aminoácido alanina en 100 ml de DMF. Almacenar a 4 ° C. | ||||||
| - Solución de desprotección- | HOBt | 135.1 | 0.1 | 3,37 g | ||
| Solución v / v 20% de piperidina en DMF con 0,1 M HOBt | Piperidina | 50 | 50 ml | |||
| DMF | 200 | 200 ml | ||||
| La desprotección se utiliza para la eliminación de los α Fmoc N - grupo protector. Para preparar una solución de 250 ml se disuelven 3,37 g de desprotección HOBt en 200 ml de DMF y agregar 50 ml de piperidina. Almacenar a 4 ° C. | ||||||
| - Solución de activador - | HBTU | 379,24 | 0.45 | 18,96 g | ||
| 0,45 M HBTU en DMF | DMF | 100 | 100 ml | |||
| Activator esutilizado con la base activador para activar el aminoácido antes de la reacción de acoplamiento. Para preparar una solución de activador 100 ml se disuelven 18,96 g HBTU en 100 ml de DMF. Almacenar a 4 ° C. | ||||||
| - Solución de base Activador - | DIEA | 129.24 | 0,742 | 2 | 34.80 ml | |
| 2 M DIEA en NMP | NMP | 65,20 ml | ||||
| Activador de base se utiliza con el activador para activar el aminoácido antes de la reacción de acoplamiento. Para preparar una mezcla de solución de base del activador 100 ml 34,8 ml de DIEA y 65,2 ml de NMP. Almacenar a 4 ° C. | ||||||
| Solución | Reactivo | MW (g / mol) | d (g / ml) | Volumen (ml) | Ec | Cantidad total |
| Solución de anhídrido - 10: 1: 10 / anhídrido DMAP / DIEA en NMP | Glutárico / anhídrido succínico | 114.1 / 100.07 | 10 | 0,11 / 0,10 g | ||
| DMAP | 122.2 | 1 | 0,01 g | |||
| DIEA | 129.24 | 0,742 | 10 | 0,09 ml | ||
| NMP | 5 | 5 ml | ||||
| Disolver 0,11 / 0,10 g de anhídrido glutárico / succínico en 5 ml de NMP, añadir 0,01 g de DMAP y 0,09 ml de DIEA a la solución. Prepare una solución fresca. | ||||||
| Solución ácida - 10: 1: 10 / ácido DMAP / DIC en DMF | Ácido adípico / pimélico | 146.14 / 160.17 | 10 | 0,15 / 0,16 g | ||
| DMAP | 122.2 | 1 | 0,01 g | |||
| DIC | 126.2 | 0,806 | 10 | 0,16 ml | ||
| DMF | 5 | 5 ml | ||||
| Disolver 0,15 / 0,16 g de adípico / ácido pimélico en 5 ml de DMF, agregar 0,01 g de DMAP y 0,16 ml de DIC a la solución. Prepare una solución fresca. | ||||||
| Solución ciclación - 05:10 PyBOP / DIEA en DBM | PyBOP | 520.3 | 5 | 0,26 g | ||
| DIEA | 129.24 | 0,742 | 10 | 0,09 ml | ||
| DBM | 5 ml | 5 ml | ||||
| Disolver 0,26 g PyBOP en 5 ml DBM y añadir 0,09 ml de DIEA a la solución. Prepara unsolución fresca. | ||||||
Tabla 1. Los reactivos y soluciones para la columna vertebral síntesis de péptidos cíclicos. Lista de las soluciones y reactivos para la síntesis se proporciona.
| Ciclo de Microondas | Potencia (W) | Temperatura (° C) | Tiempo (seg) | ||
| 1 | El acoplamiento de aminoácidos | 25 | 75 | 300 | |
| 2 | La desprotección del grupo protector Fmoc | (a) la desprotección inicial | 45 | 75 | 30 |
| (b) la desprotección completa | 45 | 75 | 180 | ||
Tabla 2. ciclos de microondas para el acoplamiento y desprotección. Ciclos de microondas paraacoplamiento de aminoácidos y Fmoc-desprotección. (1) El acoplamiento de aminoácidos. (2) La desprotección del grupo Fmoc enmascaramiento se realiza en dos pasos: (a) inicial y (b) desprotección completa.
| Problema | Posible razón | Solución |
| Pruebas de Kaiser o cloranilo son positivos después del acoplamiento de aminoácidos | El acoplamiento de aminoácidos es incompleta | Repita la etapa de acoplamiento |
| Los péptidos no están separados de manera eficiente a partir del sobrenadante | El exceso de cantidad de TFA | Evaporar la muestra usando una corriente de nitrógeno |
| La presencia de secuencias de deleción en el producto | Eliminación de Fmoc es incompleta | Supervisar la desprotección por Kaiser o cloranilo ensayos y / o pequeña hendidura escala, en el caso de la eliminación de Fmoc es repetición incompleta la etapa |
| Coupl aminoácidosING es incompleta | Monitorear el acoplamiento por Kaiser o cloranilo ensayos y / o la escisión pequeña escala, en caso de que el acoplamiento de aminoácidos es incompleta repita el paso y / o usar el tiempo de reacción más largo |
Se proporciona la Tabla 3. Solución de problemas consejos Lista de soluciones para los retos sintéticos más comunes.
| Péptidos | Secuencia | norte | SRA. California. | EM Obs. | HPLC | rendimiento | La viabilidad del parásito | ||
| pL1 | RNGQCQRK-GG-YGRKKRRQRRR | 2 | 2854.321 | 2853.456 | 98% | 86% | 25% | ||
| pL2 | RNGQCQRK-GG-YGRKKRRQRRR | 3 | 2868.348 | 2868.808 | 98% | 87% | 100% | ||
| PL3 | RNGQCQRK-GG-YGRKKRRQRRR | 4 | 2882.375 | 2881.823 | 96% | 89% | 97% | ||
| PL4 | RNGQCQRK-GG-YGRKKRRQRRR | 5 | 2896.402 | 2895.603 | 97% | 85% | 98% | ||
Tabla 4. Caracterización y bioactividad de los péptidos en este estudio. N se refiere al número de metilenos en el espaciador de alquilo (véase la Figura 3 para la estructura). MS se realizó utilizando la técnica de MALDI y la pureza se determinó mediante HPLC analítica. Los péptidos se añaden a promastigotes de Leishmania donovani y la viabilidad de los parásitos se evaluó y se expresaron como porcentaje de supervivencia en relación con los cultivos de control incubadas en ausencia de péptido. Sólo pL1 tenía una alta actividad leishmanicida. El observadorfue cegado a las condiciones experimentales. Los datos son representativos de tres experimentos independientes.
Discusión
La síntesis de una biblioteca enfocada de péptidos cíclicos de cadena principal derivadas de la proteína LACK del parásito Leishmania utilizando un sintetizador de microondas completamente automatizado se describe. Una biblioteca enfocada de péptidos cíclicos se desarrolló con farmacóforos conservados y varios conectores. La adición de varios enlazadores tales como anhídrido glutárico, anhídrido succínico, ácido adípico, ácido pimélico, lisina, ornitina, y otros bloques de construcción se puede utilizar para aumentar la variedad del espacio conformacional de los péptidos cíclicos. La síntesis de una biblioteca centrada péptidos cíclicos permite a los investigadores a la pantalla para el espacio conformacional óptima. Puesto que la conformación de péptidos cíclicos varía en función de parámetros tales como el tamaño del anillo y la posición, diversos análogos con diferentes conformaciones pueden ser generados, que puede ser útil en biológica relación estructura-actividad estudia 88.
Un reto principal en SPPS está diagnosticando la syntprogreso hetic y resolución de problemas ya que no hay intermediarios están aislados. Por lo tanto, varias pruebas colorimétricas se pueden utilizar para controlar la reacción, tales como las que identifican aminas libres mediante pruebas de Kaiser y cloranil. Si las pruebas de Kaiser o cloranilo no son indicativos (por ejemplo, prolina e hidroxi-prolina no reaccionan con ninhidrina en la misma forma que los otros aminoácidos debido a que su grupo amino alfa es parte de un anillo de cinco miembros), una reacción de escisión pequeña escala y el análisis de espectrometría de masas se puede aplicar para monitorear el progreso de síntesis.
Tiempo de la hendidura y el cóctel de escisión pueden ser modificados en base a las propiedades químicas y número de los grupos protectores utilizados. Se recomienda que una escisión de prueba inicial usando una pequeña cantidad de resina (1-10 mg) se realizó para verificar las condiciones adecuadas. King et al. Han probado diferentes cócteles de escisión para diversos péptidos y sus directrices detalladas se puede utilizar para optimizar reaction condiciones 89. Para péptidos cíclicos troncales, se recomienda la incubación durante al menos 3 horas por defecto para la plena escote. Sin embargo, los péptidos que contienen un alto número de grupos protectores o grupos protectores difíciles (por ejemplo, éster de t-butilo o pentametil-2,3-dihidrobenzofurano-5-sulfonil) deben ser incubadas durante un tiempo más largo para garantizar la desprotección completa. En esto, no hemos estudiado sistemáticamente el tiempo de escisión óptima o un cóctel. Sin embargo, encontramos que un tiempo de escisión corto (menos de 2 horas) dio lugar a la escisión incompleta de algunos grupos protectores.
El protocolo de síntesis de péptidos microondas estándar es un método de aplicación general para la síntesis de una variedad de péptidos. En la mayoría de los casos, el uso de un sintetizador automático de microondas reduce la duración síntesis y aumenta el rendimiento y la pureza de los productos. Además, disminuye reacciones secundarias tales como la racemización y la formación de aspartimida. Aunque no hemos hechouna comparación lado a lado de microondas y la síntesis convencional en este estudio, basado en nuestra experiencia y otros laboratorios ', se demostró que el uso de la síntesis asistida por microondas es superior al protocolo convencional 61,70. Casi todos los activadores y resinas pueden utilizarse eficazmente en las SPPS microondas y el método general también se pueden aplicar a la síntesis de una variedad de péptidos modificados, tales como glicopéptidos, fosfopéptidos,, azapeptides, peptoides y péptidos cíclicos 90.
La ciclación es una manera conveniente para mejorar la potencia y la estabilidad de los precursores lineales. Los péptidos cíclicos pueden obtener una conformación restringida deseable que puede contribuir al aumento de la afinidad de unión y selectividad. Además, los péptidos lineales pueden ser modificados para contener múltiples bucles cíclicos, lo que les permite dirigirse posiblemente múltiples interfaces de unión a proteínas endógenas 91. Sin embargo, es importante señalar que la ciclación no necessprincipalm ente conducir a mejoras en la totalidad o en ocasiones alguna de estas propiedades. Ciertos péptidos cíclicos pueden dar como resultado conformaciones que no son reconocidos por receptores específicos (por ejemplo 92,93) .Por lo tanto, una biblioteca enfocada de péptidos cíclicos es necesario para la detección de bioactividad. En conclusión, los péptidos cíclicos sintéticos presentan características farmacológicas deseables, son lo suficientemente pequeños para atravesar la membrana celular, y son lo suficientemente grandes como para tener una alta selectividad. De alta potencia, especificidad, y el perfil de seguridad contribuyen a la promesa péptidos cíclicos 'como fármacos candidatos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Damos las gracias a Lauren Van Wassenhove, Sunhee Hwang, y Daria Mochly-Rosen útil para los debates. El trabajo fue financiado por los Institutos Nacionales de Salud de subvención NIH RC4 TW008781-01 C-IDEA (SPARK) para NQ Los financiadores no tenía papel en el diseño del estudio, la recogida y análisis de datos, decisión de publicar, o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic. Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. |
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′- tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’-Diisopropylcarbodiimide (DIC) | Sigma | 38370 | Caution Flammable/ Toxic |
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials - micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP | |
| Nitrogen cylinder | |||
| Desiccator | |||
| Analytical RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-20AD solvent delivery unit, SIL-20AC autosampler, DGU-20A5 degasser (Shimadzu, MD, USA). | ||
| Preparative RP-HPLC system Shimadzu LC-20 | equipped with: CBM-20A system controller, SPD-20A detector, CTO-20A column oven, 2 x LC-6AD solvent delivery unit and FRC-10A fraction collector (Shimadzu, MD, USA). |
Referencias
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O'Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using 'safety catch' methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based 'building block' approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O'Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis - A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados