Method Article
人間A53T変異αシヌクレインを過剰発現するトランスジェニックマウスの脳における強化ELISAによる疾患関連αシヌクレインの検出
要約
An ELISA offering a novel quantitative approach is described. It specifically detects disease-associated α-synuclein (αSD) in a transgenic mouse model (M83) of synucleinopathy using several antibodies against either the Ser129 phosphorylated αS form or the C-terminal part of the protein.
要約
ウエスタンブロットのような確立された方法に加えて、新たな方法は、迅速かつ容易にsynucleopathiesの実験モデルにおいて疾患関連αシヌクレイン(αSD)を定量化するために必要とされています。過剰発現しているヒトA53TのαSを自発的に体重減少、衰弱、重度の運動障害などの症状を特徴と年齢の8と22ヶ月の間に劇的な臨床表現型を開発するトランスジェニックマウス系統(M83)は、この研究で使用しました。これらのマウスにおけるαSD(疾患関連αS)の分子解析のために、ELISAは、特に病気のマウスでαSDを定量化するために設計されました。このマウスモデルにおいて、中枢神経系の分析は、主に、尾側脳領域および脊髄におけるαSDの存在を示しました。臨床疾患につながる異なる実験条件、 すなわち間αSD分布の違いはuninoculに、ありませんでしたated、通常トランスジェニックマウスの老化と病気のマウスからの脳抽出物を接種したマウスで。基本的に、ウエスタンブロットおよび免疫組織化学によって得られたものと相関して、ELISAによってSer129リン酸化αSに対する抗体を用いαSD免疫反応性の特異的検出。意外にも、同様の結果がαSのC末端部分に対するいくつかの他の抗体を用いて観察しました。 αSDの伝播は、「プリオン様」メカニズムの関与を示唆し、容易に監視し、ELISA法を用いて、このマウスモデルにおいて定量することができます。
概要
Most current methods for detecting disease-associated α-synuclein (αSD) in experimental models of Parkinson's disease (PD), such as immunohistochemistry or Western blot, are time-consuming and not quantitative. This neurodegenerative disease is characterized by alpha-synuclein aggregation mainly in the form of inclusions containing an aggregated form of the normally soluble presynaptic protein αS1,2 (Lewy bodies and Lewy neurites). Normally only marginally phosphorylated, αS is hyperphosphorylated at its serine 129 residue in these inclusions3 and can be monitored by antibodies specifically directed against Ser129 phosphorylated αS, thus providing a reliable marker of the pathology.
Recent research suggests that a “prion-like” mechanism could be involved in the propagation of αS aggregation within the nervous system of an affected patient4,5. These studies reported the acceleration of a synucleinopathy by inoculating brain extracts containing αSD into a transgenic mouse model (M83) expressing an A53T mutated human αS protein associated with a severe motor impairment occurring as the mice age6. In the same manner, intra-cerebral inoculation of aggregated recombinant αS in the same M83 mouse model confirmed the acceleration of aggregation5. The induction of deposits of phosphorylated αS has also been reported after inoculation of C57Bl/6 wild-type mice with either fibrillar recombinant αS or brain extracts from human DLB patients7,8. Sacino et al.9 recently pointed out that after injection of fibrillar human αS, a widespread and progressive cerebral αS inclusion formation could be induced in M83 mice, but not in E46K transgenic mice or non-transgenic mice in which induced αS inclusions were transient, and mainly restricted to the site of injection. Recent studies on monkeys confirmed propagation of αS aggregates after inoculation of PD-derived extracts in species closer to humans10.
The link between αS alterations and Parkinson’s disease suggest that αSD is a potential biomarker for Parkinson’s disease11. A recent study showed the detection of oligomeric soluble aggregates of α-synuclein in human cerebro-spinal fluid (CSF) and plasma as a potential biomarker for Parkinson’s disease based on a conventional sandwich system ELISA using the same antibody to capture and detect αS12. Based on the same method, multimeric proteins were recognized in biological samples, including the brain, because there are multiple copies of epitopes present in the assembled forms13. Very recently, pathological αS in the CSF of patients with a proven Lewy body pathology was detected using both an ELISA kit with a highly specific antibody against αSD (5G4) and an immunoprecipitation assay14. These methods could differentiate patients with PD/DLB from other types of dementia.
The “prion-like” propagation of αS aggregation was further studied in transgenic mouse model M83 using an ELISA approach that was designed to specifically identify αSD15. In this study, we report the detailed ELISA protocol used to quantitatively detect αSD in sick mice (whether or not inoculated with αSD from sick M83 mice) and more especially in the brain regions specifically targeted by the pathological process in this M83 transgenic mouse model4.
プロトコル
動物に関わるすべての手順およびプロトコルは、EC指令609分の86 / EECに従ったと動物実験(プロトコル11から0043)に倫理の検討のために来る、フランスの国家委員会によって批准します。動物が収容され、ANSESの中に世話したリヨン(承認B 69387 0801)の実験施設を承認しました。
マウスの作製
- ペントバルビタールナトリウムの致死量を腹腔内注射によりマウスを安楽死させます。
- マウスの頭蓋骨から脳全体を取得し、抽出するまで氷上に35ミリメートルのプラスチックシャーレに入れてください。
- 頸髄を抽出します。
注 :矢状切片後、または表1に記載した実験の後に利用可能な解剖マウスの脳、のいずれかから脳の半分のいずれかからαSを抽出します。
| ExperimenT | マウス 接種材料(脳相当) | 生存期間 (DPI) | 中央値/最大生存 (日齢) | ELISAによるαSdを検出 / WB / IHC |
| 1 | 未接種のマウス | 441±166 | 736分の419 | 8/8 |
| 2 | 接種したマウス(0.2 mg)を | 150±52 | 241分の140 | 9/9 |
M83マウスで実施した実験の表1のリスト。接種をした後、病気のマウス(グルコース5%の1%重量/容量)の脳ホモジネート20μlのstriato皮質領域での実験2のための6週間で実施しました3%イソフルラン吸入による6週齢ホモ接合M83マウスの麻酔。解像度:日後inoculエーション。
脳を半減2.αS抽出
- 矢状は二つの部分を取得するために脳をカット。粉砕ボールを含むribolysisチューブに各半分を計量。
- 50 mMトリス - 塩酸、pHが7.5、750のNaCl、5mMのEDTA、1mMのDTT、1%ホスファターゼおよびプロテアーゼ阻害剤カクテルを含む高塩(HS)のバッファを準備します。 20%(重量/体積)ホモジネートを得るために、脳の半分に、高塩緩衝液を追加します。
- 脳からサンプルを調製二回23秒間6.0メートル/秒で機械的ホモジナイザーを用いて半分になります。最初の23秒の均質化の後、第二の23秒サイクルの前に2分間氷上でホモジネートを含むチューブを配置します。
- 5分間の未粉砕脳断片を除去するために1000×gで試料を遠心。 200μlのアリコートに分割し、その後のELISA分析のために-80℃でそれらを保つ、上清を回復します。
解剖脳の領域から3αS抽出
- 解剖します両端海馬を解剖する場合を除いて一緒に保持されている2つのforcepsの複数形を用いて低電力拡大鏡(8X倍率)と氷上で35ミリのプラスチックシャーレ内の全脳。脳の整合性を保持するために10分を超えないようにしてください。脳の右側を上に配置し、このためには、以下の脳領域を検索します:
- ちょうど球の後ろに配置鉗子を使用して、2つの嗅球の1を分離します。下方に移動することにより、脳からそれを取り外します。第二の電球のため、この操作を繰り返します。
- ゆっくり2皮質の間に鉗子を楔二皮質の解離を促進するために前方に移動します。 1鉗子で所定の位置に脳を維持し、海馬から大脳皮質を分離するために別のものを使用しています。
- 2ミリメートル皮質下の鉗子の位置を調整します。海馬のトップが表示されるまで、鉗子で穏やかな圧力を維持します。皮質の最初の部分を剥がし、第2の部分で繰り返します。 2皮質を分離するために鉗子を使用して、海馬で開始し、脳の前部に向かって移動します。
- 海馬の周りに開いた鉗子を置きます。海馬の一番下に鉗子を閉じて、その後静かに可能な限りの回収は、それを削除します。第海馬のための手順を繰り返します。
- 線条体の1以下に開いた鉗子を置き、ゆっくりと脳から分離。線条体から残りの皮質を除去するために鉗子を使用してください。第二線条体について、この手順を繰り返します。
- 静かに脳から小脳の分離を容易にするために2ミリメートル小脳の輪郭によって押下する鉗子を使用してください。ただ小脳後ろ鉗子を置き、前方に鉗子を移動させることによって、それを削除します。
- それは脳幹に参加する場所をはっきりと見るために脳を高めるために鉗子の広い部分を使用してください。接合部に縦切開を行い、次いで脳幹を削除します。
- 脳の後ろに鉗子を置き、どのI4丸みを帯びた構造からなります。■。脳が完全に残りの脳から分離されるまで垂直に切開。
- 利用可能な組織の量に応じて、HSバッファ変数%(重量/体積)のホモジネートを調製し、 すなわち、5%の10と30mgの間の重量のためにホモジネート、30及び80 mgの間の重量で10%、および20% 80ミリグラム以上の重量のために。
- ホモジネートの期待%を取得するために解剖した脳領域にHSバッファの適切な量を追加します。
- 渦と組織が完全にHS緩衝液に浸漬されていることを確認してください。
- 解剖した脳領域または頸髄ホウケイ酸ガラス管からなる組織グラインダーと二乳棒、AおよびBから調製したサンプルをホモジナイズ
- チューブに直接破砕されるべき各脳領域を注ぎます。チューブに乳棒Aを挿入し、それを撤回。組織を解離するために、この運動を10回程度繰り返します。次にCに乳棒Bを使用さらに20の動きで組織を粉砕ontinue。 1ミリリットルの転送ピペットで1.5mlチューブにホモジネートを転送します。
- 任意の未粉砕脳断片を除去するために4℃で5分間、1000×gでサンプルを遠心。 、上清を取り出し、200μlのアリコートにそれらを分割し、その後のELISA分析のために-80℃で保管してください。
ELISAによるαS4.検出
- 0.01 ng / mlでのコーティング抗体を希釈します。 50 mMののNa 2 CO 3 / NaHCO 3で緩衝液(pH 9.6)中の抗αSウサギポリクローナルまたはモノクローナルクローン42抗体のいずれかを使用してください。
- コート96ウェルマイクロプレートこの塗布液のウェルあたり100μlで、4°CO / Nに出発。検出抗体をsyn514を使用してのELISA用塗布液、クローン42、LB509、AS11、4D6または8A5で抗αSウサギポリクローナル抗体を使用してください。塗布液のような抗αSモノクローナル抗体クローン42を使用して抗pSer129αS検出抗体との組み合わせで。
注 :必要に応じてELISAを行う前に、プレートを、一週間、4℃に保持することができます。 - ウェル当たり0.05%のTween 20(PBST)でプレートをリン酸緩衝生理食塩水300μlので5回洗浄するためにプレートウォッシャーを使用してください。以降、このステップから、インキュベーションは室温です。
- ウェルあたりブロッキングバッファーT20200μlのPBSを追加します。 150rpmで1時間振とうします。 PBSTでプレートを5回洗浄します。
- (20%ホモジネートの100を、10%ホモジネート1:50及び1%BSA PBST中の5%ホモジネートの1:25希釈物1)、および各ウェルに100μlを添加する脳ホモジネートを希釈します。 150 rpmで振とうしながら2時間インキュベートします。 PBSTでプレートを5回洗浄します。
- 物質一覧に記載された希釈で1%BSAを含むPBSTで異なるαS検出抗体を追加します。 150rpmで1時間インキュベートします。 PBSTでプレートを5回洗浄します。
- アンチのいずれかを追加150rpmで振とうしながら1時間、1%BSAを補充したPBSTで8,000:-mouseまたは抗ウサギIgG HRPコンジュゲートの1に希釈しました。 PBSTでプレートを5回洗浄します。
- 150rpmで振とうしながら、3,3 '、5,5'-テトラメチルベンジジン(TMB)を100μlを各ウェルに溶液を加え、暗所で15分間インキュベートします。
- その後、マイクロプレートリーダーで450 nmの吸光度を測定し、ウェル当たり1 NのHClを100μl加えて反応を停止します。
- データ分析のために、分析試料のそれぞれについて測定したOD値から任意のマウス脳試料(ブランクウェル)を除くすべての試薬を用いてウェル中で得られたOD値を減算します。
5.エピトープマッピング
- オスマン16に記載の方法に従って、エピトープマッピングを行います。簡単に言えば、10アミノ酸重複でニトロセルロース上の12個のアミノ酸を含むヒトαシヌクレインの配列のスポットペプチド。
- 50mMトリス/ 150mMのNaCl緩衝液pH 1にブロック0 0.05%のTween 20および5%粉乳を含みます。 2-10°CO / Nで1mlあたり2μgの抗体の濃度でブロッキング溶液中の抗体をインキュベートします。
- メンブレンを50mMのヤギ抗マウスIgG HRPコンジュゲートで、0.05%のTween 20を含有するインキュベートトリス/ 150mMのNaCl緩衝液pH 10を用いて3回洗浄します。同じバッファを使用して別の5回は、その後、ウエスタンブロットTMB染色キットを用いて染色した膜を洗浄してください。
6.統計分析
- ODをモデル化するために混合効果回帰を実行するために、Rソフトウェアとnlmeパッケージを使用します。それぞれの比較のために、混合効果回帰モデルを実行します。無症候性の基から症候区別するために一定の効果を使用してください。
- 与えられたマウスのための繰り返しの変動を反映するために、ランダムな効果を使用します。残差を調べることにより等分散性を確認し、必要に応じて、ピニェイロとベイツ1に合わせて群内誤差の分散構造をモデル化するために、分散機能を使用します7。Pの有意性閾値として0.05を設定します。
結果
本研究では、ELISAは病気のM83マウスからの高塩緩衝液中で調製脳ホモジネート中で具体的に特定疾患関連αS(αSD)を使用しました。具体的にはpSer129αSた(p = 0.0074)を認識する抗体を用い、ELISAは容易に若い(2-5ヶ月齢)、健康なM83マウス( 図1)から(> 8ヶ月齢)古い、病気のマウスを区別します。いくつかの他の抗体は、病気のマウスからの脳ホモジネート中で同様に高い信号(> 0.6 OD)を示しました。これは、4D6(P = 0.01)、LB509(P = 0.0047)と異なるタンパク質(124から134まで、115から122のC末端部分の配列、および129から140に対する8A5た(p <0.001)の場合でありますそれぞれ)と、はるかに少ない程度に、タンパク質(P = 0.0003)のN末端(2-12)に対するsyn514。さらに、C57BL / 6S(B6のαS-ヌル)の免疫化後のヒト線維性組換えαS18に対して我々の研究室で作製し、AS11モノクローナル抗体19α-SYN遺伝子座の欠失を有するマウスは、病気の唯一のマウスからの脳ホモジネート中で同様に高い信号(p <0.01)を示しました。この抗体は、現在、ヒトαシヌクレインの118-125の配列に対応する、αSのアミノ酸配列(P)VDPDNEAY(E)を認識することが示されています。
対照的に、これらの実験条件下で、αシヌクレイン(91-96配列)の中央領域に対して誘導クローン42検出抗体と脳ホモジネートの分析、病気及び健康両方M83マウスに対して非常に低いシグナルを示しました。それは、マウス(P = 0.1158)の2つの集団を区別することができませんでした。ヤングM83マウスはそれにもかかわらず、非トランスジェニックマウスB6C3H(M83遺伝的バックグラウンド線)を行ったよりも高い免疫反応性を示しました。コントラストはC57BL / 6S(B6のαS-ヌル)で削除α-SYN座をもつマウス、さらに大きくなりました。これはM83マウスのわずかな免疫反応性は、正常αSの低い信号検出に対応することを示唆しています。 AこのELISAのnalytical感度はと比較して評価した以前に、ELISAおよびウエスタンブロット法、同じ病気のM83から調製脳ホモジネートの連続希釈の両方を使用して、検査することにより、不溶性のSer129リン酸化αシヌクレインの検出のためのウエスタンブロット法4を説明しましたマウス脳( 図2)。約10μgの脳の同等物は、LB509とPSer129抗体の両方で、この病気のマウスの脳ホモジネートについて陽性ELISAシグナルを得るために十分でした。これに対し、少なくとも200μgの脳等価物は同じPSer129抗体15を用いたウェスタンブロットにより分析サルコシル不溶性画分中pSer129αSを検出するために必要でした。これは、ELISAは、ウェスタンブロット法と分析感度を約20倍であることを示します。
病人や古いM83マウス( 図3A)、中脳、脳幹および脊髄翔からの脳ホモジネート中 LB509とELISAでPSer129抗体の両方で顕著な免疫反応性を結婚。ただし、検出可能な免疫反応性は、嗅球、大脳皮質、線条体、海馬、視床および視床下部を含む、他の脳領域で観察されませんでした。 ELISAは、小脳のためのかすかなシグナルを与えました。病気のM83マウス4( 図3B)からの脳抽出物の注射後の加速の臨床疾患を発症M83マウスの異なる脳領域における免疫反応性はM83マウスを未接種高齢者(古い> 8ヶ月)で見られるものと区別できませんでした。これらの結果は、脳や脊髄の尾側の領域におけるSer129のαシヌクレインのはるかに大きな堆積を示すウエスタンブロット( 図3C)および免疫組織化学15で得られたもの、と完全に一致しています。
/52752/52752fig1highres.jpg "幅=" 700 "/>
M83マウスからの全脳ホモジネート中の疾患関連αシヌクレイン(αSD)の図1のELISA検出 。 ELISAは、(検出)抗体が健康なM83マウスから病気のマウスを区別する抗pSer129αS(PSer129)でsyn514、LB509、AS11、4D6、8A5(検出)またはクローン42(コーティング)とウサギ抗αSポリクローナル(コーティング)を組み合わせ、抗αSウサギポリクローナルを用いたELISA(コーティング)/ clone42(検出)に対しません。 11〜16ヶ月歳から6病気、古いM83マウス(クローン42抗体を除く)抗α-SYN抗体との免疫反応性の徴候を示しました。これは、2〜5ヶ月齢から、またはB6C3H(M83マウスの遺伝的背景)やB6αS欠損マウスなどの追加のコントロールを持つ高齢者6若く、健康なマウスのいずれかの場合ではありませんでした。エラーバーはBétemps15から変更されたSDを表します。
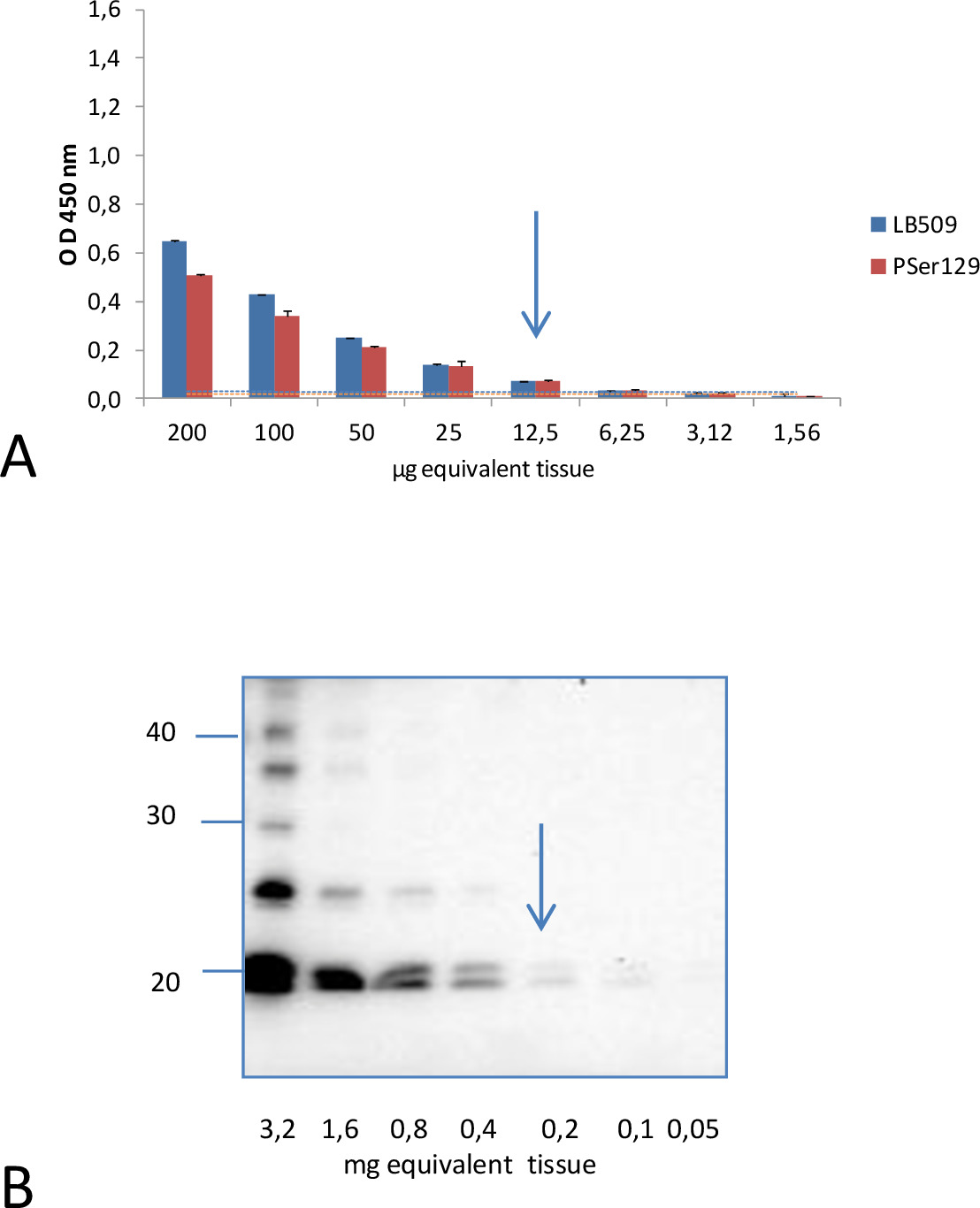
正の信号が病気から脳ホモジネートの2倍希釈から12.5μgの両方LB509と脳の等価物およびPSer129抗体についてELISAで得られたELISAおよびウエスタンブロット。A.によりαSDの検出の分析感度の図2.比較マウス。 ELISA対策+ 3標準偏差の三から六リピート中に健康なM83マウスのサンプルから得られた手段に対応した病気や健康なマウスを識別するための推定カットオフレベルは、それぞれLB509とPSer129検出抗体について0.030と0.020でした。これらは、抗体の各々に対して使用されるものと同じ色の線で示されている。B.を PRESENで超遠心分離後に得られた不溶性画分のウェスタンブロット分析によってサルコシルのCEは、200μgの脳の等価物は、同じPSer129抗体でαSDを検出するために必要でした。分子量(kDa)マーカーは、ブロットの左側に表示されています。 Bétemps15からの許可を得て転載。

図3。ELISAおよびウエスタンブロットによるM83マウスの異なる脳領域における疾患関連αシヌクレインの検出(αSD)。 ELISAは、正常な老化(A)(N = 1、4を繰り返し、平均値±SD)の間または病気のM83(からの脳ホモジネートで6週齢のM83マウスの接種後M83マウスにおけるPSer129またはLB509検出抗体とαSDを同定しましたB)(N = 1、4を繰り返し、平均±SD)。 (C)αSDは、Wにより同定されました病気のM83マウスからの脳ホモジネートを接種したマウスでも同じ神経解剖学的領域におけるPSer129検出抗体EP1536Yとesternブロット。分子量(kDa)マーカーは、総等量のタンパク質がゲル上で同等の負荷のために、各ラインに使用したパネルCの左側に表示されています。病気のM83マウスから以下の8つの神経解剖学的領域を試験した:OB:嗅覚電球、Cxの:大脳皮質、こんにちは:海馬、セント:線条体、私:脳、Cbを:小脳、BS:脳幹、SC:頸髄を。 Bétemps15から変更されました。
ディスカッション
ELISAの使用は、特にM83のトランスジェニックマウスモデルにおける疾患の間にマウス脳ホモジネートから直接αSDを検出することが実証されました。確かに、このELISAは、容易に、高塩緩衝液中で唯一の全脳ホモジネートを使用して健康なM83マウス由来の病気のM83マウスを区別することができます。
このELISAを用いて成功した結果を得るために最も重要な手順は次のとおりです。正しく解剖時の損傷を防止するために必要な手先の器用さを開発することにより、マウスの脳の異なる領域を解剖。 HSバッファに排他的にサンプルの希釈を行います。および抗体の選択は、すべての抗体は、ELISA形式で動作しますので。
αSDレベルのいくらかの変動は、それにもかかわらず、別のマウスの間明らかでした。これらの結果は、サーク島の検査で病気のM83マウスで検出された典型的なαSDパターンのウエスタンブロット検出に相当しますSer129に対する抗体で検出した後osyl不溶性画分をαS15をリン酸化しました。これは、ELISA免疫反応性は、αSDの特異的検出に対応することを示しています。
前のウェスタンブロットとの契約が15を分析して、このELISAは、同様に頸髄のように、脳、 すなわち、脳と脳幹の尾の部分の病気のM83マウスの脳の解剖後の免疫反応性を検出しました。免疫反応性は、マウスの場合には非常に低いレベルで原線維のアルファによって接種しておいた場合を除き、海馬は、病理学的プロセス6によって免れたことを示す以前のデータと一致し、嗅球、大脳皮質、線条体や海馬では検出されませんでした海馬15にシヌクレイン。 αSDの分布は、このように全体的に非常に均一に見え、どのような実験条件、どの株式会社ludedいずれかのマウスの正常な老化や病気のM83マウスからの脳ホモジネートの脳内接種後の疾患の開発を加速させました。
さらに、アッセイ性能は、前述のウェスタンブロット法よりも優れています。病気のM83マウス(ウエスタンブロットアッセイのための200μgの対 ELISA用12.5μgの)からの脳ホモジネートの連続希釈を用いて、この試験で得られた検出限界によって示されるように、ELISAの分析感度は、高く現れました。 ELISAの感度は、しかし、個々の細胞およびそのような大脳皮質15前頭葉脳領域におけるαSDを検出する免疫組織化学的検出のそれよりも低いままでした。試験の感度は、それにもかかわらず、さらに、以前13に記載のような化学発光検出等の異なる抗体および/ または最適化された検出システムを使用することによって改善することができます。
大事ですいくつかの他の抗体は、タンパク質の他の形態を認識し、特に(4D6モノクローナル抗体20を用いて検出)は、非リン酸化形態を特異的pSer129αSを認識するモノクローナル抗体に加えて、このELISAを用いて同様の結果を与えたことに注意すること。このELISA法はまた、病気のマウス15の同じ病気の動物および/ または脳領域に特異的にヒトαS(LB509)と、はるかに低い程度に、マウスαS(D37A6)を認識する抗体を用いて免疫反応性を明らかにしました。一方、免疫反応性は、これらのELISA条件下で潜在可能性エピトープに対応する、αS(91-96)21,22の中央領域に対してクローン42抗体を用いた病気のM83マウスのELISA分析により観察されませんでした。オリゴマー形態をヒト血漿中Foulds 11で観測された、場合によっては、非リン酸化のようにハムに記載されているように、このELISAフォーマットは、M83のマウスの脳の両方のSer129リン酸化αSで検出することができました血漿および脳脊髄液12,14。以前に公開されたELISA法とは異なり、私たちのELISAフォーマットは、αSのオリゴマー形態を検出するために、捕捉および検出に同じ抗体を使用していないどちらも、またUnterbergerの研究で使用さ5G4抗体のようなコンフォメーションであることが知られている抗体、。
以前M83マウス4からの脳ホモジネート中αSDを検出するために使用されるウエスタンブロット法とは異なり、ELISAは、疾患関連タンパク質23を検出するために、このようなサルコシルと超遠心分離などにより濃縮工程を必要としませんでした。疾患関連αSは、以前強2,6を増加させる緩衝液を用いて順次抽出してM83マウスにおいて同定されました。実用的な観点からは、この定量アッセイは、ウエスタンブロット手順と比較して、かなりの時間と試薬を節約できます。
本研究では、ELISA法を用いて詳細なαS分子分析には、それを可能にしました簡単に病気のM83マウスにおける異なる抗体との免疫反応性を定量化します。これは、定量的な観点からのシヌクレイノパチーの間にαS凝集に関与する分子メカニズムに光を当てることができます。このELISAアプローチは、したがってFoulds 11がショーを非リン酸化よりも診断マーカーとしてより多くの約束を信じているようなSer129リン酸化αSとして病理の信頼できるマーカーで、様々な生物学的サンプル中のαSDを検出するための迅速かつ簡単なツールのための基礎を提供することができますタンパク質。最近、彼は、全αSのレベルは初期症状24が出現した後に時間の経過とともに増加する傾向があるように、非リン酸化αSのおそらく合計αSかの措置は、PDにおける疾患進行の代理マーカーとして使用できることを指摘し。
開示事項
The authors have no competing interests to disclose.
謝辞
著者らは、予防接種のためのダミアン·ガイヤールに感謝し、動物実験のフォローアップしたいと思います。この作品は、ANSES(食品、環境·労働安全衛生のためのフランスの機関)によって、および財団フランスパーキンソンからの助成金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| LB509 | Abcam | ab27766 | Detection antibody 1/2,000 |
| AS11 | Produced at Anses | Detection antibody 1/1,000 | |
| 4D6 | Abcam | ab1903 | Detection antibody 1/2,000 |
| PSer129 | Abcam | ab59264 | Detection antibody 1/3,000 |
| PSer129 EP1536Y | Abcam | ab51253 | Detection antibody 1/1,000 |
| syn514 | Abcam | ab24717 | Detection antibody 1/500 |
| clone 42 | BD Biosciences | 610787 | Coating and detection antibody (1/2,000) |
| 8A5 | Provided by Dr. Anderson | Detection antibody 1/2,000 | |
| polyclonal anti-αsyn antibody | Millipore | AB5038P | Coating antibody |
| Anti-mouse IgG HRP conjugate | Southern Biotech | 1010-05 | |
| Anti-rabbit IgG HRP conjugate | Southern Biotech | 4010-05 | |
| Goat anti-mouse IgG HRP conjugate | Dianova | 115-035-164 | |
| HS buffer | Adjust at pH 7.5 and keep at 4 °C | ||
| Euromedex | 26-128-3094-B | |
| Euromedex | 1112-A | |
| Euromedex | EU0007-B | |
| Sigma | 43815 | |
| PBS | Adjust at pH 7.5 | ||
| Euromedex | 1309 | |
| Euromedex | 2018 | |
| Euromedex | 1112-A | |
| Euromedex | P017 | |
| Tween 20 | Euromedex | 2001-C | |
| BSA | Sigma | A7906 | |
| DTT 1 mM | Sigma | 43815 | Stock solution 100 mM, toxic |
| 1% phosphatase cocktail | Pierce | 78428 | |
| 1% protease inhibitor cocktail | Roche | 04 693 132 001 | 50x concentrated |
| Microplate MaxiSorpTM | Thermo Scientific | 442404 | |
| Tampon carbonate 50 mM pH 9.6 | |||
| Sigma | 71360 | 2.86 g/L |
| Merk | 6329 | 3.36 g/L, pH 9.6 |
| Superblock T20 PBS blocking buffer | Pierce | E6423H | 10x concentrated |
| TMB | Sigma | T0440 | Used for ELISA |
| TMB | Analytik Jena AG | 847-0104200302 | Used for epitope mapping |
| HCl 1 N | Chimie plus | 40030 | |
| Ribolyser | Thermo | Fast prep FP120 | keep on ice at this step |
| Grinding tubes | Biorad | 355-1197 | |
| Plate washer | Tecan | Columbus Pro | |
| Plate reader | Biorad | Model 680 | |
| Low power magnifier | VWR | 630-1062 | 8X magnification |
| Forceps Dumont#7 | WPI | 14097 | For dissection steps |
| Transfer pipette 1ml Samso | Samso | 043231 | |
| 1.5 ml tubes | Dutscher | 033290 | |
参考文献
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat Rev Neurol. 9, 13-24 (2013).
- Waxman, E. A., Giasson, B. I. Specificity and regulation of casein kinase-mediated phosphorylation of alpha-synuclein. J Neuropathol Exp Neurol. 67, 402-416 (2008).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Mougenot, A. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol Aging. 33, 2225-2228 (2012).
- Luk, K. C., et al. Intracerebral inoculation of pathological alpha-synuclein initiates a rapidly progressive neurodegenerative alpha-synucleinopathy in mice. J Exp Med. 209, 975-986 (2012).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34, 521-533 (2002).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological alpha-synuclein in brain. Brain : a journal of neurology. 136, 1128-1138 (2013).
- Sacino, A. N., et al. Amyloidogenic alpha-synuclein seeds do not invariably induce rapid, widespread pathology in mice. Acta neuropathologica. 127, 645-665 (2014).
- Recasens, A., et al. Lewy body extracts from parkinson's disease brains trigger alpha-synuclein pathology and neurodegeneration in mice and monkeys. Ann Neurol. , (2013).
- Foulds, P. G., et al. Phosphorylated alpha-synuclein can be detected in blood plasma and is potentially a useful biomarker for Parkinson's disease. FASEB J. 25, 4127-4137 (2011).
- El-Agnaf, O. M., et al. Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson's disease. Faseb J. 20, 419-425 (2006).
- Lee, H. J., et al. Enzyme-linked immunosorbent assays for alpha-synuclein with species and multimeric state specificities. J Neruosci Meth. 199, 249-257 (2011).
- Unterberger, U., et al. Detection of disease-associated alpha-synuclein in the cerebrospinal fluid: a feasibility study. Clin Neuropathol. 33, 329-334 (2014).
- Betemps, D., et al. Alpha-synuclein spreading in M83 mice brain revealed by detection of pathological alpha-synuclein by enhanced ELISA. Acta Neuropathol. (Berl). 2, 29 (2014).
- Osman, A. A., et al. A monoclonal antibody that recognizes a potential coeliac-toxic repetitive pentapeptide epitope in gliadins). Eur J Gastroenterol Hepatol. 13, 1189-1193 (2001).
- Pinheiro, J. C., Bates, D. M., Chambers, J. Ch. 5. Mixed-Effects Models in S and S-PLUS. 5, 206-225 (2000).
- Mougenot, A. L., et al. Production of a monoclonal antibody, against human alpha-synuclein, in a subpopulation of C57BL/6J mice, presenting a deletion of the alpha-synuclein locus. J Neruosci Meth. 192, 268-276 (2010).
- Specht, C. G., Schoepfer, R. Deletion of the alpha-synuclein locus in a subpopulation of C57BL/6J inbred mice. BMC Neurosci. 2, 11 (2001).
- Lee, B. R., Matsuo, Y., Cashikar, A. G., Kamitani, T. Role of Ser129 phosphorylation of alpha-synuclein in melanoma cells. J Cell Sci. 126, 696-704 (2013).
- Perrin, R. J., et al. Epitope mapping and specificity of the anti-alpha-synuclein monoclonal antibody Syn-1 in mouse brain and cultured cell lines. Neurosci Lett. 349, 133-135 (2003).
- Emmanouilidou, E., et al. Assessment of alpha-synuclein secretion in mouse and human brain parenchyma. PLoS One. 6, e22225 (2011).
- Mougenot, A. L., et al. Transmission of prion strains in a transgenic mouse models overexpressing human A53T mutated alpha-synuclein. J Neuropathol Exp Neurol. 70, 377-385 (2011).
- Foulds, P. G., et al. A longitudinal study on alpha-synuclein in blood plasma as a biomarker for Parkinson's disease. Sci Rep. 3, 2540 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved