Method Article
איתור של α-סינוקלאין קשורים למחלות על ידי ELISA משופר במוח של עכברים הטרנסגניים ביתר A53T אדם מוטצית α-סינוקלאין
In This Article
Summary
An ELISA offering a novel quantitative approach is described. It specifically detects disease-associated α-synuclein (αSD) in a transgenic mouse model (M83) of synucleinopathy using several antibodies against either the Ser129 phosphorylated αS form or the C-terminal part of the protein.
Abstract
בנוסף לשיטות מבוססות כמו כתם מערבי, יש צורך בשיטות חדשות לכמת במהירות ובקלות α-סינוקלאין הקשורים מחלה (αS D) במודלים ניסיוניים של synucleopathies. קו מהונדס עכבר (M83) αS A53T האנושי ופיתוח הפנוטיפ קליני דרמטי בין שמונה ו -22 חודשים של גיל, מאופיינים בתסמינים כוללים ירידה במשקל, השתטחות, וירידת ערך באופן ספונטני מוטורי קשה להביע מעל, שימש במחקר זה. עבור ניתוחים מולקולריים של αS D (αS הקשורים למחלות) בעכברים אלו, ELISA נועד לכמת במיוחד αS D בעכברים חולים. ניתוח של מערכת העצבים המרכזית במודל עכבר זה הראה הנוכחות של αS D בעיקר באזורים במוח הזנב וחוט השדרה. לא היו הבדלים בהתפלגות αS D בין תנאי ניסוי שונים שמוביל למחלה קלינית, כלומר, בuninoculated ובדרך כלל הזדקנות עכברים הטרנסגניים ובעכברים מחוסן עם תמציות מוח מעכברים חולים. זיהוי הספציפי של immunoreactivity D αS באמצעות נוגדן נגד Ser129 phosphorylated αS ידי ELISA בעצם מתואם עם שהושג על ידי כתם ואימונוהיסטוכימיה מערביים. באופן בלתי צפוי, תוצאות דומות נצפו עם כמה נוגדנים אחרים נגד חלק C-מסוף של αS. ההתפשטות של αS D, המצביעה על המעורבות של מנגנון "כמו הפריון-", לכן יכולה להיות במעקב בקלות ולכמת במודל עכבר זה באמצעות גישת ELISA.
Introduction
Most current methods for detecting disease-associated α-synuclein (αSD) in experimental models of Parkinson's disease (PD), such as immunohistochemistry or Western blot, are time-consuming and not quantitative. This neurodegenerative disease is characterized by alpha-synuclein aggregation mainly in the form of inclusions containing an aggregated form of the normally soluble presynaptic protein αS1,2 (Lewy bodies and Lewy neurites). Normally only marginally phosphorylated, αS is hyperphosphorylated at its serine 129 residue in these inclusions3 and can be monitored by antibodies specifically directed against Ser129 phosphorylated αS, thus providing a reliable marker of the pathology.
Recent research suggests that a “prion-like” mechanism could be involved in the propagation of αS aggregation within the nervous system of an affected patient4,5. These studies reported the acceleration of a synucleinopathy by inoculating brain extracts containing αSD into a transgenic mouse model (M83) expressing an A53T mutated human αS protein associated with a severe motor impairment occurring as the mice age6. In the same manner, intra-cerebral inoculation of aggregated recombinant αS in the same M83 mouse model confirmed the acceleration of aggregation5. The induction of deposits of phosphorylated αS has also been reported after inoculation of C57Bl/6 wild-type mice with either fibrillar recombinant αS or brain extracts from human DLB patients7,8. Sacino et al.9 recently pointed out that after injection of fibrillar human αS, a widespread and progressive cerebral αS inclusion formation could be induced in M83 mice, but not in E46K transgenic mice or non-transgenic mice in which induced αS inclusions were transient, and mainly restricted to the site of injection. Recent studies on monkeys confirmed propagation of αS aggregates after inoculation of PD-derived extracts in species closer to humans10.
The link between αS alterations and Parkinson’s disease suggest that αSD is a potential biomarker for Parkinson’s disease11. A recent study showed the detection of oligomeric soluble aggregates of α-synuclein in human cerebro-spinal fluid (CSF) and plasma as a potential biomarker for Parkinson’s disease based on a conventional sandwich system ELISA using the same antibody to capture and detect αS12. Based on the same method, multimeric proteins were recognized in biological samples, including the brain, because there are multiple copies of epitopes present in the assembled forms13. Very recently, pathological αS in the CSF of patients with a proven Lewy body pathology was detected using both an ELISA kit with a highly specific antibody against αSD (5G4) and an immunoprecipitation assay14. These methods could differentiate patients with PD/DLB from other types of dementia.
The “prion-like” propagation of αS aggregation was further studied in transgenic mouse model M83 using an ELISA approach that was designed to specifically identify αSD15. In this study, we report the detailed ELISA protocol used to quantitatively detect αSD in sick mice (whether or not inoculated with αSD from sick M83 mice) and more especially in the brain regions specifically targeted by the pathological process in this M83 transgenic mouse model4.
Protocol
כל הנהלים והפרוטוקולים מעורבים בעלי חיים היו בהתאם לEC Directive 86/609 / EEC ואושרר על ידי יבוא, הוועדה הלאומית הצרפתית לשיקול אתי בניסויים בבעלי חיים (פרוטוקול 11-0043). בעלי החיים שוכנו וטיפלו בANSES של אושר מתקנים ניסיוניים בליון (אישור B 69,387 0801).
1. הכנת עכברים
- להרדים עכברים על ידי הזרקת intraperitoneal של מנה הקטלנית של pentobarbital נתרן.
- אחזר את המוח כולו מגולגולת העכבר ולמקם אותו בצלחת פטרי פלסטיק 35 מ"מ על קרח עד מיצוי.
- לחלץ את חוט השדרה הצווארי.
הערה: αS או מאחד חצאים המוח לאחר חתך sagittal או ממוח עכבר גזור, זמין לאחר הניסויים מפורטים בטבלה 1 תמצית.
| Experimenלא | עכברים הבידוד (שווה ערך מוח) | תקופת הישרדות (Dpi) | חציון / הישרדות מקסימלי (ימים) | αS זיהוי ד ידי ELISA / WB / IHC |
| 1 | עכברי Uninoculated | 441 ± 166 | 419/736 | 8/8 |
| 2 | עכברים מחוסן (0.2 מ"ג) | 150 ± 52 | 140/241 | 9/9 |
רשימת טבלת 1. של ניסויים שבוצעו על עכברי M83. חיסונים בוצעו לאחר 6 שבועות לניסוי 2 באזור striato-קליפת המוח עם 20 μl של homogenate מוח של עכבר חולה (כרך / WT 1% ברמת סוכר 5%), לאחר הרדמה של עכברים הומוזיגוטים בן 6 שבועות M83 ב -3% שאיפת isoflurane. dpi: ימי הודעה inoculני.
2. αS הפקה ממוח חצאים
- Sagittally לחתוך את המוח כדי להשיג שני חצאים. לשקול כל מחצית בצינור ribolysis מכיל כדורי טחינה.
- הכן חיץ מלח גבוה (HS) המכיל 50 מ"מ טריס-HCl, pH 7.5, 750 מ"מ NaCl, 5 מ"מ EDTA, 1 מ"מ DTT, קוקטיילים phosphatase ומעכבי פרוטאז 1%. הוסף חוצץ מלח הגבוה לחצאים המוח כדי להשיג 20% homogenates (משקל / נפח).
- הכן דגימות מהחצאים המוח באמצעות homogenizer מכאני על 6.0 מ '/ s במשך 23 שניות פעמיים. לאחר הומוגניזציה 23 שניות הראשונות, למקם את הצינורות המכילים את homogenates על קרח למשך 2 דקות לפני מחזור 23-שניות השניה.
- צנטריפוגה דגימות XG ב 1000 במשך 5 דקות כדי לחסל ברי מוח unground. לשחזר את supernatants, מתחלק לaliquots 200 μl ולשמור אותם ב -80 ° C לניתוח ELISA שלאחר מכן.
3. αS הפקה מאזורי המוח גזור
- לנתחהמוח כולו בצלחת פטרי פלסטיק 35 מ"מ על קרח עם זכוכית מגדלת חשמל נמוכה (הגדלה 8X) באמצעות שתי forcipes שקצוות נשמרים יחד למעט כאשר לנתח את ההיפוקמפוס. לא יעלה על 10 דקות כדי לשמור על שלמות מוח. מניחים את המוח בצד ימין למעלה ולאחזר את האזורים במוח הבאים לפי סדר הבא:
- נפרד אחד משתי נורות חוש הריח באמצעות מלקחיים להציב מאחורי הנורה. לנתק אותו מהמוח על ידי תנועה כלפי מטה. חזור על פעולה זו עבור הנורה השנייה.
- בעדינות טריז המלקחיים בין שני cortexes ולהעביר אותה קדימה כדי להקל על ניתוק של שני cortexes. שמירה על המוח במקום אחד עם מלקחיים, להשתמש עוד להפריד את הקליפה מן ההיפוקמפוס.
- מקם את המלקחיים 2 מ"מ מתחת לקליפת המוח. לשמור על לחץ עדין על המלקחיים עד החלק העליון של ההיפוקמפוס הוא גלוי. לקלף את החלק הראשון של קליפת המוח, ולחזור עם החלק השני. השתמש במלקחיים כדי להפריד בין שני cortexesהחל משעת ההיפוקמפוס ונע לכיוון החלק הקדמי של המוח.
- מקם את המלקחיים הפתוחים סביב אחד hippocampi. סגור את המלקחיים בתחתית של ההיפוקמפוס אז בעדינות להסיר אותו, מתאושש ככל האפשר. חזור על התהליך עבור ההיפוקמפוס השני.
- מקם את המלקחיים הפתוחים מתחת לאחת מstriata ועדינות להפריד אותו מהמוח. השתמש במלקחיים כדי להסיר כל קליפה שנותרה מסטריאטום. חזור על תהליך זה עבור סטריאטום השני.
- השתמש במלקחיים כדי לדכא בעדינות על ידי 2 מ"מ קווי המתאר של המוח הקטן כדי להקל על הפרדה של המוח הקטן מהמוח. מניחים את המלקחיים ממש מאחורי המוח הקטן ולהסיר אותו על ידי העברת המלקחיים קדימה.
- השתמש בחלק הרחב של המלקחיים כדי להעלות את mesencephalon כדי לראות בבירור שבו מצטרף לגזע המוח. לעשות חתך אנכי בצומת לאחר מכן להסיר את גזע המוח.
- מקם את המלקחיים מאחורי mesencephalon, שבו אנישעות מורכבות מארבעה מבנים מעוגלים. לחתוך בצורה אנכית עד mesencephalon הופרד לחלוטין מהמוח שנותר.
- הכן homogenates של% משתנים (משקל / נפח) במאגר HS, בהתאם לכמות של רקמות זמינות, כלומר, homogenate 5% למשקל בין 10 ו -30 מ"ג, 10% למשקל בין 30 ל 80 מ"ג, ו -20% למשקל מעל 80 מ"ג.
- להוסיף נפח מתאים של חיץ HS לאזורים במוח גזור להשגת% הצפויים של homogenate.
- וורטקס ולבדוק שהרקמות שקועים לחלוטין במאגר HS.
- Homogenize דגימות שהוכנו מאזורי המוח גזור או חוט השדרה הצווארי עם מטחנת רקמה המורכבת משפופרת זכוכית בורוסיליקט ושני עליים, A ו- B.
- יוצקים כל אזור במוח שנמחץ ישירות לתוך הצינור. הכנס העלי לתוך הצינור ולחזור בו. חזור על תנועה זו כעשר פעמים ללנתק את הרקמה. לאחר מכן להשתמש העלי 'לגontinue טחינת הרקמה עם 20 תנועות נוספות. העבר את homogenates לתוך צינור 1.5 מיליליטר עם טפטפת העברה 1 מיליליטר.
- צנטריפוגה דגימות XG ב 1000 במשך 5 דקות על 4 מעלות צלזיוס לחסל את כל שברי מוח unground. אחזר את supernatants, לחלק אותם לaliquots 200 μl ולשמור אותם ב -80 ° C לניתוח ELISA שלאחר מכן.
4. איתור של αS ידי ELISA
- לדלל את נוגדני ציפוי ל0.01 ng / ml. השתמש באחת אנטי-αS ארנב polyclonal או נוגדן חד שבטי בשיבוט 42 50 2 CO 3 / NaHCO חיץ מ"מ Na 3 (pH 9.6).
- מעיל עם כל טוב של פתרון ציפוי זה 100 μl, ולהשאיר 96 גם microplates על 4 מעלות CO / N. השתמש בנוגדן polyclonal הארנב נגד αS בפתרון הציפוי לELISAs באמצעות נוגדני זיהוי syn514, לשכפל 42, LB509, AS11, 4D6 או 8A5. השתמש בשיבוט הנוגדן חד שבטי נגד αS 42 כפתרון ציפויבשילוב עם נוגדני זיהוי αS אנטי-pSer129.
הערה: אם יש צורך, הצלחות עשויות להיות כל הזמן על 4 מעלות צלזיוס במשך שבוע אחד לפני ELISA מתבצע. - השתמש מכונת כביסה צלחת לשטוף את הצלחות חמש פעמים עם 300 μl של פוספט שנאגרו מלוח עם 0.05% Tween 20 (PBST) בכל טוב. מהצעד הזה והלאה, דגירה היא על RT.
- הוסף 200 μl של T20 PBS חיץ חסימה בכל טוב. Shake עבור שעה 1 ב 150 סל"ד. לשטוף את הצלחות חמש פעמים עם PBST.
- לדלל את homogenates המוח (דילול 1: 100 של homogenates 20%, 01:50 של homogenates% 10 ו01:25 של homogenates 5% בPBST BSA 1%), ולהוסיף 100 μl היטב כל אחד. אז דגירה של 2 שעות בזמן שלוחץ על 150 סל"ד. לשטוף את הצלחות חמש פעמים עם PBST.
- הוסף את נוגדני זיהוי αS השונים בPBST עם BSA 1% בדילולים מוזכרים ברשימת חומרים. דגירה עבור שעה 1 ב 150 סל"ד. לשטוף את הצלחות חמש פעמים עם PBST.
- להוסיף או אנטי-mouse או conjugates HRP IgG נגד ארנב בדילול 1: 8,000 בPBST בתוספת 1% BSA עבור שעה 1 בעוד הרועד בסל"ד 150. לשטוף את הצלחות חמש פעמים עם PBST.
- הוסף ל3,3 ", פתרון 5,5'-tetramethylbenzidine (TMB) 100 μl לכל היטב דגירה במשך 15 דקות בחושך בזמן רועד בסל"ד 150.
- לעצור את התגובה על ידי הוספה של 1 N HCl 100 μl לכל גם אז למדוד את הספיגה ב 450 ננומטר עם קורא microplate.
- לניתוח נתונים, לחסר ערך OD שהתקבל בהיטב עם כל חומרים כימיים, למעט כל דגימות מוח עכבר (גם ריק) מערכי OD נמדדו עבור כל אחת מהדגימות נותחו.
5. epitope מיפוי
- לבצע מיפוי epitope לפי השיטה שתוארה על ידי אוסמן 16. בקצרה, פפטידים מקום של רצף α-סינוקלאין האנושי המכיל 12 חומצות אמינו על nitrocellulose עם 10 חומצות אמינו חופפות.
- לחסום עם 50 מ"מ טריס / pH חיץ 150 מ"מ NaCl 10 המכיל 0.05% Tween 20 ו 5% אבקת חלב. דגירה הנוגדן בחסימת פתרון בריכוז של 2 נוגדן מיקרוגרם למ"ל ב2-10 ° CO / N.
- לשטוף את הממברנה שלוש פעמים באמצעות 50 מ"מ טריס / 150 pH חיץ מ"מ NaCl 10 המכיל 0.05% 20. דגירה Tween עם המצומד אנטי עכבר IgG HRP העז. שטוף את הקרום חמש פעמים נוספות תוך שימוש באותה החיץ אז כתם באמצעות ערכת צביעת הכתם TMB מערבית.
6. ניתוח סטטיסטי
- השתמש בתוכנת R וnlme החבילה לבצע רגרסיות מעורבת לוואי מודל OD. עבור כל השוואה, לבצע מודל רגרסיה השפעה מעורב. השתמש השפעה קבועה להבחין סימפטומטי מקבוצות ללא תסמינים.
- השתמש השפעה אקראית על מנת לשקף את השונות של חזרות לעכבר נתון. בדוק הומוסקדסטיות על ידי בחינת השאריות ואם יש צורך, להשתמש בפונקציות השונות למודל המבנה השונות של שגיאות בקבוצה בקנה אחד עם פיניירו ו1 בייטס7. קבע 0.05 כסף המשמעות של פ
תוצאות
במחקר זה, ELISAs משמש לזיהוי ספציפי αS הקשורים מחלה (αS D) בhomogenates המוח נערכה בחיץ מלח גבוה מעכברי M83 חולים. באמצעות נוגדן ספציפי הכרת pSer129 αS (p = .0074), ELISA בקלות מבדיל עכברים זקנים, חולים (> בת 8 חודשים) מ( 2-5 חודשים) הצעירים, עכברי M83 בריאים (איור 1). כמה נוגדנים אחרים הראו אותות גבוהים באופן דומה (> 0.6 OD) רק בhomogenates המוח מעכברים חולים. זהו המקרה ל4D6 (p = 0.01), LB509 (p = .0047) ו8A5 (p <0.001) נגד רצפים שונים של חלק C-המסוף של החלבון (124-134, 115-122, ו129-140 בהתאמה), ובמידה פחותה בהרבה, syn514 נגד סוף N- המסוף (2-12) של החלבון (p = 0.0003). יתר על כן, הנוגדן חד שבטי AS11 מיוצר במעבדה שלנו נגד αS האנושי רקומביננטי הסיבי 18 לאחר החיסון של C57BL / 6S (B6 αS-null) 19עכברים עם מחיקה של מוקד α-syn, הראו אותות גבוהים באופן דומה (p <0.01) רק בhomogenates המוח מעכברים חולים. נוגדן זה עכשיו הוכח להכיר VDPDNEAY חומצות אמינו רצף (P) (E) של αS, מתאים לרצף של 118-125 α-סינוקלאין האנושי.
לעומת זאת, בתנאים אלה ניסיוניים, ניתוחים של homogenates המוח עם נוגדן זיהוי שיבוט 42 המכוונים נגד אזור של α-סינוקלאין (91-96 רצף) מרכזי, הראו אות נמוכה מאוד עבור שני עכברי M83 החולים ובריאים. זה לא היה יכול להבחין בין שתי האוכלוסיות של עכברים (p = .1158). עכברי M83 צעירים בכל זאת הראה immunoreactivity גבוה יותר מאשר עכברים מהונדסים אינם B6C3H (קו רקע גנטי M83). לעומת זאת היה גדול עוד יותר עם C57BL / 6S עכברים (B6 αS-null), שיש לי מוקד α-syn נמחק. הדבר מצביע על כך immunoreactivity הקל בעכברי M83 מתאים לזיהוי אות הנמוך של αS הנורמלי.רגישות nalytical של ELISA זה הוערכה בהשוואה לשיטה שתואר לעיל כתם מערבי 4 לאיתור α-סינוקלאין phosphorylated Ser129 מסיס, על ידי בחינה, בשתי שיטות כתם מערביות, דילולים סידוריים של homogenates המוח מוכנה מאותו M83 החולה ELISA ו מוח עכבר (איור 2). 10 מיקרוגרם שווי מוח המשוער היו מספיקים כדי לקבל אות ELISA חיובית לhomogenate המוח מעכבר חולה זו, עם שני LB509 ונוגדני PSer129. להיפך, היו צורך בלפחות 200 מיקרוגרם שווה מוח כדי לזהות pSer129 αS בשבריר sarkosyl-מסיס נותח על ידי כתם מערבי באמצעות אותו נוגדן PSer129 15. זה מצביע על כך ELISA יש רגישות אנליטיים כ -20 פעמים של שיטת הכתם המערבית.
בעכברים חולים וזקנים M83 (איור 3 א), homogenates המוח מmesencephalon, גזע המוח וחוט השדרה sho ד 'מסומן immunoreactivity עם שני LB509 ונוגדני PSer129 בELISA. עם זאת, אין immunoreactivity זיהוי נצפה באזורים האחרים במוח, כולל הנורה חוש הריח, קליפת המוח, סטריאטום, ההיפוקמפוס, התלמוס וההיפותלמוס. ELISA נתן אות קלושה למוח הקטן. Immunoreactivity באזורים השונים במוח של עכברי M83 פיתוח מחלה קלינית מואצת בעקבות ההזרקה של תמצית מוח מחולה M83 עכבר 4 (איור 3) היה נבדל שראה ב( 8 חודשים> ישן) בגיל uninoculated עכברי M83. תוצאות אלו עולות בקנה אחד באופן מלא עם אלה שהושגו על ידי כתם המערבי (איור 3 ג) ואימונוהיסטוכימיה 15, מראים בתצהיר הרבה יותר גדול של Ser129 α-סינוקלאין באזורי הזנב של המוח וחוט השדרה.
"Width =" 700 /52752/52752fig1highres.jpg "/>
איור 1. זיהוי ELISA של α-סינוקלאין הקשורים מחלה (αS D) בhomogenates המוח כולו מעכברי M83. ארנב ELISA שילוב polyclonal אנטי-αS (הציפוי) עם syn514, LB509, AS11, 4D6, 8A5 (זיהוי) או שיבוט 42 (ציפוי) עם אנטי-pSer129 αS (PSer129) נוגדנים (זיהוי) להבחין עכברים חולים מעכברי M83 בריאים, בעוד ELISA עם הארנב polyclonal אנטי-αS (ציפוי) / clone42 (זיהוי) לא. שישה העכברים חולים, ישנים M83 בגילי 11-16 חודשים הראו סימנים של immunoreactivity עם הנוגדנים אנטי-כנסת, α (למעט שיבוט 42 נוגדן). זה לא היה במקרה של שני שישה העכברים צעירים, בריאים בגילים מגיל 2 עד 5 חודשים, או עם בקרות נוספות כוללים B6C3H (רקע גנטי של עכברי M83) או עכברי αS-null B6. הברים השגיאה מייצגים SD השתנה מ -15 Bétemps.
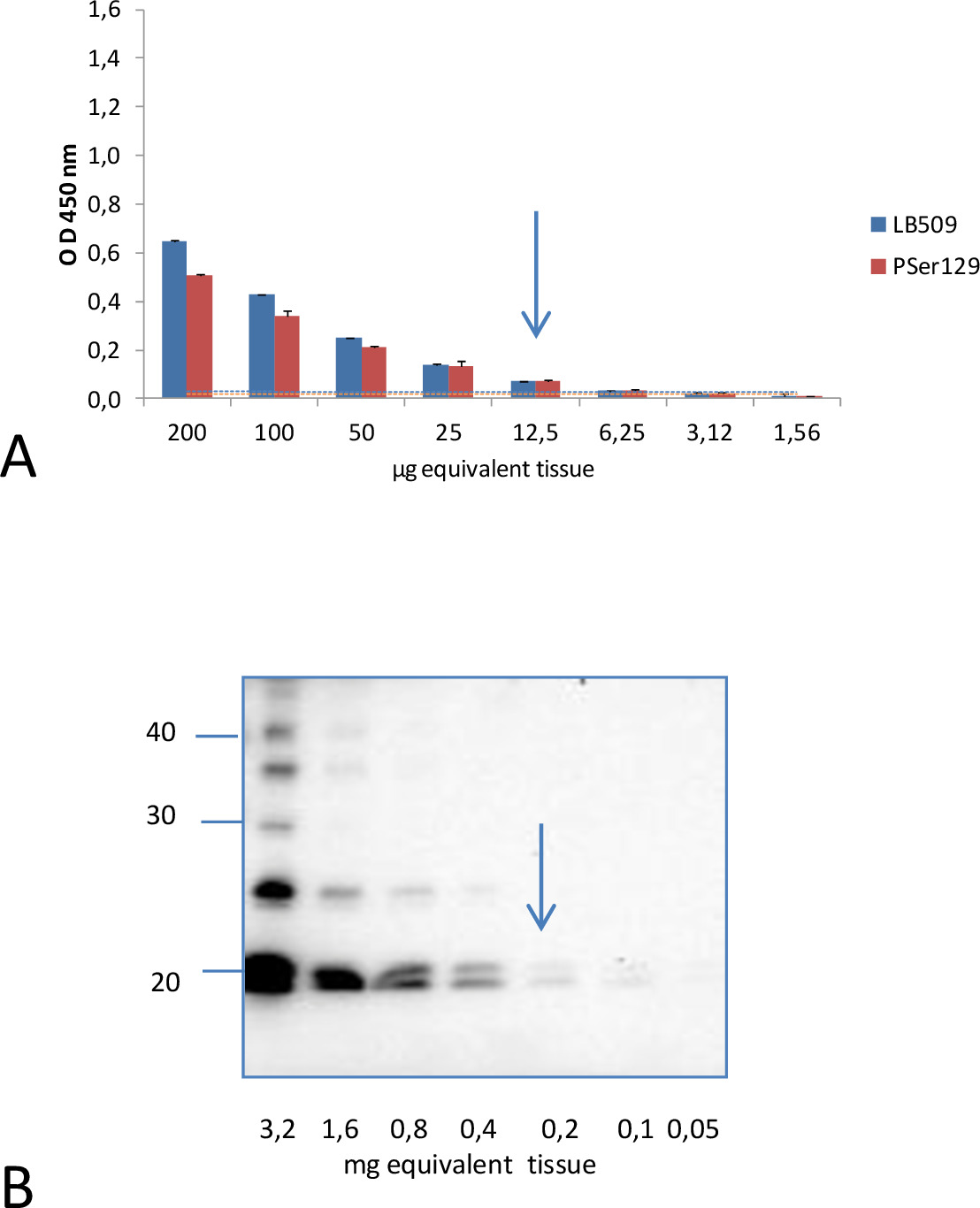
השוואת איור 2. הרגישות האנליטית של זיהוי של αS D על ידי ELISA וכתם מערבי. א אות חיובית שהושגה עם ELISA ל12.5 מיקרוגרם שווה מוח עם שני LB509 ונוגדני PSer129 מדילולים כפול של homogenates המוח מחולה עכבר. הרמה המוערכת החתוכה לאפליה של עכברים חולים ובריאים, המתאימה לאמצעי המתקבל מדגימות של עכברים בריאים M83 במהלך 05:57 חזרות של + 3 סטיות תקן אמצעי ELISA, היו 0.030 ו0.020 לLB509 ונוגדני זיהוי PSer129 בהתאמה . הם מוצגים כקו באותו הצבע כמו זה המשמש עבור כל אחד מהנוגדנים. ב על ידי ניתוח כתם המערבי של שברים מסיסים המתקבלים לאחר ultracentrifugation בpresenהספירה של sarkosyl, היו צורך 200 מיקרוגרם שווה מוח כדי לזהות αS D עם אותו נוגדן PSer129. סמני משקל מולקולריים (בKDA) מסומנים בצד השמאל של הכתם. הודפס מחדש באישור מ -15 Bétemps.

איור 3. איתור של α-סינוקלאין הקשורים מחלה (αS D) באזורים שונים במוח של עכברי M83 ידי ELISA וכתם מערבי. ELISA זיהה αS D עם נוגדני PSer129 או LB509 זיהוי בעכברי M83 במהלך הזדקנות נורמלית (א) (n = 1, 4 חזרות, ממוצע ± SD) או לאחר חיסון של עכברי M83 6 שבועות בן עם homogenate מוח מM83 חולה ( ב) (n = 1, 4 חזרות, ממוצע ± SD). (ג) αS D זוהה על ידי Western למחוק עם EP1536Y נוגדן זיהוי PSer129 באותו האזורים נוירו-אנטומיים בעכברים מחוסן עם homogenate מוח מM83 עכבר חולה. סמני משקל מולקולריים (בKDA) מסומנים בצד השמאל של ג פנל כמויות שווים של חלבונים כולל שמשו בכל שורה לטעינה שווה ערך בג'ל. שמונה האזורים נוירו-אנטומיים הבאים מעכברי M83 חולים נבדקו: OB: הנורה olfactive, Cx: קליפת מוח, היי: ההיפוקמפוס, St: סטריאטום,: mesencephalon, CB: המוח הקטן, BS: גזע מוח, SC: חוט השדרה הצווארי . שונה מ -15 Bétemps.
Discussion
השימוש בELISA הודגם כדי לזהות באופן ספציפי αS D ישירות מhomogenates מוח עכבר במחלה במודל העכבר המהונדס M83. ואכן, זה יכול בקלות ELISA להבחין עכברי M83 חולים מעכברי M83 בריאים באמצעות homogenates המוח רק כל חיץ מלח הגבוה.
השלבים הקריטיים ביותר לתוצאות מוצלחות באמצעות ELISA זה הם: נכון לנתח האזורים השונים של מוח העכבר על ידי פיתוח המיומנות הידנית הנחוצה כדי למנוע נזק במהלך נתיחה; ביצוע דילולים מדגם באופן בלעדי במאגר HS; והבחירה של נוגדנים, כי לא כל הנוגדנים יעבדו בפורמט ELISA.
שונות מסוימות ברמות D αS היו ברורות בכל זאת בין עכברים שונים. תוצאות אלו שווי ערך לאיתור הכתם המערבי של דפוס αS D הטיפוסי המזוהה רק בעכברים חולים M83 על ידי בדיקה של סארקשברים osyl-מסיס לאחר זיהוי עם נוגדנים נגד Ser129 phosphorylated αS 15. זה מוכיח כי immunoreactivity ELISA מתאים לזיהוי הספציפי של αS D.
בהסכם עם כתם מערבי קודם מנתח 15, ELISA זה זוהה immunoreactivity לאחר הנתיחה של המוח של עכברים חולים M83 בחלקי הזנב של המוח, כלומר, mesencephalon וגזע המוח, כמו גם בחוט השדרה הצווארי. אין immunoreactivity זוהה בנורת חוש הריח, קליפת המוח, סטריאטום או היפוקמפוס, עולה בקנה אחד עם נתונים קודמים מצביעים על כך שההיפוקמפוס נחסך על ידי התהליך הפתולוגי 6, אלא אם כן רמות נמוכות מאוד במקרה של עכברים שחוסן על ידי אלפא הסיבי -synuclein להיפוקמפוס 15. חלוקת αS D ובכך הופיעה בכל התנאים הכלליים, הניסיוניים אחידים להפליא, שincluded או הזדקנות נורמלית של עכברים או פיתוח מואץ של המחלה לאחר חיסון תוך-מוחי של homogenates המוח מעכברי M83 חולים.
יתר על כן, ביצועי assay הוא טובים יותר מאשר שיטת הכתם המערבית שתוארה קודם לכן. הרגישות האנליטית של ELISA הופיעה גבוהה יותר, כפי שמוצג על ידי הגבולות של גילוי שהושגו במבחן זה באמצעות דילולים סידוריים של homogenate מוח מעכבר M83 חולה (12.5 מיקרוגרם לELISA לעומת 200 מיקרוגרם לassay הכתם המערבי). הרגישות של ELISA עם זאת נותרה נמוכה מזה של גילוי immunohistochemical, אשר מזהה αS D בתאים בודדים ובאזורי מוח הקדמיים כגון קליפת המוח 15. הרגישות של הבדיקה בכל זאת אפשר לשפר עוד יותר על ידי שימוש בנוגדנים שונים ו / או מערכות גילוי מותאמות, כגון איתור chemiluminescent כפי שתואר קודם לכן 13.
זה חשובלציין כי כמה נוגדנים אחרים הכרת צורות אחרות של החלבון, ובעיקר צורה שאינה פוספורילציה (מזוהות עם הנוגדנים חד שבטי 4D6 20) נתנה תוצאות דומות באמצעות ELISA זה, בנוסף לנוגדנים חד שבטיים במיוחד הכרת pSer129 αS. גישת ELISA זה גם גילתה immunoreactivity עם נוגדני הכרת αS במיוחד אנושי (LB509) ו, להרבה יותר נמוכה במידה, αS עכבר (D37A6) באותה חיות ו / או אזורים במוח חולים של עכברים חולים 15. מצד השני, אין immunoreactivity נצפה על ידי ניתוח ELISA של עכברים חולים M83 באמצעות נוגדן שיבוט 42 נגד אזור של αS (91-96) 21,22 מרכזי, מתאים לאפיטופ אשר יכול להיות נסתר בתנאים אלה ELISA. פורמט ELISA זה יכול לזהות במוח עכבר M83 שני αS phosphorylated Ser129, כפי שנצפה על ידי 11 Foulds בפלזמה אנושית, ולא פוספורילציה, אולי צורות oligomeric, כפי שתואר בזמזוםפלזמה ו12,14 נוזל השדרתי. שלא כמו ELISAs שפורסם בעבר, פורמט ELISA שלנו לא השתמש באותו הנוגדן בלכידה וזיהוי כדי לזהות את צורת oligomeric של αS, ולא נוגדנים הידועים להיות קונפורמציה, כמו נוגדני 5G4 שימוש במחקרים של Unterberger.
בניגוד לשיטת הכתם המערבי השתמשה בעבר כדי לזהות αS D בhomogenates המוח מעכברי M83 4, ELISA לא דורש צעד ריכוז כגון על ידי ultracentrifugation עם sarkosyl לזהות את החלבון הקשורים המחלה 23. αS הקשורים מחלה זוהה בעבר בעכברי M83 על ידי מיצוי רציף באמצעות מאגרים של הגדלת הכוח 2,6. מנקודת מבט מעשית, assay כמותי זה חוסך זמן משמעותי וריאגנטים לעומת הליך הכתם המערבי.
במחקר זה, ניתוחים מולקולריים αS מפורט באמצעות גישת ELISA אפשרו לבקלות לכמת immunoreactivity עם נוגדנים שונים בעכברים חולים M83. זה יכול לשפוך אור על המנגנונים המולקולריים המעורבים בצבירת αS במהלך synucleinopathies מבחינה כמותית. גישה זו ELISA לכן יכולה לספק את הבסיס לכלי מהיר וקל לזיהוי αS D בדגימות ביולוגיות שונות עם סמן אמין של פתולוגיה כגון αS phosphorylated Ser129 ש11 Foulds מאמין מופעים יותר הבטחה כסמן לאבחון מאשר הלא פוספורילציה חלבון. לאחרונה, הוא ציין את העובדה שאמצעים של αS המוחלט או אולי של αS הלא פוספורילציה יכולים לשמש כסמן פונדקאית להתקדמות מחלה בPD, ככל שרמת αS הכולל נוטה להגדיל לאורך זמן לאחר הופעת סימפטומים ראשוניים 24 .
Disclosures
The authors have no competing interests to disclose.
Acknowledgements
המחברים מבקשים להודות לדמיאן Gaillard לחיסונים ומעקב של ניסויים בבעלי חיים. עבודה זו נתמכה על ידי ANSES (הסוכנות הצרפתית למזון, סביבה ובריאות תעסוקתית ובטיחות) ועל ידי מענק מהקרן צרפת פרקינסון.
Materials
| Name | Company | Catalog Number | Comments |
| LB509 | Abcam | ab27766 | Detection antibody 1/2,000 |
| AS11 | Produced at Anses | Detection antibody 1/1,000 | |
| 4D6 | Abcam | ab1903 | Detection antibody 1/2,000 |
| PSer129 | Abcam | ab59264 | Detection antibody 1/3,000 |
| PSer129 EP1536Y | Abcam | ab51253 | Detection antibody 1/1,000 |
| syn514 | Abcam | ab24717 | Detection antibody 1/500 |
| clone 42 | BD Biosciences | 610787 | Coating and detection antibody (1/2,000) |
| 8A5 | Provided by Dr. Anderson | Detection antibody 1/2,000 | |
| polyclonal anti-αsyn antibody | Millipore | AB5038P | Coating antibody |
| Anti-mouse IgG HRP conjugate | Southern Biotech | 1010-05 | |
| Anti-rabbit IgG HRP conjugate | Southern Biotech | 4010-05 | |
| Goat anti-mouse IgG HRP conjugate | Dianova | 115-035-164 | |
| HS buffer | Adjust at pH 7.5 and keep at 4 °C | ||
| Euromedex | 26-128-3094-B | |
| Euromedex | 1112-A | |
| Euromedex | EU0007-B | |
| Sigma | 43815 | |
| PBS | Adjust at pH 7.5 | ||
| Euromedex | 1309 | |
| Euromedex | 2018 | |
| Euromedex | 1112-A | |
| Euromedex | P017 | |
| Tween 20 | Euromedex | 2001-C | |
| BSA | Sigma | A7906 | |
| DTT 1 mM | Sigma | 43815 | Stock solution 100 mM, toxic |
| 1% phosphatase cocktail | Pierce | 78428 | |
| 1% protease inhibitor cocktail | Roche | 04 693 132 001 | 50x concentrated |
| Microplate MaxiSorpTM | Thermo Scientific | 442404 | |
| Tampon carbonate 50 mM pH 9.6 | |||
| Sigma | 71360 | 2.86 g/L |
| Merk | 6329 | 3.36 g/L, pH 9.6 |
| Superblock T20 PBS blocking buffer | Pierce | E6423H | 10x concentrated |
| TMB | Sigma | T0440 | Used for ELISA |
| TMB | Analytik Jena AG | 847-0104200302 | Used for epitope mapping |
| HCl 1 N | Chimie plus | 40030 | |
| Ribolyser | Thermo | Fast prep FP120 | keep on ice at this step |
| Grinding tubes | Biorad | 355-1197 | |
| Plate washer | Tecan | Columbus Pro | |
| Plate reader | Biorad | Model 680 | |
| Low power magnifier | VWR | 630-1062 | 8X magnification |
| Forceps Dumont#7 | WPI | 14097 | For dissection steps |
| Transfer pipette 1ml Samso | Samso | 043231 | |
| 1.5 ml tubes | Dutscher | 033290 | |
References
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat Rev Neurol. 9, 13-24 (2013).
- Waxman, E. A., Giasson, B. I. Specificity and regulation of casein kinase-mediated phosphorylation of alpha-synuclein. J Neuropathol Exp Neurol. 67, 402-416 (2008).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Mougenot, A. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol Aging. 33, 2225-2228 (2012).
- Luk, K. C., et al. Intracerebral inoculation of pathological alpha-synuclein initiates a rapidly progressive neurodegenerative alpha-synucleinopathy in mice. J Exp Med. 209, 975-986 (2012).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34, 521-533 (2002).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological alpha-synuclein in brain. Brain : a journal of neurology. 136, 1128-1138 (2013).
- Sacino, A. N., et al. Amyloidogenic alpha-synuclein seeds do not invariably induce rapid, widespread pathology in mice. Acta neuropathologica. 127, 645-665 (2014).
- Recasens, A., et al. Lewy body extracts from parkinson's disease brains trigger alpha-synuclein pathology and neurodegeneration in mice and monkeys. Ann Neurol. , (2013).
- Foulds, P. G., et al. Phosphorylated alpha-synuclein can be detected in blood plasma and is potentially a useful biomarker for Parkinson's disease. FASEB J. 25, 4127-4137 (2011).
- El-Agnaf, O. M., et al. Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson's disease. Faseb J. 20, 419-425 (2006).
- Lee, H. J., et al. Enzyme-linked immunosorbent assays for alpha-synuclein with species and multimeric state specificities. J Neruosci Meth. 199, 249-257 (2011).
- Unterberger, U., et al. Detection of disease-associated alpha-synuclein in the cerebrospinal fluid: a feasibility study. Clin Neuropathol. 33, 329-334 (2014).
- Betemps, D., et al. Alpha-synuclein spreading in M83 mice brain revealed by detection of pathological alpha-synuclein by enhanced ELISA. Acta Neuropathol. (Berl). 2, 29 (2014).
- Osman, A. A., et al. A monoclonal antibody that recognizes a potential coeliac-toxic repetitive pentapeptide epitope in gliadins). Eur J Gastroenterol Hepatol. 13, 1189-1193 (2001).
- Pinheiro, J. C., Bates, D. M., Chambers, J. Ch. 5. Mixed-Effects Models in S and S-PLUS. 5, 206-225 (2000).
- Mougenot, A. L., et al. Production of a monoclonal antibody, against human alpha-synuclein, in a subpopulation of C57BL/6J mice, presenting a deletion of the alpha-synuclein locus. J Neruosci Meth. 192, 268-276 (2010).
- Specht, C. G., Schoepfer, R. Deletion of the alpha-synuclein locus in a subpopulation of C57BL/6J inbred mice. BMC Neurosci. 2, 11 (2001).
- Lee, B. R., Matsuo, Y., Cashikar, A. G., Kamitani, T. Role of Ser129 phosphorylation of alpha-synuclein in melanoma cells. J Cell Sci. 126, 696-704 (2013).
- Perrin, R. J., et al. Epitope mapping and specificity of the anti-alpha-synuclein monoclonal antibody Syn-1 in mouse brain and cultured cell lines. Neurosci Lett. 349, 133-135 (2003).
- Emmanouilidou, E., et al. Assessment of alpha-synuclein secretion in mouse and human brain parenchyma. PLoS One. 6, e22225 (2011).
- Mougenot, A. L., et al. Transmission of prion strains in a transgenic mouse models overexpressing human A53T mutated alpha-synuclein. J Neuropathol Exp Neurol. 70, 377-385 (2011).
- Foulds, P. G., et al. A longitudinal study on alpha-synuclein in blood plasma as a biomarker for Parkinson's disease. Sci Rep. 3, 2540 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved