Method Article
Détection de α-synucléine maladie associée par ELISA renforcée dans le cerveau de souris transgéniques surexprimant A53T humaine mutée α-synucléine
Dans cet article
Résumé
An ELISA offering a novel quantitative approach is described. It specifically detects disease-associated α-synuclein (αSD) in a transgenic mouse model (M83) of synucleinopathy using several antibodies against either the Ser129 phosphorylated αS form or the C-terminal part of the protein.
Résumé
En plus des méthodes établies comme Western blot, de nouvelles méthodes sont nécessaires pour quantifier rapidement et facilement associé à une maladie α-synucléine (aS D) dans des modèles expérimentaux de synucléopathies. Une lignée de souris transgéniques (M83) sur-exprimant les aS de A53T humaines et développer spontanément un phénotype clinique dramatique entre huit et 22 mois d'âge, caractérisées par des symptômes tels que la perte de poids, une prostration, et sévère déficience motrice, a été utilisé dans cette étude. Pour les analyses moléculaires de aS D (aS associée à la maladie) chez ces souris, un test ELISA a été conçu pour quantifier spécifiquement aS D chez des souris malades. L'analyse du système nerveux central dans ce modèle de souris a montré la présence de D aS principalement dans les régions du cerveau et caudale de la moelle épinière. Il n'y avait pas de différences dans la distribution aS D entre différentes conditions expérimentales conduisant à la maladie clinique, à savoir, dans uninoculATED et le vieillissement normalement souris transgéniques et des souris inoculées avec des extraits de cerveau de souris malades. La détection spécifique de aS D immunoréactivité en utilisant un anticorps contre Ser129 phosphorylé aS par ELISA essentiellement en corrélation avec celle obtenue par transfert de Western et immunohistochimie. De façon inattendue, des résultats similaires ont été observés avec d'autres anticorps dirigés contre la partie C-terminale de aS. La propagation de aS D, suggérant l'implication d'un mécanisme de «prion-like", peut donc être facilement contrôlée et quantifiée dans ce modèle de souris en utilisant une approche ELISA.
Introduction
Most current methods for detecting disease-associated α-synuclein (αSD) in experimental models of Parkinson's disease (PD), such as immunohistochemistry or Western blot, are time-consuming and not quantitative. This neurodegenerative disease is characterized by alpha-synuclein aggregation mainly in the form of inclusions containing an aggregated form of the normally soluble presynaptic protein αS1,2 (Lewy bodies and Lewy neurites). Normally only marginally phosphorylated, αS is hyperphosphorylated at its serine 129 residue in these inclusions3 and can be monitored by antibodies specifically directed against Ser129 phosphorylated αS, thus providing a reliable marker of the pathology.
Recent research suggests that a “prion-like” mechanism could be involved in the propagation of αS aggregation within the nervous system of an affected patient4,5. These studies reported the acceleration of a synucleinopathy by inoculating brain extracts containing αSD into a transgenic mouse model (M83) expressing an A53T mutated human αS protein associated with a severe motor impairment occurring as the mice age6. In the same manner, intra-cerebral inoculation of aggregated recombinant αS in the same M83 mouse model confirmed the acceleration of aggregation5. The induction of deposits of phosphorylated αS has also been reported after inoculation of C57Bl/6 wild-type mice with either fibrillar recombinant αS or brain extracts from human DLB patients7,8. Sacino et al.9 recently pointed out that after injection of fibrillar human αS, a widespread and progressive cerebral αS inclusion formation could be induced in M83 mice, but not in E46K transgenic mice or non-transgenic mice in which induced αS inclusions were transient, and mainly restricted to the site of injection. Recent studies on monkeys confirmed propagation of αS aggregates after inoculation of PD-derived extracts in species closer to humans10.
The link between αS alterations and Parkinson’s disease suggest that αSD is a potential biomarker for Parkinson’s disease11. A recent study showed the detection of oligomeric soluble aggregates of α-synuclein in human cerebro-spinal fluid (CSF) and plasma as a potential biomarker for Parkinson’s disease based on a conventional sandwich system ELISA using the same antibody to capture and detect αS12. Based on the same method, multimeric proteins were recognized in biological samples, including the brain, because there are multiple copies of epitopes present in the assembled forms13. Very recently, pathological αS in the CSF of patients with a proven Lewy body pathology was detected using both an ELISA kit with a highly specific antibody against αSD (5G4) and an immunoprecipitation assay14. These methods could differentiate patients with PD/DLB from other types of dementia.
The “prion-like” propagation of αS aggregation was further studied in transgenic mouse model M83 using an ELISA approach that was designed to specifically identify αSD15. In this study, we report the detailed ELISA protocol used to quantitatively detect αSD in sick mice (whether or not inoculated with αSD from sick M83 mice) and more especially in the brain regions specifically targeted by the pathological process in this M83 transgenic mouse model4.
Protocole
Toutes les procédures et protocoles impliquant des animaux ont été conformément à la directive CE 86/609 / CEE du Conseil et ratifiée par Cometh, le comité national français pour l'examen de l'éthique dans l'expérimentation animale (protocole 11-0043). Les animaux ont été logés et soignés dans l'Anses approuvé d'installations expérimentales à Lyon (approbation B 69387 0801).
1. Préparation des souris
- Euthanasier souris par une injection intraperitoneale de dose létale de pentobarbital de sodium.
- Récupérer l'ensemble du cerveau de crâne de la souris et le placer dans une boîte de Petri en plastique de 35 mm sur la glace jusqu'à l'extraction.
- Extraire la moelle épinière cervicale.
REMARQUE: aS d'extrait soit à partir de l'une des moitiés du cerveau après sectionnement sagittal ou de cerveaux de souris disséquées, disponible après les expériences énumérées dans le tableau 1.
| Experiment | Souris Inoculum (cerveau équivalent) | Période de survie (Dpi) | Median / survie maximale (vieux jours) | aS détection de d par ELISA / WB / IHC |
| 1 | Souris inoculées | 441 ± 166 | 419/736 | 8/8 |
| 2 | Souris inoculées (0,2 mg) | 150 ± 52 | 140/241 | 9/9 |
Tableau 1. Liste des expériences réalisées sur des souris M83. Les inoculations ont été réalisées à 6 semaines pour l'expérience 2 dans la zone de striato-corticale avec 20 ul d'un homogénat de cerveau de souris malade (1% poids / volume dans du glucose 5%), à la suite anesthésie de six semaines vieilles souris M83 homozygotes de 3% inhalation isoflurane. dpi: jours après inoculation.
2. aS Extraction de Brain moitiés
- Sagittalement coupé le cerveau pour obtenir deux moitiés. Peser chaque moitié dans un tube contenant ribolysis boulets de broyage.
- Préparer High Salt (HS) un tampon contenant 50 mM Tris-HCl, pH 7,5, NaCl 750 mM, EDTA 5 mM, DTT 1 mM, 1% phosphatase et inhibiteurs de protéase cocktails. Ajouter tampon sel élevée aux moitiés du cerveau pour obtenir 20% (poids / volume) homogénats.
- Préparer les échantillons provenant des moitiés du cerveau à l'aide d'un homogénéiseur mécanique à 6,0 m / s pendant 23 sec deux fois. Après la première homogénéisation de 23 sec, placer les tubes contenant les homogénats sur de la glace pendant 2 minutes avant le second cycle de 23 sec.
- Centrifuger les échantillons à 1000 g pendant 5 min pour éliminer les fragments de cerveau non broyées. Récupérer les surnageants, diviser en 200 aliquotes et les conserver à -80 ° C pour analyse ultérieure ELISA.
3. aS Extraction de disséqués régions cérébrales
- Disséquer unensemble du cerveau dans une boîte de Petri en plastique de 35 mm sur la glace avec une loupe de faible puissance (8X grossissement) en utilisant deux forcipes dont les extrémités sont maintenues ensemble sauf lorsque disséquer l'hippocampe. Ne pas dépasser 10 min pour préserver l'intégrité du cerveau. Placez le côté droit du cerveau et récupérer les régions du cerveau suivants dans cet ordre:
- Séparé des deux bulbes olfactifs aide de pinces placées juste derrière l'ampoule. Détacher du cerveau par un mouvement vers le bas. Répétez cette opération pour la deuxième ampoule.
- Caler doucement la pince entre les deux cortex et le déplacer vers l'avant pour faciliter la dissociation des deux cortex. Garder le cerveau en place avec une pince, utiliser un autre pour séparer le cortex de l'hippocampe.
- Placez la pince 2 mm en dessous du cortex. Maintenir une légère pression sur la pince jusqu'à ce que le haut de l'hippocampe est visible. Décoller la première partie du cortex, et répéter avec la deuxième partie. Utilisez la pince pour séparer les deux cortexà partir de l'hippocampe et le déplacement vers l'avant du cerveau.
- Placez la pince ouverte autour de l'un des hippocampes. Fermez la pince au bas de l'hippocampe, puis retirez-le délicatement, récupérer autant que possible. Répétez la procédure pour la deuxième hippocampe.
- Positionner les pinces ouvertes en dessous de la striata une douceur et le séparer du cerveau. Utilisez la pince pour enlever tout le cortex restant dans le striatum. Répétez cette procédure pour le deuxième striatum.
- Utiliser la pince pour abaisser doucement par 2 mm le contour du cervelet pour faciliter la séparation du cervelet de cerveau. Placez la pince juste derrière le cervelet et le retirer en déplaçant la pince avant.
- Utilisez la partie large de la pince à élever le mésencéphale afin de voir clairement où il rejoint le tronc cérébral. Faire une incision verticale à la jonction puis retirez le tronc cérébral.
- Placez la pince derrière le mésencéphale, qui is composé de quatre structures arrondies. Inciser verticalement jusqu'à ce que le mésencéphale a été complètement séparé du cerveau restant.
- Préparation des homogénats de variable% (poids / volume) dans du tampon HS, en fonction de la quantité de tissus disponibles, à savoir, 5% d'homogénat pour un poids compris entre 10 et 30 mg, 10% pour un poids compris entre 30 et 80 mg, et 20% pour un poids de plus de 80 mg.
- Ajouter un volume suffisant de tampon HS aux régions du cerveau disséqués pour obtenir le% d'homogénat attendu.
- Vortex et vérifier que les tissus sont totalement immergés dans la mémoire tampon de HS.
- Homogénéiser les échantillons préparés à partir des régions du cerveau disséqués ou la moelle épinière cervicale avec un broyeur de tissu composée d'un tube en verre de borosilicate et deux pilons, A et B.
- Pour chaque région du cerveau d'être écrasé directement dans le tube. Un pilon insérer dans le tube et rétracter. Répétez ce mouvement une dizaine de fois pour dissocier le tissu. Ensuite, utilisez un pilon B à Continuer en broyant le tissu avec 20 autres mouvements. Transférer les homogénats dans un tube de 1,5 ml avec une pipette de transfert de 1 ml.
- Centrifuger les échantillons à 1000 g pendant 5 min à 4 ° C pour éliminer tous les fragments de cerveau non broyées. Récupérer les surnageants, les diviser dans 200 aliquotes et les conserver à -80 ° C pour analyse ultérieure ELISA.
4. Détection par ELISA de aS
- Diluer les anticorps de revêtement à 0,01 ng / ml. Utilisez soit anti-aS polyclonaux de lapin ou de l'anticorps monoclonal clone 42 mM Na 2 CO 3 / tampon NaHCO3 50 (pH 9,6).
- Enduire le microplaques de 96 puits avec 100 pi par puits de cette solution de revêtement, et laisser à 4 ° CO / N. Utilisation de l'anticorps polyclonal de lapin anti-aS dans la solution de revêtement pour ELISA en utilisant des anticorps de détection syn514, clone 42, LB509, AS11, 4D6 ou 8A5. Utilisez la aS monoclonal anti-clone 42 d'anticorps en tant que solution de revêtementen combinaison avec l'anticorps de détection de l'anti-pSer129.
NOTE: Si nécessaire, les plaques peuvent être conservées à 4 ° C pendant une semaine avant le test ELISA est effectuée. - Utiliser un laveur de plaques pour laver les plaques cinq fois avec 300 ul de solution saline tamponnée au phosphate avec 0,05% de Tween 20 (PBST) par puits. De cette étape en avant, l'incubation est à température ambiante.
- Ajouter 200 pi de T20 tampon PBS par puits de blocage. Agiter pendant 1 heure à 150 tours par minute. Laver les plaques cinq fois avec du PBST.
- Diluer les homogénats de cerveau (dilution de 1: 100 des 20% homogénats, 01:50 10% des broyats et 01h25 des broyats de 5% dans PBST BSA 1%), et ajouter 100 ul à chaque puits. Puis incuber pendant 2 heures tout en agitant à 150 tpm. Laver les plaques cinq fois avec du PBST.
- Ajouter les différents anticorps de détection aS en PBS avec de la BSA 1% aux dilutions mentionnées dans la liste des matériaux. Incuber pendant 1 heure à 150 tours par minute. Laver les plaques cinq fois avec du PBST.
- Ajouter soit anti--mouse ou anti-lapin conjugués IgG HRP dilué à 1: 8000 dans du PBST complété avec de la BSA 1% pendant 1 heure en agitant à 150 tpm. Laver les plaques cinq fois avec du PBST.
- Ajouter 100 pi de 3,3 ', 5,5'-tétraméthylbenzidine (TMB) à chaque puits et incuber pendant 15 min dans l'obscurité tout en agitant à 150 tpm.
- Arrêter la réaction en ajoutant 100 pi de HCl 1 N par puits puis mesurer l'absorbance à 450 nm avec le lecteur de microplaques.
- Pour l'analyse des données, il faut soustraire la valeur de DO obtenue dans un puits avec tous les réactifs à l'exception des échantillons de cerveau de la souris (de puits vierge) à partir des valeurs de DO mesurées pour chacun des échantillons analysés.
5. Epitope Mapping
- Effectuer la cartographie d'épitopes selon la méthode décrite par Osman 16. En bref, les peptides spot de la séquence α-synucléine humaine contenant 12 acides aminés sur nitrocellulose avec 10 acides aminés qui se chevauchent.
- Bloc avec Tris 50 mM / NaCl 150 mM tampon à pH 10 contenant 0,05% de Tween 20 et 5% de lait en poudre. Incuber l'anticorps dans une solution de blocage à une concentration de 2 ug d'anticorps par ml à 2-10 ° CO / N.
- Laver la membrane trois fois avec du Tris 50 mM / NaCl 150 mM tampon pH 10 contenant 0,05% de Tween 20. Incuber avec l'anticorps de chèvre anti-IgG de souris conjugué à HRP. Laver la membrane cinq fois en utilisant le même tampon puis tache en utilisant un kit de coloration blot TMB occidentale.
6. Analyse statistique
- Utilisez le logiciel de R et nlme pour effectuer des régressions à effets mixtes pour modéliser OD. Pour chaque comparaison, effectuez un modèle d'effet de régression mixte. Utilisez un effet fixe de distinguer symptomatique des groupes asymptomatiques.
- Utilisez un effet aléatoire pour refléter la variabilité des répétitions pour une souris donnée. Vérifiez homoscédasticité en examinant les résidus et, si nécessaire, utiliser les fonctions de la variance pour modéliser la structure de variance des erreurs au sein des groupes en accord avec Pinheiro et Bates 17. Réglez 0,05 comme seuil de signification de P.
Résultats
Dans cette étude, les tests ELISA utilisés spécifiquement identifiés aS associées à des maladies (aS D) dans des homogénats de cerveau préparés dans un tampon de sel élevée de souris M83 malades. En utilisant un anticorps reconnaissant spécifiquement pSer129 aS (p = 0,0074), l'ELISA distingue facilement vieux, souris malades (> 8 mois) à partir de jeunes (2-5 mois), les souris M83 sains (Figure 1). Plusieurs autres anticorps ont montré des signaux aussi élevés (> 0,6 OD) que dans les homogénats de cerveau de souris malades. Tel est le cas pour 4D6 (p = 0,01), LB509 (p = 0,0047) et 8A5 (p <0,001) par rapport à des séquences différentes de la partie C-terminale de la protéine (124-134, 115-122, 129-140 et respectivement) et, dans une moindre mesure, syn514 contre l'extrémité N-terminale (2-12) de la protéine (p = 0,0003). En outre, l'anticorps monoclonal produit AS11 dans notre laboratoire contre aS humains recombinants fibrillaires 18 après l'immunisation de souris C57BL / B6 6S (aS-19 nulles)souris avec une deletion du locus α-syn, a montré de façon similaire des signaux élevés (p <0,01) que dans des homogénats de cerveau de souris malades. Cet anticorps a été montré à présent à reconnaître la séquence (P) VDPDNEAY amino-acide (E) de aS, correspondant à la séquence de α-synucléine humaine 118-125.
En revanche, dans ces conditions expérimentales, les analyses des homogénats de cerveau avec l'anticorps de détection dirigé contre le clone 42 d'une région centrale de α-synucléine (91-96 séquence), a montré un signal très faible pour les deux souris M83 malades et sains. Il ne pouvait pas distinguer les deux populations de souris (p = 0,1158). Jeunes souris M83 néanmoins montré une immunoréactivité plus élevé que les souris non transgéniques B6C3H (M83 de la ligne de fond génétique). Le contraste était encore plus grande avec des souris C57BL / 6 S (aS-B6 nulles) des souris, qui ont un locus α-syn supprimé. Cela suggère que la légère immunoréactivité chez la souris M83 correspond à la détection de signal bas de aS normales. Le Asensibilité nalytical de ce test ELISA a été évaluée par rapport à une décrit précédemment Western méthode de transfert 4 pour la détection d'insoluble Ser129 phosphorylé α-synucléine, en examinant, en utilisant les deux tests ELISA et les méthodes de transfert de Western, des dilutions en série des homogénats de cerveau préparés à partir de la même M83 malade cerveau de souris (Figure 2). Approximatives 10 pg équivalents cérébrales étaient suffisants pour obtenir un signal positif ELISA pour le broyât de cerveau de cette souris malades, à la fois avec LB509 et des anticorps PSer129. Au contraire, au moins 200 ug d'équivalents du cerveau ont été nécessaires pour détecter pSer129 aS dans la fraction insoluble dans le sarkosyl analysés par buvardage de Western en utilisant le même anticorps PSer129 15. Ceci indique que le test ELISA a une sensibilité analytique quelques 20 fois celle de la méthode Western blot.
Chez les souris malades et vieux M83 (figure 3A), homogénats de cerveau du mésencéphale, le tronc cérébral et la moelle épinière de sho Mer marqué immunoréactivité avec deux LB509 et des anticorps PSer129 dans l'ELISA. Toutefois, aucune immunoréactivité détectable n'a été observée dans les autres régions du cerveau, y compris le bulbe olfactif, le cortex cérébral, le striatum, l'hippocampe, le thalamus et de l'hypothalamus. Le test ELISA a donné un signal faible pour le cervelet. L'immunoréactivité dans les différentes régions du cerveau de souris M83 développer une maladie clinique accélérée suite à l'injection d'un extrait de cerveau d'un malade M83 souris 4 (figure 3B) était indiscernable de celle observée dans âgés (> 8 mois) non inoculé des souris M83. Ces résultats sont pleinement cohérents avec ceux obtenus par Western blot (figure 3C) et immunohistochimie 15, montrant une plus grande dépôt de Ser129 α-synucléine dans les régions caudales du cerveau et la moelle épinière.
/52752/52752fig1highres.jpg "Width =" 700 "/>
Figure 1. La détection ELISA de la maladie associée à α-synucléine (aS D) dans des homogénats entiers de cerveau de souris M83. Le lapin ELISA combinant anti-aS polyclonaux (revêtement) avec syn514, LB509, AS11, 4D6, 8A5 (détection) ou clone 42 (revêtement) avec anti-pSer129 aS (PSer129) (détection) anticorps distinguer les souris malades de souris M83 sains, tandis ELISA anti-aS polyclonaux de lapin (revêtement) / clone42 (détection) ne fonctionne pas. Les six malades, vieilles souris M83 âgés de 11 à 16 mois a montré des signes de immunoréactivité avec les anticorps anti-α-syn (sauf clone 42 anticorps). Ce ne fut pas le cas ni pour les six jeunes, des souris en bonne santé âgés de 2 à 5 mois, ou avec les commandes supplémentaires, y compris B6C3H (fond génétique de souris M83) ou de souris aS-nuls B6. Les barres d'erreur représentent SD modification de Bétemps 15.
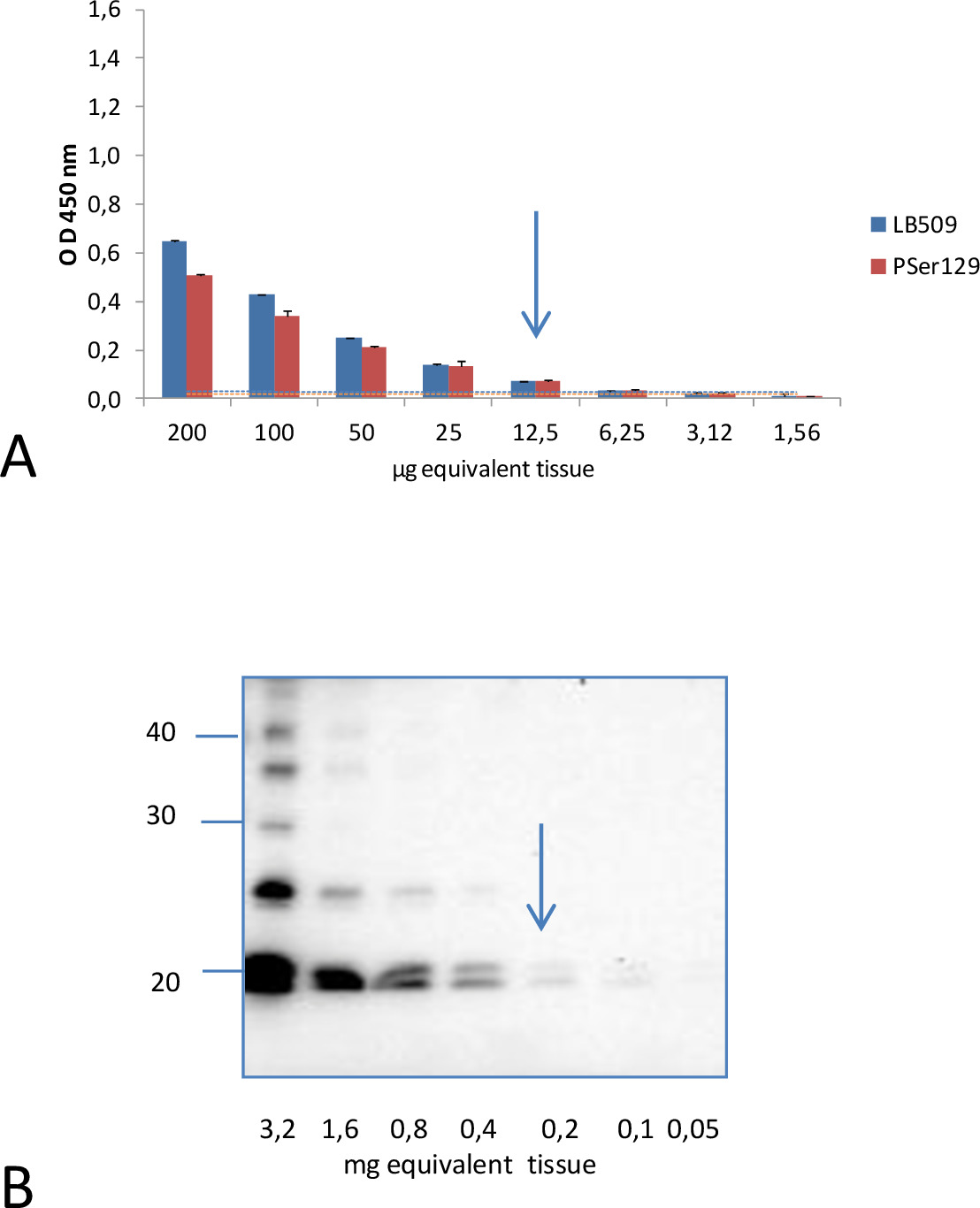
Figure 2. Comparaison de la sensibilité analytique de détection de aS D par ELISA et Western blot. A. Un signal positif a été obtenu avec ELISA pour 12,5 ug équivalents cérébrales à la fois des anticorps et LB509 PSer129 de dilutions doubles des homogénats de cerveau d'un malade souris. Le niveau de coupure estimée pour la discrimination des souris malades et sains, correspondant aux moyens obtenus à partir d'échantillons de souris M83 sains pendant trois à six répétitions de ELISA mesures + 3 écarts-types, étaient 0,030 et 0,020 pour LB509 et anticorps de détection PSer129 respectivement . Ils sont présentés comme une ligne dans la même couleur que celle utilisée pour chacun des anticorps. B. Par analyse par Western blot des fractions insolubles obtenus après ultracentrifugation dans la présenBureau du Sarkosyl, 200 ug d'équivalents du cerveau ont été nécessaires pour détecter aS D avec le même anticorps PSer129. Marqueurs de poids moléculaire (en kDa) sont indiqués à gauche de la tache. Reproduit avec la permission de Bétemps 15.

Figure 3. La détection d'une maladie associée α-synucléine (aS D) dans différentes régions du cerveau de souris M83 par ELISA et Western blot. ELISA identifié aS D avec PSer129 ou LB509 anticorps de détection chez la souris M83 au cours du vieillissement normal (A) (n = 1, 4 répétitions, moyenne ± SD) ou après l'inoculation des souris M83 âgées de 6 semaines avec un homogénat de cerveau d'un M83 malades ( B) (n = 1, 4 répétitions, moyenne ± écart type). (C) aS D a été identifié par Western éponger avec la détection d'anticorps PSer129 EP1536Y dans les mêmes régions neuro-anatomique souris inoculées avec un homogénat de cerveau d'un malade M83 souris. Marqueurs de poids moléculaire (en kDa) sont indiqués sur la gauche du panneau C. quantités égales de protéines totales ont été utilisés dans chaque ligne pour le chargement équivalent sur gel. Les huit régions suivantes neuro-anatomique de souris M83 malades ont été testés: OB: bulbe olfactif, Cx: cortex cérébral, Salut: hippocampe, St: striatum, Me: mésencéphale, Cb: cervelet, BS: tronc cérébral, SC: moelle épinière cervicale . Modifié à partir de 15 Bétemps.
Discussion
L'utilisation d'un test ELISA a été démontrée pour détecter spécifiquement aS D directement à partir d'homogénats de cerveau de souris au cours de la maladie dans le modèle de souris transgénique M83. En effet, cet ELISA pouvait facilement distinguer les souris malades de souris M83 M83 sains en utilisant des homogénats de cerveau ne entiers dans un tampon de sel élevée.
Les étapes les plus critiques pour de bons résultats à l'aide de cet ELISA sont: disséquer correctement les différentes régions du cerveau de souris en développant la dextérité manuelle nécessaire pour empêcher des dommages lors de la dissection; effectuer la dilution des échantillons exclusivement dans un tampon HS; et le choix des anticorps, parce que tous les anticorps non travaillera dans un format ELISA.
Une certaine variabilité dans les niveaux D aS était néanmoins apparente entre différentes souris. Ces résultats sont équivalents à la détection par Western blot de le modèle typique aS D uniquement détecté chez la souris M83 malades par l'examen du Sarkosyl fractions insolubles après la détection avec un anticorps dirigé contre Ser129 phosphorylé aS 15. Ceci démontre que l'immunoréactivité ELISA correspond à la détection spécifique de D aS.
En accord avec l'analyse par transfert de Western précédent 15, ce ELISA a détecté une immunoréactivité après dissection du cerveau des souris malades M83 dans les parties caudale du cerveau, à savoir, le mésencéphale et le tronc cérébral, ainsi que dans la moelle épinière cervicale. Aucune immunoréactivité a été détectée dans le bulbe olfactif, le cortex cérébral, le striatum ou l'hippocampe, en accord avec les données précédentes indiquant que l'hippocampe a été épargné par le processus pathologique 6, sauf à de très faibles niveaux dans le cas des souris qui avaient été inoculées par fibrillaire alpha synucléine dans l'hippocampe 15. La répartition des aS D est ainsi apparu, quelles que soient les conditions expérimentales globales remarquablement uniformes, qui included navigateur vieillissement normal de souris ou accéléré le développement de la maladie après inoculation intra-cérébrale de homogénats de cerveau de souris malades M83.
En outre, la performance du test est meilleur que le procédé de transfert de Western décrit précédemment. La sensibilité analytique du test ELISA est apparu plus élevée, comme le montrent les limites de détection obtenues dans cet essai en utilisant des dilutions en série d'un homogénat de cerveau d'une souris malades M83 (12,5 ug à 200 ug vs ELISA pour le dosage par transfert de Western). La sensibilité de l'ELISA est restée cependant inférieure à celle de la détection immunohistochimique, qui détecte aS D dans des cellules individuelles et dans les régions cérébrales frontales telles que le cortex cérébral 15. La sensibilité du test peut néanmoins être encore améliorée en utilisant des anticorps et / ou des systèmes de détection optimisées, telles que la détection de chimioluminescence comme décrit précédemment 13.
C'est importantà noter que plusieurs autres anticorps reconnaissant d'autres formes de la protéine, et en particulier une forme non phosphorylée (détecté avec l'anticorps monoclonal 4D6 20) a donné des résultats similaires en utilisant ces ELISA, en plus de l'anticorps monoclonal reconnaissant spécifiquement pSer129 aS. Cette approche ELISA a également révélé immunoréactivité avec des anticorps reconnaissant spécifiquement humaines aS (LB509) et, dans une bien moindre mesure, aS de souris (de D37A6) dans les mêmes animaux malades et / ou régions du cerveau de souris malades 15. D'autre part, aucune immunoréactivité n'a été observée par analyse ELISA de la souris malades M83 en utilisant l'anticorps clone 42 contre une zone centrale de aS (91-96) 21,22, ce qui correspond à un epitope qui peut être crypté dans ces conditions ELISA. Ce format ELISA pourrait détecter dans les cerveaux de souris M83 deux phosphorylés Ser129 aS, comme observé par Foulds 11 dans le plasma humain, et non phosphorylé, éventuellement formes oligomériques, comme décrit dans l'humun plasma et le liquide céphalorachidien 12,14. Contrairement ELISA publiées précédemment, notre format ELISA utilisé ni le même anticorps dans la capture et la détection pour détecter la forme d'oligomères aS, ni anticorps connus pour être de conformation, comme l'anticorps 5G4 utilisé dans les études de Unterberger.
Contrairement à la méthode de Western blot précédemment utilisé pour détecter aS D dans des homogénats de cerveau de souris M83 4, le test ELISA n'a pas besoin d'une étape de concentration, par exemple par ultracentrifugation avec Sarkosyl à détecter la protéine associée à la maladie 23. aS associés à la maladie a été précédemment identifiées chez la souris M83 par extraction séquentielle en utilisant des tampons de 2,6 en augmentant la force. D'un point de vue pratique, cette analyse quantitative permet d'économiser beaucoup de temps et réactifs par rapport à la procédure de transfert de Western.
Dans cette étude, aS détaillées analyses moléculaires en utilisant une approche ELISA ont permis dequantifier facilement l'immunoréactivité avec des anticorps différents chez les souris malades M83. Il pourrait faire la lumière sur les mécanismes moléculaires impliqués dans l'agrégation aS cours synucléinopathies à partir d'un point de vue quantitatif. Cette approche ELISA pourrait donc servir de base à un outil rapide et facile à détecter aS D dans divers échantillons biologiques avec un marqueur fiable de la pathologie comme Ser129 aS phosphorylés qui Foulds 11 croit montre plus prometteur en tant que marqueur diagnostique que la non-phosphorylée protéine. Récemment, il a souligné le fait que les mesures de aS totaux ou éventuellement de aS non phosphorylés pourraient être utilisés comme un marqueur de substitution pour la progression de la maladie dans la MP, que le niveau de aS totales tend à augmenter au fil du temps après l'apparition des premiers symptômes 24 .
Déclarations de divulgation
The authors have no competing interests to disclose.
Remerciements
Les auteurs tiennent à remercier Damien Gaillard pour inoculations et le suivi de l'expérimentation animale. Ce travail a été soutenu par l'Anses (Agence française pour l'alimentation, l'environnement et la santé et sécurité au travail) et par une subvention de la Fondation France Parkinson.
matériels
| Name | Company | Catalog Number | Comments |
| LB509 | Abcam | ab27766 | Detection antibody 1/2,000 |
| AS11 | Produced at Anses | Detection antibody 1/1,000 | |
| 4D6 | Abcam | ab1903 | Detection antibody 1/2,000 |
| PSer129 | Abcam | ab59264 | Detection antibody 1/3,000 |
| PSer129 EP1536Y | Abcam | ab51253 | Detection antibody 1/1,000 |
| syn514 | Abcam | ab24717 | Detection antibody 1/500 |
| clone 42 | BD Biosciences | 610787 | Coating and detection antibody (1/2,000) |
| 8A5 | Provided by Dr. Anderson | Detection antibody 1/2,000 | |
| polyclonal anti-αsyn antibody | Millipore | AB5038P | Coating antibody |
| Anti-mouse IgG HRP conjugate | Southern Biotech | 1010-05 | |
| Anti-rabbit IgG HRP conjugate | Southern Biotech | 4010-05 | |
| Goat anti-mouse IgG HRP conjugate | Dianova | 115-035-164 | |
| HS buffer | Adjust at pH 7.5 and keep at 4 °C | ||
| Euromedex | 26-128-3094-B | |
| Euromedex | 1112-A | |
| Euromedex | EU0007-B | |
| Sigma | 43815 | |
| PBS | Adjust at pH 7.5 | ||
| Euromedex | 1309 | |
| Euromedex | 2018 | |
| Euromedex | 1112-A | |
| Euromedex | P017 | |
| Tween 20 | Euromedex | 2001-C | |
| BSA | Sigma | A7906 | |
| DTT 1 mM | Sigma | 43815 | Stock solution 100 mM, toxic |
| 1% phosphatase cocktail | Pierce | 78428 | |
| 1% protease inhibitor cocktail | Roche | 04 693 132 001 | 50x concentrated |
| Microplate MaxiSorpTM | Thermo Scientific | 442404 | |
| Tampon carbonate 50 mM pH 9.6 | |||
| Sigma | 71360 | 2.86 g/L |
| Merk | 6329 | 3.36 g/L, pH 9.6 |
| Superblock T20 PBS blocking buffer | Pierce | E6423H | 10x concentrated |
| TMB | Sigma | T0440 | Used for ELISA |
| TMB | Analytik Jena AG | 847-0104200302 | Used for epitope mapping |
| HCl 1 N | Chimie plus | 40030 | |
| Ribolyser | Thermo | Fast prep FP120 | keep on ice at this step |
| Grinding tubes | Biorad | 355-1197 | |
| Plate washer | Tecan | Columbus Pro | |
| Plate reader | Biorad | Model 680 | |
| Low power magnifier | VWR | 630-1062 | 8X magnification |
| Forceps Dumont#7 | WPI | 14097 | For dissection steps |
| Transfer pipette 1ml Samso | Samso | 043231 | |
| 1.5 ml tubes | Dutscher | 033290 | |
Références
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat Rev Neurol. 9, 13-24 (2013).
- Waxman, E. A., Giasson, B. I. Specificity and regulation of casein kinase-mediated phosphorylation of alpha-synuclein. J Neuropathol Exp Neurol. 67, 402-416 (2008).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Mougenot, A. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol Aging. 33, 2225-2228 (2012).
- Luk, K. C., et al. Intracerebral inoculation of pathological alpha-synuclein initiates a rapidly progressive neurodegenerative alpha-synucleinopathy in mice. J Exp Med. 209, 975-986 (2012).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34, 521-533 (2002).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological alpha-synuclein in brain. Brain : a journal of neurology. 136, 1128-1138 (2013).
- Sacino, A. N., et al. Amyloidogenic alpha-synuclein seeds do not invariably induce rapid, widespread pathology in mice. Acta neuropathologica. 127, 645-665 (2014).
- Recasens, A., et al. Lewy body extracts from parkinson's disease brains trigger alpha-synuclein pathology and neurodegeneration in mice and monkeys. Ann Neurol. , (2013).
- Foulds, P. G., et al. Phosphorylated alpha-synuclein can be detected in blood plasma and is potentially a useful biomarker for Parkinson's disease. FASEB J. 25, 4127-4137 (2011).
- El-Agnaf, O. M., et al. Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson's disease. Faseb J. 20, 419-425 (2006).
- Lee, H. J., et al. Enzyme-linked immunosorbent assays for alpha-synuclein with species and multimeric state specificities. J Neruosci Meth. 199, 249-257 (2011).
- Unterberger, U., et al. Detection of disease-associated alpha-synuclein in the cerebrospinal fluid: a feasibility study. Clin Neuropathol. 33, 329-334 (2014).
- Betemps, D., et al. Alpha-synuclein spreading in M83 mice brain revealed by detection of pathological alpha-synuclein by enhanced ELISA. Acta Neuropathol. (Berl). 2, 29 (2014).
- Osman, A. A., et al. A monoclonal antibody that recognizes a potential coeliac-toxic repetitive pentapeptide epitope in gliadins). Eur J Gastroenterol Hepatol. 13, 1189-1193 (2001).
- Pinheiro, J. C., Bates, D. M., Chambers, J. Ch. 5. Mixed-Effects Models in S and S-PLUS. 5, 206-225 (2000).
- Mougenot, A. L., et al. Production of a monoclonal antibody, against human alpha-synuclein, in a subpopulation of C57BL/6J mice, presenting a deletion of the alpha-synuclein locus. J Neruosci Meth. 192, 268-276 (2010).
- Specht, C. G., Schoepfer, R. Deletion of the alpha-synuclein locus in a subpopulation of C57BL/6J inbred mice. BMC Neurosci. 2, 11 (2001).
- Lee, B. R., Matsuo, Y., Cashikar, A. G., Kamitani, T. Role of Ser129 phosphorylation of alpha-synuclein in melanoma cells. J Cell Sci. 126, 696-704 (2013).
- Perrin, R. J., et al. Epitope mapping and specificity of the anti-alpha-synuclein monoclonal antibody Syn-1 in mouse brain and cultured cell lines. Neurosci Lett. 349, 133-135 (2003).
- Emmanouilidou, E., et al. Assessment of alpha-synuclein secretion in mouse and human brain parenchyma. PLoS One. 6, e22225 (2011).
- Mougenot, A. L., et al. Transmission of prion strains in a transgenic mouse models overexpressing human A53T mutated alpha-synuclein. J Neuropathol Exp Neurol. 70, 377-385 (2011).
- Foulds, P. G., et al. A longitudinal study on alpha-synuclein in blood plasma as a biomarker for Parkinson's disease. Sci Rep. 3, 2540 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon