Method Article
发现疾病相关的α突触核蛋白通过增强ELISA在转基因小鼠表达人A53T的突变脑α突触核蛋白
摘要
An ELISA offering a novel quantitative approach is described. It specifically detects disease-associated α-synuclein (αSD) in a transgenic mouse model (M83) of synucleinopathy using several antibodies against either the Ser129 phosphorylated αS form or the C-terminal part of the protein.
摘要
除了 像Western印迹确定的方法,需要新的方法来快速并容易地量化疾病相关α突触核蛋白(αSD)在突触核蛋白病的实验模型。转基因小鼠线(M83)过表达人类A53TαS和自发发展8和22个月的年龄,特点是症状包括体重下降,虚脱,和严重运动功能障碍之间的戏剧性的临床表型,被用于这项研究。为αSD(疾病相关αS)在这些小鼠中的分子分析,将ELISA被设计成特异性量化αS中的D患病小鼠。中枢神经系统在该小鼠模型的分析表明αSD的存在主要是在尾部脑区域和脊髓。有不同的实验条件之间αS 二维分布无显着差异,导致临床疾病, 即在uninoculated和正常老化的转基因小鼠在接种与患病小鼠大脑提取物的小鼠。的αSð使用免疫抗体对抗Ser129的特异性检测磷酸化ELISAαS与Western blot和免疫组化基本得到相关。出乎意料的是,类似的结果,观察对αS的C-末端部分的几个其它抗体。 αSD的传播,这表明了"朊病毒样"机制的参与,因此,可以容易地监测和定量用ELISA方法该小鼠模型。
引言
Most current methods for detecting disease-associated α-synuclein (αSD) in experimental models of Parkinson's disease (PD), such as immunohistochemistry or Western blot, are time-consuming and not quantitative. This neurodegenerative disease is characterized by alpha-synuclein aggregation mainly in the form of inclusions containing an aggregated form of the normally soluble presynaptic protein αS1,2 (Lewy bodies and Lewy neurites). Normally only marginally phosphorylated, αS is hyperphosphorylated at its serine 129 residue in these inclusions3 and can be monitored by antibodies specifically directed against Ser129 phosphorylated αS, thus providing a reliable marker of the pathology.
Recent research suggests that a “prion-like” mechanism could be involved in the propagation of αS aggregation within the nervous system of an affected patient4,5. These studies reported the acceleration of a synucleinopathy by inoculating brain extracts containing αSD into a transgenic mouse model (M83) expressing an A53T mutated human αS protein associated with a severe motor impairment occurring as the mice age6. In the same manner, intra-cerebral inoculation of aggregated recombinant αS in the same M83 mouse model confirmed the acceleration of aggregation5. The induction of deposits of phosphorylated αS has also been reported after inoculation of C57Bl/6 wild-type mice with either fibrillar recombinant αS or brain extracts from human DLB patients7,8. Sacino et al.9 recently pointed out that after injection of fibrillar human αS, a widespread and progressive cerebral αS inclusion formation could be induced in M83 mice, but not in E46K transgenic mice or non-transgenic mice in which induced αS inclusions were transient, and mainly restricted to the site of injection. Recent studies on monkeys confirmed propagation of αS aggregates after inoculation of PD-derived extracts in species closer to humans10.
The link between αS alterations and Parkinson’s disease suggest that αSD is a potential biomarker for Parkinson’s disease11. A recent study showed the detection of oligomeric soluble aggregates of α-synuclein in human cerebro-spinal fluid (CSF) and plasma as a potential biomarker for Parkinson’s disease based on a conventional sandwich system ELISA using the same antibody to capture and detect αS12. Based on the same method, multimeric proteins were recognized in biological samples, including the brain, because there are multiple copies of epitopes present in the assembled forms13. Very recently, pathological αS in the CSF of patients with a proven Lewy body pathology was detected using both an ELISA kit with a highly specific antibody against αSD (5G4) and an immunoprecipitation assay14. These methods could differentiate patients with PD/DLB from other types of dementia.
The “prion-like” propagation of αS aggregation was further studied in transgenic mouse model M83 using an ELISA approach that was designed to specifically identify αSD15. In this study, we report the detailed ELISA protocol used to quantitatively detect αSD in sick mice (whether or not inoculated with αSD from sick M83 mice) and more especially in the brain regions specifically targeted by the pathological process in this M83 transgenic mouse model4.
研究方案
所有的程序和涉及动物的协议是根据欧盟86/609 / EEC和来的时候,考虑在动物实验(协议11-0043)道德的法国国家委员会批准。动物饲养和照顾在ANSES的认可实验设施在里昂(许可B 69387 0801)。
1.准备小鼠
- 通过腹膜内注射致死剂量的戊巴比妥钠的安乐死的小鼠。
- 检索来自小鼠头盖骨的整个大脑,并放置在35毫米的塑料培养皿中在冰上直到萃取。
- 提取脊髓型颈椎病。
注 :提取αS无论是从一个接矢状切片或从解剖小鼠大脑脑半部,可在表1中列出的实验之后。
| ExperimenŤ | 老鼠 物(相当于大脑) | 生存期 (DPI) | 平均/最大生存 (天) | αS 三维检测用ELISA / WB / IHC |
| 1 | 未接种小鼠 | 441±166 | 七百三十六分之四百十九 | 8/8 |
| 2 | 接种小鼠(0.2毫克) | 150±52 | 241分之140 | 9/9 |
。预防接种在6个星期进行表1中的对M83小鼠进行的实验清单实验2中的纹状体-皮质区与20μl的患病小鼠的脑匀浆(1%重量/体积的葡萄糖5%),后6周龄纯合子小鼠M83异氟烷吸入3%麻醉。 DPI:天后inocul通货膨胀。
2.αS提取脑减半
- 矢状切开大脑,得到两半。每个重达半含磨球一个ribolysis管。
- 制备含有50mM Tris-盐酸,pH为7.5,750 mM氯化钠,5mM的EDTA,1mM的DTT,1%磷酸和蛋白酶抑制剂鸡尾酒高盐(HS)的缓冲器。添加高盐缓冲到大脑半部,以获得20%(重量/体积)匀浆。
- 制备从使用机械均化器大脑半部样品为6.0米/秒的23秒两次。前23秒均化之后,将包含第二23秒周期之前在冰上2分钟的匀浆管。
- 离心样品在1000×g离心5分钟以消除未磨制脑片段。回收上清液,分成200微升的等分试样,并保持在-80℃下用于随后的ELISA分析。
3.αS提取解剖脑区
- 解剖全脑在35毫米的塑料培养皿在冰上与使用两个forcipes的两端放在一起解剖海马时除外低倍放大镜(8倍放大)。不要超过10分钟,以保持大脑的完整性。将大脑右侧朝上和检索下列顺序的脑区:
- 使用置于仅次于灯泡镊子两个嗅球中单独之一。由向下运动的大脑分离。重复此操作,对于在第二灯泡。
- 轻轻楔镊子在两皮质之间并移动其转发到促进两个皮层解离。保持大脑到位与一种钳子,使用另一个皮层从海马中分离出来。
- 定位钳2毫米皮层下面。保持对钳子轻柔压力直到海马的顶部可见。剥离皮质的第一部分,并重复与第二部分。使用镊子分开的两个皮层起始于海马和移向大脑的前部。
- 围绕定位海马的一个开放的镊子。关闭钳在海马的底部,然后轻轻将其删除,恢复尽可能。重复该过程的第二个海马。
- 定位低于芨之一的开放镊子轻轻它从大脑中分离出来。使用镊子从纹状体删除任何剩余的皮质。重复此过程的第二纹状体。
- 使用镊子至2毫米的小脑的轮廓轻踏以有利于从大脑小脑的分离。将镊子仅次于小脑和通过移动镊子向前卸下。
- 使用镊子的宽部,以提高中脑,以便清楚地看到,它加入脑干。使在路口一纵切口,然后取出脑干。
- 定位钳脑后面,我Ş由四个圆形结构。切开垂直直到脑已完全从剩余的脑分离。
- 准备的变量%(重量/体积)中的HS缓冲器,这取决于可用的组织的量, 即,5%的匀浆为10至30毫克的重量,为30和80毫克之间的重量的10%,和20%匀浆对于高于80毫克的重量。
- 加入的HS缓冲区足够的容量来解剖大脑区域获得匀浆的预期%。
- 涡和检查组织被完全沉浸在HS缓冲区。
- 均匀化从解剖大脑区域或颈髓制备用组织研磨机硼硅玻璃管和两个杵,A和B组成的样品
- 倾每个大脑区域直接粉碎成管。将杵进管和收回它。重复此动作大约十倍以离解的组织。然后用杵b到continue研磨组织与另外的20的运动。转移匀浆到1.5毫升管与1毫升移液管。
- 离心样品在1000×g离心5分钟,在4℃下,以消除任何未磨制脑片段。检索上清液,它们划分成200μl的等分试样,并保持在-80℃下用于随后的ELISA分析。
4.检测αS的通过ELISA
- 稀释涂料抗体0.01纳克/毫升。使用任一抗αS兔多克隆或单克隆的克隆42抗体在50mM的Na 2 CO 3 / 碳酸氢钠缓冲液(pH 9.6)。
- 涂层的96孔板,每该涂覆溶液的孔100μl,并在4℃CO / N离开。使用抗αS兔多克隆抗体在用于使用抗体检测syn514 ELISA中的涂布液,克隆42,LB509,AS11,4D6或8A5。使用抗αS单克隆抗体克隆42作为涂布液在与抗pSer129αS检测抗体结合。
注 :如果需要的话,板可以保持在4℃下进行一周的ELISA之前进行。 - 使用洗板与每孔0.05%吐温20(PBST)洗涤板五次用300μl磷酸盐缓冲盐水。从该步骤起,孵育是在室温。
- 加入200μl的PBS T20阻止每口井的缓冲区。摇1小时以150rpm。用PBST洗平板五次。
- 稀释脑匀浆(稀释1:100的20%匀浆,1:50 10%匀浆并在PBST中的BSA 1%5%匀浆1:25),并添加100微升到每个孔中。然后孵育2小时,在150转速下晃动。用PBST洗平板五次。
- 添加不同αS检测抗体在PBST与BSA 1%的材料清单中提到的稀释液。孵育1小时以150rpm。用PBST洗平板五次。
- 无论是添加抗-mouse或抗兔IgG HRP结合物稀释1:8000在PBST中补充有BSA的1%1小时以150rpm摇动。用PBST洗平板五次。
- 加入100微升3,3',5,5'-四甲基联苯胺(TMB)溶液至每个孔,并孵育在黑暗中15分钟以150rpm摇动。
- 停止加入100微升1N HCl中,每孔然后测量450nm处的吸光度与酶标仪反应。
- 进行数据分析,减去在井与除从测量每个所分析的样品的OD值的任何小鼠大脑样品(空白孔)中的所有的试剂中得到的OD值。
5.表位作图
- 根据由奥斯曼16中记载的方法进行表位作图。简言之,将包含在硝酸纤维素12个氨基酸的10个重叠氨基酸的人类α突触核蛋白序列的点的肽。
- 用50mM的Tris / 150mM的NaCl的缓冲液1方框0含0.05%吐温20和5%奶粉。孵育抗体在阻断以每毫升2微克抗体的浓度的溶液在2-10°CO / N。
- 洗膜用的50mM Tris / 150含有0.05%Tween 20的孵育与山羊抗 - 小鼠IgG HRP缀合物mM氯化钠缓冲液pH 10三次。洗用同样的缓冲液然后另一个五次染色用Western印迹TMB染色试剂盒的膜。
6.统计分析
- 使用R软件和NLME包进行混合效应回归模型OD。对于每一个对比,进行混合效应回归模型。使用固定的效果,从无症状群体区分症状。
- 使用随机效果来反映重复的变异用于给定鼠标。查同方差通过检查残差和如果需要的话,可以使用方差函数来符合皮涅罗和贝茨1组内的错误的方差结构的模型7,设置0.05作为P的意义门槛
结果
在这项研究中,所用的ELISA中具体鉴定疾病相关αS(αSD)在从患病M83小鼠高盐缓冲液中制备脑匀浆。使用抗体特异性识别pSer129αS(p值= 0.0074),酶联免疫吸附容易从年轻(2-5个月大),健康M83小鼠( 图1)区分老,病小鼠(> 8月龄)。其他几个抗体显示类似的高信号(> 0.6 OD)仅在从患病老鼠脑组织匀浆。这是129-140的情况下为4D6(p值= 0.01),LB509(p值= 0.0047)和8A5(P <0.001)对蛋白(124-134,115-122的C-末端部分的不同的序列,和分别),以及在较小程度上,syn514针对该蛋白(p值= 0.0003)的N末端(2-12)。此外,AS11单克隆抗体产生于我们的实验室对人类的纤维状重组αS18 C57BL / 6S的免疫后(B6αS空)19小鼠具有缺失α-顺轨迹,显示类似的高信号(P <0.01)仅在从患病小鼠的脑匀浆。该抗体已经被证明识别αS的氨基酸序列(P)的VDPDNEAY(E)所示,对应于118-125序列人α突触核蛋白的。
与此相反,在这些实验条件下,分析脑组织匀浆用针对α突触核蛋白(91-96序列)的中心区域的克隆42检测抗体,表现出了非常低的信号为病人和健康M83小鼠。它不能区分小鼠的两个种群(P = 0.1158)。不过年轻的M83小鼠表现出更高的免疫反应比没有转基因非小鼠B6C3H(M83遗传背景线)。对比度为更大与C57BL / 6S(B6αS空)的小鼠,它有一个已删除的α - 顺轨迹。这表明,在M83小鼠轻微免疫对应于正常αS低信号检测。在一个该ELISA的nalytical灵敏度相比被评估为先前描述Western印迹方法4为不溶性Ser129磷酸化α突触核蛋白的检测,通过检查,同时使用ELISA和Western印迹的方法,从同一患病M83制备脑匀浆的连续稀释鼠脑( 图2)。近似为10μg脑当量足以得到正的ELISA信号,用于从该患病小鼠的脑匀浆,既LB509和PSer129抗体。与此相反,还需要至少200微克脑当量检测pSer129αS中通过使用相同的PSer129抗体15 Western印迹分析了肌氨酰不溶部分。这表明ELISA具有分析灵敏度约20倍,该Western印迹方法。
在生病的老M83小鼠( 图3A),从脑脑组织匀浆,脑干和脊髓笑星期三标记免疫反应既LB509和PSer129抗体在ELISA。但是,没有可检测的免疫反应中观察到的其它脑区域,包括嗅球,大脑皮质,纹状体,海马,丘脑和下丘脑。酶联免疫吸附了一个微弱的信号,小脑。在M83小鼠的不同脑区显影加速临床疾病的注射从患病M83小鼠4( 图3B)脑提取物的下述的免疫反应从见于老年人(> 8月龄)未接种M83小鼠没有区别。这些结果与那些通过Western印迹( 图3C)和免疫组15获得的示出Ser129α突触核蛋白的大脑和脊髓的尾部区域大得多沉积完全一致。
/52752/52752fig1highres.jpg"WIDTH ="700"/>
图中从M83小鼠全脑匀浆1的ELISA检测疾病相关α突触核蛋白(αSD)。酶联免疫吸附相结合的兔抗αS多克隆(涂层)与syn514,LB509,AS11,4D6,8A5(检测)或克隆42(涂层)具有抗pSer129αS(PSer129)(检测)抗体区分患病老鼠从健康小鼠的M83,而ELISA具有抗αS兔多克隆(涂层)/ clone42(检测)没有。这六个病了,老M83年龄从11至16个月的小鼠表现出免疫反应的迹象与抗α-顺抗体(除克隆抗体42)。这不是为任何六个年轻,健康年龄为2至5个月大的小鼠的情况下,或与附加的控制,包括B6C3H或B6αS无效的老鼠(M83小鼠的遗传背景)。误差条表示SD从Bétemps15改性。
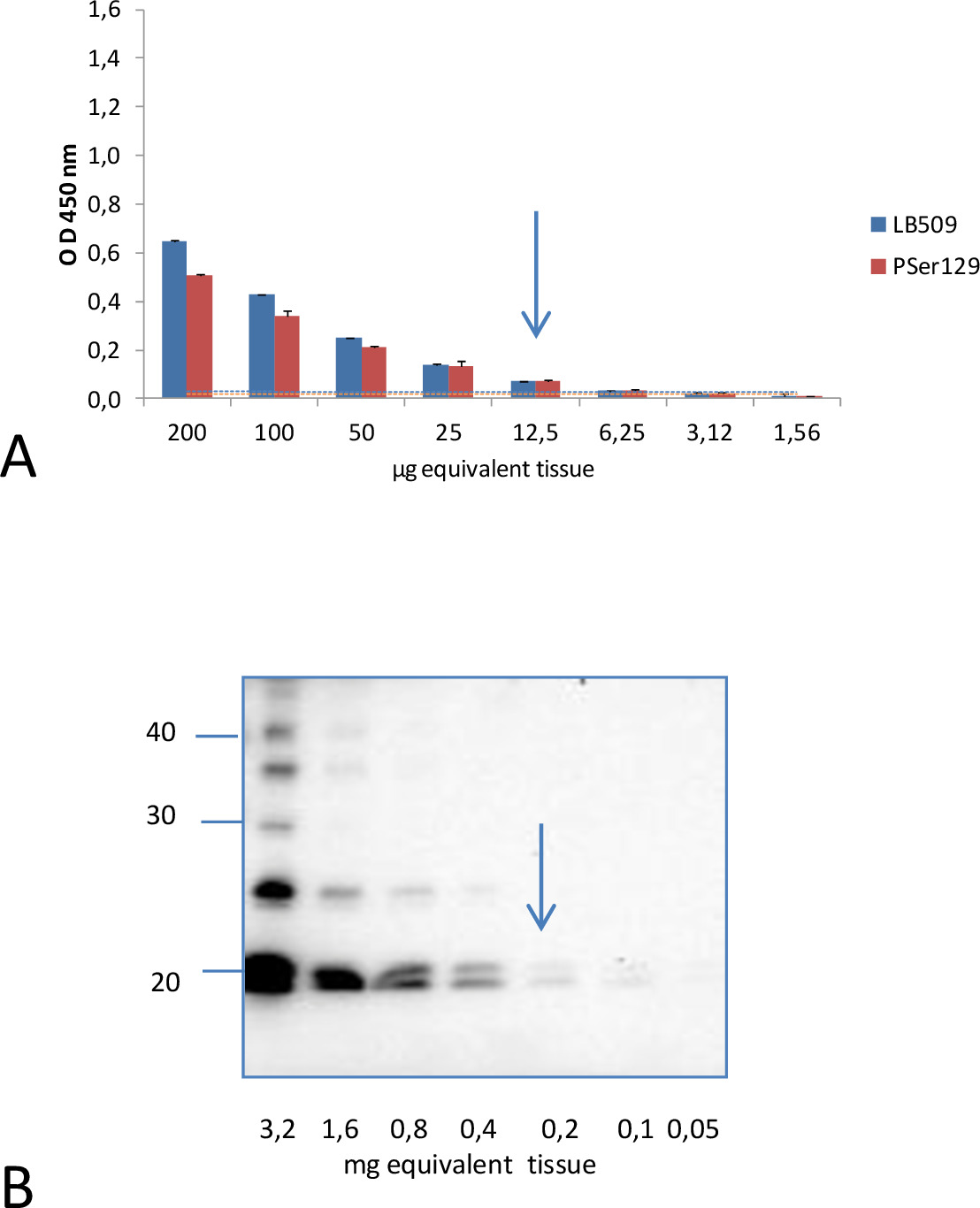
检测αS 的D与 ELISA法得到的阳性信号为12.5微克脑当量既LB509和PSer129抗体从脑匀浆的两倍稀释液从一个患病的分析灵敏度通过ELISA和Western印迹。A的图2的比较鼠标。对病人和健康小鼠的鉴别所估计的截止电平,对应于过程的酶联免疫吸附措施+3标准偏差五点五十七重复从健康M83小鼠的试样所得到的装置,用于LB509和PSer129检测抗体分别为0.030和0.020 。它们被示为在相同的颜色与用于各抗体的一条线。B.通过在presen超速离心后得到的不溶性级 分的Western印迹分析肌氨酸的CE认证,还需要200微克的大脑等同检测αSð与同PSer129抗体。分子量标记物(以kDa)标示在印迹的左侧。从Bétemps15授权转载。

图3。在M83的小鼠,通过ELISA和Western印迹不同脑区的检测疾病相关α突触核蛋白(αSD)。 ELISA检测αSð与正常老化(a)在M83中的小鼠PSer129或LB509检测抗体(N = 1,重复4,平均值±SD)或6周龄小鼠M83接种与患病M83脑匀浆后( B)(n = 1时,4个重复,平均值±SD)。 (C)αSD的用W标识西部时代印迹的PSer129检测抗体EP1536Y在同一个神经解剖区域的接种从生病M83鼠标脑匀浆小鼠。分子量标记物(以kDa)标示在面板C的总蛋白的等量的每行相当于装载在凝胶上被用于左侧。从患病小鼠M83以下八个神经解剖区域进行了测试:OB:嗅觉灯泡,CX:大脑皮质,喜:海马,ST:纹状体,我:脑,CB:小脑,BS:脑干,SC:脊髓型颈椎病。从Bétemps15修改。
讨论
采用ELISA检测法被证明特别是从小鼠脑组织匀浆检测αSÐ直接的病在M83转基因小鼠模型中。事实上,这ELISA可以很容易地分辨健康M83小鼠在高盐缓冲只使用全脑组织匀浆病鼠M83。
使用这种ELISA成功的结果的最重要的步骤是:正确地制定必要的手巧,以防止在切除损坏解剖老鼠大脑的不同区域;执行样本稀释只在HS缓冲区;和抗体的选择,因为并非所有的抗体将工作在ELISA格式。
在αSD水平的一些变化是不同的小鼠之间仍然明显。这些结果相当于Western印迹检测只在患病M83小鼠中检测到的典型αSð图案通过检查萨克的检测之后戊糖基不溶成分与抗Ser129抗体磷酸αS15。这表明,ELISA免疫对应αSD的特异性检测。
在与先前的Western印迹协议分析15,该ELISA检测免疫病M83小鼠在大脑中, 即,中脑和脑干的尾部部分的大脑解剖后,以及在颈脊髓。在嗅球,大脑皮质,纹状体或海马,与以前的数据表明,海马由病理过程6幸免,除非在非常低的水平在小鼠已被接种由纤维状的α的情况下保持一致,没有检测到免疫反应突触核蛋白进入海马15。 αSD的分布从而出现显着均匀的整体,无论实验条件下,该公司luded任小鼠的正常老化或加速疾病发展的脑匀浆脑内接种从患病M83小鼠后。
此外,测定性能比前面所述的Western印迹方法更好。 ELISA的分析灵敏度似乎更高,如由检测在该试验中获得的使用的脑匀浆连续稀释从患病M83小鼠(12.5微克用于ELISA VS 200微克的蛋白质印迹试验)的限制。 ELISA的灵敏度但是仍然比免疫组化检测,其检测αS 中的D的单个细胞和额叶脑区的下部,如大脑皮层15。测试的灵敏度仍可以通过使用不同的抗体和/或优化的检测系统,例如化学发光检测如前所述13进一步提高。
这很重要要注意的是其它几种抗体识别其他形式的蛋白质,并且尤其是一种非磷酸化形式(与4D6单克隆抗体20检测),得到类似的结果使用该ELISA中,除了该单克隆抗体特异性识别pSer129αS。该ELISA方法也揭示免疫反应性在相同的患病动物和/或大脑区域患病小鼠15的抗体特异性识别人类αS(LB509),并且以低得多的程度,小鼠αS(D37A6)。另一方面,无免疫反应性,通过使用克隆42抗体针对αS(91-96)21,22的中央区域生病M83的小鼠的ELISA分析观察到的,对应的表位可能是这些ELISA条件下隐蔽。此ELISA形式可以检测在M83老鼠大脑既Ser129磷酸化αS,通过Foulds 11在人血浆中所观察到的,和非磷酸化,可能是寡聚形式,如在哼描述一个脑脊液和血浆12,14。与此前公布的ELISA试剂盒,ELISA我们既不格式用于捕获和检测抗体一样检测αS的低聚形式,也不是已知的抗体是构象,像Unterberger的研究中使用的5G4抗体。
不像先前用来检测αS 中的D从M83小鼠4的脑匀浆的蛋白质印迹法,ELISA法不需要浓缩步骤,例如通过超离心与肌氨酰,以检测疾病相关蛋白23。在M83采用小鼠强度增加2,6缓冲区疾病相关αS先前确定连续提取。从实际的观点来看,这种定量测定保存相比,Western印迹过程显著时间和试剂。
在这项研究中,使用ELISA方法详细αS分子分析使得能够很容易量化与免疫病中的小鼠M83不同的抗体。它有助于了解在从定量的角度来看突触核蛋白参与αS聚集的分子机制的光芒。因此该ELISA方法可以提供基础的便捷的工具来检测αSð各种生物样品中与病理学的可靠标志如Ser129磷酸化αS其中Foulds 11认为节目更希望成为比非磷酸化的诊断标志物蛋白质。最近,他指出一个事实,即总αS或可能的非磷酸化αS的措施可以被用作替代标记为在帕金森病的疾病进展,如总αS的水平趋于的最初症状24出现后随时间而增加。
披露声明
The authors have no competing interests to disclose.
致谢
作者要感谢达盖拉德的接种和后续的动物实验。这项工作是由ANSES(法语局食品,环境和职业健康安全),并从基金会法国帕金森的赠款支持。
材料
| Name | Company | Catalog Number | Comments |
| LB509 | Abcam | ab27766 | Detection antibody 1/2,000 |
| AS11 | Produced at Anses | Detection antibody 1/1,000 | |
| 4D6 | Abcam | ab1903 | Detection antibody 1/2,000 |
| PSer129 | Abcam | ab59264 | Detection antibody 1/3,000 |
| PSer129 EP1536Y | Abcam | ab51253 | Detection antibody 1/1,000 |
| syn514 | Abcam | ab24717 | Detection antibody 1/500 |
| clone 42 | BD Biosciences | 610787 | Coating and detection antibody (1/2,000) |
| 8A5 | Provided by Dr. Anderson | Detection antibody 1/2,000 | |
| polyclonal anti-αsyn antibody | Millipore | AB5038P | Coating antibody |
| Anti-mouse IgG HRP conjugate | Southern Biotech | 1010-05 | |
| Anti-rabbit IgG HRP conjugate | Southern Biotech | 4010-05 | |
| Goat anti-mouse IgG HRP conjugate | Dianova | 115-035-164 | |
| HS buffer | Adjust at pH 7.5 and keep at 4 °C | ||
| Euromedex | 26-128-3094-B | |
| Euromedex | 1112-A | |
| Euromedex | EU0007-B | |
| Sigma | 43815 | |
| PBS | Adjust at pH 7.5 | ||
| Euromedex | 1309 | |
| Euromedex | 2018 | |
| Euromedex | 1112-A | |
| Euromedex | P017 | |
| Tween 20 | Euromedex | 2001-C | |
| BSA | Sigma | A7906 | |
| DTT 1 mM | Sigma | 43815 | Stock solution 100 mM, toxic |
| 1% phosphatase cocktail | Pierce | 78428 | |
| 1% protease inhibitor cocktail | Roche | 04 693 132 001 | 50x concentrated |
| Microplate MaxiSorpTM | Thermo Scientific | 442404 | |
| Tampon carbonate 50 mM pH 9.6 | |||
| Sigma | 71360 | 2.86 g/L |
| Merk | 6329 | 3.36 g/L, pH 9.6 |
| Superblock T20 PBS blocking buffer | Pierce | E6423H | 10x concentrated |
| TMB | Sigma | T0440 | Used for ELISA |
| TMB | Analytik Jena AG | 847-0104200302 | Used for epitope mapping |
| HCl 1 N | Chimie plus | 40030 | |
| Ribolyser | Thermo | Fast prep FP120 | keep on ice at this step |
| Grinding tubes | Biorad | 355-1197 | |
| Plate washer | Tecan | Columbus Pro | |
| Plate reader | Biorad | Model 680 | |
| Low power magnifier | VWR | 630-1062 | 8X magnification |
| Forceps Dumont#7 | WPI | 14097 | For dissection steps |
| Transfer pipette 1ml Samso | Samso | 043231 | |
| 1.5 ml tubes | Dutscher | 033290 | |
参考文献
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat Rev Neurol. 9, 13-24 (2013).
- Waxman, E. A., Giasson, B. I. Specificity and regulation of casein kinase-mediated phosphorylation of alpha-synuclein. J Neuropathol Exp Neurol. 67, 402-416 (2008).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Mougenot, A. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol Aging. 33, 2225-2228 (2012).
- Luk, K. C., et al. Intracerebral inoculation of pathological alpha-synuclein initiates a rapidly progressive neurodegenerative alpha-synucleinopathy in mice. J Exp Med. 209, 975-986 (2012).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34, 521-533 (2002).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological alpha-synuclein in brain. Brain : a journal of neurology. 136, 1128-1138 (2013).
- Sacino, A. N., et al. Amyloidogenic alpha-synuclein seeds do not invariably induce rapid, widespread pathology in mice. Acta neuropathologica. 127, 645-665 (2014).
- Recasens, A., et al. Lewy body extracts from parkinson's disease brains trigger alpha-synuclein pathology and neurodegeneration in mice and monkeys. Ann Neurol. , (2013).
- Foulds, P. G., et al. Phosphorylated alpha-synuclein can be detected in blood plasma and is potentially a useful biomarker for Parkinson's disease. FASEB J. 25, 4127-4137 (2011).
- El-Agnaf, O. M., et al. Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson's disease. Faseb J. 20, 419-425 (2006).
- Lee, H. J., et al. Enzyme-linked immunosorbent assays for alpha-synuclein with species and multimeric state specificities. J Neruosci Meth. 199, 249-257 (2011).
- Unterberger, U., et al. Detection of disease-associated alpha-synuclein in the cerebrospinal fluid: a feasibility study. Clin Neuropathol. 33, 329-334 (2014).
- Betemps, D., et al. Alpha-synuclein spreading in M83 mice brain revealed by detection of pathological alpha-synuclein by enhanced ELISA. Acta Neuropathol. (Berl). 2, 29 (2014).
- Osman, A. A., et al. A monoclonal antibody that recognizes a potential coeliac-toxic repetitive pentapeptide epitope in gliadins). Eur J Gastroenterol Hepatol. 13, 1189-1193 (2001).
- Pinheiro, J. C., Bates, D. M., Chambers, J. Ch. 5. Mixed-Effects Models in S and S-PLUS. 5, 206-225 (2000).
- Mougenot, A. L., et al. Production of a monoclonal antibody, against human alpha-synuclein, in a subpopulation of C57BL/6J mice, presenting a deletion of the alpha-synuclein locus. J Neruosci Meth. 192, 268-276 (2010).
- Specht, C. G., Schoepfer, R. Deletion of the alpha-synuclein locus in a subpopulation of C57BL/6J inbred mice. BMC Neurosci. 2, 11 (2001).
- Lee, B. R., Matsuo, Y., Cashikar, A. G., Kamitani, T. Role of Ser129 phosphorylation of alpha-synuclein in melanoma cells. J Cell Sci. 126, 696-704 (2013).
- Perrin, R. J., et al. Epitope mapping and specificity of the anti-alpha-synuclein monoclonal antibody Syn-1 in mouse brain and cultured cell lines. Neurosci Lett. 349, 133-135 (2003).
- Emmanouilidou, E., et al. Assessment of alpha-synuclein secretion in mouse and human brain parenchyma. PLoS One. 6, e22225 (2011).
- Mougenot, A. L., et al. Transmission of prion strains in a transgenic mouse models overexpressing human A53T mutated alpha-synuclein. J Neuropathol Exp Neurol. 70, 377-385 (2011).
- Foulds, P. G., et al. A longitudinal study on alpha-synuclein in blood plasma as a biomarker for Parkinson's disease. Sci Rep. 3, 2540 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。