Method Article
La detección de la enfermedad asociada-α-sinucleína por ELISA mejorada en el cerebro de ratones transgénicos que sobreexpresan A53T humano mutado α-sinucleína
En este artículo
Resumen
An ELISA offering a novel quantitative approach is described. It specifically detects disease-associated α-synuclein (αSD) in a transgenic mouse model (M83) of synucleinopathy using several antibodies against either the Ser129 phosphorylated αS form or the C-terminal part of the protein.
Resumen
Además de los métodos establecidos como Western blot, se necesitan nuevos métodos para cuantificar rápida y fácilmente asociado a la enfermedad α-sinucleína (aS D) en modelos experimentales de synucleopathies. Una línea de ratón transgénico (M83) sobre-expresión de los aS A53T humanos y desarrollar espontáneamente un fenotipo clínico dramática entre ocho y 22 meses de edad, que se caracterizan por síntomas que incluyen pérdida de peso, postración, y deterioro motor severa, se utilizó en este estudio. Para los análisis moleculares de aS D (aS asociado a la enfermedad) en estos ratones, un ELISA fue diseñado para cuantificar específicamente aS D en ratones enfermos. Análisis del sistema nervioso central en este modelo de ratón mostró la presencia de aS D principalmente en las regiones cerebrales caudal y la médula espinal. No hubo diferencias en la distribución aS D entre diferentes condiciones experimentales que conducen a la enfermedad clínica, es decir, en uninoculado y normalmente envejecimiento ratones transgénicos y en ratones inoculados con extractos de cerebro de ratones enfermos. La detección específica de aS D inmunorreactividad utilizando un anticuerpo contra la Ser129 fosforilada aS por ELISA esencialmente correlacionados con la obtenida por Western blot e inmunohistoquímica. Inesperadamente, se observaron resultados similares con varios otros anticuerpos contra la parte C-terminal de aS. La propagación de aS D, lo que sugiere la participación de un mecanismo de "-prión como", de este modo se puede monitorizar y cuantificar en este modelo de ratón utilizando un enfoque ELISA fácilmente.
Introducción
Most current methods for detecting disease-associated α-synuclein (αSD) in experimental models of Parkinson's disease (PD), such as immunohistochemistry or Western blot, are time-consuming and not quantitative. This neurodegenerative disease is characterized by alpha-synuclein aggregation mainly in the form of inclusions containing an aggregated form of the normally soluble presynaptic protein αS1,2 (Lewy bodies and Lewy neurites). Normally only marginally phosphorylated, αS is hyperphosphorylated at its serine 129 residue in these inclusions3 and can be monitored by antibodies specifically directed against Ser129 phosphorylated αS, thus providing a reliable marker of the pathology.
Recent research suggests that a “prion-like” mechanism could be involved in the propagation of αS aggregation within the nervous system of an affected patient4,5. These studies reported the acceleration of a synucleinopathy by inoculating brain extracts containing αSD into a transgenic mouse model (M83) expressing an A53T mutated human αS protein associated with a severe motor impairment occurring as the mice age6. In the same manner, intra-cerebral inoculation of aggregated recombinant αS in the same M83 mouse model confirmed the acceleration of aggregation5. The induction of deposits of phosphorylated αS has also been reported after inoculation of C57Bl/6 wild-type mice with either fibrillar recombinant αS or brain extracts from human DLB patients7,8. Sacino et al.9 recently pointed out that after injection of fibrillar human αS, a widespread and progressive cerebral αS inclusion formation could be induced in M83 mice, but not in E46K transgenic mice or non-transgenic mice in which induced αS inclusions were transient, and mainly restricted to the site of injection. Recent studies on monkeys confirmed propagation of αS aggregates after inoculation of PD-derived extracts in species closer to humans10.
The link between αS alterations and Parkinson’s disease suggest that αSD is a potential biomarker for Parkinson’s disease11. A recent study showed the detection of oligomeric soluble aggregates of α-synuclein in human cerebro-spinal fluid (CSF) and plasma as a potential biomarker for Parkinson’s disease based on a conventional sandwich system ELISA using the same antibody to capture and detect αS12. Based on the same method, multimeric proteins were recognized in biological samples, including the brain, because there are multiple copies of epitopes present in the assembled forms13. Very recently, pathological αS in the CSF of patients with a proven Lewy body pathology was detected using both an ELISA kit with a highly specific antibody against αSD (5G4) and an immunoprecipitation assay14. These methods could differentiate patients with PD/DLB from other types of dementia.
The “prion-like” propagation of αS aggregation was further studied in transgenic mouse model M83 using an ELISA approach that was designed to specifically identify αSD15. In this study, we report the detailed ELISA protocol used to quantitatively detect αSD in sick mice (whether or not inoculated with αSD from sick M83 mice) and more especially in the brain regions specifically targeted by the pathological process in this M83 transgenic mouse model4.
Protocolo
Todos los procedimientos y protocolos con animales estaban en conformidad con la Directiva 86/609 / CEE del Consejo y ratificado por venir, el Comité Nacional Francés para la consideración de la ética en la experimentación animal (protocolo de 11 a 0043) de la CE. Los animales fueron alojados y atendidos en ANSES aprobada de instalaciones experimentales en Lyon (aprobación B 69387 0801).
1. Preparación de ratones
- La eutanasia a los ratones mediante una inyección intraperitoneal de dosis letal de pentobarbital de sodio.
- Recuperar todo el cerebro del cráneo del ratón y colocarlo en un 35 mm placa Petri de plástico en el hielo hasta la extracción.
- Se extrae la médula espinal cervical.
NOTA: aS Extraer ya sea desde una de las mitades del cerebro después de la sección sagital o de cerebros de ratón disecados, disponible después de los experimentos enumerados en la Tabla 1.
| Experiment | Ratones Inóculo (cerebro equivalente) | Período de supervivencia (Dpi) | La mediana / supervivencia máxima (días de edad) | aS d detección por ELISA / BM / IHC |
| 1 | Los ratones inoculados | 441 ± 166 | 419/736 | 8/8 |
| 2 | Ratones inoculados (0,2 mg) | 150 ± 52 | 140/241 | 9/9 |
Tabla 1. Lista de experimentos realizados en ratones M83. Las inoculaciones se realizaron a las 6 semanas para el experimento 2 en la zona cortical-estriado con 20 l de un homogeneizado de cerebro de un ratón enfermo (1% peso / vol en glucosa al 5%), después de anestesia de 6 semanas de edad ratones homocigotos M83 en un 3% la inhalación de isoflurano. dpi: días después inoculación.
2. aS Extracción de Brain Mitades
- Sagitalmente cortó el cerebro para obtener dos mitades. Pesar cada mitad en un tubo que contiene ribolysis bolas de molienda.
- Preparar elevado de sal (HS) tampón que contiene 50 mM Tris-HCl, pH 7,5, NaCl 750 mM, EDTA 5 mM, DTT 1 mM, 1% de fosfatasa inhibidores de la proteasa y cócteles. Añadir tampón elevado de sal a las mitades del cerebro para obtener 20% (peso / volumen) homogeneizados.
- Preparar las muestras de las mitades del cerebro utilizando un homogeneizador mecánico a 6,0 m / s para 23 seg dos veces. Después de la primera homogeneización 23 seg, colocar los tubos que contienen los homogeneizados en hielo durante 2 minutos antes de que el segundo ciclo de 23 seg.
- Centrifugar las muestras a 1000 xg durante 5 min para eliminar fragmentos cerebrales no molidos. Recuperar los sobrenadantes, se dividen en 200 ml de alícuotas y mantenerlos a -80 ° C para el análisis ELISA posterior.
3. aS Extracción de diseccionado cerebrales Regiones
- Diseccionar untodo el cerebro en un 35 mm placa Petri de plástico en el hielo con una lupa de baja potencia (ampliación 8X) utilizando dos forcipes cuyos extremos se mantienen juntos, excepto cuando la disección del hipocampo. No exceda de 10 minutos para preservar la integridad del cerebro. Coloque el cerebro boca arriba y recuperar las regiones cerebrales siguientes en este orden:
- Separar una de las dos bulbos olfatorios utilizando fórceps colocados justo detrás de la bombilla. Separe desde el cerebro por un movimiento hacia abajo. Repita esta operación para el segundo foco.
- Cuña suavemente las pinzas entre las dos cortezas y moverlo hacia delante para facilitar la disociación de las dos cortezas. Mantener el cerebro en su lugar con uno fórceps, utilizar otra para separar la corteza del hipocampo.
- Coloque la pinza 2 mm por debajo de la corteza. Mantener una presión suave sobre las pinzas hasta la parte superior del hipocampo es visible. Despegar la primera parte de la corteza, y repetir con la segunda parte. Utilice las pinzas para separar las dos cortezascomenzando en el hipocampo y moviéndose hacia la parte delantera del cerebro.
- Coloque las pinzas abiertas alrededor de uno de los hipocampos. Cierre la pinza en la parte inferior del hipocampo luego retire suavemente, recuperando tanto como sea posible. Repita el procedimiento para el segundo hipocampo.
- Coloque las pinzas abiertas debajo de uno de los cuerpos estriados y suavemente separarlo del cerebro. Utilice las pinzas para quitar cualquier corteza restante del cuerpo estriado. Repita este procedimiento para el segundo cuerpo estriado.
- Usa los fórceps para deprimir suavemente por 2 mm el contorno del cerebelo para facilitar la separación del cerebelo del cerebro. Coloque la pinza justo detrás del cerebelo y quitarlo moviendo la pinza hacia adelante.
- Utilice la parte ancha de las pinzas para levantar el mesencéfalo con el fin de ver claramente donde se une con el tallo cerebral. Hacer una incisión vertical en la unión luego retire el tallo cerebral.
- Coloque la pinza detrás del mesencéfalo, que is compuesta de cuatro estructuras redondeadas. Una incisión vertical hasta el mesencéfalo ha sido completamente separado del cerebro restante.
- Preparar homogeneizados de% variable (peso / volumen) en tampón HS, dependiendo de la cantidad de tejidos disponibles, es decir, 5% homogeneizado para un peso entre 10 y 30 mg, 10% para un peso entre 30 y 80 mg, y 20% para un peso por encima de 80 mg.
- Añadir un volumen adecuado de tampón HS a las regiones cerebrales disecadas para obtener el% esperado de homogeneizado.
- Vortex y comprobar que los tejidos están completamente inmersos en el búfer HS.
- Homogeneizar las muestras preparadas a partir de las regiones cerebrales disecadas o la médula espinal cervical con un triturador de tejidos compuesta de un tubo de vidrio de borosilicato y dos manos de mortero, A y B.
- Verter cada región del cerebro de ser aplastado directamente en el tubo. Inserte mano de mortero A en el tubo y retraerlo. Repita este movimiento alrededor de diez veces para disociar el tejido. A continuación, utilice la maja B para continuac moliendo el tejido con 20 movimientos. La transferencia de los homogeneizados en un tubo de 1,5 ml con una pipeta de transferencia 1 ml.
- Centrifugar las muestras a 1000 xg durante 5 min a 4 ° C para eliminar cualquier fragmento cerebrales no molidos. Recuperar los sobrenadantes, dividirlos en 200 ml de alícuotas y mantenerlos a -80 ° C para el análisis ELISA posterior.
4. Detección de aS por ELISA
- Diluir los anticuerpos de recubrimiento de 0,01 ng / ml. Utilice-aS policlonal anti conejo o monoclonal clon 42 de anticuerpos en 50 mM Na 2 CO 3 / NaHCO3 (pH 9,6).
- Escudo del microplacas de 96 pocillos con 100 l por pocillo de esta solución de revestimiento, y dejar a 4 ° CO / N. Utilice el anticuerpo policlonal de conejo anti-aS en la solución de recubrimiento para ELISA utilizando anticuerpos de detección syn514, clonar 42, LB509, AS11, 4D6 o 8A5. Utilice el clon de anticuerpo monoclonal anti-aS 42 como una solución de revestimientoen combinación con el anticuerpo de detección anti-pSer129 aS.
NOTA: Si es necesario, las placas pueden mantenerse a 4 ° C durante una semana antes de la prueba ELISA se lleva a cabo. - Utilice un lavador de placas para lavar las placas cinco veces con 300 l de solución salina tamponada con fosfato con 0,05% de Tween 20 (PBST) por pocillo. A partir de este paso hacia adelante, la incubación es a TA.
- Añadir 200 l de PBS T20 tampón de bloqueo por pocillo. Agitar durante 1 hora a 150 rpm. Lavar las placas cinco veces con PBST.
- Diluir los homogeneizados de cerebro (dilución 1: 100 de los homogeneizados de 20%, 01:50 de los homogeneizados de 10% y 1:25 de los homogeneizados de 5% en PBST BSA 1%), y añadir 100 l a cada pocillo. A continuación se incuba durante 2 horas con agitación a 150 rpm. Lavar las placas cinco veces con PBST.
- Añadir los diferentes anticuerpos de detección aS en PBST con BSA 1% en las diluciones mencionadas en la Lista de materiales. Incubar durante 1 hora a 150 rpm. Lavar las placas cinco veces con PBST.
- Añadir o bien contra-Ratón o anti-conejo conjugados HRP IgG diluyeron 1: 8000 en PBST suplementado con BSA 1% durante 1 h con agitación a 150 rpm. Lavar las placas cinco veces con PBST.
- Añadir 100 l de 3,3 ', solución de 5,5'-tetrametilbencidina (TMB) a cada pocillo e incubar durante 15 min en la oscuridad con agitación a 150 rpm.
- Detener la reacción mediante la adición de 100 l de HCl 1 N por pocillo luego medir la absorbancia a 450 nm con el lector de microplacas.
- Para el análisis de datos, restar el valor de DO obtenido en un pozo con todos los reactivos excepto las muestras de cerebro de ratón (así en blanco) de los valores de la DO medidos para cada una de las muestras analizadas.
5. Epitope Mapping
- Realizar el mapeo de epítopos de acuerdo con el método descrito por Osman 16. En pocas palabras, los péptidos del punto de la secuencia de α-sinucleína humana contiene 12 aminoácidos de nitrocelulosa con 10 aminoácidos que se solapan.
- Bloque con 50 mM Tris / tampón NaCl 150 mM pH 10 que contiene 0,05% de Tween 20 y 5% de leche en polvo. Incubar el anticuerpo en solución de bloqueo a una concentración de 2 mg de anticuerpo por ml a 2-10 ° CO / N.
- Se lava la membrana tres veces con 50 mM Tris / NaCl 150 mM pH del tampón 10 que contiene 0,05% de Tween 20. Incubar con el anticuerpo de cabra anti-IgG de ratón conjugado HRP. Lavar la membrana otros cinco veces con el mismo tampón a continuación mancha usando un kit de tinción blot TMB occidental.
6. Análisis estadístico
- Utilice el paquete de software de R y nlme para realizar regresiones de efectos mixtos para modelar OD. Para cada comparación, lleve a cabo un modelo de regresión efecto mixto. Use un efecto fijo para distinguir los síntomas de los grupos asintomáticos.
- Utilice un efecto aleatorio para reflejar la variabilidad de repeticiones para un ratón dado. Compruebe homocedasticidad mediante el examen de los residuos y, si es necesario, utilice las funciones de varianza para modelar la estructura de la varianza de los errores dentro de los grupos de acuerdo con Pinheiro y Bates 17. Establecer 0,05 como el umbral de significación de P.
Resultados
En este estudio, las pruebas ELISA utilizadas específicamente identificados aS enfermedades asociadas (aS D) en homogeneizados de cerebro preparados en un tampón de alta sal de ratones enfermos M83. El uso de un anticuerpo que reconoce específicamente pSer129 aS (p = 0,0074), el ELISA distingue fácilmente de edad, ratones enfermos (> 8 meses de edad) de los jóvenes (2-5 meses de edad), los ratones sanos M83 (Figura 1). Varios otros anticuerpos mostraron igualmente altos señales (> 0,6 OD) sólo en homogeneizados de cerebro de los ratones enfermos. Este es el caso para 4D6 (p = 0,01), LB509 (p = 0,0047) y 8A5 (p <0,001) frente a diferentes secuencias de la parte C-terminal de la proteína (124-134, 115-122, y 129-140 respectivamente) y, en un grado mucho menor, syn514 contra el extremo N-terminal (2-12) de la proteína (p = 0,0003). Además, el anticuerpo monoclonal AS11 producido en nuestro laboratorio contra aS humanos recombinantes fibrilares 18 después de la inmunización de ratones C57BL / 6S (B6 aS-null) 19los ratones con una deleción del locus α-syn, mostró señales igualmente altos (p <0,01), sólo en homogeneizados de cerebro de ratones enfermos. Este anticuerpo ha demostrado ahora de reconocer la secuencia (P) VDPDNEAY-amino ácido (E) de aS, correspondiente a la secuencia 118-125 de α-sinucleína humana.
En contraste, bajo estas condiciones experimentales, los análisis de homogeneizados de cerebro con el anticuerpo de detección clon 42 dirigido contra una región central de α-sinucleína (91-96 secuencia), mostró una señal muy baja tanto para los ratones M83 enfermos y sanos. No podía distinguir las dos poblaciones de ratones (p = 0,1158). Ratones jóvenes M83 sin embargo mostraron una inmunorreactividad mayor que los ratones no transgénicos B6C3H (M83 genética línea de fondo). El contraste fue aún mayor con C57BL / 6S ratones (B6 aS-null), que tienen un locus α-syn eliminado. Esto sugiere que la inmunorreactividad leve en ratones M83 corresponde a baja detección de la señal de aS normales. La Analytical sensibilidad de este ELISA se evaluó en comparación con un método de transferencia de Western 4 anteriormente descrito para la detección de insoluble Ser129 fosforilada α-sinucleína, mediante el examen, utilizando tanto métodos de ELISA y Western blot, diluciones seriadas de homogeneizados de cerebro preparados a partir de la misma enfermo M83 cerebro de ratón (Figura 2). Aproximados 10 g equivalentes cerebrales eran suficientes para obtener una señal ELISA positiva para el homogeneizado de cerebro de este ratón enfermo, tanto con LB509 y anticuerpos PSer129. Por el contrario, se necesitan al menos 200 mg equivalentes cerebrales para detectar pSer129 aS en la fracción insoluble-sarcosil analizado por transferencia de Western usando el mismo anticuerpo PSer129 15. Esto indica que el ELISA tiene una sensibilidad analítica unas 20 veces la del método de Western blot.
En los ratones enfermos y de edad M83 (Figura 3A), homogeneizados de cerebro de la mesencéfalo, tronco cerebral y la médula espinal sho wed marcado inmunoreactividad con tanto LB509 y anticuerpos PSer129 en el ELISA. Sin embargo, ninguna inmunorreactividad detectable se observó en las otras regiones del cerebro, incluyendo el bulbo olfatorio, corteza cerebral, cuerpo estriado, hipocampo, el tálamo y el hipotálamo. El ELISA dio una señal débil para el cerebelo. La inmunoreactividad en las diferentes regiones del cerebro de los ratones M83 desarrollar una enfermedad clínica acelerada después de la inyección de un extracto de cerebro de un enfermo M83 ratón 4 (Figura 3B) era indistinguible de la observada en la edad (> 8 meses de edad) sin inocular ratones M83. Estos resultados son totalmente coherentes con los obtenidos por Western blot (Figura 3C) e inmunohistoquímica 15, mostrando una mayor deposición de Ser129 α-sinucleína en las regiones caudales del cerebro y la médula espinal.
/52752/52752fig1highres.jpg "Width =" 700 "/>
Figura 1. ELISA de detección de enfermedad asociada a α-sinucleína (aS D) en homogeneizados cerebrales enteras procedentes de ratones M83. El conejo ELISA combinación anti-aS policlonal (revestimiento) con syn514, LB509, AS11, 4D6, 8A5 (detección) o clon 42 (revestimiento) con anti-pSer129 aS (PSer129) (detección de anticuerpos) distinguir los ratones enfermos de ratones sanos M83, mientras que ELISA con anti-aS policlonal de conejo (revestimiento) / clone42 (detección) no lo hace. Los seis viejos ratones enfermos, M83 edades comprendidas de 11 a 16 meses mostró signos de inmunorreactividad con los anticuerpos α-syn contra (excepto clon 42 de anticuerpos). Este no era el caso, ya sea para los seis ratones jóvenes y sanos de edades comprendidas entre 2 y 5 meses de edad, o con los controles adicionales que incluyen B6C3H (antecedentes genéticos de M83 ratones) o de ratones nulos aS-B6. Las barras de error representan SD Modificado de Bétemps 15.
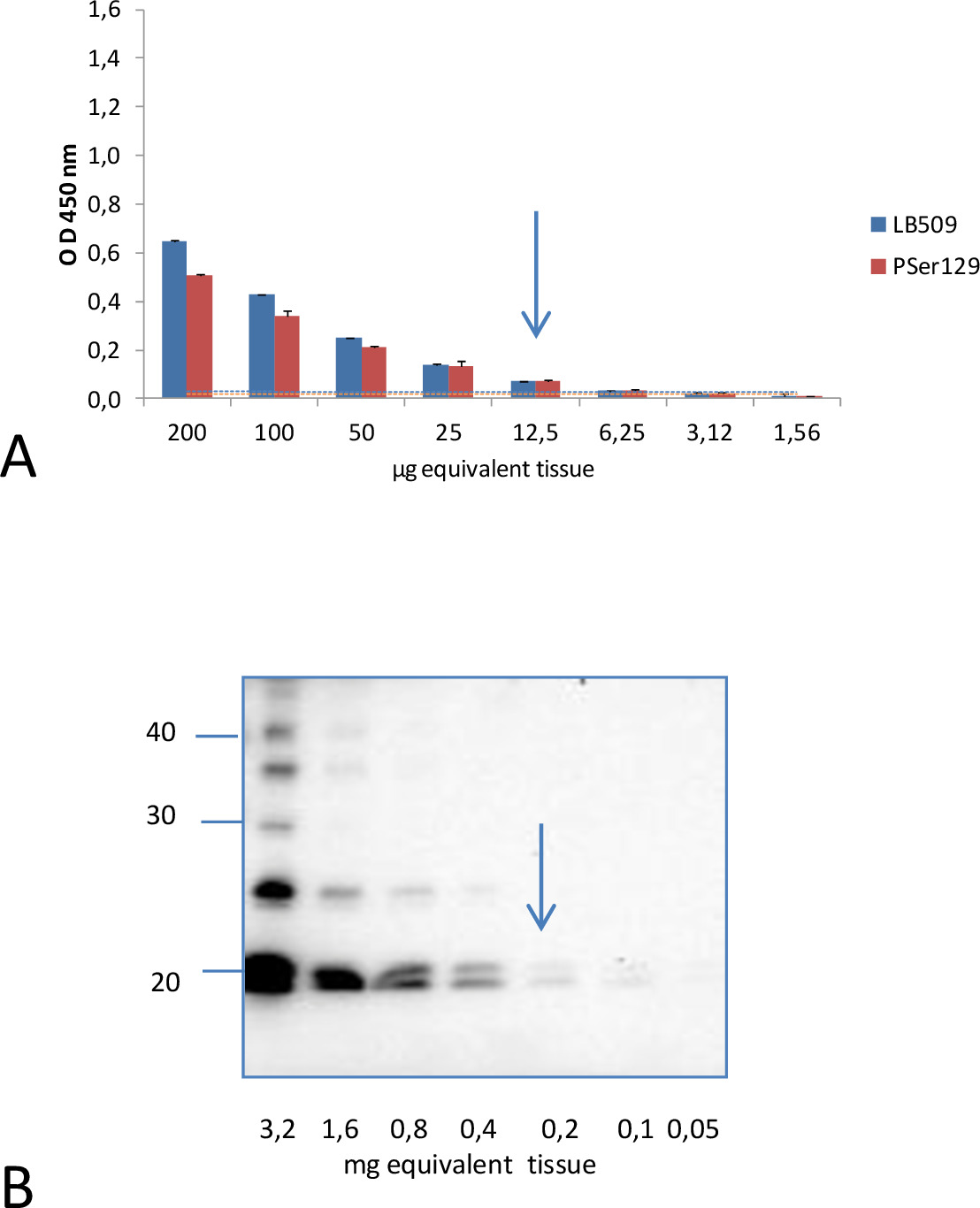
Figura 2. Comparación de la sensibilidad analítica de detección de aS D por ELISA y Western blot. A. Una señal positiva se obtuvo con ELISA para 12,5 g equivalentes cerebrales con tanto LB509 y anticuerpos PSer129 de diluciones de dos veces de homogeneizados de cerebro de un enfermo ratón. El nivel de corte estimada para la discriminación de los ratones enfermos y sanos, que corresponden a las medias obtenidas a partir de muestras de ratones sanos M83 durante cinco y cincuenta y siete repeticiones de ELISA mide + 3 desviaciones estándar, fueron 0,030 y 0,020 para LB509 y anticuerpos de detección PSer129 respectivamente . Ellos se muestran como una línea en el mismo color que el utilizado para cada uno de los anticuerpos. B. Por análisis de transferencia Western de las fracciones insolubles obtenidos después de la ultracentrifugación en la presence de sarcosilo, se necesitaban 200 g equivalentes cerebrales para detectar aS D con el mismo anticuerpo PSer129. Marcadores de peso molecular (en kDa) se indican a la izquierda de la transferencia. Reproducido con permiso del Bétemps 15.

Figura 3. La detección de enfermedad asociada a α-sinucleína (aS D) en diferentes regiones del cerebro de los ratones M83 por ELISA y Western blot. ELISA identifica aS D con anticuerpos PSer129 o LB509 detección en ratones M83 durante el envejecimiento normal (A) (n = 1, 4 repeticiones, con una media ± DE) o después de la inoculación de los ratones M83 6 semanas de edad, con un homogeneizado de cerebro de un enfermo M83 ( B) (n = 1, 4 repeticiones, media ± DE). (C) aS D fue identificado por Western blot con el anticuerpo de detección EP1536Y PSer129 en las mismas regiones neuro-anatómico en ratones inoculados con un homogeneizado de cerebro de un ratón M83 enfermo. Marcadores de peso molecular (en kDa) se indican a la izquierda del panel C. Igual cantidad de proteínas totales se utilizaron en cada línea para la carga equivalente en gel. Las ocho regiones siguientes neuro-anatómico de los ratones enfermos M83 fueron probados: OB: bulbo olfativo, Cx: corteza cerebral, Hi: hipocampo, St: cuerpo estriado, Me: mesencéfalo, Cb: cerebelo, BS: tronco cerebral, Carolina del Sur: la médula espinal cervical . Modificado de Bétemps 15.
Discusión
El uso de un ELISA se demostró para detectar específicamente aS D directamente a partir de homogeneizados de cerebro de ratón durante la enfermedad en el modelo de ratón transgénico M83. De hecho, este ELISA podría distinguir fácilmente los ratones M83 enfermos de ratones sanos M83 utilizando homogeneizados de cerebro solamente enteros en tampón elevado de sal.
Los pasos más importantes para los resultados exitosos que utilizan este ELISA son: disección correctamente las diferentes regiones de los cerebros de los ratones mediante el desarrollo de la destreza manual necesaria para evitar daños durante la disección; realizar diluciones de muestras exclusivamente en tampón HS; y la elección de anticuerpos, porque no todos los anticuerpos trabajará en un formato ELISA.
Algunos variabilidad en los niveles aS D fue sin embargo aparente entre diferentes ratones. Estos resultados son equivalentes a la detección de Western blot del patrón típico aS D sólo se detectó en los ratones enfermos M83 mediante el examen del sarkfracciones-osil insoluble después de la detección con un anticuerpo contra Ser129 fosforilados aS 15. Esto demuestra que ELISA inmunorreactividad corresponde a la detección específica de aS D.
De acuerdo con los análisis de Western blot anterior 15, este ELISA detecta inmunorreactividad después de la disección del cerebro de los ratones enfermos M83 en las partes caudal del cerebro, es decir, el mesencéfalo y el tallo cerebral, así como en la médula espinal cervical. No se detectó inmunorreactividad en el bulbo olfatorio, corteza cerebral, cuerpo estriado o el hipocampo, consistente con los datos anteriores que indican que el hipocampo se salvó por el proceso patológico 6, a menos que los niveles muy bajos en el caso de los ratones que habían sido inoculados por alfa fibrilar sinucleína en el hipocampo 15. La distribución de aS D por lo tanto apareció independientemente de las condiciones notablemente uniformes en general, experimental, que included ya sea envejecimiento normal de los ratones o acelerado el desarrollo de la enfermedad después de la inoculación intra-cerebral de homogeneizados de cerebro de ratones enfermos M83.
Además, el rendimiento del ensayo es mejor que el método de transferencia Western descrito anteriormente. La sensibilidad analítica de la prueba ELISA apareció superior, como se muestra por los límites de detección obtenidos en esta prueba utilizando diluciones seriadas de un homogeneizado de cerebro de un ratón enfermo M83 (12,5 g para ELISA vs 200 g para el ensayo de Western blot). La sensibilidad del ELISA sin embargo seguía siendo inferior a la de la detección inmunohistoquímica, que detecta aS D en las células individuales y en las regiones frontales del cerebro como la corteza cerebral 15. La sensibilidad de la prueba, sin embargo, podría mejorarse aún más mediante el uso de diferentes anticuerpos y / o sistemas de detección optimizadas, tales como la detección quimioluminiscente como se ha descrito previamente 13.
Es importantenotar que varios otros anticuerpos que reconocen otras formas de la proteína, y en particular una forma no fosforilada (detectada con el anticuerpo monoclonal 4D6 20) dieron resultados similares usando este ELISA, en adición al anticuerpo monoclonal que reconoce específicamente pSer129 aS. Este enfoque ELISA también reveló inmunorreactividad con anticuerpos que reconocen aS específicamente humanas (LB509) y, en un grado mucho menor, aS ratón (D37A6) en los mismos animales enfermos y / o regiones del cerebro de los ratones enfermos 15. Por otro lado, no se observó inmunorreactividad por el análisis ELISA de los ratones enfermos M83 utilizando el anticuerpo clon 42 contra una región central de aS (91-96) 21,22, correspondiente a un epítopo que podría ser críptico en estas condiciones de ELISA. Este formato de ELISA pudo detectar en cerebros de ratón M83 ambos Ser129 aS fosforilados, como se observa por Foulds 11 en el plasma humano, y no fosforilada, posiblemente formas oligoméricas, como se describe en humun plasma y líquido cefalorraquídeo 12,14. A diferencia de los ELISA publicados anteriormente, nuestro formato ELISA ni utilizar el mismo anticuerpo en la captura y detección para detectar la forma oligomérica de aS, ni anticuerpos conocidos para ser conformacional, al igual que el anticuerpo 5G4 utilizado en estudios de Unterberger.
A diferencia del método de transferencia de Western previamente utilizado para detectar aS D en homogeneizados cerebrales de ratones M83 4, el ELISA no requería una etapa de concentración tal como por ultracentrifugación con sarcosilo para detectar la proteína asociada a la enfermedad 23. AS enfermedad asociada fue identificado previamente en ratones M83 por extracción secuencial utilizando tampones de aumento del grado 2,6. Desde un punto de vista práctico, este ensayo cuantitativo ahorra tiempo y reactivos significativa en comparación con el procedimiento de Western blot.
En este estudio, permitieron aS detallados análisis moleculares utilizando un enfoque ELISAcuantificar fácilmente inmunorreactividad con diferentes anticuerpos en ratones enfermos M83. Se podría arrojar luz sobre los mecanismos moleculares implicados en la agregación aS durante sinucleinopatías desde un punto de vista cuantitativo. Por tanto, este método de ELISA podría servir de base para una herramienta rápida y fácil de detectar aS D en diversas muestras biológicas con un marcador fiable de la patología como Ser129 aS fosforilados que Foulds 11 cree espectáculos más prometedora como marcador diagnóstico de la no fosforilada proteína. Recientemente, destacó el hecho de que las medidas de aS totales o posiblemente de aS no fosforilados podrían utilizarse como un marcador sustituto para la progresión de la enfermedad en la EP, como el nivel de aS totales tiende a aumentar con el tiempo después de la aparición de los síntomas iniciales 24 .
Divulgaciones
The authors have no competing interests to disclose.
Agradecimientos
Los autores desean agradecer a Damien Gaillard para inoculaciones y el seguimiento de los experimentos con animales. Este trabajo fue apoyado por la ANSES (Agencia Francesa para la Alimentación, Medio Ambiente y Salud Ocupacional y Seguridad) y por una beca de la Fundación France Parkinson.
Materiales
| Name | Company | Catalog Number | Comments |
| LB509 | Abcam | ab27766 | Detection antibody 1/2,000 |
| AS11 | Produced at Anses | Detection antibody 1/1,000 | |
| 4D6 | Abcam | ab1903 | Detection antibody 1/2,000 |
| PSer129 | Abcam | ab59264 | Detection antibody 1/3,000 |
| PSer129 EP1536Y | Abcam | ab51253 | Detection antibody 1/1,000 |
| syn514 | Abcam | ab24717 | Detection antibody 1/500 |
| clone 42 | BD Biosciences | 610787 | Coating and detection antibody (1/2,000) |
| 8A5 | Provided by Dr. Anderson | Detection antibody 1/2,000 | |
| polyclonal anti-αsyn antibody | Millipore | AB5038P | Coating antibody |
| Anti-mouse IgG HRP conjugate | Southern Biotech | 1010-05 | |
| Anti-rabbit IgG HRP conjugate | Southern Biotech | 4010-05 | |
| Goat anti-mouse IgG HRP conjugate | Dianova | 115-035-164 | |
| HS buffer | Adjust at pH 7.5 and keep at 4 °C | ||
| Euromedex | 26-128-3094-B | |
| Euromedex | 1112-A | |
| Euromedex | EU0007-B | |
| Sigma | 43815 | |
| PBS | Adjust at pH 7.5 | ||
| Euromedex | 1309 | |
| Euromedex | 2018 | |
| Euromedex | 1112-A | |
| Euromedex | P017 | |
| Tween 20 | Euromedex | 2001-C | |
| BSA | Sigma | A7906 | |
| DTT 1 mM | Sigma | 43815 | Stock solution 100 mM, toxic |
| 1% phosphatase cocktail | Pierce | 78428 | |
| 1% protease inhibitor cocktail | Roche | 04 693 132 001 | 50x concentrated |
| Microplate MaxiSorpTM | Thermo Scientific | 442404 | |
| Tampon carbonate 50 mM pH 9.6 | |||
| Sigma | 71360 | 2.86 g/L |
| Merk | 6329 | 3.36 g/L, pH 9.6 |
| Superblock T20 PBS blocking buffer | Pierce | E6423H | 10x concentrated |
| TMB | Sigma | T0440 | Used for ELISA |
| TMB | Analytik Jena AG | 847-0104200302 | Used for epitope mapping |
| HCl 1 N | Chimie plus | 40030 | |
| Ribolyser | Thermo | Fast prep FP120 | keep on ice at this step |
| Grinding tubes | Biorad | 355-1197 | |
| Plate washer | Tecan | Columbus Pro | |
| Plate reader | Biorad | Model 680 | |
| Low power magnifier | VWR | 630-1062 | 8X magnification |
| Forceps Dumont#7 | WPI | 14097 | For dissection steps |
| Transfer pipette 1ml Samso | Samso | 043231 | |
| 1.5 ml tubes | Dutscher | 033290 | |
Referencias
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat Rev Neurol. 9, 13-24 (2013).
- Waxman, E. A., Giasson, B. I. Specificity and regulation of casein kinase-mediated phosphorylation of alpha-synuclein. J Neuropathol Exp Neurol. 67, 402-416 (2008).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Mougenot, A. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol Aging. 33, 2225-2228 (2012).
- Luk, K. C., et al. Intracerebral inoculation of pathological alpha-synuclein initiates a rapidly progressive neurodegenerative alpha-synucleinopathy in mice. J Exp Med. 209, 975-986 (2012).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34, 521-533 (2002).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological alpha-synuclein in brain. Brain : a journal of neurology. 136, 1128-1138 (2013).
- Sacino, A. N., et al. Amyloidogenic alpha-synuclein seeds do not invariably induce rapid, widespread pathology in mice. Acta neuropathologica. 127, 645-665 (2014).
- Recasens, A., et al. Lewy body extracts from parkinson's disease brains trigger alpha-synuclein pathology and neurodegeneration in mice and monkeys. Ann Neurol. , (2013).
- Foulds, P. G., et al. Phosphorylated alpha-synuclein can be detected in blood plasma and is potentially a useful biomarker for Parkinson's disease. FASEB J. 25, 4127-4137 (2011).
- El-Agnaf, O. M., et al. Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson's disease. Faseb J. 20, 419-425 (2006).
- Lee, H. J., et al. Enzyme-linked immunosorbent assays for alpha-synuclein with species and multimeric state specificities. J Neruosci Meth. 199, 249-257 (2011).
- Unterberger, U., et al. Detection of disease-associated alpha-synuclein in the cerebrospinal fluid: a feasibility study. Clin Neuropathol. 33, 329-334 (2014).
- Betemps, D., et al. Alpha-synuclein spreading in M83 mice brain revealed by detection of pathological alpha-synuclein by enhanced ELISA. Acta Neuropathol. (Berl). 2, 29 (2014).
- Osman, A. A., et al. A monoclonal antibody that recognizes a potential coeliac-toxic repetitive pentapeptide epitope in gliadins). Eur J Gastroenterol Hepatol. 13, 1189-1193 (2001).
- Pinheiro, J. C., Bates, D. M., Chambers, J. Ch. 5. Mixed-Effects Models in S and S-PLUS. 5, 206-225 (2000).
- Mougenot, A. L., et al. Production of a monoclonal antibody, against human alpha-synuclein, in a subpopulation of C57BL/6J mice, presenting a deletion of the alpha-synuclein locus. J Neruosci Meth. 192, 268-276 (2010).
- Specht, C. G., Schoepfer, R. Deletion of the alpha-synuclein locus in a subpopulation of C57BL/6J inbred mice. BMC Neurosci. 2, 11 (2001).
- Lee, B. R., Matsuo, Y., Cashikar, A. G., Kamitani, T. Role of Ser129 phosphorylation of alpha-synuclein in melanoma cells. J Cell Sci. 126, 696-704 (2013).
- Perrin, R. J., et al. Epitope mapping and specificity of the anti-alpha-synuclein monoclonal antibody Syn-1 in mouse brain and cultured cell lines. Neurosci Lett. 349, 133-135 (2003).
- Emmanouilidou, E., et al. Assessment of alpha-synuclein secretion in mouse and human brain parenchyma. PLoS One. 6, e22225 (2011).
- Mougenot, A. L., et al. Transmission of prion strains in a transgenic mouse models overexpressing human A53T mutated alpha-synuclein. J Neuropathol Exp Neurol. 70, 377-385 (2011).
- Foulds, P. G., et al. A longitudinal study on alpha-synuclein in blood plasma as a biomarker for Parkinson's disease. Sci Rep. 3, 2540 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados