Method Article
定量リアルタイムPCRを用いて脳脊髄液マイクロRNAプロファイリング
要約
私たちは、脳脊髄液(CSF)中のマイクロRNAをプロファイリングするリアルタイムPCRのプロトコルを記述します。 RNA抽出プロトコールを除いて、手順は他の体液、培養細胞、または組織試料から抽出したRNAに拡張することができる。
要約
マイクロRNA(miRNA)は、それらの翻訳抑制を調節することにより、mRNAおよびその結果として、上に位置する部位を標的とするRISCを誘導することにより、遺伝子制御の強力な層を構成している。 miRNA発現の変化は、すべての主要な複雑な疾患の発症に関与することが示されている。さらに、最近の知見は、miRNAが細胞外環境に分泌し、それらが高い安定性で循環することができ、血流および他の体液を入力することができることを示した。このような循環のmiRNAの機能は、主にとらえどころのないままですが、このようなmiRNAプロファイリングアレイのような体系的な高スループットのアプローチは、神経変性疾患や癌のいくつかのタイプを含むいくつかの病的状態におけるmiRNAシグネチャーの同定につながるている。この文脈において、脳脊髄液中のmiRNA発現プロファイルの同定は、我々の最近の研究で報告されたように、バイオマーカー分析のためのmiRNAの魅力的な候補にする。 _content ">このようなマイクロアレイ、定量的リアルタイムPCR(定量PCR)、および深いシーケンシングなどのマイクロRNAのプロファイリングに利用できるいくつかのツールがあります。ここでは、定量的リアルタイムPCRにより脳脊髄液中のマイクロRNAのプロファイルを作成するための感度の高い方法を記載している。私たちは、 Exiqon社のマイクロRNAを使用し、すぐに使用できるPCR法人間のパネルIと742のユニークな人間のマイクロRNAの検出を可能にする二V2.R、我々は、三連の実行で配列を行い、我々は処理され、ジェネックスプロフェッショナル5ソフトウェアを使用してデータを分析した。
このプロトコルを使用して、我々は成功した細胞株および初代細胞の様々な種類のマイクロRNA、CSF、血漿、およびホルマリン固定パラフィン包埋組織をプロファイルしています。
概要
マイクロRNAは、転写後に遺伝子発現を調節する非コードRNA(長さ21〜23ヌクレオチド)の小さなファミリーに属する。マイクロRNAは、比較的安定であると思われる細胞外空間に分泌させることができる。 miRNAの発現の変化を決定するmiRNAプロファイルを行い、大量のデータを処理する、バイオマーカーの同定に向けた重要なステップであることができるが威圧されてもよい。
ここでは、敏感なリアルタイムPCRによって(他の体液に適用)脳脊髄液におけるmiRNA発現の変化を決定するためのプロトコルを記載している。また、統計分析および結果のグラフ表示を含む、データ分析のためのソフトウェアの使用を記載している。全体の手順は、比較的容易かつ簡単であり、プロファイリングおよびリアルタイムPCRマシンの数が利用可能な、比較的迅速されるサンプルの数に応じ。実験の部は、取り扱いの精度が要求さ384ウェルプレートへピペッティングRNA、ジェネックスを用いてデータ解析部インフォマティクスと統計の一部の基本的な知識を必要とする。
プロトコル
次のプロトコルは、準備ができてPCRプレートを使用して、CSF、プロファイルマイクロRNAからRNAを単離するための標準的な手順を説明します。有機相抽出は、任意であり、キャリアRNAがRNAの最大の回収を確実に抽出の間、試料に添加されていることに注意してください。これにより、RNAを定量化する必要はない。
cDNAは、前日(約2時間)を合成した場合、全体的な6-8のプレートの平均は一日に実行することができる。全てのサンプルは、プロファイルおよびソフトウェアにロードされたときにデータの解析を行う。比較のためのサンプル/基又はそれらの組合せの数に応じて、データ分析は、1〜数時間必要とし得る。
1。 RNA抽出
RNA抽出を分析まで一定分量で-80℃で凍結保存CSFサンプルから実施された。この手順ではパリのmirVana分離キットを製造業者の楽器以下、使用した全RNA単離のためctions。小さなRNA種の濃縮は、このキットには可能であるが、このステップは行われず、RNA抽出手順は、全RNAの単離工程の後に終了し、次の点に注意してください。 (他の市販のRNA抽出キットのような)のmirVanaパリ分離キットは、有機溶媒抽出を必要としませんが、また、この手順のためのプロトコルを以下に記載されています。
RNA抽出のためのプロトコルは、2つのステップで構成されます。
1.1。有機抽出(のmirVanaパリRNA抽出キットを使用している場合は不要)
1.2.2。全RNAの分離
1.1。有機抽出
1.1.1。試薬を準備します
- 変性溶液2倍の2 - メルカプトエタノール375μl加え、4℃で保管し
1.1.2。 CSFを準備します
- RNA抽出前に氷上でCSFのすべてのアリコートを解凍。解凍されたCSFの0.5ミリリットルにMS2 RNAのキャリアの1μgのを加え、穏やかに混ぜる。有機溶媒抽出が省略された場合、MS2キャリアは以下の1.2.2.1で説明したサンプルの前にRNA単離に追加されることに注意してください。
- CSFに室温で2XたDenaturing溶液0.5mlを混ぜる。
- CSFプラス2XたDenaturingソリューションにクロロホルム:酸 - フェノールの1ミリリットルを追加し、クロロホルムではなく、混合物の上にある水性緩衝液:酸 - フェノールを含む下相を取り下げてください。この試薬を扱う際の手袋やその他の個人用保護具を使用し、クロロホルムを毒と刺激性であるフェノールが含まれていますまた、酸 - フェノールことに注意してください。
- 混合する30〜60秒間ボルテックスする。便宜のために、試料を2ml /溶液/酸変性フェノール:クロロホルム混合物2つの1.5mlのエッペンドルフチューブに分けられる。
- 室温で最大速度(10,000×g)で5分間遠心分離する。
- 丁寧に下相や相間を乱すことなく、水(上)相を除去し、それを転送する新しいチューブ。回収されたボリュームに注意してください。
1.2。 RNAの単離
それはRNAサンプルを処理するための専用のベンチ、ピペットのセット、およびラックを持っていることをお勧めします。作業領域およびツールは、RNアーゼザップスプレーを用いて汚染除去及び各実験の前ワイプされる。
1.2.1。試薬を準備します。
- 洗浄液2月3日に100%エタノールのmiRNA洗浄液1〜100%エタノールを21ミリリットルと40ミリリットルを追加します。 miRNAの洗浄液1は、潜在的に危険な物質であるグアニジンチオシアネートが含まれていることに注意してください。
1.2.2。全RNAの分離
- 有機抽出から水相に、室温の100%エタノール1.25ボリュームを追加し、完全に混合する。
- コレクションチューブの1にフィルターカートリッジを置きます。
- フィルターカートリッジにライセート/エタノール混合物の700μL以下でピペット。
- 最大で30秒間遠心分離スピード。同じフィルタに連続したアプリケーションでは700μLを超える混合物を適用します。すべての遠心分離後、フロースルーを捨て、洗浄の工程のためにコレクションチューブを保存します。
- 最高速度で15秒間フィルターカートリッジおよび遠心分離機に700μLのmiRNA洗浄液1を適用します。コレクションチューブからフロースルーを捨て、同じコレクションチューブにフィルターカートリッジを交換してください。
- 最高速度で15秒間500μlの洗浄液2月3日、遠心分離を適用します。コレクションチューブからフロースルーを捨て、同じコレクションチューブにフィルターカートリッジを交換してください。最高速度で15秒間第500μLのWash Solution 2月3日、遠心分離を適用します。コレクションチューブからフロースルーを捨て、同じコレクションチューブにフィルターカートリッジを交換してください。フィルターから残留液を除去するために、最大速度で1分間のアセンブリを回転。
- 新鮮なコレクションチューブにフィルターカートリッジを転送します。 100&ムーを適用;フィルタの中心に予熱した(95℃)ヌクレアーゼフリー水のL、キャップを閉じます。 RNAを回収するために最大速度で30秒間遠心分離する。
- RNAを含む溶出液を収集し、その後のアプリケーションのために-80℃で保管してください。
- 光度計の2000C分光光度計を用いて、RNAの1μLを定量化。 RNAキャリアはRNA抽出の間にサンプルに添加された場合RNA定量をスキップすることができることに留意されたい。以下に詳述するように、その場合に8μlのRNAを、cDNA合成に供される。
2。 miRNAプロファイル:定量RT-PCRプロトコル
miRNAプロファイリングのためのプロトコルは、2つのステップで構成されます。
- 第一鎖cDNA合成
- リアルタイムPCR増幅
2.1。第一鎖cDNA合成
2.1.1。鋳型RNAを希釈
- 5 NG /ヌクレアーゼを含まない水を使用した液の濃度に鋳型RNA試料のそれぞれを調整します。もしRNAは(ステップ1.2.2.9を参照)を定量化していない場合、RNAの8μlのcDNA合成に利用される
2.1.2。試薬を準備します
- 優しく5X反応緩衝液およびヌクレアーゼフリーの水を解凍し、直ちに氷上に置きます。
- ボルテックスで混和する。チューブに40μLのヌクレアーゼフリーの水を加えることにより、RNAスパイクインを再懸濁し、ボルテックスで混合し、15〜20分間氷上でそのままにしておきます。使用直前に、冷凍庫から酵素ミックスを削除チューブをフリックで混ぜ、氷上に置きます。すべての試薬をスピンダウン。
2.1.3。逆転写反応のセットアップ
- 1.5ミリリットルエッペンドルフチューブ、またはそれと同等のRT使用液の必要量を準備します(割合でRNA鋳型を除いて、 表1に示されている)、(最大速度で1〜2秒)ボルテックスで混ぜ、簡単に(スピンダウン我々は一定の速度、10秒)でミニエッペンドルフ遠心機を使用し、氷の上に置きます。尚、UniSp6 RNAのスパイクインは、RT反応( 表1参照)、優先検体に添加する。
- ヌクレアーゼフリーのPCRチューブに、RT使用液を分注する。
- 各チューブにテンプレートRNAを分注する。
注意:ピペッティングおよび/またはロボットデッドボリューム10%過剰量/各試薬を計算することを忘れないでください。試薬 パネルIの容量(μL) パネルⅠ+Ⅱ容量(μL) 5X反応バッファー 4.4 8.8 ヌクレアーゼを含まない水 9.9 19.8 酵素ミックス 2.2 4.4 UniSp6 RNAスパイクインテンプレート 1.1 2.2 テンプレートの全RNA(5 NG /μL) 4.4 8.8 全容積 22 44
表1。転写反応のセットアップを逆にします。
2.1.4。試薬を混合し、スピン
- すべての試薬を完全に混合されることを保証するために、穏やかな(1〜2秒)ボルテックスにより反応を混ぜる。混合した後、(一定の速度、10秒でミニエッペンドルフ遠心機)をスピンダウン。
2.1.5。インキュベートし、熱不活性化
- 以下のようにPCR装置をプログラムする:
- 42℃で60分間インキュベート
- 95℃で5分間の逆転写酵素を熱不活性化
- 4℃にすぐに涼しい
- 4℃または凍結で保存
注意:このプロトコルは、この段階で中断することができる。未希釈のcDNAを最大5週間(最大4日間、4℃で随意ストア)を-20℃で保存してもよい。
2.2.1。リアルタイムPCR用試薬を準備
- 氷上でのcDNA(ステップ2.1.5から)を配置します。
- ヌクレアーゼフリーの水と氷の上でPCRマスターミックスを解凍する。アルミホイルで覆うことによって、光からのPCRマスターミックスバイアルを保護します。使用直前に、ミニ遠心機で1〜2秒ボルテックスすることによりPCRマスターミックスを混ぜ、1分間1500×gでスピンダウン。
2.2.2。サイバーグリーンマスターミックス、水、およびcDNAを組み合わせて、PCRプレートに追加
以下の手順は、チューブ表面に付着するcDNAの低濃度を避けることをお勧めします。
- プレートシールを取り外す前に、簡単に1分間1500×gで冷却遠心機でプレート(複数可)をスピンダウン。
- 15ミリリットルコニカルチューブに、2X PCRマスターミックスと水を兼ね備えています。パネルI:2000μL2Xマスターミックスと1980μlの水、パネルⅠ+Ⅱ:4000μL2Xマスターミックスと3,960μ;リットルの水。
- 20μLのcDNA(パネルI)または40μlのcDNAを(私はII +パネル)を追加し、混合する。
- 1〜2秒ボルテックスで穏やかに混合し、1分間1500×gで冷却遠心機でスピンダウン。
- マルチチャンネルピペットリザーバ内にPCRマスターミックス/ cDNAのミックスを置きます。あなたは、マルチチャンネルピペットの長さを有するリザーバを同定するために有していてもよい。これは、マルチチャンネルを通して、等量の分量を可能に十分な大音量のレベルを維持する。これが最後の数分量に向けて非常に重要です。
- 10μlのPCRマスターミックスを分配/ cDNAは、16チャンネルピペットを用いて、384ウェルプレートの各ウェルに混合する。
- 光学シールでプレートをシールする。
- 溶液を混合し、気泡を除去するために、冷却遠心機(1分間1,500×g)で短時間でプレートをスピン。
注意:実験は、この時点で一時停止することができる。最大24時間、4℃で遮光して反応を保管してください。
2.2.3。リアルタイム·PCR
表2に詳述以下のパラメータのリアルタイムPCR増幅および融解曲線分析を行う。
| プロセスステップ | [設定]、ロシュLC480 |
| ポリメラーゼの活性化/変性 | 95°C、10分間 |
| 増幅 | 45増幅サイクルでの 95℃、10秒 60℃、1分 ランプ·レート 1.6℃/秒 光学読む |
| 融解曲線分析 | はい |
表2。ロシュライトサイクラー480を用いてリアルタイムPCRサイクル条件。
2.3。リアルタイムPCRデータ分析
リアルタイムPCRのデータ解析は、Exiqon社ジェネックスプロフェッショナル5.0を使用して行われ、次のT彼は指示をお勧めします。ジェネックスステップバイステップのマニュアルがダウンロードできhttp://www.exiqon.com/ls/Documents/Scientific/Exiqon-data-analysis-guide.pdf
データ分析は、3つのステップで構成されています。
- データのインポート
- データの前処理
- 統計分析
2.3.1。データのインポート
- ロシュライトサイクラー480で2 番目の微分解析方法を選択およびCQ値を計算します。データを表としてエクスポートし、テキストファイルとして保存されます。
- 、データをインポートし、オープンジェネックスとをExiqonインポートウィザード]ボタンをクリックして「開始」をクリックしてください。形式、楽器、プレートレイアウトファイル(複数可)を選択するように指示に従ってください。そのプレートレイアウトファイル(ファイルをEXCEL)をExiqonのWebサイト(からダウンロードされることに注意してくださいhttp://www.exiqon.com/plate-layout-filesを )。
- 重要TパネルIおよびII、「次へ」をクリックします。
- ファイルのインポート後に生成されたテーブルは、定義済みの列が含まれています。サンプルの名前を編集することができ、分類の列は、この工程で添加または除去することができる。完了したら「次へ」をクリックします。
- データを保存し、データエディタにロードします。
2.3.2。データの前処理
- Exiqon社とジェネックスが推奨する複数のプレートを比較する際に、最初に行うことは、前処理メニューからプレート間のキャリブレーションを選択することにより、プレート間のデータを較正することである。
- これは、三連の実行でmiRNAアレイを実行することをお勧めします。 miRNAは3つの複製のうち少なくとも2つに存在していない場合、それは発現されないように設定される。
- 前処理の次のステップでは、カットオフに設定します。カットオフ値を定義すると、閾値サイクル(C Tは)この値よりも高いとのデータが破棄されることを示しています。脳脊髄液試料を用いた本実験では、カットオフは39に設定した。 THERお使いになる前、3つのレプリカにある39以上のC Tが高いと、すべてのサンプルは破棄されます。 miRNAは1プローブ(3つのうちの1レプリカ)が> 39のC tを有する場合は、その測定値は、他の二つのプローブのためのC Tの平均に置き換えられます、彼らが39以下の両方が提供される。
- 参照遺伝子を定義します。ジェネックスProfessionalは、参照遺伝子を同定するためにgeNormおよび/またはNormFinderを利用するためのオプションがあります。すべてのサンプルで同様Cqを値を持つmiRNAのリストを選択し、geNormおよび/またはNormFinderを実行します。この分析によれば、ここに提供された例において、該miR-622及びmiR-1266は、サンプルにわたって最も均一な値を有し、参照遺伝子( 図1)として選択した。
- 次に、データは、参照遺伝子を用いて正規化し、得られた値ΔCtに対応している
- cDNA合成反応は三連で実施した場合は、この時点での値が平均化されるべきである。
- 再シートを検証空とほぼ空の列を移動します。前処理のウィンドウで選択して「シートを検証」し、削除空の列ラインに適用されなく。下の行では、有効なデータの所望の割合を選択し、[適用]をクリックします。あなたはすべてのサンプルに共通する唯一のmiRNAを比較したい場合は、例えば、100パーセントを選択します。
- 失われたデータを処理します。
前処理メニューから「失われたデータ」を選択し、欠落したデータを処理するためのオプションのいずれかを選択しました。このステップは必須です。あなたが未処理欠損データを含むファイルをロードしようとした場合ジェネックスはあなたにエラーになりますので注意してください。 - サンプル(対照に対するすなわち実験)のグループ間の相対的な定量化を決定します。グループ間の相対的な定量化は、ΔΔC T法を用いて計算される。ジェネックスでは、前処理]タブをクリックして、相対的な定量化を選択します。ウィンドウで参照グループを選択し、適用を押します。 exprは、グラフィック表示のためのおよび/またはさらなる統計分析のためにそれを注意してくださいessionデータは対数スケールに変換する必要があります。前処理メニューで、のLog2を選択します。
2.3.3。統計分析
ジェネックス·ソフトウェアは、T-検定およびANOVA統計分析を含む、広範囲のを可能にする。
- ジェネックス、オープンデータ管理に最終的なmdfファイルをロードします。これは、統計分析が遂行される試料の正確なサンプルまたはグループを選択することが重要である。
- 「統計」を選択し、必要なテストに対応するアイコンを選択しました。
- コントロールパネルウィンドウで「ファイル名を指定して実行」をクリックしてください。 Excelやmdfファイルとして結果を保存します。
2.3.4。発現プロファイリング
次のようにマイクロRNAおよびサンプルは、分類されたクラスタ化、および熱マップと系統樹上で可視化することができる
- ジェネックス、オープンデータ管理に最終的なmdfファイルをロードします。サンプルやmiRNAのグループを選択し、作成するには、このウィンドウを使用します。完了したら、「適用」をクリックします。 <左上隅を選択し、クラスタにおけるLi>とは、ヒートマップアイコンをクリック
- コントロールパネル]ウィンドウで「ファイル名を指定して実行」をクリックしてください。ヒートマップは、例えば、TIFF形式やBMPのような様々な形式で保存することができ、それはまたコピーされ、必要に応じて変更することができる。
結果
この研究からの結果は、以前に公開されている1。geNormアプリケーションを使用して、候補参照マイクロRNAの解析から1の結果を示す図 。したがって、2つのマイクロRNAは、miR-622及びmiR-1266は、参照遺伝子として同定されたおよびmiRNA値を正規化するために使用した。
CSFの研究のために、我々は、サンプルの三つのグループを有していた:HIV-(n = 10)に、HIVE脳炎なし(n = 4)に、およびHIV +(HIV +、n = 5)であった。二つのグループは、HIVEおよびHIV +は、HIV-対照群と比較した。統計分析の後に(2.3.3項)11マイクロRNAの発現レベルは、統計的に有意な1発見された。 図2は 、この11マイクロRNA、のmiR-1203-1224-3P、-182 *、-19B-2 *のボックスプロットを表し-204、-362-5P、-484、-720、-744 *、-934、および-937。各列は、リファレンスのないHIV陽性のグループ(ハイブの緑と赤の内のサンプル間でのデータの分布を示しているphalitis)。ウィスカは、中央値、 第 1(Q1)と第 3(Q3)四分位、最大値と最小nonoutliersを示す。
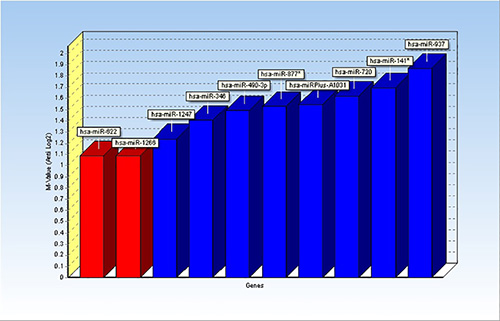
図1。ジェネックス内geNormアプリケーションからの結果を示すグラフバーが。十マイクロRNAは、可能な参照遺伝子と結果として分析したが、最も安定的に発現するmiRNAとしては、miR-622およびmiR - 1266(赤いバー)を示している。 拡大画像を表示するにはここをクリックしてください。

図2。データfの分布を示すボックスプロット脳炎のないHIVE(緑)、HIV陽性のグループ内の11のmiRNA(HIV +、赤)。各列のウィスカーは中央値を示し、 第 1(ボックスの第1四半期、下)および第 3(第3四半期、トップの各箱の)四分位数、nonoutliers(黒線)が最大値と最小値は、より大きな画像を見るにはここをクリックしてください。
ディスカッション
マイクロRNAは、翻訳を阻害および/ またはmRNA分解2を促進することにより、遺伝子発現を調節する小さな非コードRNAである。による無細胞条件での高い安定性のために、マイクロRNAは、多くの体液中で検出されている。さらに、マイクロRNAの別個の発現プロフィールがヒトの癌3-9の様々な段階および/ または進行と相関している。
古典チップアレイまたは最新の深いシーケンシング技術を含むマイクロRNAのプロファイルを作成するために利用できるいくつかのツールがあります。しかし、我々はRNAの最小量を必要とするというさらなる利点を有する高感度のqPCRプラットフォーム10,11を利用することを選んだ。 miRCURY LNAユニバーサルRT microRNAのPCRプロトコールは、完全な2のパネルアレイの40 NGを20μlのcDNA合成反応あたり20 ngの全RNAを使用するように最適化されています。 valuablを扱うときにRNAの少量を使用するオプションを持つことは非常に重要である EなどCSFまたはホルマリン固定パラフィン包埋組織1などの難得る臨床検体。重要なのは、RNAの低量を利用して、試料中に存在する可能性抑制剤の濃度を最小限に抑えます。スパイクインの範囲Ct値からおそらく、サンプル中のいくつかの阻害剤の存在が示されます。スパイクでのプローブは、miRNAプロファイリングする前に阻害剤の存在のためのサンプルをテストするために、別々に購入することができます。このテストでは、単一のリアルタイムPCRは、(かNGかμL)RNAの増加濃度を使用して実行されます。
この議定書では、我々は前にRNA単離に有機相抽出を報告します。これは、多くの新しいRNA抽出キットは、この手順を必要としないことに留意すべきである。例えば、我々は正常にフェノール/クロロホルム抽出せず(データは示していない)の血漿を200μlから直接RNA抽出用miRCURY RNA単離キット生体液を用いたプラズマmiRNAをプロファイリングしている。
一般に_content ">、それは統計的に有意な結果を得るために必要な反復の数を適切に決定するために、事前に実験を設計することが重要である。反復の数は、分析されるサンプルの数に依存し得るとに依存し得るサンプルまたはサンプルのグループ内でのバリエーション。我々は、サンプル、合計で20の比較的低い数字を使用しているため、我々の研究、のために、我々は三重でcDNA合成反応を設立することを決定した。実験を設定する前に、生物統計学者と相談月賢明な選択であると強くお勧めします。C tを定義すると、カットオフ値は重要であり、サンプルの種類に依存し、高度に発現されたmiRNAのためにそれは25〜35の間で設定できますが、このような私たちのCSF検体のような低発現したmiRNAのために、高く設定することができます。それはデータ解析になる別の重要なステップは、参照遺伝子(単数または複数)の選択である。 (このような培養細胞におけるmiRNAプロファイリングのような)いくつかの堅牢なデータAG用すべてのサンプルの平均C tを示しローバル正規化を用いてもよい。しかし、これは、バリエーションを提示し、CSFのようなサンプルのためのオプションではありません。同様に、我々は、参照遺伝子として一般に体液中に変化しないと考えられているそれらのmiRNAを利用することができなかった。その代わりに、我々は、レプリカを含むすべてのサンプルで同様のC Tを示したすべてのmiRNAを、選択され、ジェネックスで利用geNorm分析( 図1)を実行しました。結果は、少なくとも可変的発現miRNAとしてのmiR-1266およびmiR-622が示され、それらは参照遺伝子として用いた。 (CtrelのCt-) -基との間のmiRNAの発現の比較は、標準的な化学式2に従うジェネックスの相対的定量化ツールを使用して決定することができる。最後に、結果がヒートマップ図、グラフィック·バーや、 図2のボックスプロットとしてプロットし、他のタイプとして視覚化することができる。ジェネックスで利用可能な視覚化の他のタイプは、階層的クラスタリングを含む、自己組織化マップ(SOM)と、主成分分析(PCA)。 miRNAのに加えて、ジェネックスソフトウェアは、長い非コードRNAである(lncRNAs)プロファイリングのようなアレイの他のタイプの分析のために使用することができる。プレートレイアウトは、エクセル形式でインポートすることができ、miRNAの分析のために記載されるようにデータを扱うことができる。実際、上記の手順で説明したように、我々はのmirVana miRNAの単離キットを使用して、プライマリマウス胎児皮質ニューロンからのlncRNAsをプロファイルしていると我々はジェネックス(未発表データ)を使用してデータを分析した。
要約すると、我々は、脳脊髄液中のマイクロRNAのプロファイルを作成するためのプロトコルを記載した。 RNA抽出に関連するいくつかの変更を加えて、この手順は、他の体液および/または組織の他のタイプのmiRNAをプロファイリングするように適合させることができる。ここで説明する手順で、有機溶媒抽出工程が、事前のRNA単離するために実行されることに注意してください。市販のキットを使用するとき、一般的に、これは、パリのmirVana内線として、必要とされないractionキット。体液からRNAを抽出し、キャリアRNAを試料に添加する場合に加えて、RNA及び2-8μlのRNAをcDNA合成に供される定量化する必要はない。私たちの経験と実験のこのタイプに関連した高いコストを考慮から、我々は最初の数のサンプルをテストしてから、統計的に有意な結果を得るために、プロファイル対象のサンプル/レプリカの数のための統計学者と相談をお勧めします。
開示事項
著者らは、開示することは何もありません。
謝辞
国立精神衛生研究所から:記載されたプロジェクトは、受賞番号R01MH079751(F·ペルッツィPI)によってサポートされていました。内容はもっぱら著者の責任であり、必ずしも国立精神衛生研究所や国立衛生研究所の公式見解を示すものではありません。
資料
| Name | Company | Catalog Number | Comments |
Table 3. List of equipment. | |||
| Finnpipette Novus Multichannel Pipetter | Thermo Scientific | HH05279 | |
| Finntip Pipette Tips | Thermo Scientific | 9400613 | |
| Thermal Cycler C1000 | Biorad | ||
| 0.2 ml Low Profile, Clear PCR tubes | Biorad | TLS0801 | |
| Flat Cap Strips | Biorad | TLS0803 | |
LightCycler 480 Real-Time PCR System | Roche | ||
LightCycler 480 Sealing Foil | Roche | 04 729 757 001 | |
| Refrigerated Centrifuge 5804R | Eppendorf | ||
| Swing-bucket Rotor, 4-place | Eppendorf | A-4-44 | |
| Bench-Top Mini Centrifuge | Fisher | 05-090-100 | |
| Bench-Top Vortex | Fisher | ||
| 1.5 ml Microcentrifuge Tubes, Sterilized | Fisher | 02-681-5 | |
| Matrix Reagent Reservoir, 25 ml | Thermo Scientific | 8093 | |
| Thermomixer Confort | Eppendorf | ||
Bench-Top Mini Centrifuge Sigma 1-15 | Sigma | ||
| Bench-Top Vortex | Velp Scientifica | F202A0173 | |
Table 4. List of reagents. | |||
| Universal c-DNA synthesis kit, 16-32 rxns | Exiqon | 203300 | |
| SYBR Green master mix, Universal RT, 25 ml | Exiqon | 203400 | |
| Ultrapure Distilled Water Dnase, Rnase free | Invitrogen | 10977-015 | |
| MicroRNA Ready to use PCR Human Panels (I+II) V2.R | Exiqon | 203608 | |
mirVana miRNA isolation Kit, 40 isolations | Ambion | AM1556 | |
| MS2 RNA carrier | Roche Applied Science | 10165948001 | |
2-mercaptoethanol 98% | Sigma Aldrich | M3148-25ml | |
| Ethanol 100% | Carlo Erba | 64-17-5 | |
| Nuclease free water | Qiagen | 1039480 | |
RNAse Zap | Ambion | AM9780 | |
参考文献
- Pacifici, M., et al. Cerebrospinal fluid miRNA profile in HIV-encephalitis. J. Cell. Physiol. 10, (2012).
- Krol, J., Loedige, I., Filipowicz, W. The widespread regulation of microRNA biogenesis, function and decay. Nat. Rev. Genet.. 11, 597-610 (2010).
- Calin, G. A., Croce, C. M. MicroRNA signatures in human cancers. Nat. Rev. Cancer. 6, 857-866 (2006).
- Chen, X., et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 18, 997-1006 (2008).
- De Smaele, E., Ferretti, E., Gulino, A. MicroRNAs as biomarkers for CNS cancer and other disorders. Brain Res. 1338, 100-111 (2010).
- Heneghan, H. M., Miller, N., Kerin, M. J. MiRNAs as biomarkers and therapeutic targets in cancer. Curr. Opin. Pharmacol. 10, 543-550 (2010).
- Kosaka, N., Iguchi, H., Ochiya, T. Circulating microRNA in body fluid: a new potential biomarker for cancer diagnosis and prognosis. Cancer Sci. 101, 2087-2092 (2010).
- Lu, J., et al. MicroRNA expression profiles classify human cancers. Nature. 435, 834-838 (2005).
- Shah, A. A., Leidinger, P., Blin, N., Meese, E. miRNA: small molecules as potential novel biomarkers in cancer. Curr. Med. Chem. 17, 4427-4432 (2010).
- Blondal, T., et al. Assessing sample and miRNA profile quality in serum and plasma or other biofluids. Methods. 59, 1-6 (2013).
- Jensen, S. G., et al. Evaluation of two commercial global miRNA expression profiling platforms for detection of less abundant miRNAs. BMC Genomics. 12, 435 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved