Method Article
النخاعي السوائل عن طريق الرنا الميكروي التنميط الكمي في الوقت الحقيقي PCR
In This Article
Summary
نحن تصف بروتوكول الوقت الحقيقي PCR لملف microRNAs في السائل النخاعي (CSF). باستثناء بروتوكولات استخراج الحمض النووي الريبي، ويمكن تمديد هذا الإجراء إلى الحمض النووي الريبي المستخرج من مخالطة سوائل جسمه الأخرى، الخلايا المستزرعة، أو عينات الأنسجة.
Abstract
MicroRNAs (miRNAs) تشكل طبقة قوية من تنظيم الجينات من خلال توجيه RISC لاستهداف مواقع تقع على mRNAs و، وبالتالي، من خلال تحوير قمعهم متعدية. وقد تبين أن التغيرات في التعبير ميرنا أن تشارك في تطوير جميع الأمراض المعقدة الكبرى. علاوة على ذلك، أظهرت النتائج الأخيرة التي miRNAs يمكن يفرز في البيئة خارج الخلية وتدخل إلى مجرى الدم وسوائل الجسم الأخرى حيث يمكن أن تعمم مع ارتفاع الاستقرار. لا تزال وظيفة مثل هذه miRNAs تعميم بعيد المنال إلى حد كبير، ولكن قد يؤدي النهج إنتاجية عالية منهجية، مثل ميرنا صفائف التنميط، إلى التعرف على التواقيع ميرنا في العديد من الحالات المرضية، بما في ذلك الاضطرابات العصبية وعدة أنواع من السرطان. في هذا السياق، وتحديد ميرنا الشخصي التعبير في السائل النخاعي، كما ورد في دراستنا الأخيرة، يجعل miRNAs المرشحين جذابة للتحليل العلامات البيولوجية. _content "> هناك العديد من الأدوات المتاحة لالتنميط microRNAs، مثل ميكروأرس، الكمي في الوقت الحقيقي PCR (QPCR)، وتسلسل عميق. هنا، نحن تصف طريقة حساسة لملف microRNAs في السوائل المخية التي كتبها الكمي في الوقت الحقيقي PCR. نحن استخدام Exiqon الرنا الميكروي جاهزة للاستخدام الألواح الإنسان PCR الأول والثاني V2.R، والذي يسمح الكشف عن 742 microRNAs الإنسان فريدة من نوعها. أجرينا صفائف في أشواط ثلاث نسخ، ونحن المصنعة وتحليل بيانات باستخدام برنامج GENEX المهنية 5.
باستخدام هذا البروتوكول، لدينا لمحة بنجاح microRNAs في أنواع مختلفة من خطوط الخلايا والخلايا الأولية، CSF، والبلازما، والأنسجة جزءا لا يتجزأ من البارافين الثابتة الفورمالين.
Introduction
MicroRNAs تنتمي لعائلة صغيرة (21-23 الإقليم الشمالي في الطول) غير المكودة الرنا التي تنظم التعبير الجيني آخر ما بعد transcriptionally. microRNAs يمكن يفرز في الفضاء خارج الخلية حيث تبدو مستقرة نسبيا. مع تحديد التغيرات في التعبير ميرنا يمكن أن يكون خطوة مهمة نحو تحديد المؤشرات الحيوية، وأداء لمحات ميرنا والتعامل مع كمية كبيرة من البيانات قد تكون مخيفة.
هنا، نحن تصف بروتوكول لتحديد التغيرات في التعبير ميرنا في السائل النخاعي (ينطبق على سوائل الجسم الأخرى) من قبل في الوقت الحقيقي PCR الحساسة. نحن أيضا وصف استخدام البرمجيات لتحليل البيانات، بما في ذلك التحليل الإحصائي وتمثيل رسومي للنتائج. الإجراء بأكمله من السهل نسبيا ومباشرة، واعتمادا على عدد من العينات المراد لمحة وعدد من آلات PCR الوقت الحقيقي متاحة، أيضا سريع نسبيا. الجزء التجريبي يتطلب الدقة في التعامل معالحمض النووي الريبي وpipetting لفي لوحات 384 جيدا، في حين أن قسم تحليل البيانات باستخدام GENEX يتطلب بعض المعرفة الأساسية في مجال المعلوماتية والإحصاءات.
Protocol
يصف بروتوكول التالية الإجراء العادي لعزل الحمض النووي الريبي من CSF و ملفه الشخصي microRNAs باستخدام لوحات PCR جاهزة. علما بأن استخراج مرحلة العضوية هو اختياري، والتي يتم إضافتها على الحمض النووي الريبي الناقل للعينة خلال استخراج ضمان الانتعاش القصوى من الحمض النووي الريبي. وبالتالي، ليست هناك حاجة لتحديد الحمض النووي الريبي.
عموما، يمكن تشغيل ما معدله 6-8 لوحات في يوم واحد إذا تم تصنيعه [كدنا] قبل (حوالي 2 ساعة) في اليوم. يتم تنفيذ تحليل البيانات عندما تم محة عن العينات وتحميلها في البرنامج. اعتمادا على عدد من العينات / مجموعات أو الجمع بينهما للمقارنة، قد تتطلب تحليل البيانات من واحد إلى عدة ساعات.
1. استخراج الحمض النووي الريبي
تم إجراء استخراج الحمض النووي الريبي من عينات السائل النخاعي، وتخزينها في المجمد -80 درجة مئوية في مأخوذة حتى التحليل. لهذا الإجراء تم استخدام عدة العزلة mirVana باريس، في أعقاب الصكوك الشركة المصنعةctions لعزل الحمض النووي الريبي مجموع. يرجى ملاحظة أنه على الرغم من تخصيب للأنواع الحمض النووي الريبي الصغيرة هو ممكن مع هذه المجموعة، لا يتم إجراء هذه الخطوة ويتم إنهاء إجراءات استخراج الحمض النووي الريبي مجموع الخطوة بعد عزل الحمض النووي الريبي. بالإضافة إلى ذلك، على الرغم من أن عدة العزلة mirVana باريس (مثل غيرها من مستلزمات عزل الحمض النووي الريبي متوفرة تجاريا) لا يتطلب استخراج العضوية، وبروتوكول لهذا الإجراء يمكن الاطلاع أدناه.
بروتوكول لاستخراج الحمض النووي الريبي يتكون من خطوتين:
1.1. استخراج العضوية (غير مطلوب إذا باستخدام mirVana باريس عدة استخراج الحمض النووي الريبي)
1.2.2. مجموع عزل الحمض النووي الريبي
1.1. استخراج العضوية
1.1.1. إعداد الكواشف
- إضافة 375 ميكرولتر من 2 المركابتويثانول إلى 2x تغيير طبيعة الحل، وتخزينها في 4 درجات مئوية.
1.1.2. إعداد CSF
- ذوبان الجليد كل قسامة من CSF على الجليد قبل استخراج الحمض النووي الريبي. إضافة 1 ميكروغرام من الحمض النووي الريبي الناقل MS2 إلى 0.5 مل من السائل النخاعي إذابة وبلطفالمزيج. لاحظ أنه إذا تم حذف استخراج العضوية، وستضاف الناقل MS2 إلى عينة عزل الحمض النووي الريبي قبل وصفها في 1.2.2.1 أدناه.
- خلط 0.5 مل من 2X تغيير طبيعة الحل في درجة حرارة الغرفة إلى CSF.
- إضافة 1 مل من حمض الفينول: كلوروفورم إلى CSF بالإضافة إلى تغيير طبيعة الحل 2X: تأكد من سحب مرحلة القاع التي تحتوي على حمض الفينول: كلوروفورم، وليس العازلة المائية التي تقع على قمة الخليط. بالإضافة إلى ذلك، لاحظ أن حمض الفينول: كلوروفورم يحتوي على الفينول، وهو السم ومصدر إزعاج، والقفازات وغيرها من استخدام معدات الوقاية الشخصية عند العمل مع هذا كاشف.
- دوامة لمدة 30-60 ثانية إلى المزيج. للراحة، ومل من عينة 2 / تغيير طبيعة الحل / حمض الفينول: كلوروفورم مزيج تنقسم إلى قسمين أنابيب 1.5 مل إيبندورف.
- أجهزة الطرد المركزي لمدة 5 دقائق في أقصى سرعة (10،000 x ج) في درجة حرارة الغرفة.
- إزالة بعناية (العلوي) المرحلة المائية من دون إزعاج مرحلة أقل أو الطور البيني وتحويلها إلىأنبوب جديد. لاحظ حجم استردادها.
1.2. عزل الحمض النووي الريبي
فمن المستحسن أن يكون لها مقعد مخصص، مجموعة من الماصات، ورفوف للتعامل مع عينات الحمض النووي الريبي. يتم تطهير منطقة العمل والأدوات باستخدام رذاذ ريبونوكلياز زاب ومناديل قبل كل تجربة.
1.2.1. إعداد الكواشف:
- إضافة 21 مل من الإيثانول بنسبة 100٪ لميرنا غسل الحل 1 و 40 مل من الإيثانول بنسبة 100٪ لغسل الحل 2/3. يرجى ملاحظة أن ميرنا غسل الحل 1 يحتوي على ثيوسيانات guanidium التي هي عبارة عن مادة يحتمل أن تكون خطرة.
1.2.2. مجموع عزل الحمض النووي الريبي
- إضافة 1.25 حجم درجة حرارة الغرفة الإيثانول بنسبة 100٪ إلى المرحلة المائية من استخراج العضوية وتخلط جيدا.
- وضع خرطوشة تصفية في واحدة من أنابيب جمع.
- ماصة لا يزيد عن 700 ميكرولتر من خليط المحللة / الإيثانول على خرطوشة تصفية.
- أجهزة الطرد المركزي لمدة 30 ثانية كحد أقصىالسرعة. تطبيق الخليط تتجاوز 700 ميكرولتر في التطبيقات المتتالية لنفس المرشح. تجاهل التدفق من خلال بعد كل الطرد المركزي وحفظ أنبوب جمع للخطوات الغسيل.
- تطبيق 700 ميكرولتر ميرنا غسل الحل 1 إلى خرطوشة تصفية وأجهزة الطرد المركزي لمدة 15 ثانية في أقصى سرعة. تجاهل التدفق من خلال أنبوب من جمع واستبدال خرطوشة تصفية في نفس مجموعة أنبوب.
- تطبيق 500 ميكرولتر محلول الغسيل 2/3 وأجهزة الطرد المركزي لمدة 15 ثانية في أقصى سرعة. تجاهل التدفق من خلال أنبوب من جمع واستبدال خرطوشة تصفية في نفس مجموعة أنبوب. تطبيق 500 ميكرولتر الثانية محلول الغسيل 2/3 وأجهزة الطرد المركزي لمدة 15 ثانية في أقصى سرعة. تجاهل التدفق من خلال أنبوب من جمع واستبدال خرطوشة تصفية في نفس مجموعة أنبوب. تدور الجمعية لمدة 1 دقيقة في أقصى سرعة لإزالة السوائل المتبقية من التصفية.
- نقل خرطوشة تصفية في أنبوب جمع الطازجة. تطبيق 100 ومو؛ لتر من مسخن (إلى 95 درجة مئوية) nuclease خالية من المياه لوسط التصفية، وأغلق الغطاء. أجهزة الطرد المركزي لمدة 30 ثانية في أقصى سرعة لاسترداد الحمض النووي الريبي.
- جمع الحمض النووي الريبي التي تحتوي على شطافة وتخزينها في -80 درجة مئوية لمدة التطبيقات اللاحقة.
- قياس 1 ميكرولتر من الحمض النووي الريبي باستخدام معمل معمل NanoDrop 2000C. لاحظ أن الحمض النووي الريبي الكمي يمكن تخطي إذا تم إضافة حاملة الحمض النووي الريبي للعينة خلال استخراج الحمض النووي الريبي. في هذه الحالة يتعرضون 8 ميكرولتر من الحمض النووي الريبي لتخليق [كدنا] كما هو مفصل أدناه.
2. الملف ميرنا: بروتوكول QRT-PCR
بروتوكول لميرنا التنميط يتكون من خطوتين:
- التوليف [كدنا] أول حبلا
- في الوقت الحقيقي PCR التضخيم
2.1. التوليف [كدنا] أول حبلا
2.1.1. تمييع القالب الحمض النووي الريبي
- ضبط كل من عينات الحمض النووي الريبي القالب إلى تركيز من 5 نانوغرام / ميكرولتر باستخدام نوكلياز مجانية المياه. إذا كانولم يتم تحديد الحمض النووي الريبي (راجع الخطوة 1.2.2.9)، ثم تستخدم 8 ميكرولتر من الحمض النووي الريبي لتخليق [كدنا]
2.1.2. إعداد الكواشف
- ذوبان الجليد بلطف العازلة رد فعل 5X والمياه nuclease الحرة، ووضع على الفور على الجليد.
- مزيج من قبل vortexing. resuspend والحمض النووي الريبي في ارتفاع بإضافة 40 ميكرولتر المياه مجانا نوكلياز إلى أنبوب ومزيج من قبل vortexing؛ ترك الأمر على الجليد لمدة 15-20 دقيقة. مباشرة قبل الاستعمال، وإزالة مزيج الانزيم من الثلاجة، ومزيج عبها بواسطة الأنابيب ووضع على الجليد. تدور أسفل كل الكواشف.
2.1.3. عكس الإعداد رد فعل النسخ
- إعداد المبلغ المطلوب من حل RT العمل في أنبوب 1.5 مل إيبندورف، أو ما يعادلها (بالنسب المشار إليها في الجدول 1، باستثناء القالب الحمض النووي الريبي)، ومزيج من قبل vortexing (1-2 ثانية في سرعة قصوى)، وتدور لفترة وجيزة لأسفل ( ونحن نستخدم أجهزة الطرد المركزي إيبندورف مصغرة مع سرعة ثابتة، و 10 ثانية) ووضعه على الجليد. لاحظ أن الحمض النووي الريبي ارتفاع UniSp6في يضاف إلى العينة قبل رد الفعل RT (انظر الجدول 1).
- الاستغناء RT حل العمل في نوكلياز أنابيب PCR الحرة.
- الاستغناء قالب الحمض النووي الريبي في كل أنبوب.
ملاحظة: تذكر لحساب 10٪ حجم الفائض / كل كاشف للpipetting لو / أو حجم القتلى الروبوتية. ص>كاشف الفريق الأول المجلد (ميكرولتر) الفريق الأول + الثاني المجلد (ميكرولتر) 5X العازلة رد فعل 4.4 8.8 نوكلياز مجانية المياه 9.9 19.8 مزيج انزيم 2.2 4.4 UniSp6 RNA سبايك في قالب 1.1 2.2 الحمض النووي الريبي مجموع القالب (5 نانوغرام / ميكرولتر) 4.4 8.8 اجمالى حجم التداول 22 44
الجدول 1. عكس النسخ الإعداد التفاعل.
2.1.4. خلط وتدور الكواشف
- خلط رد فعل من جانب لطيف (1-2 ثانية) vortexing للضمان أن جميع الكواشف يتم خلطها بشكل تام. بعد الاختلاط، وتدور باستمرار (مصغرة الطرد المركزي إيبندورف مع سرعة ثابتة، و 10 ثانية).
2.1.5. احتضان وتعطيل الحرارة
- برمجة جهاز PCR على النحو التالي:
- احتضان لمدة 60 دقيقة في 42 ° C
- للحرارة إبطال نشاط الناسخ العكسي لمدة 5 دقائق عند 95 درجة مئوية
- بارد على الفور إلى 4 درجات مئوية
- تخزينها في 4 درجة مئوية أو التجميد
ملاحظة: يمكن أن توقف البروتوكول في هذه المرحلة. قد أبقى [كدنا] مخفف في -20 درجة مئوية لمدة تصل إلى 5 أسابيع (مخزن اختياري في 4 درجات مئوية لمدة تصل إلى 4 أيام).
الطبقة = "jove_step"> 2.2. في الوقت الحقيقي PCR التضخيم
2.2.1. إعداد الكواشف لفي الوقت الحقيقي PCR
- وضع كدنا] (من الخطوة 2.1.5) على الجليد.
- ذوبان الجليد المياه الحرة وماستر PCR مزيج نوكلياز على الجليد. حماية PCR قارورة مزيج الماجستير من الضوء من خلال تغطية لهم رقائق الألومنيوم. فورا قبل الاستخدام، وخلط مزيج ماجستير PCR من قبل vortexing 1-2 ثانية في جهاز للطرد المركزي مصغرة وتدور باستمرار في 1،500 x ج لمدة 1 دقيقة.
2.2.2. الجمع بين SYBR الأخضر مزيج الرئيسي، والمياه، وكدنا] وإضافة إلى لوحات PCR
ينصح الإجراء التالي لتجنب تركيزات منخفضة من [كدنا] من الانضمام إلى سطح الأنبوب:
- قبل إزالة الختم لوحة، وتدور لفترة وجيزة لأسفل لوحة (ق) في جهاز للطرد المركزي المبردة في 1،500 x ج لمدة 1 دقيقة.
- في أنبوب 15 مل المخروطية، والجمع بين 2X PCR مزيج الماجستير والمياه. الفريق الأول: 2،000 ميكرولتر مزيج الرئيسي 2X و1،980 ميكرولتر المياه؛ وحة I + II: 4،000 ميكرولتر مزيج الرئيسي 2X و3،960 μ؛ لتر ماء.
- إضافة 20 ميكرولتر [كدنا] (الفريق الأول) أو 40 ميكرولتر [كدنا] (لوحة I + II) والمزيج.
- المزيج بلطف من قبل vortexing 1-2 ثانية وتدور باستمرار في جهاز للطرد المركزي المبردة في 1،500 x ج لمدة 1 دقيقة.
- وضع PCR ماستر مزيج / [كدنا المزيج في ماصة الأقنية الخزان. قد يكون لديك لتحديد الخزان الذي يحتوي على طول ماصة الأقنية. هذا يحافظ على مستوى حجم عالية بما فيه الكفاية ليسمح مأخوذة حجم مساو في جميع أنحاء الأقنية. هذا أمر بالغ الأهمية نحو مأخوذة القليلة الماضية.
- الاستغناء PCR 10 ميكرولتر مزيج ماستر / كدنا] مزيج إلى كل بئر من لوحة 384 جيدا باستخدام ماصة 16 قناة.
- ختم لوحة مع الختم البصرية.
- تدور لفترة وجيزة في لوحة أجهزة الطرد المركزي المبردة (1،500 x ج لمدة 1 دقيقة)، وخلط الحلول وإزالة فقاعات الهواء.
ملاحظة: يمكن أن يكون مؤقتا التجربة في هذه المرحلة. ردود الفعل تخزين محمية من الضوء في 4 درجات مئوية لمدة تصل إلى 24 ساعة.
2.2.3. في الوقت الحقيقي PCR
أداء في الوقت الحقيقي PCR التضخيم وتحليل منحنى ذوبان التالية المعلمات المفصلة في الجدول 2.
| الخطوة العملية | الإعدادات، روش LC480 |
| البلمرة تفعيل / تمسخ | 95 ° C، 10 دقيقة |
| توسيع | 45 دورات التضخيم في 95 ° C، 10 ثانية 60 درجة مئوية، 1 دقيقة معدل المنحدر 1.6 ° C / ثانية قراءة البصرية |
| تحليل منحنى ذوبان | نعم |
الجدول 2. في الوقت الحقيقي PCR الظروف دورة باستخدام روش LightCycler 480.
2.3. في الوقت الحقيقي PCR تحليل البيانات
ويتم في الوقت الحقيقي PCR تحليل البيانات مع Exiqon GENEX الاحترافية 5.0، ر التاليةوأوصى التعليمات. وGENEX خطوة بخطوة دليل يمكن تحميلها في http://www.exiqon.com/ls/Documents/Scientific/Exiqon-data-analysis-guide.pdf
يتكون تحليل البيانات من ثلاث خطوات:
- استيراد البيانات
- تجهيزها من البيانات
- التحليل الإحصائي
2.3.1. استيراد البيانات
- في روش LightCycler 480 حدد أسلوب التحليل المشتقة الثانية (2) وحساب القيم الكلوروكوين. ويتم تصدير البيانات كجدول وحفظها كملفات نصية.
- لاستيراد البيانات، مفتوحة GENEX وانقر على زر معالج الاستيراد Exiqon وانقر على زر "البدء". اتبع الإرشادات لتحديد الشكل، والصك وملف تخطيط لوحة (ق). لاحظ أن ملفات تخطيط لوحة (ملفات اكسل) يتم تحميلها من موقع على شبكة الإنترنت Exiqon ( http://www.exiqon.com/plate-layout-files ).
- المجمدةر الفريق الأول والثاني وانقر على زر "التالي".
- الجدول إنشاؤها بعد ملف الاستيراد يحتوي على أعمدة محددة مسبقا. أسماء العينات يمكن تحريرها والأعمدة تصنيف يمكن إضافة أو إزالة في هذه الخطوة. انقر على زر "التالي" عند الانتهاء.
- حفظ البيانات وتحميل البيانات إلى محرر.
2.3.2. تجهيزها من البيانات
- على النحو الموصى به من قبل Exiqon وGENEX، عند المقارنة بين لوحات متعددة أول شيء نفعله هو لمعايرة البيانات بين لوحات عن طريق اختيار بين لوحة المعايرة من القائمة تجهيزها.
- فمن المستحسن لتشغيل صفائف ميرنا في أشواط ثلاث نسخ. إذا كان ميرنا غير موجود في اثنين على الأقل من أصل ثلاث نسخ طبق الأصل أن يتم تعيين أنها nonexpressed.
- في الخطوة التالية في تجهيزها، ووضع قطع. تحديد قيمة قطع يشير إلى أن البيانات مع دورة عتبة (C ر) أعلى من هذه القيمة يتم تجاهل. في التجارب الحالية باستخدام عينة السائل النخاعي، تم تعيين قطع في 39. ذرefore، سيتم تجاهل جميع العينات مع C ر أعلى من 39 في النسخ المتماثلة الثلاثة. إذا كان لديه ميرنا C ر> 39 لتحقيق واحد (نسخة متماثلة واحدة من أصل ثلاثة)، سيتم استبدال تلك القراءة مع متوسط C طن الآخر تحقيقين، شريطة أن تكون كلا أدناه 39.
- تحديد الجينات المرجعية. GENEX المهنية لديه خيار للاستفادة geNorm و / أو NormFinder لتحديد الجينات المرجعية. تحديد قائمة لل miRNAs التي تحتوي على قيم الكلوروكوين مماثلة في جميع العينات وتشغيل geNorm و / أو NormFinder. وفقا لهذا التحليل، في المثال المقدمة هنا، وكان مير 622 ومير 1266 أهم القيم موحدة عبر العينات وكما تم اختيار الجينات المرجعية (الشكل 1).
- المقبل، يتم تطبيع البيانات باستخدام الجينات المرجعية والقيم التي تم الحصول عليها تتوافق مع ر ΔC
- إذا أجريت ردود فعل التوليف [كدنا] في يثلث، في هذه النقطة يجب أن متوسط القيم.
- التحقق من صحة ورقة لإعادةنقل أعمدة فارغة وخاوية تقريبا. في إطار تجهيزها حدد "التحقق من صحة ورقة" ومما تنطبق على إزالة خط أعمدة فارغة. في السطر التالي، اختارت النسبة المئوية المطلوبة من بيانات صالحة وانقر فوق تطبيق. على سبيل المثال، حدد 100٪ إذا كنت ترغب في مقارنة miRNAs فقط مشتركة بين جميع العينات.
- معالجة البيانات المفقودة.
حدد "بيانات مفقود" من القائمة تجهيزها واختار واحد من الخيارات للتعامل مع البيانات المفقودة. مطلوب هذه الخطوة. نلاحظ أن GENEX سوف أعطيك خطأ إذا حاولت تحميل الملفات التي تحتوي على بيانات مفقودة لم تتم معالجته. - تحديد الكمي النسبي بين مجموعات من عينات (أي. التجربة مقابل السيطرة). يتم حساب الكمي النسبي بين المجموعات باستخدام ΔΔ C طريقة ر. في GENEX، انقر فوق علامة التبويب تجهيزها وتحديد الكمي النسبي. في إطار اختيار المجموعة المرجعية وضرب تطبيق. لاحظ أن للتمثيلات رسومية و / أو لمزيد من التحليلات الإحصائية، EXPRيجب تحويل البيانات ession إلى مقياس لوغاريتمي. في القائمة تجهيزها، حدد Log2.
2.3.3. التحليل الإحصائي
برنامج يسمح GENEX مجموعة واسعة من التحليلات الإحصائية، بما في ذلك اختبار T-ANOVA و.
- تحميل ملف يمول النهائي في GENEX وإدارة البيانات المفتوحة. فمن الأهمية بمكان لتحديد عينات أو مجموعات الصحيح للعينات التي تم إجراء التحليل الإحصائي.
- حدد "الإحصاء" واختار رمز المقابلة لاختبار المطلوب.
- انقر على زر "تشغيل" في إطار لوحة التحكم. حفظ النتائج على النحو التفوق أو الملفات يمول.
2.3.4. التنميط التعبير
MicroRNAs والعينات ويمكن تصنيف، مجمعة، وتصور على نار خرائط وdendrograms، على النحو التالي
- تحميل ملف يمول النهائي في GENEX وإدارة البيانات المفتوحة. استخدام هذه النافذة لتحديد مجموعات من عينات أو miRNAs وخلق. انقر فوق "تطبيق" عند الانتهاء. <لى> في الزاوية اليسرى العليا حدد العنقودية وانقر على أيقونة heatmap
- في إطار لوحة التحكم انقر فوق "تشغيل". يمكن حفظ heatmap في أشكال مختلفة مثل شجار أو BMP، بل يمكن أيضا أن يتم نسخها وتعديلها حسب الحاجة.
النتائج
النتائج من هذه الدراسة قد نشرت سابقا 1. الشكل 1 يبين النتائج من تحليل microRNAs المرجعية المرشحة باستخدام تطبيق geNorm. وفقا لذلك، وهما microRNAs، مير 622 ومير 1266، كما تم تحديد الجينات المرجعية، وكانت تستخدم لتطبيع القيم ميرنا.
لدراسة CSF كان لدينا ثلاث مجموعات من العينات: فيروس نقص المناعة البشرية (ن = 10)، HIVE (ن = 4)، وفيروس نقص المناعة البشرية + دون التهاب الدماغ (HIV +، ن = 5). المجموعتين، وفيروس نقص المناعة البشرية HIVE +، وتمت مقارنة مع السيطرة فيروس نقص المناعة البشرية للمجموعة. بعد التحليل الإحصائي (القسم 2.3.3) تم العثور على مستويات التعبير من أحد عشر microRNAs ذات دلالة إحصائية 1. الشكل 2 يمثل مؤامرة مربع من هذه أحد عشر microRNAs، مير 1203، 1224--3P، -182 *،-19B-2 *، -204،-362-5P، -484، -720، -744 *، -934، -937 و. يظهر كل عمود توزيع البيانات عبر العينات ضمن المجموعة (الأخضر للHIVE والأحمر لفيروس نقص المناعة البشرية + دون سينعقدphalitis). شعيرات تشير إلى الوسيط، 1 شارع (Q1) و 3 الثالث (Q3) الربع، والحد الأقصى والحد الأدنى nonoutliers.
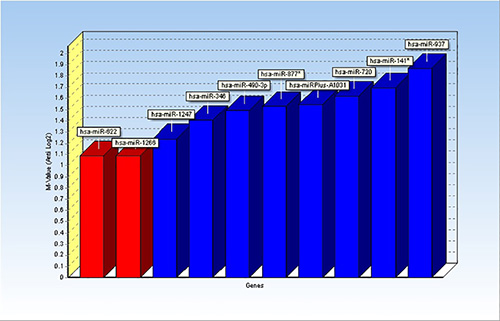
الشكل 1. شريط الرسم تظهر النتائج من تطبيق geNorm داخل GENEX. تم تحليل عشرة microRNAs كما جينات مرجعية ممكن، وتشير النتائج إلى مير ومير 622 و 1266 (الحانات الحمراء) كما أعرب معظم miRNAs ثابت. اضغط هنا لمشاهدة صورة أكبر.

الشكل 2. مؤامرة مربع تبين توزيع و البياناتأو كل من miRNAs أحد عشر ضمن مجموعات من HIVE (الخضراء) وفيروس نقص المناعة البشرية + دون التهاب الدماغ (HIV + والأحمر)، وشعيرات في كل عمود إلى الوسيط، 1 شارع (Q1، أسفل مربع) و 3 الثالث (Q3، أعلى من مربع) الربعية، القيم القصوى والدنيا التي هي nonoutliers (الخطوط السوداء). اضغط هنا لمشاهدة صورة أكبر.
Discussion
MicroRNAs هي الرناوات غير المكودة الصغيرة التي تنظم التعبير الجيني عن طريق تثبيط الترجمة و / أو تعزيز تدهور مرنا 2. بسبب ارتفاع الاستقرار في ظروف خالية من الخلايا، وقد تم الكشف عن microRNAs في كثير من سوائل الجسم. علاوة على ذلك، ارتبط الشخصي التعبير متميزة من microRNAs مع المرحلة و / أو تطور في مجموعة متنوعة من السرطانات البشرية 3-9.
وهناك العديد من الأدوات المتاحة لملف microRNAs، بما في ذلك صفائف رقاقة الكلاسيكية أو أحدث تكنولوجيا التسلسل عميق. ومع ذلك، اخترنا للاستفادة من منصة حساسة للغاية QPCR 10، 11، والذي لديه ميزة إضافية تتطلب الحد الأدنى من الرنا. هو الأمثل لبروتوكول miRCURY LNA العالمي RT PCR الرنا الميكروي لاستخدام 20 نانوغرام في الحمض النووي الريبي مجموع 20 ميكرولتر [كدنا] رد فعل التوليف، 40 نانوغرام للمجموعة الكاملة لوحة يومين. وجود خيار استخدام كمية صغيرة من الحمض النووي الريبي من المهم للغاية عند التعامل مع valuabl ه والعينات السريرية يصعب الحصول على مثل CSF أو جزءا لا يتجزأ من البارافين الأنسجة الثابتة الفورمالين 1. الأهم من ذلك، استخدام كميات قليلة من الحمض النووي الريبي تقليل تركيز مثبطات ممكن موجودة في العينة. خارج النطاق القيم ط لفي ارتفاع، من المرجح أن تشير إلى وجود بعض مثبطات في العينة. تحقيقات ارتفاع في يمكن شراؤها بشكل منفصل لاختبار عينات لوجود مثبطات قبل ميرنا التنميط. لهذا الاختبار، يتم تنفيذ واحد في الوقت الحقيقي PCR باستخدام تركيزات متزايدة من الحمض النووي الريبي (سواء نانوغرام أو ميكرولتر).
في هذا البروتوكول، ونحن التقرير مرحلة استخراج العضوية قبل عزل الحمض النووي الريبي. تجدر الإشارة إلى أن العديد من مجموعات جديدة استخراج الحمض النووي الريبي لا تتطلب هذا الإجراء. على سبيل المثال، لدينا لمحة بنجاح miRNAs البلازما باستخدام الحمض النووي الريبي miRCURY biofluids عدة العزلة لاستخراج الحمض النووي الريبي مباشرة من 200 ميكرولتر من البلازما (لا تظهر البيانات)، دون استخراج الفينول / الكلوروفورم.
_content "> بشكل عام، فمن المهم لتصميم التجربة في وقت مبكر من أجل تحديد عدد من مكررات المناسبة اللازمة للحصول على نتائج ذات دلالة إحصائية. قد يعتمد عدد مكررات على عدد من العينات لتحليلها وربما تعتمد على الاختلافات داخل عينات أو مجموعة من العينات. لدراستنا، والتي استخدمنا العدد المنخفض نسبيا من العينات، 20 في المجموع، وقرروا تشكيل رد فعل التوليف [كدنا] في يثلث. استشارات مع الإحصاء الحيوي وزملائه قبل إعداد التجارب قد يكون من الحكمة وينصح بشدة.تعريف C ر بقطع القيمة مهم ويعتمد على نوع من العينات، لmiRNAs أعرب بشدة يمكن تعيين بين 25-35، ولكن لmiRNAs منخفضة أعرب، مثل عينات السائل النخاعي لدينا، يمكن تعيين أعلى. خطوة حاسمة أخرى عندما يتعلق الأمر تحليل البيانات هو اختيار الجينات المرجعية (ق). بالنسبة لبعض البيانات القوية (مثل ميرنا التنميط في الخلايا المستزرعة) AGالتطبيع lobal، والذي يمثل المعدل C طن من جميع العينات، ويمكن استخدام. ومع ذلك، هذا ليس خيارا للعينات السائل النخاعي التي تقدم مثل الاختلافات. وبالمثل، لم نتمكن من الاستفادة كما جينات مرجعية تلك miRNAs التي تعتبر عموما دون تغيير في سوائل الجسم. بدلا من ذلك، اخترنا جميع miRNAs التي أظهرت مماثلة C ر في جميع العينات، بما في ذلك النسخ المتماثلة، وركض تحليل geNorm المتاحة في GENEX (الشكل 1). وأشارت النتائج مير 1266 ومير 622 كما أعرب الأقل miRNAs بنسب مختلفة، وأنها كانت تستخدم لجينات مرجعية. مقارنة بين التعبير لل miRNAs بين المجموعات يمكن تحديد باستخدام أداة القياس الكمي النسبي في GENEX، الذي يتبع الصيغة القياسية 2 - (CT-Ctrel). أخيرا، يمكن تصور النتائج على النحو المخططات خريطة الحرارة والحانات الرسم أو غيرها من أنواع المؤامرات، مثل المؤامرة مربع في الشكل 2. أنواع أخرى من التصور المتاحة في GENEX تشمل المجموعات الهرمية،خريطة التنظيم الذاتي (SOM)، وتحليل المكونات الرئيسية (PCA). بالإضافة إلى miRNAs، ويمكن استخدام البرنامج GENEX لتحليل أنواع أخرى من المصفوفات مثل الرنا غير المكودة طويلة (lncRNAs) التنميط. يمكن استيرادها تخطيط لوحة في شكل اكسل ويمكن التعامل معها كما هو موضح البيانات للتحليل ميرنا. في الواقع، لدينا لمحة lncRNAs من الخلايا العصبية الجنينية الماوس القشرية الأولية باستخدام عدة العزلة mirVana ميرنا كما هو موضح في الخطوات أعلاه وقمنا بتحليل البيانات باستخدام GENEX (نتائج غير منشورة).
باختصار، وصفنا بروتوكول لمحة microRNAs في السائل المخي الشوكي. مع بعض التعديلات المتعلقة استخراج الحمض النووي الريبي، ويمكن تكييف هذا الإجراء لملف miRNAs في سوائل الجسم الأخرى و / أو أي نوع آخر من الأنسجة. لاحظ أنه في الإجراء الموصوفة هنا، يتم تنفيذ خطوة من استخراج العضوية قبل عزل الحمض النووي الريبي. بشكل عام، وهذا غير مطلوب عند استخدام مجموعات المتاحة تجاريا، مثل تحويلة miRVANA باريسطقم raction. بالإضافة إلى ذلك، يتم إضافة عند استخراج الحمض النووي الريبي من سوائل الجسم والحمض النووي الريبي الناقل للعينات ليست هناك حاجة لقياس التي يتعرض لها الحمض النووي الريبي و2-8 ميكرولتر الحمض النووي الريبي لتخليق [كدنا]. من تجربتنا والنظر في التكاليف المرتفعة المرتبطة بهذا النوع من التجارب، ونحن ننصح باختبار عينات قليلة أولا، ثم التشاور مع إحصائي لعدد العينات / النماذج المقلده، ليكون لمحة من أجل الحصول على نتائج ذات دلالة إحصائية.
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد المشروع التي وصفها عدد جائزة R01MH079751 (PI: F. بيروتزي) من المعهد الوطني للصحة العقلية. المحتوى هو فقط من مسؤولية الكتاب ولا تمثل بالضرورة وجهة النظر الرسمية للمعهد الوطني للصحة العقلية أو المعهد الوطني للصحة.
Materials
| Name | Company | Catalog Number | Comments |
Table 3. List of equipment. | |||
| Finnpipette Novus Multichannel Pipetter | Thermo Scientific | HH05279 | |
| Finntip Pipette Tips | Thermo Scientific | 9400613 | |
| Thermal Cycler C1000 | Biorad | ||
| 0.2 ml Low Profile, Clear PCR tubes | Biorad | TLS0801 | |
| Flat Cap Strips | Biorad | TLS0803 | |
LightCycler 480 Real-Time PCR System | Roche | ||
LightCycler 480 Sealing Foil | Roche | 04 729 757 001 | |
| Refrigerated Centrifuge 5804R | Eppendorf | ||
| Swing-bucket Rotor, 4-place | Eppendorf | A-4-44 | |
| Bench-Top Mini Centrifuge | Fisher | 05-090-100 | |
| Bench-Top Vortex | Fisher | ||
| 1.5 ml Microcentrifuge Tubes, Sterilized | Fisher | 02-681-5 | |
| Matrix Reagent Reservoir, 25 ml | Thermo Scientific | 8093 | |
| Thermomixer Confort | Eppendorf | ||
Bench-Top Mini Centrifuge Sigma 1-15 | Sigma | ||
| Bench-Top Vortex | Velp Scientifica | F202A0173 | |
Table 4. List of reagents. | |||
| Universal c-DNA synthesis kit, 16-32 rxns | Exiqon | 203300 | |
| SYBR Green master mix, Universal RT, 25 ml | Exiqon | 203400 | |
| Ultrapure Distilled Water Dnase, Rnase free | Invitrogen | 10977-015 | |
| MicroRNA Ready to use PCR Human Panels (I+II) V2.R | Exiqon | 203608 | |
mirVana miRNA isolation Kit, 40 isolations | Ambion | AM1556 | |
| MS2 RNA carrier | Roche Applied Science | 10165948001 | |
2-mercaptoethanol 98% | Sigma Aldrich | M3148-25ml | |
| Ethanol 100% | Carlo Erba | 64-17-5 | |
| Nuclease free water | Qiagen | 1039480 | |
RNAse Zap | Ambion | AM9780 | |
References
- Pacifici, M., et al. Cerebrospinal fluid miRNA profile in HIV-encephalitis. J. Cell. Physiol. 10, (2012).
- Krol, J., Loedige, I., Filipowicz, W. The widespread regulation of microRNA biogenesis, function and decay. Nat. Rev. Genet.. 11, 597-610 (2010).
- Calin, G. A., Croce, C. M. MicroRNA signatures in human cancers. Nat. Rev. Cancer. 6, 857-866 (2006).
- Chen, X., et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 18, 997-1006 (2008).
- De Smaele, E., Ferretti, E., Gulino, A. MicroRNAs as biomarkers for CNS cancer and other disorders. Brain Res. 1338, 100-111 (2010).
- Heneghan, H. M., Miller, N., Kerin, M. J. MiRNAs as biomarkers and therapeutic targets in cancer. Curr. Opin. Pharmacol. 10, 543-550 (2010).
- Kosaka, N., Iguchi, H., Ochiya, T. Circulating microRNA in body fluid: a new potential biomarker for cancer diagnosis and prognosis. Cancer Sci. 101, 2087-2092 (2010).
- Lu, J., et al. MicroRNA expression profiles classify human cancers. Nature. 435, 834-838 (2005).
- Shah, A. A., Leidinger, P., Blin, N., Meese, E. miRNA: small molecules as potential novel biomarkers in cancer. Curr. Med. Chem. 17, 4427-4432 (2010).
- Blondal, T., et al. Assessing sample and miRNA profile quality in serum and plasma or other biofluids. Methods. 59, 1-6 (2013).
- Jensen, S. G., et al. Evaluation of two commercial global miRNA expression profiling platforms for detection of less abundant miRNAs. BMC Genomics. 12, 435 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved