Biodistribución de nanotransportadores de fármacos: Aplicaciones del MEB
Visión general
Fuente: Peiman Shahbeigi-Roodposhti y Sina Shahbazmohamadi, Departamento de Ingeniería Biomédica, Universidad de Connecticut, Storrs, Connecticut
Las nanopartículas se han utilizado cada vez más la investigación para la entrega de medicamentos dirigidos y la liberación controlada de drogas. Mientras que la mayoría de estas partículas se han desarrollado como partículas poliméricas o liposómicas debido a su biocompatibilidad, hay una tendencia en la investigación actual hacia el uso de nanopartículas metálicas y magnéticas. Estas nanopartículas metálicas se utilizaron originalmente como un agente de contraste en la toma de imágenes, pero los avances recientes han demostrado lo importantes que podrían ser en la administración de fármacos y genes y en las terapias. El oro, la plata y las nanopartículas paramagnéticas tienen la mayor participación en la investigación que se está realizando. Se ha demostrado que tienen una buena biocompatibilidad y ciertas variedades de nanopartículas magnéticas ya se han desarrollado y distribuido como fármacos terapéuticos dirigidos.
Estos elementos pesados se utilizan típicamente para la investigación utilizando fluorescencia para evaluar la entrega y distribución, pero sus pesos atómicos son buenos requisitos para un mayor contraste en el análisis de electrones de retrodispersión utilizando un microscopio electrónico de barrido (SEM ). La espectroscopia de rayos X dispersante de energía, que utiliza rayos X característicos emitidos tras la interacción del haz de electrones con la muestra para identificar la composición química, también se puede utilizar con el SEM. Estos métodos tienen los beneficios de una mayor resolución y una mayor confianza en la detección, ya que el EDS puede garantizar que el sujeto de una imagen sea de la composición correcta, mientras que los métodos actuales de fluorescencia pueden desprenderse de las nanopartículas y desvanecerse rápidamente imágenes.
Esta demostración examinará la distribución de nanopartículas metálicas dependientes del tamaño en los órganos del cuerpo a lo largo del tiempo. Los órganos extirpados se examinarán con SEM para diversos tamaños de partículas en un rango de puntos de tiempo después de la entrega de partículas al cuerpo.
Principios
Es difícil sobreestimar la importancia de las nanopartículas (NP) para aplicaciones médicas. Se utilizan como drogas, portadores de drogas, agentes de contraste, etc. Sin embargo, para utilizar un cierto tipo de nanopartículaes es necesario saber cómo y dónde se distribuirá en cada órgano después de la aplicación y cuánto tiempo tomará antes de salir del órgano y, posteriormente, del cuerpo. Esto se llama su biodistribución.
El proceso de administración de fármacos de nanopartículas puede variar ampliamente en su complejidad, desde fármacos pasivos que no apuntan al tejido sino que se liberan en todo el cuerpo, hasta la orientación más activa de fármacos a un órgano o ubicación muy preciso. La mayoría de los medicamentos y terapias utilizarán la segmentación pasiva, que todavía muestra un gran éxito debido a la mayor permeabilidad y retención (efecto EPR) en tumores con grandes cantidades de flujo sanguíneo y altas cantidades de fugas vasculares. Además de la orientación pasiva, la orientación activa se puede realizar en el procesamiento de las nanopartículas a través de la unión de ligandos específicos del sitio del tumor, o se puede hacer después de la inyección mediante la adición de una fuerza magnética a las nanopartículas magnéticas. Este campo magnético extrae las nanopartículas del torrente sanguíneo hacia la zona afectada, reduciendo así el tiempo del medicamento que pasa en el torrente sanguíneo y aumentando la dosis a la zona afectada. Estos diferentes métodos de entrega deberían afectar enormemente la distribución de las nanopartículas después del tratamiento, y este experimento tiene como objetivo investigar tanto su distribución inicial, como su distribución a lo largo del tiempo.
Los métodos actuales de medición de la distribución de nanopartículas generalmente implican la unión de partículas de fluorescencia a las nanopartículas. Dependiendo de la concentración de las nanopartículas, el tamaño del área objetivo y la intensidad de la fluorescencia, los ratones translúcidos pueden analizarse utilizando imágenes ópticas mientras siguen vivos para determinar si las partículas están en el área correcta. La fluorescencia post mortem también se puede utilizar para determinar los niveles de nanopartículas en diferentes órganos de ratones. Sin embargo, estos métodos carecen de la resolución de nanopartículas y afirma que la fluorescencia no se ha separado de las nanopartículas.
La demostración actual explota la microscopía electrónica retrodispersada (BEM) y el análisis basado en espectroscopia de dispersión de energía (EDS) para comprender la biodistribución de nanopartículas magnetoeléctricas (MEN) dependiendo de su tamaño y el tiempo invertido en el Cuerpo. Los MEN de la muestra son nanopartículas magnetoeléctricas de bario y titanio que se introdujeron en los órganos del ratón a través de la inyección y luego se dirigieron pasivamente a los órganos. Los ratones quedaron inconscientes y sus órganos fueron extraídos y preservados a la 1 semana, 4 semanas y 8 semanas después de la inyección. Los órganos: el hígado, el bazo, los pulmones, los riñones y el cerebro, se seccionaron utilizando una máquina de microtoma y se prepararon utilizando métodos de preparación de muestras descritos en el video educativo "Imágenes SEM de muestras biológicas". Como modo de escaneo de microscopía electrónica (SEM), BEM junto con el análisis EDS proporciona un análisis de composición de alta resolución que permite detectar nanopartículas individuales de tan solo 10 nm de diámetro. Mientras tanto, esta demostración puede ilustrar cómo se pueden utilizar diferentes detectores para detectar, confirmar y mapear diferentes elementos y partículas en un entorno de investigación y también cómo diferentes parámetros pueden afectar a la imagen resultante.
Procedimiento
1. Inyección de nanopartículas y recolección de órganos
- Inyecte nanopartículas en un ratón anestesiado por vía intravenosa para permitir la orientación pasiva.
- En los momentos deseados, es decir, 1, 4 y 8 semanas, después de la inyección, humanmente eutanasia a los ratones de acuerdo con las directrices de la Asociación Médica Veterinaria Estadounidense (AVMA).
- Abra la cavidad corporal y retire quirúrgicamente los órganos de interés. Coloque los órganos en una formalina tamponada al 10% de fosfato en un recipiente de polipropileno hasta la preparación de la muestra.
2. Preparación de muestras de tejido
- Utilice fórceps para transferir el tejido del ratón del fijador a la solución salina tamponada de fosfato (PBS). Mece la muestra durante 30 minutos, reemplazando el PBS cada 10 min.
- Retire el tejido y séquelo con un kimwipe. A continuación, colóquelo en un molde de plástico que contenga un compuesto de temperatura de corte óptimo (OCT). Conservar a -80oC durante la noche.
- Al día siguiente, transfiera la muestra al criostato y ajuste la temperatura a -23 oC.
- Etiqueta los portaobjetos con el tipo de órgano y el tamaño de las nanopartículas, y colócalos en un estante en el criostato.
- Cubra el mandril de criostato con OCT y coloque la muestra en la parte superior. Baje el émbolo del extractor sobre la muestra y deje que se equilibre durante 3-5 min.
- Monte el mandril en el soporte de la muestra y oriente para que la cuchilla pueda cortar directamente a través de la muestra congelada. Acerque la muestra a la cuchilla para que esté rugosa. Ajuste el espesor a 30 m y corte varias secciones hasta que se produzca una rebanada cortada uniformemente.
- Cambie a la cara fina reduciendo el espesor de la sección a 7-8 m. Recoja una sección en rodajas presionando una diapositiva de vidrio etiquetada en la rebanada. Coloque dos diapositivas en cada diapositiva y guárdelas en un portaobjetos. Dejar secar a temperatura ambiente.
- Una vez secas, deshidratar las muestras sumergiendo la portaobjetos en etanol al 50% durante 3 min para eliminar los PTU. A continuación, transfiera el bastidor al 80% de etanol durante 3 minutos antes de colocar el bastidor en una proporción de 1:1 de metanol frío a acetona durante 10 minutos a -20 oC.
- Retire la portaobjetos y escurra el exceso de disolvente en una toalla de papel. Después de 20-30 minutos, coloque las diapositivas en una caja de diapositivas y guárdelas en un congelador a -20 oC hasta la toma de imágenes.
3. Imágenes de alta resolución utilizando SEM y EDS
- Prepare la muestra como se describe en "Imágenes SEM de muestras biológicas." A continuación, cargue la muestra en el SEM.
- Encienda el SEM y ajuste la distancia de trabajo a alrededor de 5 mm y la tensión de aceleración y la corriente de haz a 25 keV, que normalmente sería demasiado alta para una muestra biológica. Sin embargo, la muestra está recubierta para la conductividad y la protección.
- Inicie la toma de imágenes y haga zoom a alrededor de 1.000-2.000X de aumento para ver las estructuras que contendrían las nanopartículas. Tenga en cuenta que sin la detección de dispersión posterior (BSD) no se puede distinguir por debajo de una cierta profundidad.
- Inserte el BSD bajo los mismos parámetros y mueva la etapa en la dirección z a la misma distancia de trabajo que antes.
- Comience a tomar imágenes en torno al mismo aumento y compruebe que puede ver un alto contraste en presencia de nanopartículas. Guarde las imágenes.
- Utilice diferentes configuraciones BSD (donde las cargas en el detector se alinean) para elegir la que muestra el contraste más alto para las nanopartículas.
- Acercar en un área de alto contraste que muestra una nanopartícula o grupo de nanopartículas.
- Abra la2a cámara de la cámara y observe mientras inserta el EDS en el sistema pulsando el botón hacia abajo del accesorio SEM. Una vez que el EDS esté cerca pero no toque el BSD o el cañón, suelte el botón.
- Abra el programa azteca en el ordenador EDS (todavía en la estación de trabajo) y adquiera una imagen del SEM. Utilice el método "punto y disparo" para hacer clic en un área muy densa en contraste y nanopartículas.
- El EDS mostrará el espectro de rayos X característicos a partir de ese punto. Busque los picos de bario y titanio que se identificarán en el gráfico. Esto confirma que lo que está viendo son de hecho las nanopartículas y no cualquier tipo de contaminación.
- Vuelva a la muestra y utilice el software Atlas para mapear los bordes del órgano en la diapositiva. Seleccione el protocolo "Organ" para crear una imagen de mosaico del área y déjela funcionar (esto puede tardar unas horas como máximo).
- Una vez que el software cree y cose la imagen compuesta, expórtela como un archivo Tif.
- Abra el archivo Tif en ImageJ, un software de código abierto, y ajuste los valores de umbral de contraste para resaltar las áreas de contraste muy alto (es decir, las nanopartículas). Utilice funciones integradas para cuantificar el volumen de nanopartículas utilizando el tamaño de píxel definido en el protocolo Organ (debe ser de alrededor de 100 nm).
- Mientras que este procedimiento se refiere sólo a la muestra de 1 semana del pulmón del ratón, este procedimiento se repite con las muestras de otras semanas y otros órganos para compilar un gráfico que muestra la distribución.
- Después de calcular la biodistribución de cada órgano para cada semana, los gráficos de biodistribución mostrarán los cambios en la biodistribución y la concentración de nanopartículas en el transcurso de las 8 semanas. Estos muestran la concentración máxima y también proporcionan información sobre cuánto tiempo tardan las nanopartículas en borrarse del órgano.
Resultados
Las siguientes imágenes ilustran cómo se pueden extraer los datos de biodistribución de las imágenes. El contraste de las nanopartículas se detecta mediante el detector de EEB, como se muestra en la Figura 1. Los datos de EDS, que se presentan en la Figura 2, muestran dónde los cúmulos de titanio y bario corresponden a áreas de alto contraste en las imágenes recopiladas utilizando el detector de EEB.

Figura 1: Imagen de electrones secundarios del pulmón (izquierda) y imagen de electrones de retrodispersión de la misma área (derecha).

Figura 2: Datos EDS, mostrando racimos de titanio y bario en el centro inferior y la parte superior de la imagen, correspondientes a áreas de alto contraste que se ven utilizando el detector de EEB.
En una imagen compuesta, como se muestra en la Figura 3, los círculos rojos indican áreas de alto contraste y sugieren las ubicaciones que contienen nanopartículas. El volumen de las áreas de nanopartículas blancas se puede calcular y promediar sobre el tamaño del propio órgano. Esto proporciona un cálculo del área ocupada por las nanopartículas. Luego, los datos de varios órganos durante varias semanas se pueden agregar para mostrar la distribución media de partículas en un micra cuadrado de la imagen. Estos datos se presentan en la Figura 4, que muestra una disminución general de las nanopartículas de tamaño de 30 nm en el transcurso de las 8 semanas, una indicación de aclaramiento. Otra cosa a tener en cuenta es el aumento de la concentración de nanopartículas en el hígado después de 4 semanas. Esto proporciona información sobre cómo el cuerpo procesa las nanopartículas, y la gran migración de partículas al hígado muestran que el cuerpo puede estar procesando las nanopartículas como toxinas. Esta es información importante para saber al desarrollar y probar nanopartículas in vivo.
Del mismo modo, los datos sobre la distribución de órganos de partículas de diferentes tamaños se presentan en la Figura 5. Este gráfico muestra cómo el tamaño cambiante de las nanopartículas puede aumentar la ingesta general en las células de las nanopartículas o aumentar la tasa de aclaramiento.

Figura 3: Secciones de la imagen compuesta creada con el software Atlas.

Figura 4: Biodistribución de nanopartículas de 30 nm en el pulmón, hígado, bazo y riñón después de la inyección en un ratón.
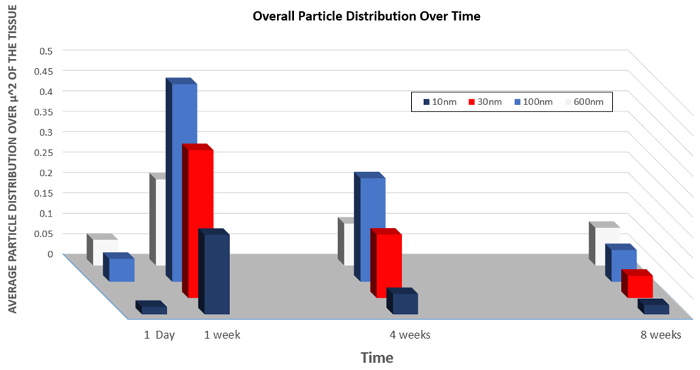
Figura 5: Biodistribución de nanopartículas de diferente tamaño a lo largo del tiempo.
Aplicación y resumen
Las nanopartículas son ampliamente utilizadas en la investigación de ingeniería biomédica y tienen aplicaciones como imágenes, diagnósticos y agentes terapéuticos. Por ejemplo, se están desarrollando nanopartículas para su uso en la administración de vacunas. Al encapsular la vacuna en nanopartículas, los componentes de la vacuna están protegidos de la degradación y estimulan la respuesta inmunitaria máxima.
En aplicaciones de imágenes por resonancia magnética, las nanopartículas metálicas se utilizan a menudo como agentes de contraste para visualizar la estructura y la función del tejido. Son sondas de diagnóstico útiles en la detección de placas arteroscleróticas.
Las nanopartículas que integran capacidades diagnósticas y terapéuticas se denominan tenósticas. Hay nanopartículas simultáneamente detectan tumores en estadio temprano y suministran agentes quimioterápicos.
Este experimento demostró cómo se puede utilizar el SEM para calcular la biodistribución de nanopartículas inyectadas en el cuerpo con el tiempo. Este experimento se puede replicar en otras muestras de nanopartículas o cultivos celulares que tienen nanopartículas como una forma de analizar las concentraciones, la penetración celular o el aclaramiento de nanopartículas.
Esta demostración se centró en el estudio y medición de la biodistribución de nanopartículas utilizando SEM. Los resultados de estas mediciones pueden ser importantes en muchos campos. Las empresas farmacéuticas y las instalaciones de investigación pueden utilizar estos estudios para el desarrollo de fármacos y la investigación de agentes de contraste.
Lista de materiales
| Nombre | Empresa | Número de catálogo | Comentarios |
| Equipo | |||
| Rebanada seccionada (preparada antes) | |||
| Software de código abierto ImageJ | |||
| SEM de haz cruzado | Zeiss | ||
| ATLAS 3-D SEM Software | Zeiss |
Referencias
- Hadjikhani, Ali. "Nanofabrication and Spectroscopy of Magnetic Nanostructures Using a Focused Ion Beam." (2016).
Saltar a...
Vídeos de esta colección:

Now Playing
Biodistribución de nanotransportadores de fármacos: Aplicaciones del MEB
Biomedical Engineering
9.3K Vistas

Obtención de imágenes de muestras biológicas con microscopía óptica y confocal
Biomedical Engineering
35.7K Vistas

Imágenes con MEB de muestras biológicas
Biomedical Engineering
23.5K Vistas

Imágenes por ultrasonido de alta frecuencia de la aorta abdominal
Biomedical Engineering
14.4K Vistas

Mapeo cuantitativo de la deformación de un aneurisma de la aorta abdominal
Biomedical Engineering
4.6K Vistas

Tomografía fotoacústica para obtener imágenes de sangre y lípidos de la Aorta Infrarrenal
Biomedical Engineering
5.7K Vistas

Resonancia Magnética Cardíaca
Biomedical Engineering
14.7K Vistas

Simulaciones de dinámica de fluidos computacionales del flujo sanguíneo en un aneurisma cerebral
Biomedical Engineering
11.7K Vistas

Imágenes de fluorescencia infrarroja de aneurismas aórticos abdominales
Biomedical Engineering
8.2K Vistas

Técnicas no invasivas para medir la presión arterial
Biomedical Engineering
11.9K Vistas

Adquisición y análisis de una señal de ECG (electrocardiografía)
Biomedical Engineering
104.8K Vistas

Resistencia a la tracción de biomateriales reabsorbibles
Biomedical Engineering
7.5K Vistas

Imágenes por micro-CT de la médula espinal de un ratón
Biomedical Engineering
8.0K Vistas

Visualización de la degeneración articular de rodilla posterior a una lesión no invasiva del LCA en ratas
Biomedical Engineering
8.2K Vistas

Imágenes combinadas de SPECT y TC para visualizar la funcionalidad cardíaca
Biomedical Engineering
11.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados