Purificazione del ferrocene per sublimazione
Panoramica
Fonte: Tamara M. Powers, Dipartimento di Chimica, Texas A & M University
La sublimazione, la transizione di fase diretta di un solido in un gas senza prima diventare un liquido, avviene a temperature e pressioni inferiori a quella del punto triplo del composto (Figura 1). Il processo di sublimazione può essere utilizzato per purificare sia i solidi organici che quelli inorganici. Durante la tecnica di purificazione, un solido viene riscaldato direttamente nella fase gassosa. Tutte le impurità non volatili vengono lasciate indietro mentre il composto vaporizzato viene quindi raccolto (deposizione) come solido su una superficie fredda. Qui, useremo la sublimazione per purificare il ferrocene, un solido inorganico con una temperatura a triplo punto di 183 °C.1
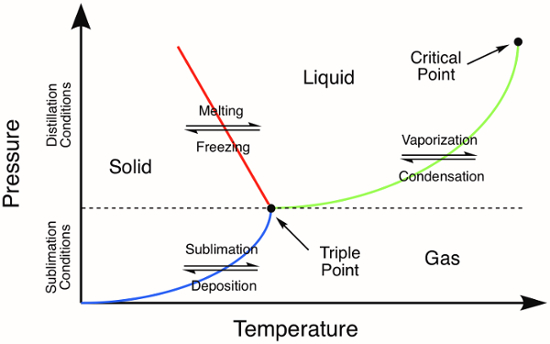
Figura 1. Diagramma di fase generico. Le linee colorate rappresentano i requisiti di pressione e temperatura per le transizioni di fase. La distillazione di un solido avverrà a pressioni e temperature superiori al punto triplo, rappresentato dalla linea verde nel diagramma di fase. La linea blu rappresenta le condizioni di temperatura e pressione in cui si verifica la sublimazione.
Principi
Molti composti inorganici sono solidi e quindi è importante comprendere i metodi per la purificazione dei solidi. Alcune delle tecniche per la purificazione dei solidi sono simili a quelle utilizzate per la purificazione dei liquidi. Ad esempio, la distillazione è un'utile tecnica di purificazione per i solidi a bassa fusione, che si sciolgono prima di vaporizzare. In un diagramma di fase, si noti che la distillazione può essere effettuata a pressioni superiori al punto triplo di un composto (Figura 1). Dopo la fusione iniziale per produrre un liquido (linea rossa, Figura 1), la distillazione procede come per qualsiasi altro composto in fase liquida.
La sublimazione è correlata alla distillazione, ma non comporta la transizione di fase intermedia alla fase liquida. La sublimazione si verifica solo a temperature e pressioni specifiche che si trovano al di sotto del punto triplo di un composto nel suo diagramma di fase (Figura 1). La sublimazione è una tecnica di purificazione in cui un solido viene riscaldato (a volte sotto vuoto) con conseguente transizione di fase direttamente dalla fase solida alla fase gassosa. La deposizione del composto vaporizzato su una superficie fredda provoca l'isolamento del materiale sublimolato. Le impurità non volatili vengono lasciate indietro dopo che la sublimazione è completa. Esempi comuni di sostanze che subiscono facilmente la sublimazione a pressione atmosferica sono il ghiaccio (a temperature inferiori a 0 °C) e la CO2.
A seconda della volatilità del solido sublimare, è possibile utilizzare vari apparati. Per i solidi altamente volatili (composti con un punto triplo ad alta pressione e bassa temperatura), è possibile realizzare una semplice camera di sublimazione utilizzando un becher e un vetro per orologi. Tale apparecchio è appropriato per composti che sublimano a o vicino alla pressione atmosferica e alla temperatura ambiente. Se sono necessari vuoto e/o gas inerte, è possibile utilizzare vetreria specificamente progettata per la sublimazione(ad es.una camera di sublimazione). La camera di sublimazione (Figura 2) consente la sublimazione sotto vuoto o sotto atmosfera inerte. È composto da due pezzi di vetro: il solido viene messo sul fondo della camera principale e alla sublimazione il materiale purificato viene raccolto sul lungo cilindro al centro della camera chiamato dito freddo, che può essere riempito con acqua ghiacciata, ghiaccio secco e acetone o qualche altro criogeno. La base e il dito freddo sono sigillati con un O-ring e fissati con un morsetto. Al termine della sublimazione, la camera può essere smontata (nell'aria per composti non sensibili all'aria o nel glovebox per materiali sensibili all'aria) e il solido purificato può essere raschiato dal dito freddo. Tutte le impurità non volatili devono rimanere nella parte inferiore della camera di sublimazione.

Figura 2. Una camera di sublimazione progettata per la sublimazione a bassa pressione.
Procedura
1. Configurazione della linea Schlenk
Per una procedura più dettagliata, consultare i video "Schlenk Lines Transfer of Solvent" e "Degassing Liquids" nella serie Essentials of Organic Chemistry. La sicurezza della linea Schlenk deve essere rivista prima di condurre questo esperimento. La vetreria deve essere ispezionata per le crepe delle stelle prima dell'uso. Prestare attenzione per assicurarsi che O2 non sia condensato nella trappola della linea di Schlenk se si utilizza N2liquido . A temperatura N2 liquida, O2 condensa ed è esplosivo in presenza di solventi organici. Se si sospetta che O2 sia stato condensato o che si osservi un liquido blu nella trappola fredda, lasciare la trappola fredda sotto vuoto dinamico. NON rimuovere la trappola N2 liquida o spegnere la pompa per vuoto. Nel corso del tempo il liquido O2 sublima nella pompa - è sicuro rimuovere la trappola N2 liquida solo una volta che tutto l'O2 è sublimare.
- Chiudere la valvola di rilascio della pressione.
- Accendere il gas N2 e la pompa per vuoto.
- Mentre la linea Schlenk si equilibra sottovuoto, preparare la trappola fredda con N2 liquido o ghiaccio secco/acetone.
- Assemblare la trappola fredda.
2. Aggiungere 500 mg (2,7 mmol) di ferrocene alla base della camera di sublimazione.
3. Assemblaggio della Camera di Sublimazione
- Posizionare l'O-ring nella scanalatura della base della camera.
- Posizionare delicatamente il dito freddo nella base della camera e assicurarsi che l'O-ring si adatti alla scanalatura della vetreria.
- Fissare i due pezzi della camera di sublimazione utilizzando un morsetto.
4. Collegare la camera di sublimazione alla linea schlenk e aprire la camera per aspirare per 1 minuto. Chiudere la valvola del vuoto sulla camera di sublimazione. La sublimazione sarà effettuata sotto vuoto statico.
5. Riempi il dito freddo con un bagno di ghiaccio.
6. Posizionare la base della camera di sublimazione in un bagno d'acqua riscaldato a 80°C.
7. Al termine della sublimazione, rimuovere la camera di sublimazione dal bagno.
8. Chiudere il rubinetto sulla linea Schlenk.
9. Rimuovere il tubo della linea Schlenk dalla camera di sublimazione e reprimeturizzare la camera di sublimazione aprendo lentamente la valvola. Stai attento! Se la camera viene repressurizzata troppo rapidamente, disturberà i cristalli purificati sul dito freddo.
10. Svestire la camera di sublimazione e rimuovere l'acqua dal dito freddo con una pipetta.
11. Sollevare con attenzione il dito freddo fuori dalla camera di sublimazione.
12. Raschiare il ferrocene purificato dal dito freddo e trasferirlo in un flaconcino. Registrare il peso del prodotto purificato. Se il composto sublimato è sensibile all'aria, l'intero apparecchio deve essere portato in un glovebox in atmosfera inerte prima di aprire la camera di sublimazione.
Risultati
Ferrocene (99%) è stato acquistato da Alfa Aesar. La sublimazione di 500 mg come descritto ha dato adito a 493 mg di prodotto isolato. Il ferrocene purificato è stato analizzato mediante 1H NMR. 1 H NMR (cloroformio-d, 300 MHz, δ, ppm): 4.17 (s).
Applicazione e Riepilogo
La sublimazione è una tecnica utilizzata nella purificazione dei solidi. I solidi che sublimano a bassa pressione e temperatura sono buoni candidati per la purificazione per sublimazione. Qui, abbiamo dimostrato come utilizzare una camera di sublimazione per sublimare il ferrocene sotto vuoto statico a 80 °C.
In un ambiente di laboratorio, la sublimazione è una tecnica utile che può essere applicata alla purificazione dei solidi in una varietà di situazioni, compresa la purificazione di materiali di partenza o prodotti sintetizzati. In questo esempio, il solido purificato viene raccolto sul dito freddo, mentre le impurità vengono lasciate nella parte inferiore della camera di sublimazione. Tuttavia, si potrebbe voler rimuovere un'impurità solida che può essere sublimata da un solido non volatile. In questo caso, il materiale desiderato rimane nella parte inferiore della camera di sublimazione.
La sublimazione è anche usata nella liofilizzazione, chiamata liofilizzazione. La liofilizzazione è un processo per asciugare i materiali utilizzati sia nell'industria farmaceutica che in quella alimentare, nonché nei laboratori di ricerca. Nel processo di liofilizzazione, un materiale viene prima congelato, seguito dalla riduzione della pressione circostante, che consente di rimuovere l'acqua (o altro solvente) per sublimazione.
Riferimenti
- Kaplan, L., Kester, W. L., Katz, J. J. Some properties of iron biscyclopentadienyl. J Am Chem Soc. 74, 5531-5532 (1952).
Vai a...
Video da questa raccolta:

Now Playing
Purificazione del ferrocene per sublimazione
Inorganic Chemistry
54.5K Visualizzazioni

Sintesi di un Ti(III) metallocene utilizzando la tecnica della linea Schlenk
Inorganic Chemistry
31.6K Visualizzazioni

Scatola a guanti (Glove Box) e sensori di impurezze
Inorganic Chemistry
18.6K Visualizzazioni

Il metodo di Evans
Inorganic Chemistry
68.3K Visualizzazioni

Diffrazione a raggi X su cristallo singolo e su polveri
Inorganic Chemistry
104.3K Visualizzazioni

Spettroscopia di risonanza paramagnetica elettronica (EPR)
Inorganic Chemistry
25.4K Visualizzazioni

Spettroscopia Mössbauer
Inorganic Chemistry
22.0K Visualizzazioni

Interazione acido-base di Lewis in Ph3P-BH3
Inorganic Chemistry
38.8K Visualizzazioni

Struttura del ferrocene
Inorganic Chemistry
79.4K Visualizzazioni

Applicazione della teoria dei gruppi nella spettroscopia infrarossa
Inorganic Chemistry
45.1K Visualizzazioni

Teoria degli orbitali molecolari
Inorganic Chemistry
35.3K Visualizzazioni

Paddlewheel a quadruplo legame metallo-metallo
Inorganic Chemistry
15.3K Visualizzazioni

Celle di Grätzel (Dye-sensitized Solar Cells)
Inorganic Chemistry
15.8K Visualizzazioni

Sintesi di un complesso di cobalto (II) legato ad ossigeno
Inorganic Chemistry
51.6K Visualizzazioni

Inizio fotochimico di una reazione di polimerizzazione radicalica
Inorganic Chemistry
16.7K Visualizzazioni