Celle di Grätzel (Dye-sensitized Solar Cells)
Panoramica
Fonte: Tamara M. Powers, Dipartimento di Chimica, Texas A & M University
Il mondo moderno di oggi richiede l'uso di una grande quantità di energia. Mentre sfruttiamo l'energia da combustibili fossili come carbone e petrolio, queste fonti non sono rinnovabili e quindi l'offerta è limitata. Per mantenere il nostro stile di vita globale, dobbiamo estrarre energia da fonti rinnovabili. La fonte rinnovabile più promettente, in termini di abbondanza, è il sole, che ci fornisce energia solare più che sufficiente per alimentare completamente il nostro pianeta molte volte.
Quindi, come estraiamo energia dal sole? La natura è stata la prima a capirlo: la fotosintesi è il processo con cui le piante convertono l'acqua e l'anidride carbonica in carboidrati e ossigeno. Questo processo si verifica nelle foglie delle piante e si basa sui pigmenti di clorofilla che colorano le foglie di verde. Sono queste molecole colorate che assorbono l'energia dalla luce solare e questa energia assorbita che guida le reazioni chimiche.
Nel 1839, Edmond Becquerel, allora un fisico francese di 19 anni che sperimentava nel laboratorio di suo padre, creò la prima cella fotovoltaica. Ha illuminato una soluzione acida di cloruro d'argento che è stata collegata a elettrodi di platino che hanno generato una tensione e corrente. 1 Molte scoperte e progressi sono stati fatti alla fine del 19° e nella prima metà del 20° secolo, ed è stato solo nel 1954 che la prima cella solare pratica è stata costruita dai Bell Laboratories. A partire dal 1950, le celle solari sono state utilizzate per alimentare i satelliti nello spazio. 2
Le celle solari sono dispositivi elettrici che utilizzano la luce per creare una corrente. Questo video mostra la preparazione e il test di uno di questi tipi di cellule, la cella solare sensibilizzata al colorante (DSSC). Inventato per la prima volta alla UC Berkeley da Brian O'Regan e Michael Grätzel, Grätzel ha proseguito questo lavoro presso l'École Polytechnique Fédérale de Lausanne in Svizzera, culminando nel primo DSSC altamente efficiente nel 1991. 3 Queste celle solari, come le piante, usano un colorante per aiutare a sfruttare l'energia del sole.
Principi
Teoria delle bande:
Quando due atomi si uniscono per formare orbitali molecolari, si formano due orbitali, uno con un legame e l'altro con una simmetria anti-legante. 4 Questi sono separati da una certa quantità di energia. Quando n atomi si uniscono per formare orbitali molecolari, come in una forma solida, n orbitali molecolari. Quando n è grande, anche il numero di orbitali che sono strettamente distanziati in energia è grande. Il risultato è una banda di orbitali di energia simile (Figura 1). Gli elettroni degli atomi risiedono in queste bande. La banda di valenza è la banda di energia più alta popolata da elettroni. È simile all'orbitale molecolare occupato più alto (HOMO) delle molecole. La banda di conduzione è la banda più bassa che non è popolata da elettroni ed è simile all'orbitale molecolare non occupato più basso (LUMO) delle molecole. Il gap di banda è la differenza di energia tra queste due bande.
Quando il gap di banda è grande, il materiale solido è un isolante: gli elettroni non possono fluire liberamente all'interno del materiale (Figura 1). Al contrario, i conduttori sono quelli in cui il gap di banda valenza-conduzione è sfocato. In un conduttore, come un metallo, l'applicazione di una tensione aumenta alcuni degli elettroni nella banda di valenza alla banda di conduzione. Questi elettroni eccitati sono liberi di muoversi. Gli elettroni lasciano dietro di sé buchi positivi, che sono anche liberi di muoversi. In realtà, i buchi non si muovono, ma piuttosto gli elettroni si muovono per riempire i buchi positivi. Nei conduttori, all'aumentare della temperatura, le vibrazioni molecolari aumentano, ostruendo così il flusso di elettroni e diminuendo la conduttività.
I semiconduttori sono materiali che fungono da isolanti a 0 Kelvin, ma diventano conduttori all'aumentare della temperatura (Figura 1). Questo perché il gap di banda - l'energia tra la banda di valenza e la banda di conduzione - è piccolo, quindi l'energia termica è sufficiente per eccitare gli elettroni nella banda di conduzione. I semiconduttori intrinseci tipici includono silicio e germanio.
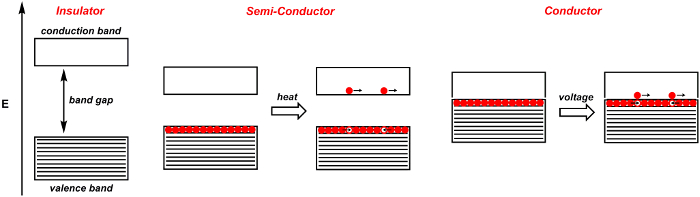
Figura 1. Diagramma a banda per un isolante, un semiconduttore e un conduttore. Le bande ombreggiate sono piene di elettroni, mentre le bande bianche sono vuote. Gli elettroni discreti sono indicati da una sfera rossa, mentre i fori discreti sono indicati da una sfera bianca.
Effetto fotovoltaico:
Quando la luce colpisce un semiconduttore, può eccitare un elettrone dalla banda di valenza alla banda di conduzione. Questo elettrone può quindi ricombinarsi con il foro che ha lasciato, con conseguente uscita di nessun flusso netto di elettroni. Oppure, può muoversi attraverso il semiconduttore, attorno a un circuito, e ricombinarsi con un foro all'altra estremità del circuito. Questo flusso di elettroni creato dall'esposizione alla luce solare è chiamato effetto fotovoltaico. Quest'ultimo scenario è desiderato per generare elettricità, e quindi i sistemi devono essere progettati per favorire questo rispetto alla ricombinazione.
Un modo per favorire questo è quello di progettare celle con una giunzione p-n, cioèuna giunzione tra un semiconduttore drogato n- e p. Questi sono semiconduttori per cui alcuni degli atomi sono stati sostituiti da atomi vicini sulla tavola periodica. Nei semiconduttori n-drogati, questi sono sostituiti da atomi che hanno più elettroni, e nei semiconduttori drogati p, questi sono sostituiti da atomi che hanno meno elettroni. Le celle solari "tradizionali" a base di silicio fanno uso di questo approccio.
Tuttavia, un tipo emergente di celle solari sono DSSC, spesso indicato come la cella di Grätzel. 5 Questi sono promettenti in quanto sono semi-traslucidi e il loro costo è significativamente inferiore. Queste celle solari fanno ancora uso di semiconduttori, ma è un colorante che viene utilizzato per assorbire la luce dal sole.
Componenti di un DSSC:
Esistono molti componenti per un DSSC, illustrato nella Figura 2.
Tingere
Per promuovere l'effetto fotovoltaico, un DSSC fa uso di coloranti. La molecola del colorante assorbe la luce, promuovendo un elettrone da un orbitale di legame a un orbitale anti-legame. Questo elettrone eccitato può quindi cadere di nuovo verso l'orbitale di legame, con conseguente ingiatura di nessun flusso di elettroni. Oppure, può essere iniettato in un semiconduttore, il percorso produttivo di un DSSC. Questo lascia dietro di sé un buco, che deve essere riempito per completare il circuito. Per il percorso produttivo, l'energia dell'elettrone allo stato eccitato nel colorante deve essere maggiore della banda di conduzione del semiconduttore. Il colorante dovrebbe anche assorbire gran parte dello spettro solare, per migliorare l'efficienza della cella. I coloranti tipici sono a base di rutenio (Ru) e quindi limitano un DSSC, poiché questo metallo non è molto economico.
In questo esperimento, utilizzeremo un colorante naturale (antociani) trovato in alcune bacche, come more e lamponi. La struttura del colorante antocianico deve presentare diversi gruppi =O o -OH, che consentono al colorante di legarsi alla superficie TiIVO2 (Figura 3). 6
Semiconduttore
L'elettrone eccitato fluisce quindi verso la banda di conduzione del semiconduttore. Il semiconduttore che utilizzeremo in questo esperimento è TiO2.
Anodo
L'elettrone scorre dal semiconduttore all'anodo, che in questo caso è vetro rivestito SnO2. L'SnO2 consente una superficie conduttiva sul vetro, che altrimenti sarebbe un isolante.
Catodo
Dopo aver attraversato un carico, l'elettrone arriva al catodo, che è anche coperto in SnO2. Il catodo è inoltre coperto da un catalizzatore, in questo caso, la grafite, che aiuta a promuovere la reazione redox del mediatore.
Mediatore
L'elettrone passa dal catodo a I3-, riducendolo a I-. Questa molecola ridotta può quindi donare un elettrone al foro lasciato nella molecola del colorante, completando il circuito. Questo processo rigenera I3-. La differenza tra il potenziale della cella I3-/I- e il livello di Fermi corrisponde al potenziale a circuito aperto della cella solare, o alla tensione massima che può essere prodotta con la cella.
In questo video viene preparato un DSSC e ne vengono valutate le prestazioni.
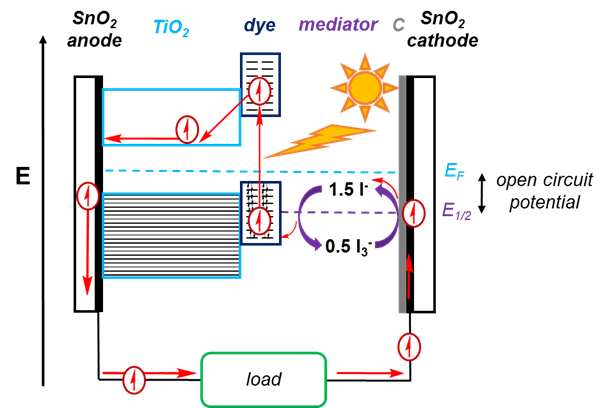
Figura 2. Schema di un DSSC. La luce solare viene assorbita dal colorante, sollevando un elettrone a un orbitale anti-legame nel colorante. Questo elettrone si sposta quindi nella banda di conduzione TiO2, lasciando dietro di sé un foro. L'elettrone gira intorno al circuito e passa un carico, e viene utilizzato per ridurre I3- a I-, che viene poi ossidato di nuovo a I3- mentre l'elettrone riempie il buco lasciato nel colorante.

Figura 3. Il pigmento antocianico trovato in alcune bacche chela sulla superficie del TiO2.
Procedura
1. Preparazione della pasta TiO2
- Massaggiare 6 g di polvere colloidale tiO2 e metterlo in un mortaio.
- Aggiungere con attenzione 2-3 ml di aceto al TiO2e iniziare a macinare la sospensione con il pestello fino a ottenere una pasta uniforme. La macinazione serve a rompere i ciuffi aggregati nella polvere.
- Continuare ad aggiungere aceto, con incrementi di ~ 1 mL durante la macinazione, fino a ~ 9 mL di volume totale. Prima di ogni aggiunta, la consistenza della pasta deve essere uniforme e priva di grumi. La pasta finale dovrebbe essere spessa, ma non così spessa da non poter essere spremuta da una bottiglia contagocce.
- Aggiungere 1 goccia di sapone per i piatti a 1 mL di acqua distillata, mescolare delicatamente.
- Aggiungere la soluzione di sapone per i piatti alla sospensione di TiO2 e mescolare delicatamente, facendo attenzione a non produrre bolle.
- Lasciare equilibrare la sospensione per 15 minuti. Il sapone per i piatti funge da tensioattivo, per aiutare a rendere la sospensione più facilmente distribuita in un film uniforme sul vetro.
2. Deposizione di TiO2 su vetro
- Pulire due vetrini conduttivi. Immergere un kimwipe con etanolo e usarlo per pulire due vetrini conduttivi. Posizionare le diapositive pulite su un kimwipe fresco.
- Determinare quale lato del vetro è conduttivo. Utilizzando un multimetro impostato su ohm, toccare entrambi i cavi su un lato del vetro. Se si osserva una lettura tra 10 e 30 Ω, è il lato conduttivo. Una lettura di 0 Ω indica il lato non conduttivo.
- Mascherare la diapositiva. Posizionare una diapositiva di vetro con il lato conduttivo verso l'alto e l'altra con il lato conduttivo verso il basso. Mantenendo con attenzione le diapositive in contatto, fissare le diapositive di vetro al piano di lavoro. Posizionare il nastro su tre dei quattro lati delle diapositive, assicurandosi che ~ 5-8 mm della diapositiva siano coperti da nastro adesivo su ciascuno dei tre lati (Figura 4). Premere saldamente il nastro, per assicurarsi che non ci siano bolle d'aria.
- Applicare la pasta TiO2. Utilizzando un'asta di vetro, applicare una sottile linea di pasta sul bordo superiore mascherato della diapositiva. Utilizzare l'asta di vetro per arrotolare con cura la pasta lungo la lunghezza della diapositiva e tornare indietro. Ripetere questo movimento 2-3x senza sollevare l'asta o fino a ottenere un film uniforme.
- Se il film non è uniforme, è sufficiente pulirlo con un kimwipe, pulire il vetro con etanolo e, una volta asciutto, riprovare.
- Lasciare asciugare un po 'il film, quindi rimuovere con cura il nastro dal vetro. La diapositiva con la pellicola TiO2 dovrebbe essere sul lato conduttivo. L'altra diapositiva può essere pulita e utilizzata in un secondo momento.
- Anneal il film TiO2. Posizionare con attenzione la diapositiva (TiO2 lato verso l'alto) su una piastra calda impostata a 450 °C. Guarda come il TiO2 si scurisce in un colore viola / marrone e riacquista il suo colore bianco. A questo punto, spegnere la piastra riscalda e lasciare raffreddare lentamente il film. Se la diapositiva viene raffreddata troppo rapidamente, potrebbe rompersi o frantumarsi.
- Con un righello, misurare l'area della superficie coperta con il film e annotare questo valore.

Figura 4. Deposizione di TiO2 su vetro.
3. Macchia il film TiO2 con il colorante
- Metti alcune more, lamponi o ciliegie in un mortaio e schiacciali con un pestello.
- Filtrare la soluzione attraverso un filtro per caffè e in una capsula di Petri. Potrebbe essere necessario aggiungere qualche ml di acqua al succo.
- Posizionare la pellicola TiO2 raffreddata, a faccia in giù nella capsula di Petri. Fai attenzione a non graffiare via qualsiasi TiO2. Lasciare che il colorante venga adsorbito sul film. Questa tà potrebbe richiedere alcuni minuti.
- Una volta che il film è completamente rivestito (dovrebbe essere rosso scuro o viola e non ci sono macchie bianche), sollevare lo scivolo con le pinze (fare attenzione a mettere indurire solo il vetro e non il film) e risciacquare il vetrino con acqua, quindi etanolo. Asciugare il film con un kimwipe e utilizzare immediatamente.
- Se non utilizzato immediatamente, conservare il film in una capsula di Petri contenente acido acetico a pH 3-5 e coprire il piatto con il coperchio e avvolgere in un foglio.
4. Preparare il controelettrodo
- Utilizzando un'altra diapositiva di vetro conduttivo, seguire i passaggi 2.1-2.2.
- Applicare il catalizzatore di carbonio sul lato conduttivo. Usando una pinzetta, tieni la diapositiva, il lato conduttivo verso il basso, sopra la punta di un bruciatore Bunsen. Spostare la diapositiva in modo che la fuliggine si raccolga su tutta la superficie, ma per non più di 30 s. Lasciare raffreddare la diapositiva e pulire la fuliggine lungo un lato della diapositiva con un batuffolo di cotone.
- In alternativa, utilizzando una matita HB, coprire l'intera superficie conduttiva con grafite. Questo dà un elettrodo più robusto, ma uno che funziona meno bene.
5. Assemblare la cella solare
- Asciugare il film macchiato. Risciacquare con etanolo e metterlo su un kimwipe. Asciugare delicatamente il film con un secondo kimwipe. Il film deve essere asciutto in modo da non influire sulla soluzione elettrolitica.
- Con il film dell'elettrodo rivolto verso l'alto, posizionare delicatamente l'elettrodo rivestito in carbonio sulla parte superiore (carbonio rivolto verso il basso). Assicurarsi di sfalsare le diapositive in modo che i lati esposti di entrambi gli elettrodi possano essere agganciati ai fili. Posizionare due clip leganti sui lati adiacenti al vetro offset.
- Posizionare alcune gocce della soluzione elettrolitica lungo un bordo delle diapositive e aprire/chiudere con attenzione ciascun lato della cella aprendo/chiudendo alternativamente le clip leganti. Assicurarsi che tutta l'area macchiata sia a contatto con la soluzione elettrolitica e ripetere il passaggio 5.2 se necessario.
- Pulire l'elettrolita in eccesso dalle aree esposte usando kimwipes ed etanolo.
- Fissare le clip di alligatore ai due lati esposti della cella solare.
6. Misurazione delle prestazioni della cella
Nota: Idealmente, queste misurazioni devono essere eseguite all'esterno. Tuttavia, se il tempo non lo consente, possono essere fatti all'interno usando una lampada alogena. Tutte le misurazioni devono essere eseguite senza alcun movimento della cella in modo che vengano eseguite in condizioni identiche.
- Assicurarsi di orientare la cella in modo che la pellicola TiO2 sia rivolta verso il sole e posizionare una copertura in policarbonato sopra la cella. Questo protegge la cellula dai danni UV.
- Collegare l'elettrodo negativo (vetro rivestito TiO2)al filo negativo del multimetro e l'elettrodo positivo (C) al filo positivo del multimetro (Figura 5).
- Impostare il multimetro su volt e misurare la tensione. Questo è il potenziale a circuito aperto (tensione massima a corrente zero). Coprire la cella (con una mano o un oggetto solido) per assicurarsi che la tensione diminuisca.
- Impostare il multimetro su milliampere (mA) e misurare la corrente massima. Questa è la corrente di cortocircuito (corrente massima a tensione zero). Coprire la cella con (con una mano) per assicurarsi che la corrente diminuisca.
- Registrare una curva corrente-tensione completa utilizzando un potenziometro da 500 Ω come carico variabile.
- Determinare quale piombo sul potenziometro è il rubinetto centrale. Questo piombo consente di variare la resistenza. Per fare ciò, collegare il multimetro (impostato su ohm) a due dei cavi sul potenziometro e variare la resistenza sul potenziometro. Nota se la resistenza cambia. Ripeti questo con le altre due combinazioni di lead. I cambiamenti nella resistenza dovrebbero essere osservati in due delle tre combinazioni. Il piombo che è stato utilizzato in entrambe le combinazioni che hanno dato modifiche è il rubinetto centrale, e gli altri due sono funzionalmente identici.
- Assemblate il circuito come mostrato nella Figura 5 (a destra).
- Impostare il potenziometro su piena (o zero) resistenza e annotare la corrente e la tensione.
- Cambia la resistenza sul potenziometro con piccoli incrementi e nota la corrente e la tensione in modo che ci siano diversi punti che coprono l'intera gamma del potenziometro. Assicurarsi di non spostare la cella durante queste misurazioni. Una volta che la corrente inizia a cambiare, assicurati di raccogliere molti punti dati; è possibile ottenere meno punti dati quando è costante.
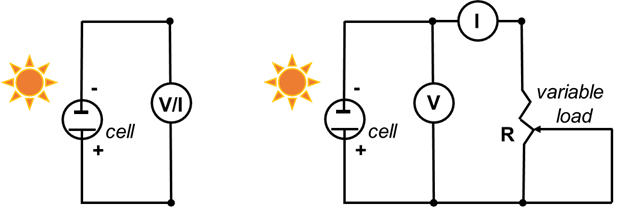
Figura 5. Schema elettrico per misurare il potenziale a circuito aperto e la corrente di cortocircuito (a sinistra, passaggi 6.3 e 6.4) e per registrare la curva I-V (a destra).
Risultati
Per ogni punto dati raccolto nei passaggi 6.5.3-6.5.4, calcolare la densità di corrente (mA/cm2) e la densità di potenza (mW/cm2). Per calcolare la densità di corrente, dividere la corrente per l'area della superficie del film determinata nel passaggio 2.7. Per calcolare la densità di potenza, moltiplicare la tensione per la densità di corrente. Tracciare la corrente (mA) rispetto alla tensione (mV) per i dati raccolti nei passaggi 6.3, 6.4 e 6.5.3-6.5.4. Traccia la densità di corrente rispetto ai volt per tutti i dati. Questo dovrebbe essere vicino al "ginocchio" della curva. Determinare l'efficienza di conversione della luce solare in energia elettrica dividendo la potenza massima (mW / cm2) per l'energia solare in entrata (considerata 800-1.000 W / m2) e moltiplicando per il 100%.
L'analisi dei dati e la preparazione delle curve I-V è standard nella letteratura delle celle solari come mezzo per confrontare le prestazioni delle celle. La tensione a circuito aperto misurata deve essere compresa tra 0,3 e 0,5 V e si ottiene un potenziale di cortocircuito di 1-2 mA/cm2.
Applicazione e Riepilogo
Questo video ha mostrato la preparazione e l'analisi di un semplice DSSC.
Le celle solari stanno diventando sempre più comuni e ci sono molte ricerche in corso per migliorare le loro prestazioni. Le celle solari tradizionali basate su semiconduttori di silicio vengono utilizzate per realizzare pannelli solari utilizzati nello spazio e sulla terra. L'aeroporto internazionale di Denver sfrutta il clima soleggiato del Colorado e dispone di quattro pannelli solari che forniscono il 6% del fabbisogno energetico dell'aeroporto.
I DSSC operano con efficienze fino al 15%,7 rispetto all'efficienza del 14-17% per i tradizionali pannelli di silicio commerciali a basso costo. Mentre l'efficienza operativa dei DSSC è competitiva, l'alto costo dei materiali (come il ru-dye) è problematico per le applicazioni su larga scala. Forse il più grande svantaggio dei DSSC è l'uso di un elettrolita liquido sensibile alle variazioni di temperatura. L'elettrolita liquido può congelare a basse temperature, interrompendo così la produzione di energia e/o causando danni strutturali al pannello solare. A temperature elevate, l'elettrolita liquido si espande, il che rende difficile la sigillatura dei pannelli.
Riferimenti
- Williams, R. Becquerel Photovoltaic Effect in Binary Compounds. J Chem Phys, 32 (5), 1505-1514 (1960).
- Perlin (2005), Late 1950s - Saved by the Space Race", Solar Evolution - The history of Solar Energy. The Rahus Institute. Retrieved 28 June 2016.
- Regan, B., Gratzel, M. Nature, 353, 737-740 (1991).
- Miessler, G. L., Fischer, P. J., Tarr, D. A. Inorganic Chemistry, Pearson, 2014.
- Wikipedia page: Dye-sensitized solar cell,
- Smestad, G. P., Grätzel, M. Demonstrating Electron Transfer and Nanotechnology: A Natural Dye-Sensitized Nanocrystalline Energy Converter. J Chem Ed. 75 (6), 752 (1998).
- Burschka, J., Pellet, N., Moon, S.-J., Humphry-Baker, R., Nazeeruddin, M. K., Grätzel, M. Sequential deposition as a route to high-performance perovskite-sensitized solar cells. Nature, 499 (7458), 316-9 (2013).
Tags
Vai a...
Video da questa raccolta:

Now Playing
Celle di Grätzel (Dye-sensitized Solar Cells)
Inorganic Chemistry
15.8K Visualizzazioni

Sintesi di un Ti(III) metallocene utilizzando la tecnica della linea Schlenk
Inorganic Chemistry
31.6K Visualizzazioni

Scatola a guanti (Glove Box) e sensori di impurezze
Inorganic Chemistry
18.6K Visualizzazioni

Purificazione del ferrocene per sublimazione
Inorganic Chemistry
54.7K Visualizzazioni

Il metodo di Evans
Inorganic Chemistry
68.6K Visualizzazioni

Diffrazione a raggi X su cristallo singolo e su polveri
Inorganic Chemistry
104.7K Visualizzazioni

Spettroscopia di risonanza paramagnetica elettronica (EPR)
Inorganic Chemistry
25.5K Visualizzazioni

Spettroscopia Mössbauer
Inorganic Chemistry
22.0K Visualizzazioni

Interazione acido-base di Lewis in Ph3P-BH3
Inorganic Chemistry
38.9K Visualizzazioni

Struttura del ferrocene
Inorganic Chemistry
79.6K Visualizzazioni

Applicazione della teoria dei gruppi nella spettroscopia infrarossa
Inorganic Chemistry
45.5K Visualizzazioni

Teoria degli orbitali molecolari
Inorganic Chemistry
35.4K Visualizzazioni

Paddlewheel a quadruplo legame metallo-metallo
Inorganic Chemistry
15.3K Visualizzazioni

Sintesi di un complesso di cobalto (II) legato ad ossigeno
Inorganic Chemistry
51.7K Visualizzazioni

Inizio fotochimico di una reazione di polimerizzazione radicalica
Inorganic Chemistry
16.8K Visualizzazioni