Purification du Ferrocène par sublimation
Vue d'ensemble
Source : Tamara M. Powers, département de chimie, Texas A & M University
Sublimation, la transition de phase directe d’un solide dans un gaz sans premier devenir liquide, se déroule à des températures et des pressions inférieures à celle du point triple du composé (Figure 1). Le processus de sublimation peut être utilisé pour purifier les solides organiques et inorganiques. Au cours de la technique de purification, un solide est chauffé directement dans la phase gazeuse. Toutes les impuretés non volatils sont laissées pour compte alors que le composé vaporisé est ensuite recueilli (dépôt) sous forme de solide sur une surface froide. Ici, nous allons utiliser la sublimation pour purifier le ferrocène, un solide inorganique avec une température du point triple de 183 ° C. 1
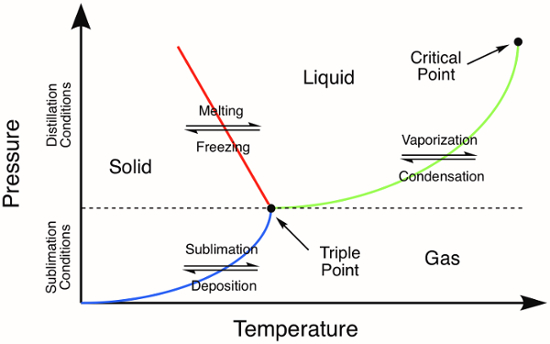
Figure 1. Diagramme de phase générique. Les lignes de couleur représentent les exigences de pression et de température pour les transitions de phase. Distillation d’un solide se produira à des pressions et des températures au-dessus du point triple, représenté par la ligne verte dans le diagramme de phase. La ligne bleue représente les conditions de température et de pression où se produit la sublimation.
Principles
Beaucoup de composés inorganiques est solides et c’est pourquoi il est important de comprendre les méthodes de purification des solides. Certaines des techniques de purification des solides sont semblables à ceux utilisés pour l’épuration des liquides. Par exemple, la distillation est une technique de purification utile pour les solides à bas point de fusion, qui fondent avant ils se vaporisent. Sur un diagramme de phase, Notez que la distillation peut être accomplie à des pressions qui sont au-dessus du point triple d’un composé (Figure 1). Après la fusion initialement pour produire un liquide (ligne rouge, Figure 1), distillation procède comme il serait devant toute autre phase liquide composé.
Sublimation est liée à la distillation, mais n’implique pas la transition de phase intermédiaire vers la phase liquide. Sublimation se produit uniquement à des températures et des pressions qui se trouvent au-dessous du point triple d’un composé dans son diagramme de phase (Figure 1). Sublimation est une technique de purification où un solide est chauffé (parfois sous vide) aboutissant à une transition de phase directement à partir de la phase solide à la phase gazeuse. Déposition du composé vaporisé sur une surface froide entraîne d’isolation du matériau sublimé. Impuretés non volatiles sont laissées après que la sublimation est terminée. Des exemples courants de substances qui subissent facilement une sublimation à la pression atmosphérique sont glace (à des températures inférieures à 0 ° C) et CO2.
Fonction de la volatilité du solide étant sublimé, différents appareils peuvent être utilisés. Pour les solides très volatils (composés ayant un point triple à une haute pression et basse température), il est possible de faire une chambre simple sublimation à l’aide d’un gobelet et verre de montre. Un tel appareil est approprié pour les composés qui sublime à ou près de la pression atmosphérique et la température ambiante. Si vide ou gaz inerte sont nécessaires, verrerie, spécialement conçu pour la sublimation (c.-à-d., une chambre de sublimation) peut être utilisé. La chambre de sublimation (Figure 2) permet de sublimation sous vide ou sous atmosphère inerte. Il est composé de deux morceaux de verre : le solide est placé au fond de la chambre principale et à la sublimation, le matériel purifié est perçue sur le manchon long dans le centre de la chambre appelée à un doigt froid, qui peut être rempli d’eau glacée , neige carbonique et acétone ou certains autre cryogène. La base et le doigt froid sont scellés avec un joint torique et fixés avec une pince. À l’issue de la sublimation, la chambre peut être démontée (dans les airs pour des composés sensibles sans air ou dans la boîte à gants pour les matériaux sensibles à air) et le solide purifié peut être gratté hors du doigt froid. Toutes les impuretés non volatile doivent rester au fond de la chambre de sublimation.

Figure 2. Une chambre de sublimation conçue pour la sublimation de la basse pression.
Procédure
1. installation de la ligne de Schlenk
Une procédure plus détaillée, veuillez consulter les vidéos « Schlenk lignes transfert de solvant » et « Dégazage liquide » dans la série Essentials of Organic Chemistry . Sécurité de canalisation de Schlenk devrait être révisée avant la tenue de cette expérience. Verrerie doit être inspecté pour fissures étoiles avant utilisation. Il faut pour s’assurer que O2 n’est pas condensée dans le piège de ligne Schlenk si vous utilisez le liquide N2. À température2 N, O2 se condense et est explosif en présence de solvants organiques. Si l'on soupçonne que O2 a été condensée, ou un liquide bleu est observé dans le piège froid, laissez le piège froid sous vide dynamique. Ne pas enlever le liquide N2 collecteur ou éteignez la pompe à vide. Au fil du temps que le liquide O2 sera sublime dans la pompe - il n’est plus sécuritaire d’enlever le piège2 liquide N une fois tous les O2 a sublimé.
- Fermez le robinet de purge.
- Allumez le gaz2 N et la pompe à vide.
- Comme le vide de ligne Schlenk s’équilibre, préparer le piège froid avec liquide N2 ou neige carbonique et d’acétone.
- Assembler le piège froid.
2. ajouter 500 mg (2,7 mmol) du ferrocène dans la base de la chambre de sublimation.
3. montage de la chambre de Sublimation
- Placer le joint torique dans la rainure de la base de la chambre.
- Doucement, placer le doigt froid dans la base de chambre et assurez-vous que le joint torique dans la rainure de la verrerie.
- Fixez les deux pièces de la chambre de sublimation à l’aide d’une pince.
4. Connectez la chambre de sublimation de la ligne de Schlenk et ouvrir la chambre pour passer l’aspirateur pendant 1 min. fermer la soupape de dépression sur la chambre de sublimation. La sublimation s’effectuera sous vide statique.
5. remplir le doigt froid avec un bain de glace.
6. Placez la base de la chambre de sublimation dans un bain d’eau chauffé à 80° C.
7. une fois que la sublimation est terminée, retirer la chambre de sublimation du bain.
8. Fermez le robinet d’arrêt sur la ligne de Schlenk.
9. Retirer le tube de ligne Schlenk de la chambre de sublimation et pressuriser la chambre sublimation en ouvrant lentement le robinet. Fais attention ! Si la chambre est isole trop vite il perturbe les cristaux purifiés sur le doigt froid.
10. la chambre de sublimation de desserrage et retirer l’eau du doigt froid avec une pipette.
11. Soulevez le doigt froid dans la chambre de sublimation.
12. Grattez le ferrocène purifié du doigt froid et transfert dans un flacon. Noter le poids du produit purifié. Si le composé est sublimé est sensible à air, l’ensemble de l’appareil doit être inclus dans une boîte à gants atmosphère inerte avant l’ouverture de la chambre de sublimation.
Résultats
Ferrocène (99 %) a été acheté chez Alfa Aesar. Sublimation 500 mg comme décrit a provoqué 493 mg produit isolé. Le ferrocène purifié a été analysé par 1H RMN. 1 H RMN (chloroforme -d, 300 MHz, δ, ppm) : 4.17 (s).
Applications et Résumé
Sublimation est une technique utilisée dans la purification des solides. Solides qui sublime à basse pression et de température sont de bons candidats pour la purification par sublimation. Ici, nous avons montré comment utiliser une chambre de sublimation avec le ferrocène sublime sous vide statique à 80 ° C.
Dans un environnement de laboratoire, la sublimation est une technique utile qui peut être appliquée à la purification de solides dans diverses situations, y compris dans la purification des matières premières ou produits de synthèse. Dans cet exemple, le solide purifié est perçue sur le doigt froid, tandis que les impuretés restent au fond de la chambre de sublimation. Cependant, on peut vouloir arracher une impureté solide qui peut être sublimée non volatile. Dans ce cas, le matériel désiré reste au fond de la chambre de sublimation.
Sublimation est également utilisée en lyophilisation, appelé lyophilisation. Lyophilisation est un procédé à sec des matériaux utilisés dans les industries pharmaceutiques et de denrées alimentaires, ainsi que dans les laboratoires de recherche. Dans le processus de lyophilisation, un matériau est gelé tout d’abord, suivie par une réduction de la pression environnante, qui permet à l’eau (ou autre solvant) à enlever par sublimation.
References
- Kaplan, L., Kester, W. L., Katz, J. J. Some properties of iron biscyclopentadienyl. J Am Chem Soc. 74, 5531-5532 (1952).
Passer à...
Vidéos de cette collection:

Now Playing
Purification du Ferrocène par sublimation
Inorganic Chemistry
54.5K Vues

Synthèse d'un métallocène de Ti(III) avec une ligne Schlenk
Inorganic Chemistry
31.6K Vues

Boîte à gants et capteurs d'impuretés
Inorganic Chemistry
18.6K Vues

La méthode Evans
Inorganic Chemistry
68.3K Vues

Diffraction par rayons X : cristal vs poudre
Inorganic Chemistry
104.3K Vues

Spectroscopie par résonance paramagnétique électronique (RPE)
Inorganic Chemistry
25.4K Vues

Spectroscopie Mössbauer
Inorganic Chemistry
22.0K Vues

Interaction des acides et bases de Lewis au sein du complexe Ph3P-BH3
Inorganic Chemistry
38.8K Vues

Structure du ferrocène
Inorganic Chemistry
79.3K Vues

Application de la théorie des groupes à la spectroscopie IR
Inorganic Chemistry
45.1K Vues

Théorie de l’orbital moléculaire (OM)
Inorganic Chemistry
35.3K Vues

Quadruples clusters métalliques
Inorganic Chemistry
15.3K Vues

Capteurs solaires teintés
Inorganic Chemistry
15.7K Vues

Synthèse d'un complexe de cobalt(II) porteur d'oxygène
Inorganic Chemistry
51.6K Vues

Initiation photochimique des réactions de polymérisation radicalaire
Inorganic Chemistry
16.7K Vues